温度影响的单增李斯特菌生长异质性研究
费福林,刘丽莎,谷鑫,龙正串,赵勇,3,4,刘海泉,3,4,5*,白莉*
1(上海海洋大学 食品学院,上海,201306)2(国家食品安全风险评估中心,国家卫生健康委员会食品安全风险评估重点实验室,中国医学科学院创新单元(2019RU014),北京,100022) 3(上海水产品加工及贮藏工程技术研究中心,上海,201306) 4(农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海,201306) 5(上海海洋大学,食品热加工工程技术研究中心,上海,201306)
单核细胞增生李斯特菌(Listeriamonocytogenes)简称单增李斯特菌,能在广泛的盐浓度、温度和pH值条件下生存,是全球重要食源性致病菌[1-2],易感人群为老年人、新生儿、孕妇和免疫功能低下的患者,致死率高达20%~30%[3]。李斯特菌病主要通过食用受污染的食品传播给人类,例如肉类、蔬菜、鱼类、加工食品、即食食品和乳制品等食品[4],食源性比例高达99%[5]。2011年,美国28个州的147人因食用污染的哈密瓜感染李斯特菌病,其中33名患者死亡[6];2018年,南非因猪肉香肠污染,导致1 034例病例和204例死亡,预估损失近3亿美元[7]。在中国2008—2017年部分临床病例(759例)报告中,有128人(18%)死亡,其中新生儿93人,占73%[8]。
近年来,随着居民饮食习惯的改变、冷链物流的成熟以及即食食品的消费需求增加,我国居民发生李斯特菌病的风险呈上升态势[9]。因此,我国亟需开展相关食品的单增李斯物菌的风险评估工作。已有研究发现,从不同环境中分离的致病菌在生长、毒力、生物被膜形成和耐药性等表型方面存在广泛的差异性,即微生物的异质性[10-12]。研究者们[13-15]探究了不同来源和不同基因型的副溶血性弧菌在纯培养、食品基质和人工模拟胃液环境下的生长异质性,结果表明致病基因型(tlh+/tdh+/trh-)菌株在纯培养和模拟胃液环境下表现出更大的生长异质性。微生物的生长异质性直接影响风险评估“危害特性描述”和“暴露评估”过程,影响剂量反应模型结果的可靠性,给风险评估工作带来巨大的挑战[16]。
根据菌体抗原H和鞭毛抗原O的特异性不同,L.monocytogenes可分为13个血清型(1/2a、1/2b、1/2c、3a、3b、3c、4a、4ab、4b、4c、4d、4e和7),其中1/2a、1/2b、1/2c和4b为主要血清型,占食品和临床分离株的95%以上[2,17]。1/2a和1/2b型菌株在食品中检出较高,感染后可导致腹泻、发烧、呕吐等症状[18]。在李斯特菌病的流行暴发中,4b型菌株为优势致病血清型,患者感染4b型菌株时的死亡率为26%,而感染1/2a或1/2b型菌株的患者死亡率为16%[19]。在我国,食品和临床病例中最常见的是1/2b型菌株[20]。
因此,为了构建基于“中国国情”的异质性数据库以减少异质性对风险评估的影响,本文选取了来自我国不同地区的40株L.monocytogenes,通过Biosceen C全自动微生物生长曲线分析仪测定不同来源及血清型的L.monocytogenes在37、25、10 ℃下的生长数据,建立生长预测模型拟合得到以μmax为主的生长参数,分析不同来源和血清型的菌株之间的差异,丰富具有“中国特色”的L.monocytogenes生长异质性数据库,为开展L.monocytogenes精准定量风险评估提供数据支撑。
1 材料与方法
1.1 材料与试剂
40株L.monocytogenes由国家食品安全风险评估中心鉴定保存,具体菌株信息如表1所示。

表1 四十株单增李斯特菌菌株信息Table 1 Information of 40 L.monocytogenes strains
BHI肉汤、PALCAM培养基基础、PALCAM选择性添加剂,北京陆桥技术有限责任公司。
1.2 仪器与设备
Bioscreen FP-1100C型全自动微生物生长曲线分析仪,芬兰Oy Growth Curves Ab公司;ZQZY-70B振荡培养箱,上海知楚仪器有限公司;GHP-9270型隔水式恒温培养箱,上海一恒科技有限公司。
1.3 实验方法
1.3.1 不同温度条件下L.monocytogenes的生长实验
将L.monocytogenes从-80 ℃保存的甘油管中活化,划线至PALCAM平板,37 ℃培养48 h。挑取单菌落接种至9 mL BHI肉汤中,振荡培养,37 ℃,150 r/min,培养5~8 h,再次接种至BHI肉汤中,37 ℃振荡培养,菌株生长到达指数中期,以此为初始接种液。
参考LIU等[13]的方法,在Bioscreen C配套的100微孔板中进行梯度稀释。吸取初始接种液20 μL接种至第一孔180 μL BHI肉汤中,以此为第一稀释梯度。用移液器吹吸混匀后进行逐级稀释,依次梯度稀释到第5孔(~104CFU/mL)BHI肉汤中,按相同方式做3个平行。Bioscreen C设置吸光度为600 nm的宽波段,温度分别为37、2、和10 ℃,时间分别为24、48、96 h,测定生长曲线,每组试验重复3次。
1.3.2 生长参数拟合
采用修正Gomperz生长模型[21],得到菌株的延滞期(λ)、最大比生长速率(μmax)、最大最小生长密度之差(ymax),计算拟合决定系数(R2)、变异系数(coefficient of variation,CV)。调整优化后的修正Gomperz生长模型表达式如公式(1)所示:
(1)
式中:A为最初的细菌接种量OD值;C为最大菌种量与初始菌种量OD值之差;μmax为最大比增长速率,OD/h;t为时间,h;λ为延滞期,h。模型评价采用R2,决定系数R2值在0~1,且越靠近1即表明预测模型的参考价值越高。
CV的计算如公式(2)所示:
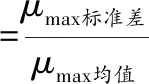
(2)
1.3.3 数据处理与统计分析
生长曲线拟合分析采用Origin Pro 2021软件,显著性差异比较采用SPSS statistics 26.0软件进行单因素方差分析(ANOVA),P<0.05,差异显著,具有统计学意义。
2 结果与分析
2.1 不同温度下40株L.monocytogenes的μmax分析
40株L.monocytogenes在37、25、10 ℃下的生长数据均可用修正Gomperz生长模型进行拟合,拟合决定系数R2在0.972~0.998,表明所选模型拟合效果良好。37、25、10 ℃条件下40株L.monocytogenes的μmax值分别为0.206~0.332、0.167~0.232、0.036~0.066 OD/h,结果见图1。
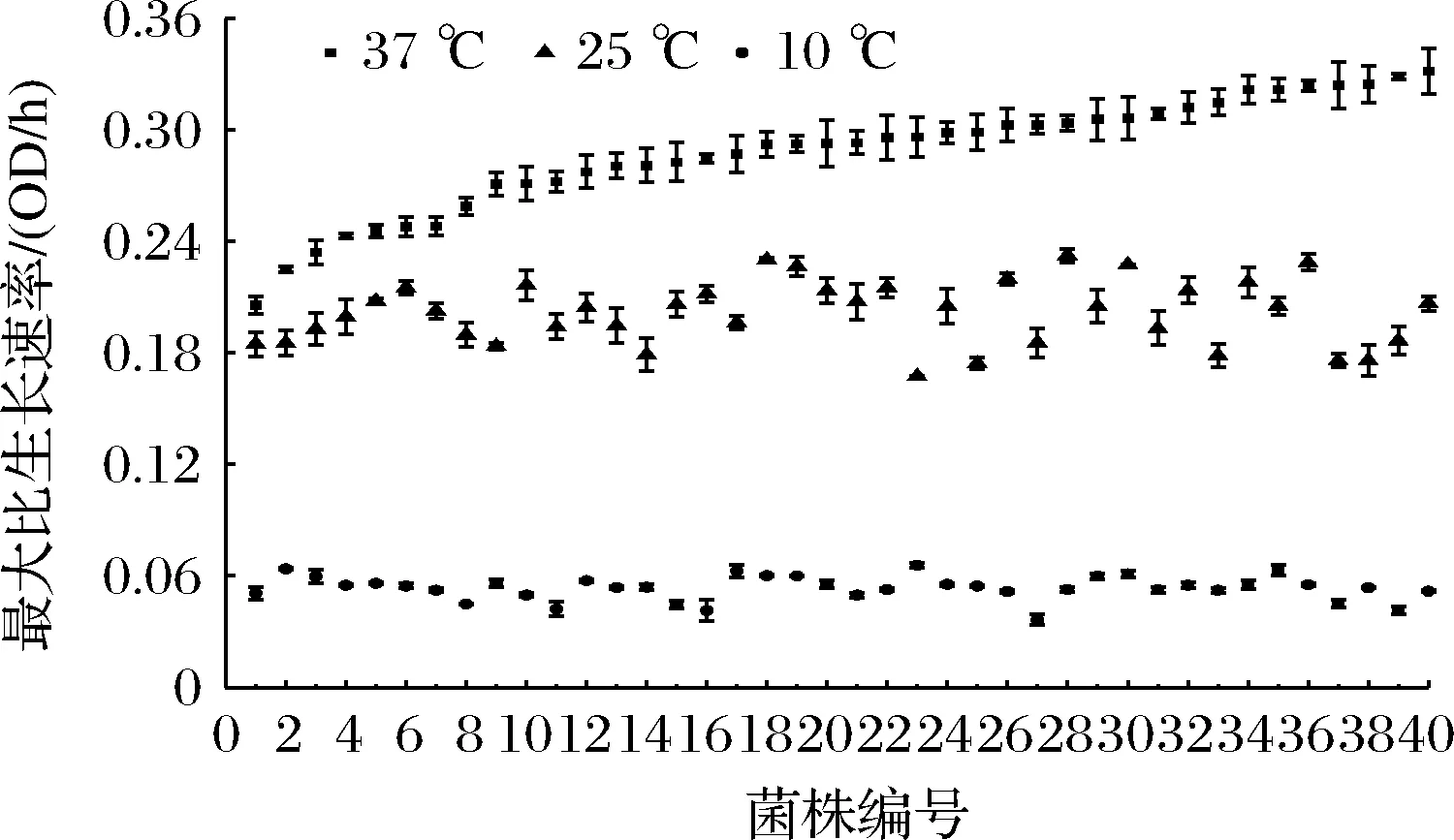
图1 四十株不同来源L.monocytogenes在37、25和10 ℃下的μmaxFig.1 Specific growth rate μmax of 40 L.monocytogenes strains from different sources at 37、25, and 10 ℃
由图1可知,随着温度降低,L.monocytogenes菌株的μmax显著减小。以37 ℃的最佳生长条件为参照,LM1~LM40菌株在37 ℃条件下的平均μmax值呈现阶梯状增长的趋势。与37 ℃条件相比,25、10 ℃条件下菌株的生长是随机的,没有固定的趋势,这与LIU等[13]的研究中的现象相同。25 ℃条件下,LM28菌株的μmax值最大,LM23菌株的μmax值最小,但在10 ℃条件下,LM23菌株的μmax值最大,LM27菌株的μmax值最小。
2.2 不同温度对40株L.monocytogenes的动力学生长参数影响
采用修正Gomperz生长模型对40株L.monocytogenes在不同温度下的生长数据进行拟合,得到40株不同来源的L.monocytogenes在37、25、10 ℃条件下的延滞期(λ)、最大比生长速率(μmax),计算CV,结果见表2。

表2 四十株L.monocytogenes在37、25、10 ℃下的动力学生长参数Table 2 Kinetic growth parameters of 40 L.monocytogenes strains at 37、25, and 10 ℃
由表2可知,40株L.monocytogenes的平均λ值随着温度的升高而减少,平均μmax值随着温度的升高而增大(P<0.05)。菌株的最大比生长速率的CV值代表了L.monocytogenes菌株的生长异质性。随着温度的升高,L.monocytogenes菌株的CV值先降低后增加。在25 ℃条件下,L.monocytogenes菌株的CV值最小,此时L.monocytogenes菌株对环境变化的响应小。另外,在37、10 ℃的生长环境中进行菌株选育,有助于减小菌株生长异质性对风险评估的影响。
2.3 不同来源对L.monocytogenes菌株的生长异质性影响
统计临床和食品分离菌株在不同温度下的平均μmax值进行显著性差异分析,结果见图2。在37、25、10 ℃下,临床菌株的平均μmax值均大于食品分离菌株。在25 ℃下,临床和食品分离菌株的μmax值分别为(0.212±0.014)、(0.191±0.013) OD/h,存在显著性差异,其他条件下差异不显著。

图2 37、25、10 ℃下40株临床和食品分离L.monocytogenes菌株之间的箱线图Fig.2 Box plot between 40 clinical and food isolates of L.monocytogenes strains at 37, 25, and 10 ℃注:*表示与临床株相比差异显著(P<0.05)。
如图3所示,随着温度升高,临床和食品分离菌株的CV值均是先减少后增大,在25 ℃时,菌株的生长异质性最小,与表2显示的整体40株菌株在不同温度下的CV值的趋势相同。临床菌株在37、25、10 ℃下的CV值均小于食品分离菌株,这表明临床菌株的生长异质性小于食品分离株。已有研究发现,与食品分离菌株相比,临床菌株往往具有更强的毒力和致病力,更好地适应宿主肠道环境[22-23]。37 ℃条件下,强致病力的临床菌株表现出较小的生长异质性,可能导致其更好地定植于肠腔,更有效地侵入宿主组织,增加感染人员健康风险。

图3 不同来源的L.monocytogenes菌株在37、25、10 ℃下的CV值Fig.3 The CV values of L.monocytogenes strains from different sources at 37, 25, and 10 ℃
2.4 不同血清型L.monocytogenes菌株的生长异质性
不同血清型L.monocytogenes菌株在不同温度下的μmax值呈现出不同程度的差异性,结果见表3。在不同温度条件下,不同血清型菌株之间的μmax值没有明显规律。在25 ℃下,1/2b、1/2c和4b型菌株的μmax值显著大于1/2a型菌株(P<0.05)。在10、37 ℃下,不同血清型的菌株之间的μmax值并没有显著性差异。

表3 不同血清型的L.monocytogenes菌株在37、25、10 ℃下的μmax均值 单位:OD/h
不同血清型的L.monocytogenes菌株的致病力有所不同。绝大多数暴发或散发的侵袭型李斯特菌病病例由4b型引起,而肠胃炎型病例多由1/2a和1/2b引起,其中1/2b和4b型属于谱系I,1/2a和1/2c型属于谱系Ⅱ[24-25],而谱系I的菌株的毒力强于谱系Ⅱ内的菌株[22]。在25 ℃下,致病力更强的1/2b和4b型菌株的μmax值显著大于1/2a型菌株;谱系I内不同血清型菌株之间在不同温度下的μmax值无明显差异,谱系Ⅱ的1/2c型菌株在25 ℃时的μmax值显著大于1/2a型菌株。
不同血清型菌株在不同温度条件下的μmax的CV值如图4所示。随着温度的升高,不同血清型菌株的生长异质性都先减小后增大,在25 ℃时,菌株的生长异质性最小,与表2显示的整体40株菌株在不同温度下的CV值的趋势相同。除1/2b型菌株外,其他血清型菌株的CV在37 ℃条件下达到最大,表现出最大的生长异质性;在25 ℃时,1/2a的CV值最低;在10 ℃时,4b型菌株的生长异质性最小,表现出对较低温环境的良好适应。

图4 血清型对L.monocytogenes在37、25、10 ℃下的生长异质性的影响Fig.4 The influence of serotype on the growth heterogeneity of L.monocytogenes at 37, 25, and 10 ℃
3 结论与讨论

本研究发现,37、10 ℃下,不同来源、不同致病力的L.monocytogenes之间的μmax无显著性差异,这表明在人体环境下,温度对不同致病力的L.monocytogenes的生长速率无显著影响。在25 ℃条件(常温环境)下,1/2b型菌株具有显著的生长优势,其在我国的临床和食品样本的高检出率可能与此有关[20]。另外,谱系I内的1/2b和4b菌株在25 ℃条件时表现出更佳的生长状况,这表明在常温条件下,致病力强的1/2b和4b型L.monocytogenes菌株在食品中的污染水平更高。感染李斯特菌病的关键因素之一是食物带菌量,被污染食物可能因达不到感染量而不引起疾病[3]。因此,污染水平更高的1/2b和4b型L.monocytogenes菌株进入人体后,更容易穿过消化道、血胎和血脑屏障,从而增加婴儿死亡、脑膜炎和败血症等疾病风险[32]。1/2b和4b菌株在常温下的生长优势可能是导致其具有强致病力的原因之一。
微生物生长异质性是为了适应复杂多变的生存环境,从而表现出生长行为的差异,是微生物变异和多样性的基础。L.monocytogenes作为一种高度多样化的物种,宽泛的生存环境决定了L.monocytogenes菌株在生长、毒力等表型存在不同程度的异质性。正是由于这种菌株间的生长异质性,导致剂量-反应模型结果的不准确性,直接影响了风险评估“危害特性描述”和“暴露评估”过程,从而夸大或降低了食源性致病菌的真实风险,威胁我国人民的健康安全。然而这种菌株之间的差异源于其固有属性,无法降低或消除。因此,只有将生长异质性作为微生物风险评估中筛选特征良好菌株或混合菌株的科学依据,并纳入精准剂量-反应模型及风险表征的考量范畴,才能更加科学、准确地描述食源性致病菌在食品中的存在情况,客观、精准地评估微生物对不同人群的健康风险,保障人民的生命安全。
综上,本研究对40株不同来源和不同血清型的单增李斯特菌在不同温度(10、25、37 ℃)下的生长动力学特征进行了研究。研究结果表明,不同温度下临床菌株的平均μmax值大于食品分离株,临床菌株的生长变异系数小于食品分离株,表现出较小的温度生长异质性;同时在25 ℃时,强致病力的1/2b和4b型菌株表现出了更显著的生长优势;4b型菌株对较低温度具有更好的适应性。本研究结果将为我国L.monocytogenes精准风险评估以及实验中的菌株选择提供数据支撑,为科学地进行食源性致病菌疾病防控提供依据。

