苓桂术甘汤抑制脂多糖诱导小胶质细胞由M2向M1型极化作用机制
赵小云,李心仪,周春祥
(南京中医药大学,江苏 南京 210046)
阿尔茨海默病(Alzheimer’s disease,AD)是原发于中枢神经系统内的神经退行性疾病,多表现为记忆力衰减、认知及语言功能障碍、性格及行为学改变等[1]。越来越多的证据表明,神经炎症在AD发病中起着关键作用。小胶质细胞是中枢神经系统的常驻巨噬细胞,不仅在神经发生、神经元可塑性和再生中也起着重要作用,也是免疫防御的第一道防线。当产生炎症刺激性损伤时,小胶质细胞M2表型被激活来修复损伤,一旦这个过程无效,就会转变为M1表型,对神经元造成损害[2]。小胶质细胞从抗炎表型转换到促炎表型,启动炎症反应的关键是增加IL-1β、TNF-α、IL-6等炎症因子分泌[3]。中医药治疗AD历史悠久,具有独特优势,具有多层次、多靶点的独特优势,有良好的抗炎抗氧化功能且毒性明显小于化学药物[4]。近年研究发现,多种中药制剂及成分通过抑制小胶质细胞激活,或逆转其被激活表型,达到改善神经炎症目的,产生神经保护作用[5-8]。本科研团队前期研究证实,苓桂术甘汤可显著抑制由Aβ诱导的小胶质细胞炎症因子IL-1β、IL-6、TNF-α过度表达,发挥良好的抗炎作用,且其他研究也表明多种方剂具有保护神经作用[6-10]。基于此,本次将重点观察在苓桂术甘汤干预下,小胶质细胞由M2向M1极化过程。
1 材料与方法
1.1 实验材料
1.1.1 细胞株:BV2细胞株(货号Q0397,中乔新舟生物科技有限公司)。
1.1.2 SD大鼠:SPF级成年雄性SD大鼠共12只,体重220~250 g购自于杭州医学院,许可证号[SCXK(苏)2017-0001]、动物合格证号(201909302)。动物使用经南京中医药大学实验动物伦理委员会批准,伦理号(202004A031)。SD大鼠饲养于南京中医药大学动物房屏障环境中,实验操作符合《实验动物管理条例》要求,适应性喂养7 d后开始实验。
1.1.3 主要药品及试剂:不完全DMEM低糖培养液含双抗(货号KGM31600-500);胎牛血清(批号AB-FBS0500);CCK-8试剂盒(批号C0038);抗荧光淬灭封片液含DAPI(批号P0131-25ml);LPS(货号L8880-100mg);二甲基亚砜DMSO(批号D8371);盐酸米诺环素(批号IM0450-50mg);一氧化氮(NO)测定试剂盒(批号A012-1-2);Goat Anti-Mouse IgG H&L/Alexa Fluor 594 antibody(批号bs-0296G-AF594);Goat Anti-rabbit IgG H&L/Alexa Fluor 488 antibody(批号bs-0295G-AF488);CD206 Polyclonal Antibody(批号18704-1-AP);COX2/Cyclooxygenase 2/PTGS2 Monoclonal Antibody(批号66351-1-Ig );24孔板圆形细胞爬片(批号WHB-24-CS)。
1.1.4 主要仪器:细胞培养箱(型号MSO-20AIC)、超净工作台(型号SW-CJ-JF)、倒置显微镜(型号Ts 100-F)、荧光显微镜(型号Axio Scope A1)、医用低温离心机(型号Sorvall ST 16R)、旋转蒸发器(型号RE52-99)、小动物麻醉机(型号R74661-016)、全自动酶标仪(型号ELX800)。
1.2 实验方法
1.2.1 苓桂术甘汤含药血清制备:茯苓40 g,桂枝30 g,白术、炙甘草各20 g,购自于南京中医药大学国医堂。将220 g中药生药放入调温电热器大烧瓶中,加入1100 ml超纯水,大火煮沸后转小火煮30 min后倒出药液,用同样方法重复1次,将两次药液混合后,放入旋转蒸发器内将其浓缩至220 ml,使药物终浓度为1 g/ml。将成年雄性SD大鼠12只随机分为两组,即空白组、苓桂术甘汤组,每组6只。两组剂量选择依据《伤寒论》[11]原文、2020年版《中华人民共和国药典:一部》[12]、《人和动物间按体表面积折算的等效剂量比值表》规定剂量进行换算,确定大鼠等效剂量是1.2 g/kg,苓桂术甘汤组大鼠以等效剂量4倍灌胃,空白组大鼠用等体积0.9%氯化钠溶液灌胃。两组大鼠适应性喂养3 d,再灌胃给药,灌胃前称取大鼠体重并标记,各给药组2次/d,连续灌胃7 d。第8天在灌胃1.5 h后进行腹主动脉取血,用异氟烷吸入法麻醉SD大鼠,收集其腹主动脉血液,全血静置3 h后于离心机4 ℃下,3500 r/min、10 min,取上清血清,于水浴锅56 ℃水浴灭活30 min,0.22 μm孔过滤膜过滤2次,-80 ℃保存备用。两组对比来看,血清未对实验结果产生影响。
1.2.2 LPS溶液制备:称取LPS粉末1 mg,加入1 ml的PBS溶液,配置成浓度为1 G/L的LPS母液,用一次性滤菌器过滤后放于EP管中,于-20 ℃保存。使用前用PBS进行稀释,使其终浓度为1 μg/ml。
1.2.3 盐酸米诺环素溶液制备:称取盐酸米诺环素粉末,用经过高压灭菌0.1 mol /L的PBS(pH7.4) 缓冲液溶解,使其最终浓度为100 μmol/L。
1.2.4 分组与模型制备:将培养的小胶质细胞分为对照组、模型组、米诺环素组、苓桂术甘汤组。除对照组外,其余各组均加入浓度为1 μg/ml的LPS,制成细胞神经炎症模型。
1.2.5 给药方法:取生长状态良好的BV2小胶质细胞,以每孔4×104个/ml 细胞数接种于96 孔板中,实验分组同上,每组5个复孔,每孔加入100 μl的全培,培养24 h待细胞贴壁。吸出原有培养液,每孔加入100 μl的PBS缓冲液清洗两遍,每孔加入100 μl单培,米诺环素组加入25 μl米诺环素,苓桂术甘汤组加入预实验筛选出25 μl苓桂术甘汤含药血清(1.2.1所得)预保护12 h,除对照组外,每组加入浓度为1 μg/ml的LPS 10 μl,对照组不做任何处理,培养24 h。
1.2.6 显微镜下观察BV2细胞形态:取生长状态良好的BV2小胶质细胞,以4×104/孔接种于96孔板中,分为对照组、模型组、苓桂术甘汤组,每组设4个复孔,培养24 h待细胞贴壁后,苓桂术甘汤组加入25 μl苓桂术甘汤含药血清预保护12 h,除对照组外,每组加入浓度为 1 μg/ml 的 LPS 10 μl,培养24 h后观察各组细胞形态变化。
1.2.7 硝酸还原酶法检测BV2小胶质细胞培养液中NO水平:实验分组与药物干预方法同上,收集细胞培养液,按照NO检测试剂盒说明书进行操作,于波长550 nm、光径0.5 cm处测定各管吸光度值。
1.2.8 ELISA法检测BV2细胞上清中IL-1β、IL-6、IL-10 含量:实验分组与药物干预方法同上,收集各组细胞的细胞上清液,按照TNF-α、IL-1β、IL-6、IL-10 ELISA 试剂盒说明书进行操作,使用酶标仪于波长405 nm处依次测出各组吸光度值。
1.2.9 免疫荧光染色法检测BV2细胞M1型标志物COX-2及M2型标志物CD206表达:将生长状态良好的BV2细胞取出经消化离心后,加入2 ml全培制成2×104/ml细胞悬液待用,在空24孔板中每孔加入2 μl培养基后,放入圆形细胞爬片,使细胞爬片与24孔板紧密贴合,每孔加入100 μl细胞悬液,800 μl全培,培养24 h待细胞贴壁,实验分组及实验处理同上,细胞贴壁80%后吸出全培,每孔使用PBS清洗3遍,加入4%多聚甲醛溶液固定30 min,PBS清洗3遍,免疫染色通透液于室温下孵育10 min以完全覆盖细胞爬片为度,PBS清洗3遍。室温下用5%的BSA溶液封闭30 min。加入鼠抗COX-2抗体(1∶800),兔抗CD206抗体(1∶1000),以一抗溶液完全覆盖细胞爬片为度,于冰箱4 ℃下过夜。复温后吸出一抗,用10%TBST溶液清洗3次,每孔滴加Alexa Fluor 488标记的Goat Anti-rabbit IgG(1∶1000) 和Alexa Fluor 594标记的Goat Anti-Mouse IgG(1∶1000)荧光二抗溶液以完全覆盖细胞爬片为度,于摇床上室温避光孵育1 h。吸出二抗,用10%TBST溶液清洗3次,滴加抗荧光淬灭封片液(含DAPI)于载玻片上,将细胞爬片细胞面浸没于封片液内,覆盖盖玻片固定,期间避免产生气泡,最后于正置荧光显微镜下放大200倍,观察并采集图片。
2 结 果
2.1 各组含药血清对BV2细胞活力影响比较 在分别使用药物剂量为10、20、25、30 μl苓桂术甘汤含药血清干预LPS诱导的BV2细胞,其中25 μl苓桂术甘汤对BV2细胞活力最强,当药物剂量增加至30 μl时,细胞活力明显下降,因此选用药物剂量为25 μl苓桂术甘汤含药血清用于后续实验。
2.2 各组BV2细胞的形态比较 见图1。对照组BV2细胞为静息状态,胞体较小为圆形,整体明亮,边缘清晰;模型组的BV2细胞经LPS刺激后产生明显的形态学改变,细胞胞体变大,细胞突触变短变粗,突触数量变多,呈现出典型的阿米巴样改变;米诺环素组、苓桂术甘汤组给予含药血清24 h后,部分BV2细胞的胞体胀大恢复,突触消失,胞体变圆,且苓桂术甘汤组细胞形态更趋近于对照组。

图1 各组BV2细胞形态学比较(倒置显微镜,图标尺=50 μm)
2.3 各组BV2细胞NO释放情况比较 硝酸还原酶法检测BV2细胞上清中NO含量水平,见表1。模型组BV2细胞释放的NO高于对照组,苓桂术甘汤组BV2细胞上清中的NO含量低于模型组(P<0.05)。
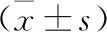
表1 各组BV2细胞NO释放情况比较
2.4 各组BV2细胞炎症因子TNF-α、IL-1β、IL-6、IL-10分泌量比较 见表2。ELISA法检测BV2细胞上清中炎症因子TNF-α、IL-1β、IL-6和抗炎因子IL-10的分泌量。模型组的炎症因子IL-1β、IL-6高于对照组,抗炎因子IL-10低于对照组,差异有统计学意义(P<0.05)。米诺环素组、苓桂术甘汤组的TNF-α、IL-1β、IL-6含量低于模型组 ,而IL-10高于模型组,差异有统计学意义(P<0.05)。
2.5 各组BV2细胞M1型向M2型转化比较 免疫荧光化学染色法观察四组小胶质细胞M1型标志物COX-2及M2型标志物CD206表达,见图2。对照组BV2细胞以M2型标志物CD206为主,表明其处于静息态;模型组BV2细胞以M1型标志物COX-2为主,CD206的荧光反应则降低;米诺环素组、苓桂术甘汤组的M1型标志物COX-2明显减少,M2型标志物CD206升高。
3 讨 论
小胶质细胞是来自于中枢神经系统中胚层的巨噬细胞,归属于免疫系统。一般来说,小胶质细胞激活和TNF-α、IL-6、IL-1β等促炎细胞因子释放必然伴随在神经炎症发生和发展过程中,小胶质细胞在健康大脑的中枢神经系统中处于静止状态(M0型),起到对周围组织的“免疫监视”[13]。出现病理炎症刺激时,小胶质细胞发生形变并活化,释放TNF-α、IL-6、IL-1β等细胞炎症因子,参与神经炎症的发生发展[14]。炎症刺激时小胶质细胞由M0转向M2型,释放抗炎因子IL-10等,发挥对神经元的保护作用,但小胶质细胞持续激活会使抗炎表型M2转变到促炎表型M1型,这一转变过程同时伴随着过量TNF-α、IL-6、IL-1β等炎症因子释放及氧化应激,对神经细胞造成损伤,而这类炎症因子被证明与多种脑疾病相关[14-15]。促炎细胞因子iNOS会诱使小胶质细胞释放大量NO,从而介导炎症反应[3]。因此可通过检测细胞上清中NO含量判断BV2细胞神经炎症模型建立的成功与否。更多实验数据表明,小胶质细胞被过度激活至M1型,会产生对神经元细胞的损伤,加重AD病理。M1、M2型的小胶质细胞分别存在不同标志物,COX-2是M1 型的标志物,处于M1型的小胶质细胞会分泌 TNF-α、IL-1β、IL-6 等致炎因子和NO,介导神经炎症,产生神经毒性;CD206是M2 型标志物,处于M2型的小胶质细胞分泌 IL-10 等抗炎因子,可进行抗炎修复[16]。因此通过药物干预小胶质细胞的激活表型,减少 M1 型小胶质细胞增多,逆转部分小胶质细胞由M2转向M1,使其更多存在于M2型,可能会对修复神经元损伤和中枢神经系统损伤起到积极效果[17]。体内和体外研究中,实验性诱导小胶质细胞向神经保护性表型M2极化,可显著缓解AD模型中的神经炎症反应,改善病理损伤[18-20]。因此,控制小胶质细胞极化可能是治疗AD靶点。
中医学并没有与AD完全对应的病症名称,本病的主要临床表现包括健忘、智力低下、呆傻愚笨等,多归属于中医“痴呆”“健忘”“善忘”等范畴。《医林改错》记载:“灵机记性在脑者,因饮食生气血,长肌肉,精汁之清者,化而为髓,由脊骨上行入脑,名曰脑髓”[21]。指出年龄的增长,是脏腑功能减弱,神智异常的主要病因,年龄增长,脾气也随之虚弱,气血化生不足,无法充养脑髓,脑络失养,神机失用,同时脾失运化,易内生痰液,痰浊上犯,蒙蔽清窍,可见头晕神疲,反应呆钝,或终日无语,产生神志的异常改变[22]。
脾为后天之本,气血生化之源。脾可运化水液,化生水谷精微并运输至全身,脾气升清,将水谷精微上输心肺,下输膀胱;脾胃为气机升降的枢纽;且脾藏意在志为思。因此,脾与人的思想记忆有着密切联系。脾胃健运,方可使“清阳出上窍,浊阴出下窍”[23]。脾气虚弱升清受阻,亦会导致胃降浊功能受损,清阳不升浊阴不降,上不能濡养清窍,且浊气上逆,会致清窍失养,出现神疲、头昏等症状。《四圣心源》言:“己土东升……若轮枢莫运,升降失职,喜怒不生,悲恐弗作,则土气凝滞,而生忧思”[24]。脾胃气机升降功能与神智功能密切相关。脾主运化水液,发挥着对水液吸收、传输、布散功能。“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺,通调水道,下输膀胱”[25],指的是饮食的水谷经脾转化为津液向四周分散输布至其他脏腑,濡养组织器官,上达肺卫,下达膀胱,经代谢后的水液通过汗液、尿液排出体外,维持人体水液代谢平衡。脾性喜燥恶湿,若脾为湿困,影响脾气运化功能,水液正常代谢及精微输布失常,则会积生痰饮。《景岳全书》言:“盖痰涎之化,本因水谷,使脾强胃健如少壮者流,则随食随化,皆成血气,焉得留而为痰,惟其不能尽化,而十留一二,则一二为痰矣。十留三四,则三四为痰矣……而痰涎日多,由其故,正以无气,不能运化,愈虚则痰盛也”[26]。《医宗必读》云:“脾为生痰之源,治痰不理脾胃,非其治也”,指出从脾论治痰饮是治痰之要[27]。因此,从痰饮论治AD也要兼顾脾脏功能的恢复,是治病必求本的理念。顾保群[28]认为,中医痰饮的本质可涉及诸多病理学过程,炎症液体渗出、细胞和组织变性、坏死为基础的变质,多呈现为液态的“痰饮”,通过人体孔窍排出体外,形成所谓“有形之痰饮”。随着LPS诱导小胶质细胞M1激活产生的TNF-α、IL-1β、IL-6等神经炎症因子不断增加和堆积,均属于体内有形的病理物质,酷似痰饮中有形之痰的病理基础,因而可归属于“痰饮”范畴。积生痰饮,神机失用是AD的重要病理。AD整个疾病过程的生命活动呈下降趋势,类属“阴病”,痴呆中的痰饮为病,亦为阴邪,从其基本属性上看,二者相同。AD症状多以神志异常为主,而痰饮擅长蒙蔽清窍,扰乱神明致神志不清,因此二者的致病要点相符。AD还伴有多处并发症和各种不可预测的临床表现,痰饮致病广泛,病症繁杂,“痰饮善动不局,随气机升降,内而脏腑经络,外而皮肉筋骨,周身上下无所不至”“痰之为物,随气升降,无处不到”,二者致病特点相符[26]。同时,AD病程早期隐匿性强,不易诊断,且疾病进展过程缓慢,与痰饮致病病势缠绵,病程较长类似。“痰气最盛,呆气最深”[29],可见痰饮的蓄积程度与AD病程进展相关。总之,中医认为AD的病机多为虚实夹杂,常见于气血阴阳失调、脏腑亏虚,伴有瘀血、痰湿等病理产物[30],根据历代医家对AD相关临床症状及病因病机的描述和分析,结合现代中医药对AD治疗效果的实验发现,痰饮以年龄增长,脏腑虚衰为本,水液痰湿等停聚为标。
“病痰饮者,当以温药和之。”苓桂术甘汤出自张仲景《伤寒杂病论》,由茯苓、桂枝、白术、甘草四味中药组成。原方以茯苓为君,利水渗湿,健脾宁心;桂枝温经通阳,化气利水;白术补脾化湿;甘草甘平,补脾益气,调和诸药。《金匮要略·痰饮咳嗽病脉证治》云:“心下有痰饮,胸胁支满,目眩,苓桂术甘汤主之”[31]。神经炎症伴随着的炎症因子释放,这与中医痰饮范围中的“有形之痰”相似,苓桂术甘汤是治疗脾虚痰饮的基础方剂,该方通过减少多种炎症因子分泌,发挥抗炎和保护神经作用。多项研究表明,白术内酯I、桂皮醛、18β-甘草次酸等均有减少炎症因子分泌,抗炎抗氧化功能及神经保护作用,通过MAPK或NF-κB通路发挥对AD的治疗作用[32-34]。
综上,苓桂术甘汤含药血清可以显著降低经LPS激活的BV2细胞NO、TNF-α、IL-1β、IL-6等促炎因子释放,增加抗炎因子IL-10分泌,逆转LPS激活的BV2细胞由M2向M1型转变,促进其向M2型转变,减轻神经炎症反应,是治疗AD的一种策略[35-36]。因本实验只是在体外细胞模型中进行,仍需体内验证,且本实验采用的苓桂术甘汤含药血清干预BV2细胞,也需开展更多检测验证其功效。

