饲喂沉香叶对育肥黑山羊瘤胃微生物区系及其代谢物的影响
闵 力 吴林瑛 童 雄 谭 昇 孙 浩 张志飞 丁迪云 陈卫东 徐 斌* 李大刚**
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.岭南现代农业科学与技术广东省实验室河源分中心,河源 517541;3.河南农业大学动物科技学院,河南省草地资源创新与利用重点实验室,郑州 450046)
沉香(Aquilariasinensis)是瑞香科、沉香属的一种极具药用价值的植物,广泛分布于我国华南热带、亚热带地区。迄今为止,沉香中超过249种的生物活性物质已被分离和鉴定,具有广泛的生物学功效[1]。沉香叶是沉香树的非药用部位,在沉香树生长过程中需要不断修剪掉,其产量巨大。为了使沉香产业的商业价值最大化,除了沉香的药用价值外,近年来也在进行沉香叶的开发与利用[2]。
研究人员通过小鼠和临床试验对沉香叶进行了毒理学安全性评价,结果表明:食用沉香叶没有毒副作用,无安全隐患[3]。Min等[4]对沉香叶的营养成分进行了测定,发现其中含有41.85%的干物质、37.10%的有机物、11.93%的粗蛋白质、3.46%的粗脂肪、36.06%的中性洗涤纤维和31.25%的酸性洗涤纤维;能够作为反刍动物的非常规饲料原料进行利用。研究发现,与饲喂基础饲粮的对照组相比,饲喂含有20%沉香叶饲粮的试验组3~6月龄育肥黑山羊的平均日采食量(705.4 g/d vs. 697.8 g/d)和平均日增重(53.7 g/d vs. 53.5 g/d)无显著差异,但能够在一定程度上降低饲料成本;在这个过程中,试验组黑山羊血液中的胆固醇含量显著降低、血液中的高密度脂蛋白含量显著提高,饲喂沉香叶导致黑山羊机体的脂肪分解代谢增强;此外,试验组羊肉中的胆固醇含量也显著降低(366.28 mg/kg vs. 889.02 mg/kg),更有利于人体健康[4]。在前期研究基础上,本试验旨在进一步研究饲粮中添加20%沉香叶对育肥黑山羊瘤胃微生物区系及其代谢物的影响,以期从瘤胃功能变化的角度进一步完善饲喂沉香叶影响育肥黑山羊的机理,为沉香叶作为非常规饲料原料在黑山羊养殖中的开发利用提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用沉香叶采自广东省阳江市阳西县羊场周边种植的沉香树,其中营养成分含量参见文献[4]。
1.2 试验设计及饲养管理
本研究是沉香叶作为饲料原料进行的黑山羊饲养试验的系列研究的一个部分,其中试验设计、生长性能和血液生化指标等结果已经发表[4]。在此,试验设计简述如下:选取3月龄、体重(16.6±2.8) kg、健康的努比亚羊×雷州山羊杂交后代育肥阉公羊12只,随机分为2组(每组6只),分别饲喂基础饲粮(对照组)和含有20%沉香叶的试验饲粮(试验组)。对照组基础饲粮参考《肉羊饲养标准》(NY/T 816—2004)进行配制,试验组试验饲粮使用20%的沉香叶(干物质基础)部分替代对照组基础饲粮中的青贮玉米秸秆和花生藤,并保持营养水平基本一致,饲粮组成及营养水平见表1。试验期90 d。每日于08:00和17:00各饲喂1次,试验羊自由采食,自由饮水。

表1 饲粮组成及营养水平(干物质基础)
1.3 样本采集
于试验的第90天对试验羊禁食12 h后空腹称重,颈静脉放血处死,迅速取出瘤胃液,倒入无菌袋中混合均匀后,经4层纱布过滤分装至灭菌的冻存管内,放入液氮罐中冷冻保存,备用。
1.4 测定指标及方法
1.4.1 沉香叶中的生物活性物质测定
将沉香叶样品真空冷冻干燥,用研磨仪研磨(30 Hz,1.5 min)至粉末状。称取100 mg 粉末,用0.6 mL 70%甲醇提取,于4 ℃冰箱过夜。10 000×g离心10 min,吸取上清液,采用0.22 μm微孔滤膜过滤样品,并保存于进样瓶中,用于生物活性物质分析。
利用超高效液相色谱串联质谱(UPLC-MS/MS)系统(Shim-pack UFLC SHIMADZU CBM30A,Applied Biosystems 6500 QTRAP)对样本进行分析。液相和质谱条件参考Cao等[5]的方法。
1.4.2 瘤胃微生物区系测定
采用十六烷基三甲基溴化铵(CTAB)结合酚-氯仿-异戊醇法提取瘤胃微生物的DNA,测定样品DNA的浓度和纯度,确保使用的DNA样品的吸光度(OD)260/OD280在1.8~2.0。
选择细菌16S rRNA基因的V3~V4可变区进行PCR扩增。引物序列为:338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR扩增条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,进行27个循环;最后72 ℃ 10 min[6]。
回收PCR产物进行纯化,纯化后的瘤胃微生物样品根据标准操作,使用Illumina MiSeq PE 300平台进行测序,测序服务委托上海美吉生物医药科技有限公司进行。
1.4.3 瘤胃液代谢组学分析
将瘤胃液样品解冻,取50 μL样品与150 μL预冷的冰甲醇(含1 μg/mL的2-氯苯丙氨酸)旋涡混匀,于1 2000 r/min、4 ℃下离心10 min后,取上清液进行液相色谱串联质谱(LC-MS/MS)分析。液相条件为:色谱柱,Waters ACQUITY UPLC HSS T3 C18,1.8 μm,2.1 mm×100 mm;流动相,A相为超纯水(0.1%甲酸),B相为乙腈(0.1%甲酸);洗脱梯度,0 min为水∶乙腈=95∶5(体积比,后同),11.0 min为水∶乙腈=10∶90,12.0 min为水∶乙腈=10∶90,12.1 min为水∶乙腈=95∶5,14.0 min为水∶乙腈=95∶5;流速为0.4 mL/min,柱温40 ℃,进样量2 μL。质谱条件为:电喷雾离子源温度500 ℃,质谱电压5 500 V(正)、-4 500 V(负),离子源气体Ⅰ 55 psi、气体Ⅱ 60 psi,气帘气25 psi,碰撞诱导电离参数设置为高。在三重四极杆中,每个离子对根据优化的去簇电压和碰撞能进行扫描检测。
基于南京迈维生物科技有限公司MWDB数据库,根据检测物质的保留时间、字母离子对信息及二级谱数据对代谢物进行定性分析。
1.5 数据统计分析
瘤胃菌群α多样性和微生物区系组间差异显著性检验的数据采用SPSS 23.0软件进行独立样本t检验,结果以平均值和标准差表示,P<0.05为差异显著,0.05 以变量投影重要性(VIP)>1和差异倍数(FC)>2或<0.5为标准,筛选获得瘤胃液中的差异显著代谢物。 沉香叶中共检测出418种生物活性物质[4]。在前期研究基础上,将这些活性物质进行分类,并分析其所占比例。其中,黄酮类化合物占主导地位(19.38%),其次是氨基酸及其衍生物(18.66%)、脂质(15.07%)、酚酸(11.96%)、有机酸(7.89%)以及生物碱(5.26%)等(图1)。黄酮类化合物中包含了黄酮、异黄酮、黄酮醇、二氢黄酮醇、黄酮碳糖苷、黄烷醇类、花青素和查耳酮。 本试验中,各组样品测序的覆盖度均达到99%以上,采集的样品能够真实反映瘤胃微生物区系的变化。其中,与对照组相比,饲喂沉香叶对黑山羊瘤胃菌群的香农指数和辛普森指数均无显著性影响(P>0.05),有降低瘤胃菌群丰富度(Ace指数和Chao指数)的趋势(P=0.052)。 在门水平上(图2-A),黑山羊瘤胃中的优势菌群依次为:拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、软壁菌门(Tenericutes)和蓝藻门(Cyanobacteria)。饲喂沉香叶后,瘤胃中的拟杆菌门相对丰度由65.07%提高至75.86%(P=0.175),厚壁菌门相对丰度由27.61%降低至19.26%(P=0.182),软壁菌门和蓝藻门相对丰度分别由3.27%和1.02%降低至1.07%和0.29%。 在属水平上(图2-B),饲喂沉香叶后,黑山羊瘤胃中的普雷沃氏菌属1(Prevotella_1)相对丰度由38.94%提高至54.54%(P=0.097),理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)相对丰度由7.92%降低至4.96%,未定级_f_F082(norank_f_F082)相对丰度由2.08%提高至8.47%(P=0.080);瘤胃中未定级_f_拟杆菌目RF16群(norank_f_Bacteroidales_RF16_group,6.01%)、未分类_f_毛螺菌科(unclassified_f_Lachnospiraceae,3.22%)、未定级_f_普雷沃氏菌科(norank_f_Prevotellaceae,3.04%)、假丁酸弧菌属(Pseudobutyrivibrio,3.51%)、普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003,3.09%)相对丰度均降低至3%以下。 Class Ⅰ:物质Ⅰ级分类;Class Ⅱ:物质Ⅱ级分类;Alkaloids:生物碱;Amino acids and derivatives:氨基酸及其衍生物;Anthocyanins:花青素;Anthraquinone:蒽醌;Chalcones:查耳酮;Coumarins:香豆素;Dihydroflavonol:二氢黄酮醇;Flavanols:黄烷醇类;Flavonoid:黄酮;Flavonoids:黄酮类化合物;Flavonoid carbonoside:黄酮碳糖苷;Flavonols:黄酮醇;Free fatty acids:游离脂肪酸;Glycerol ester:甘油酯;Isoflavones:异黄酮;Lignans and coumarins:木脂素和香豆素;Lignans:香豆素;Lipids:脂质;LPC:溶血磷脂酰胆碱 lysophosphatidylcholine;LPE:溶血磷脂酰乙醇胺 lysophosphatidyl ethanolamine;Monoterpenoids:倍萜;Nucleotides and derivatives:核苷酸及其衍生物;Organic acids:有机酸;Others:其他类;PC:磷脂酰胆碱 phosphatidylcholine;Phenolamine:酚胺;Phenolic acids:酚酸;Plumerane:吲哚类生物碱;Proanthocyanidins:原花青素;Quinones:醌类;Saccharides and alcohols:糖及醇类;Sphingolipids:鞘脂;Tannins:单宁酸;Terpenoids:萜类;Triterpene:三萜;Triterpene Saponin:三萜皂苷;Vitamin:维生素;Xanthone:口山酮。 组间差异显著性检验的结果(图3-A)表明:饲喂沉香叶的黑山羊瘤胃中普雷沃氏菌科UCG-003、未定级_f_普雷沃氏菌科(norank_f_Veillonellaceae)、未定级_f_拟杆菌目BS11肠道群(norank_f_Bacteroidales_BS11_gut_group)、毛螺菌科ND3007群(Lachnospiraceae_ND3007_group)、帕匹杆菌属(Papillibacter)以及未定级_f_未定级_o_红蝽菌目(norank_f_norank_o_Coriobacteriales)等相对丰度显著降低(P<0.05);瘤胃中厌氧弧菌属(Anaerovibrio)、丹毒丝菌科UCG-009(Erysipelotrichaceae_UCG-009)、疣微菌科UCG-004(Ruminococcaceae_UCG-004)和颤螺菌属(Oscillospira)相对丰度显著提高(P<0.05)。 A:门水平 at phylum level;B:属水平 at genus level;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Tenericutes:软壁菌门;Cyanobacteria:蓝藻门;Prevotella_1:普雷沃氏菌属1;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;Norank_f_F082:未定级_f_F082;Norank_f_Bacteroidales_RF16_group:未定级_f_拟杆菌目RF16群;Unclassified_f_Lachnospiraceae:未分类_f_毛螺菌科;Norank_f_Prevotellaceae:未定级_f_普雷沃氏菌科;Pseudobutyrivibrio:假丁酸弧菌属;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003;Succiniclasticum:解琥珀酸菌属;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群;Lachnospiraceae_XPB1014_group:毛螺菌科XPB1014群;Anaeroplasma:厌氧原体属;Veillonellaceae_UCG-001:韦荣球菌科UCG-001;Selenomonas_1:月形单胞菌属1;[Ruminococcus]_gauvreauii_group:[瘤胃球菌属] gauvreauii群;Unclassified_c_Mollicutes:未分类_c_柔膜菌纲;Unclassified_f_Veillonellaceae:未分类_f_韦荣球菌科;Oribacterium:假丁酸菌属;Others:其他。 LEfSE多级物种差异判别分析的结果(图3-B)表明:饲喂沉香叶的黑山羊瘤胃中毛螺菌科XPB1014群(g_Lachnospiraceae_XPB1014_group)、未分类_c_柔膜菌纲(unclassified_c_Mollicutes)、未分类_f_韦荣球菌科(unclassified_f_Veillonellaceae)、红蝽菌目(o_Coriobacteriales)及帕匹杆菌属等相对丰度降低;f_F082、纤维杆菌从纤维杆菌门(Fibrobacteres)至纤维杆菌属(Fibrobacter)以及丹毒丝菌从丹毒丝菌纲(Erysipelotrichia)至丹毒丝菌科UCG-004(g_Erysipelotrichaceae_UCG-004)相对丰度均提高。 在黑山羊瘤胃液中共鉴定出450种代谢物(图4-A)。其中,饲喂沉香叶导致瘤胃液中26种代谢物含量显著提高,其中牛磺鹅去氧胆酸(log2FC=16.55)和马尿酸(log2FC=14.57)含量的变化最大(表3,图4-B);54种代谢物含量显著降低,其中4-香豆酸(log2FC=-14.26)含量的变化最大(表4,图4-B)。差异代谢物的京都基因与基因组百科全书(KEGG)富集分析显示:饲喂沉香叶主要影响了黑山羊瘤胃中的代谢途径(metabolic pathways)、蛋白质消化吸收(protein digestion and absorption)、氨基酸生物合成(biosynthesis of amino acids)和ABC转运蛋白(ABC transporters)等通路(图4-C)。 沉香叶具有抗炎、抗菌、抗氧化及保护肝脏等多种功效[7]。在肉鸡饲粮中添加2%的沉香叶粉能够显著提高其生长性能、屠宰性能和饲粮养分消化率,提高免疫器官指数以及抗氧化和血脂分解代谢能力[8-9]。作为反刍动物的非常规饲料原料,饲喂含有20%沉香叶的饲粮能够显著降低黑山羊血液中的胆固醇含量,促进脂肪分解代谢[4],这可能是由于沉香叶中富含黄酮和酚酸等促进脂肪分解代谢的生物活性物质[10-11]。沉香叶中的芫花素、山奈酚、芒果苷等酚酸类活性物质能够发挥过氧化物酶体增殖物激活受体(PPAR)激动剂的作用效果[12],在临床上能够有助于治疗人体的高胆固醇血症。此外,沉香叶中的生物碱、单宁酸、萜类等活性物质,具有降低机体血脂的作用[13-15]。 A:组间差异显著性检验 significance test of differences between groups;B:LEfSE多级物种差异判别分析 LEfSE multilevel discriminant analysis of species differences;Prevotellaceae_UCG-003:普雷沃氏菌科UCG-003;Norank_f_Veillonellaceae:未定级_f_韦荣球菌科;Anaerovibrio:厌氧弧菌属;Norank_f_Bacteroidales_BS11_gut_group:未定级_f_拟杆菌目BS11肠道群;Lachnospiraceae_ND3007_group:毛螺菌科ND3007群;Erysipelotrichaceae_UCG-009:丹毒丝菌科UCG-009;Ruminococcaceae_UCG-004:疣微菌科UCG-004;Papillibacter:帕匹杆菌属;Norank_o_Coriobacteriales:未定级_o_红蝽菌目;norank_f_norank_o_Coriobacteriales:未定级_f_未定级_o_红蝽菌目;Oscillospira:颤螺菌属;Lachnospiraceae_XPB1014_group:毛螺菌科XPB1014群;Unclassified_c_Mollicutes:未分类_c_柔膜菌纲;Unclassified_f_Veillonellaceae:未分类_f_韦荣球菌科;Pseudomonadales:假单胞菌目;[Eubacterium]_ventriosum_group:凸腹真杆菌群;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Coprococcus_2:粪球菌属2;Norank_f_F082:未定级_f_F082;Fibrobacterales:纤维杆菌目;Fibrobacteria:纤维杆菌纲;Fibrobacteres:纤维杆菌门;Fibrobacteraceae:纤维杆菌科;Fibrobacter:纤维杆菌属;Erysipelotrichaceae:丹毒丝菌科;Erysipelotrichia:丹毒丝菌纲;Erysipelotrichales:丹毒丝菌目;Prevotellaceae_UCG-004:普雷沃氏菌科UCG-004。 不过,沉香叶是如何通过调节黑山羊机体脂质代谢信号通路从而发挥降血脂的作用机制,需要进一步的研究和验证。后续可对黑山羊血液和肌肉中的脂类物质进行深入解析,检测肌肉中与脂肪代谢相关的标志基因变化。本文重点关注饲喂沉香叶对黑山羊瘤胃功能的影响,并结合前期研究结果,解析瘤胃、血液、肌肉三者之间所发生变化的内在关联。 研究表明,胃肠道中拟杆菌门的相对丰度与宿主机体的体脂含量呈显著负相关[16],拟杆菌门相对丰度的提高有利于增强宿主的脂肪分解代谢能力。在本试验中,饲喂沉香叶后,黑山羊瘤胃中拟杆菌门的相对丰度由65.07%提高至75.86%,这一趋势与黑山羊血液和肌肉中胆固醇含量显著降低的结论[4]相一致,这也进一步佐证了饲喂沉香叶可能导致机体脂肪分解代谢激活的推论。在本试验中,饲喂沉香叶导致黑山羊瘤胃中普雷沃氏菌科UCG-003的相对丰度显著降低。Hassan等[17]给奶水牛饲喂含有印度獐牙菜叶子等植物混合物后,瘤胃中普雷沃氏菌科UCG-003的相对丰度也出现了显著降低。给滩羊饲喂桑叶青贮替代苜蓿青贮的饲粮,导致瘤胃中普雷沃氏菌科UCG-003的相对丰度降低;且普雷沃氏菌科UCG-003的相对丰度与滩羊血液中的丙二醛含量呈正相关,与血液总抗氧化能力和超氧化物歧化酶活性呈负相关[18]。然而,目前尚不能确定普雷沃氏菌科UCG-003菌群变化在这一过程中发挥的生物学功能。 表3 饲喂沉香叶后黑山羊瘤胃液中含量显著提高的26种代谢物 表4 饲喂沉香叶后黑山羊瘤胃液中含量显著提高的54种代谢物 续表4编号 No.代谢物 Metabolites代谢物类别 Metabolite categories变量投影重要性 VIPlog2差异倍数 log2FC编号 No.代谢物 Metabolites代谢物类别 Metabolite categories变量投影重要性 VIPlog2差异倍数 log2FC95′-单磷酸-2′-脱氧腺苷核苷酸及其代谢物1.66-2.0436甘氨酰苯基丙氨酸氨基酸及其代谢物1.54-1.3810二甲基鸟苷核苷酸及其代谢物1.17-1.9837L-亮氨酸氨基酸及其代谢物1.04-1.3711L-鸟氨酸氨基酸及其代谢物1.54-1.9538L-天冬氨酸-L-苯丙氨酸氨基酸及其代谢物1.24-1.37127-甲基鸟嘌呤核苷酸及其代谢物1.55-1.9339反-4-羟基-L-脯氨酸氨基酸及其代谢物1.03-1.37132-苯基乙酰胺苯及其衍生物1.20-1.9240胆碱胆碱类1.44-1.3514L-蛋氨酸氨基酸及其代谢物1.61-1.8741十三烷酸脂质1.80-1.30152,6-二氨基庚二酸有机酸及其衍生物1.30-1.87425-尿嘧啶核苷酸核苷酸及其代谢物1.44-1.29162′-脱氧尿苷核苷酸及其代谢物1.04-1.8643L-瓜氨酸氨基酸及其代谢物1.11-1.2917L-异亮氨酸氨基酸及其代谢物1.19-1.8444L-酪氨酸氨基酸及其代谢物1.33-1.2718L-苯丙氨酸氨基酸及其代谢物1.58-1.8445N′-甲酰基犬尿氨酸有机酸及其衍生物1.71-1.2619阿拉伯糖醇碳水化合物及其代谢物1.52-1.8146吲哚-3-乙酸吲哚及其衍生物1.75-1.2520乙酰基组胺有机酸及其衍生物1.64-1.77472-甲基苯甲酸苯及其衍生物1.31-1.2321阿斯巴甜有机酸及其衍生物1.01-1.7448尿刊酸有机酸及其衍生物1.29-1.1822黄嘌呤核苷酸及其代谢物1.43-1.6849N-异戊酰氨基乙酸氨基酸及其代谢物1.56-1.1723DL-O-酪氨酸有机酸及其衍生物1.33-1.6550甘氨鹅脱氧胆酸胆汁酸1.04-1.1624色胺色胺及其衍生物1.89-1.6551D-海藻糖碳水化合物及其代谢物1.07-1.14254,4′-二氨基二苯基甲烷苯及其衍生物1.37-1.6252马来酸有机酸及其衍生物1.86-1.0826氯化胆碱其他1.65-1.6053ω-羟基十二烷酸脂质2.08-1.0727DL-亮氨酸氨基酸及其代谢物1.14-1.5754L-脯氨酸氨基酸及其代谢物1.77-1.04 帕匹杆菌属是瘤胃中的一类丁酸产生菌,富含有机酸的环境不利于帕匹杆菌属的生长[19]。沉香叶中含有33种有机酸(占比7.89%),饲喂20%沉香叶可能导致黑山羊瘤胃中帕匹杆菌属的生长受到抑制,帕匹杆菌属的相对丰度显著降低。未定级_f_F082是拟杆菌目的一类未知菌属,Han等[20]研究表明,饲喂桑叶青贮替代玉米青贮和豆粕的饲粮后,滩羊瘤胃中未定级_f_F082的相对丰度显著提高,且未定级_f_F082与滩羊瘤胃的发酵参数密切相关,认为其在非常规饲料(桑叶青贮)的消化利用过程中发挥着重要的作用。本试验中,饲喂沉香叶后黑山羊瘤胃中未定级_f_F082的相对丰度由2.08%提高至8.47%。 普雷沃氏菌属1是瘤胃中的优势菌群,能够消化和利用植物来源的淀粉、单糖和非纤维素多糖等营养成分并提供能量[21]。普雷沃氏菌属1还与蛋白质和多肽的消化吸收以及瘤胃中的氨基酸代谢相关[22],泌乳奶牛直接饲喂布氏普雷沃氏菌25A(Prevotellabryantii25A)能够显著提高瘤胃中氨态氮含量[23]。瘤胃中普雷沃氏菌属1相对丰度的提高有利于增加饲粮中营养成分的消化利用[24-25]。此外,Li等[26]和Zhang等[27]研究发现,在饲料利用效率高的肉牛和绵羊的瘤胃中,韦荣球菌科(Veillonellaceae)的相对丰度均降低。在本试验中,饲喂沉香叶有提高瘤胃中普雷沃氏菌属1相对丰度的趋势,并降低了韦荣球菌科的相对丰度。尽管黑山羊的平均日采食量和增重无显著差异[4],但瘤胃中未定级_f_F082、普雷沃氏菌属1和韦荣球菌科的相对丰度变化有利于饲粮中营养成分的消化利用。 研究表明,厌氧弧菌属参与了瘤胃中的脂肪分解代谢[28],将脂肪分解成脂肪酸。饲喂120 g/d富含花青素(黄酮类化合物)的甘蓝提取物,能够显著提高西门塔尔育肥牛瘤胃中厌氧弧菌属的相对丰度,改善瘤胃的脂肪代谢[29]。此外,有研究指出,毛螺菌科XPB1014群的相对丰度与体脂呈负相关[30];饲喂桑叶青贮替代苜蓿青贮的饲粮,导致滩羊瘤胃中毛螺菌科XPB1014群的相对丰度降低,生物氢化过程被抑制,更多的不饱和脂肪酸被消化吸收利用[18]。本试验中,与饲喂基础饲粮相比,饲喂沉香叶显著提高了育肥黑山羊瘤胃中厌氧弧菌属的相对丰度,降低了毛螺菌科XPB1014群的相对丰度;这2种菌群的变化能够促进瘤胃中脂肪分解代谢,从而导致黑山羊机体的脂肪分解代谢增强,羊肉中的胆固醇含量降低。然而,这2种菌是否直接参与了胆固醇的代谢有待进一步的研究。 牛磺鹅去氧胆酸是动物胆汁酸的主要活性物质,具有调节胆固醇和脂肪代谢的作用。牛磺鹅去氧胆酸在微生物的作用下产生鹅去氧胆酸激活法尼醇X受体(FXR)通路,通过调节胆固醇7α-羟化酶(CYP7A1)的表达从而控制胆固醇的代谢。给大鼠灌胃牛磺鹅去氧胆酸能够显著提高肝脏中FXR的基因和蛋白表达量[31]。Huang等[32]在高脂肪饮食小鼠饲粮中添加15 mg/kg石斛生物碱,试验组小鼠肝脏中牛磺鹅去氧胆酸含量显著增加,FXR基因表达量提高,表明其可以促进机体胆固醇排泄,减少肝脏脂质积累,改善肝脏脂质稳态。饲喂沉香叶能够显著提高黑山羊瘤胃液中牛磺鹅去氧胆酸的含量,其可通过瘤胃壁吸收进入血液循环,在肝脏中代谢调节胆固醇,促进脂肪分解代谢。瘤胃液中另一个潜在的生物标志物——马尿酸来源于饲粮中的蛋白质降解,同时也是微生物代谢产物苯甲酸与甘氨酸反应的产物[33]。瘤胃中苯甲酸的积累会对动物产生毒副作用,在本试验中,马尿酸不仅作为饲喂沉香叶的黑山羊瘤胃中的生物标志物,还能够清除苯甲酸可能产生的毒副作用。 饲喂沉香叶导致黑山羊血液和肌肉中的4-对羟基苯甲酸甲酯含量均显著提高[4],4-对羟基苯甲酸甲酯属于一类防腐剂,不常见于生物体。通过对沉香叶中的生物活性物质分析发现,沉香叶中含有4-羟基苯甲酸(酚酸类)。4-羟基苯甲酸和甲醇可通过2个酶促反应生成4-对羟基苯甲酸甲酯[34]。沉香叶中的4-羟基苯甲酸经瘤胃微生物代谢形成差异代谢物4-对羟基苯甲酸甲酯,后经瘤胃壁进入黑山羊的血液循环并沉积在肌肉组织。 饲喂沉香叶导致黑山羊血液中29种差异代谢物含量显著提高,5种差异代谢物含量显著降低;肌肉中14种差异代谢物含量显著提高,12种差异代谢物含量显著降低[4]。在本试验中,饲喂沉香叶导致瘤胃液中26种差异代谢物含量显著提高,54种差异代谢物含量显著降低;相比血液和肌肉,沉香叶对黑山羊瘤胃微生物区系的影响更大。其中,瘤胃液中含量显著提高的代谢物:对羟基苯乙醇、十六烷二酸和4-对羟基苯甲酸甲酯,在血液中也呈现显著提高。瘤胃液中含量显著提高的代谢物:香草酸和4-对羟基苯甲酸甲酯,在肌肉中也呈现显著提高。由此可见,4-对羟基苯甲酸甲酯是瘤胃、血液和肌肉中共同提高的差异代谢物,可能来源于沉香叶中的活性物物质4-羟基苯甲酸。 ① 饲喂沉香叶有提高育肥黑山羊瘤胃普雷沃氏菌属1相对丰度的趋势,并提高了未定级_f_F082的相对丰度,降低了韦荣球菌科的相对丰度,有利于饲粮中营养成分的消化利用。 ② 饲喂沉香叶后,育肥黑山羊瘤胃中的拟杆菌门相对丰度由65.07%提高至75.86%,并提高了育肥黑山羊瘤胃中厌氧弧菌属的相对丰度,降低了毛螺菌科XPB1014群的相对丰度。 ③ 黑山羊瘤胃液中的牛磺鹅去氧胆酸、马尿酸和4-对羟基苯甲酸甲酯能够作为饲喂沉香叶后的潜在生物标志物。2 结果与分析
2.1 沉香叶中的生物活性物质分析
2.2 饲喂沉香叶对黑山羊瘤胃微生物区系的影响


2.3 饲喂沉香叶对黑山羊瘤胃中代谢物的影响
3 讨 论
3.1 沉香叶中的生物活性物质分析
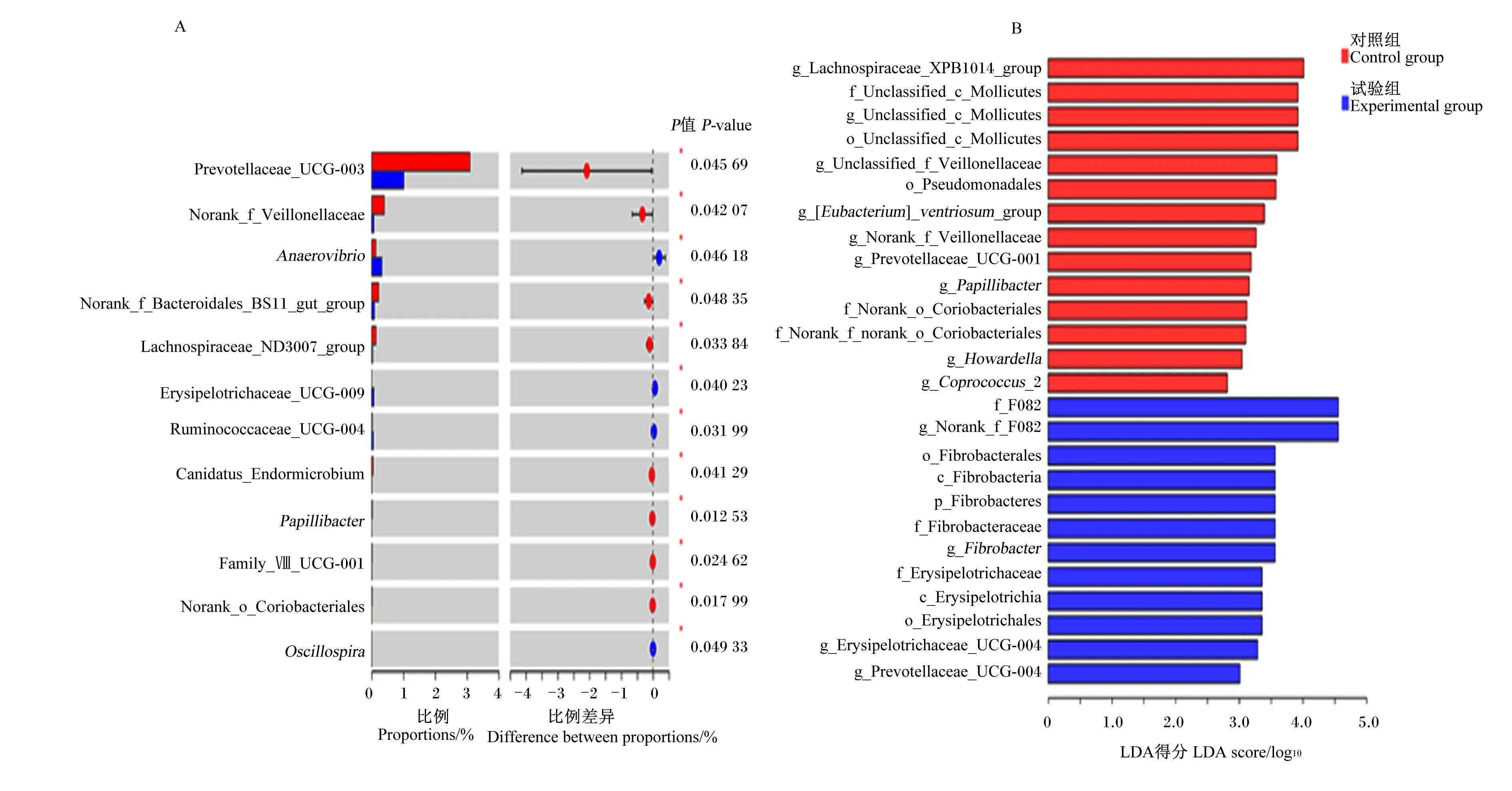
3.2 饲喂沉香叶对黑山羊瘤胃微生物区系的影响
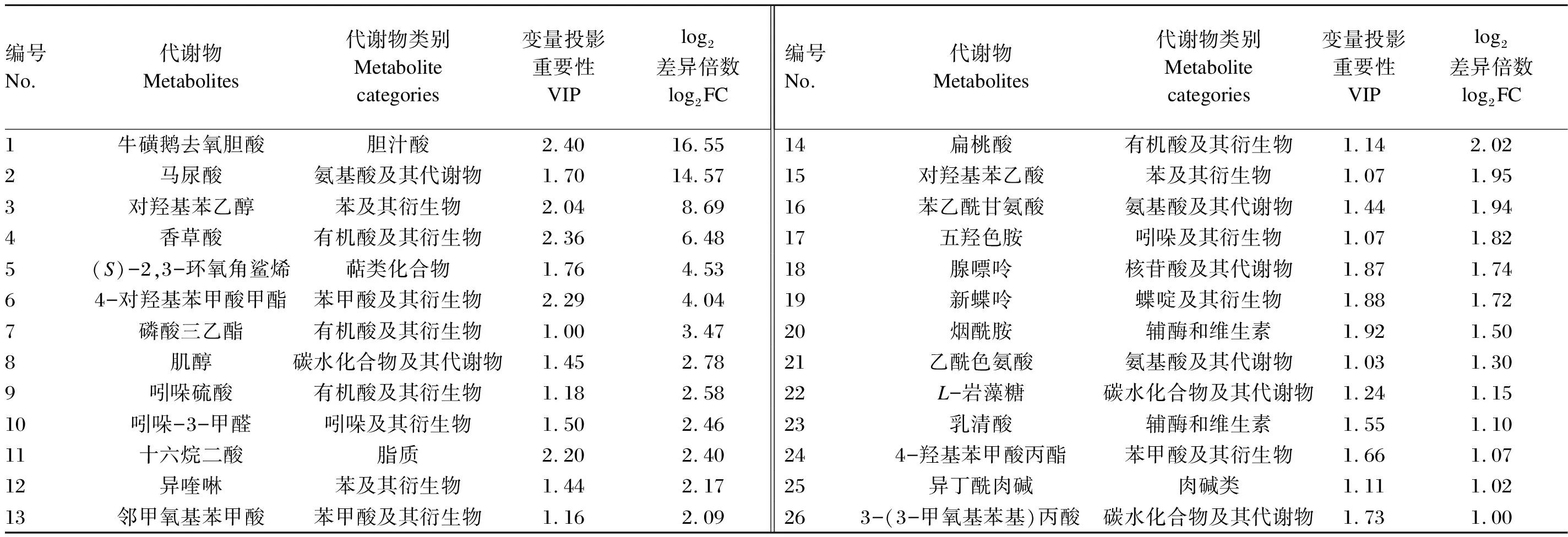
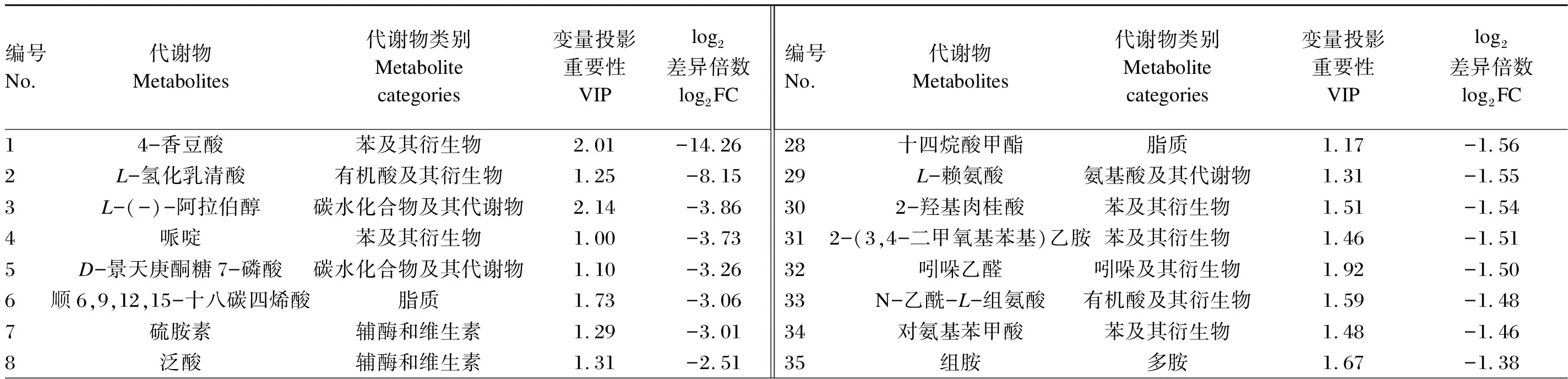
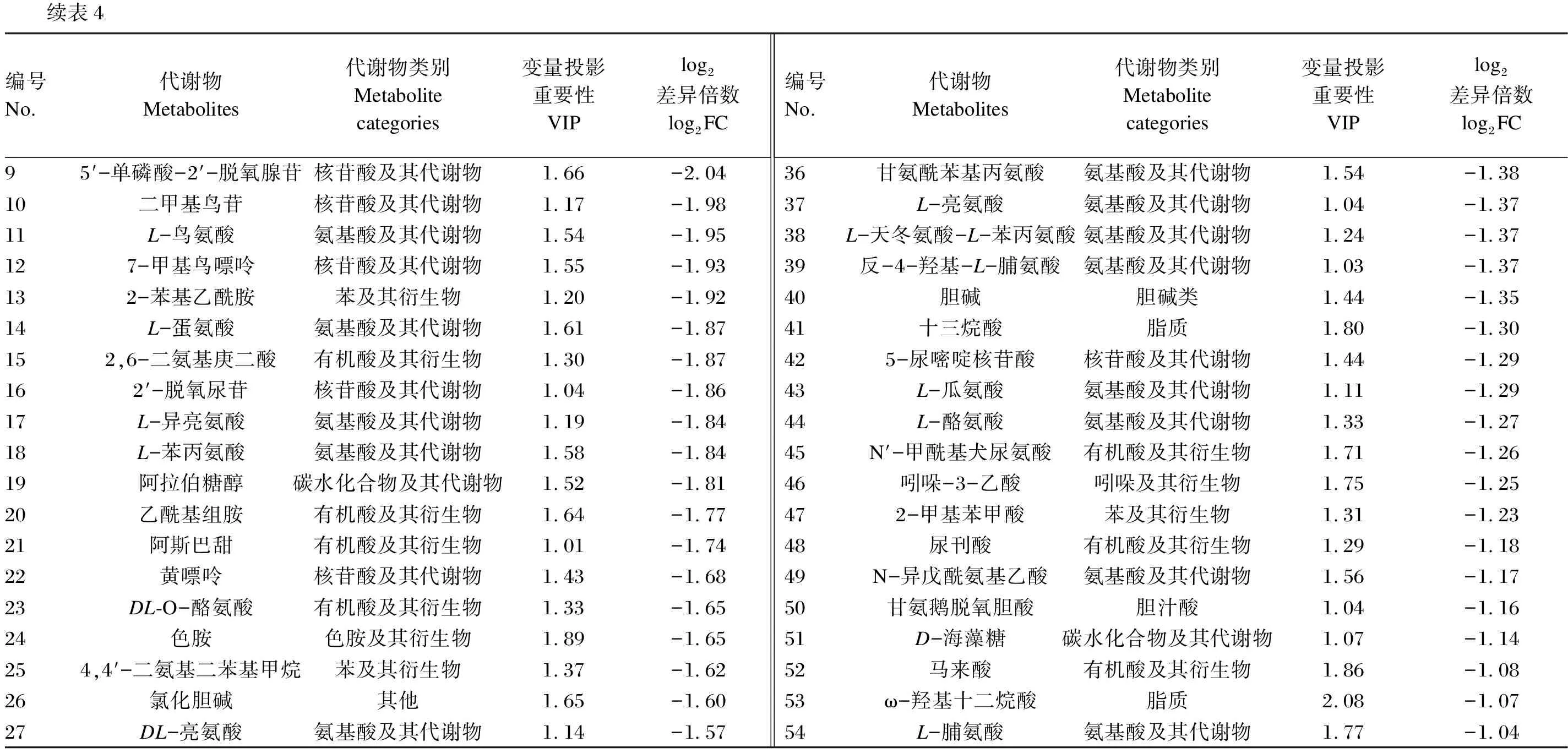
3.3 饲喂沉香叶对黑山羊瘤胃中代谢物的影响
4 结 论

