海藻酶解物对体外培养大黄鱼肠道菌群结构和短链脂肪酸合成的影响
王登峰 张 露 梁 萍 秦志清 王 磊 江和基 黄志坚 林建斌* 殷光文*
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.福建农林大学,福建省动物药物工程实验室,福州 350002;3.福建省淡水水产研究所,福州 350002)
大黄鱼(Larimichthyscrocea)是我国重要经济鱼种,2021年,我国大黄鱼的产量超过25万t,以网箱养殖为主,主要集中在福建、浙江、广东和江苏等沿海地区,其中福建是核心养殖区,产量占80%以上[1-2]。随着养殖规模的不断壮大,养殖密度、养殖用水和饲料质量等各种问题不断涌现,导致大黄鱼养殖中变形假单胞菌病、弧菌病、细菌性肠炎病、盾形纤毛虫病、刺激隐核虫病等细菌性和寄生虫疾病频发,其中细菌性疾病是养殖过程中的主要病害[1]。肠道是细菌侵入的主要途径,肠道健康有益于机体整体健康[3]。肠道菌群是肠道健康的基础,其厌氧发酵碳水化合物产生的短链脂肪酸(short-chain fatty acids,SCFAs)可调节肠道和宿主健康[4-5]。
肠道菌群合成的SCFAs包括乙酸(acetic acid,AA)、丙酸(propionic acid,PA)、丁酸(butyric acid,BA)、异丁酸(isobutyric acid,IBA)、戊酸(valeric acid,VA)、异戊酸(isovaleric acid,IVA)、己酸(caproic acid,CA)和异己酸(isocaproic acid,ICA),可作为细菌自身和宿主肠上皮细胞的能量来源,促进细胞生长、降低肠内环境pH和减少有害菌生长,也可调节宿主肠道免疫力和降低肠道炎症反应[6]。肠道菌群合成的SCFAs中乙酸、丙酸和丁酸含量较高,占80%以上[7-8]。有关哺乳动物肠道菌群与健康的研究表明,肠道菌群产生的丁酸可诱导CD4+T细胞和先天性淋巴细胞(ILC)产生白细胞介素-22(IL-22)以维持肠道稳态[9]。但有关鱼类肠道菌群与SCFAs关系的研究较少,目前仅有报道显示斑马鱼肠道菌群可以产生SCFAs,并发现丁酸可减少中性粒细胞和M1型促炎巨噬细胞向伤口的募集而产生抗炎作用,且在鱼类中存在保守性丁酸分子受体使这种抗炎作用具有普遍性,但丙酸在斑马鱼上具有促炎作用,与其在哺乳动物中的抗炎作用不一致[10]。
近年来,我国研究人员对大黄鱼消化道菌群[3,11-12]、菌群与健康的关系[4]以及不同养殖模式消化道菌群的差异[12-13]等方面进行了细致研究,并研究了不同饲料原料与添加剂[14-16]、饲喂模式[17]等对大黄鱼肠道菌群的影响,但大黄鱼肠道菌群是否合成SCFAs以及不同SCFAs的合成与肠道菌群的相关性尚未见报道。鉴于此,本试验使用添加0.5%的不同海藻酶解物(复合海藻酶解物与海带酶解物)的培养基厌氧培养大黄鱼的肠道菌群,通过检测培养物中不同SCFAs的含量和相应菌群组成,研究不同海藻酶解物对大黄鱼肠道菌群结构组成的影响以及肠道菌群与不同SCFAs合成的相关性,为大黄鱼肠道菌群与健康的相关性研究以及开发海藻酶解物作为大黄鱼饲料添加剂提供数据支持。
1 材料与方法
1.1 试验试剂
厌氧培养基为GAM培养基(青岛高科园海博生物技术有限公司),每升GAM培养基含有胨10 g、大豆胨3 g、酵母浸粉5 g、牛肉粉2.2 g、消化血清粉13.5 g、牛肝浸粉1.2 g、葡萄糖3 g、磷酸二氢钾(KH2PO4)2.5 g、可溶性淀粉5 g、L-半胱氨酸盐0.3 g、硫乙醇酸钠0.3 g,按照说明书配制后调节pH至6.8。
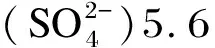
1.2 试验方法
1.2.1 大黄鱼肠道菌群的采集与处理
2022年5月30日采集福建省宁德海域网箱养殖、投喂冰鲜杂鱼糜,近3个月内无使用抗生素的1岁龄健康存活状态大黄鱼(体重150~200 g、体长20~24 cm)4尾。无菌环境下,采用75%酒精擦拭活体大黄鱼体表,解剖,提取消化道,收集每尾鱼的小肠和直肠内容物,混匀,使用经灭菌的GAM培养基按1 g∶9 mL的比例配制成肠道菌液YC1、YC2、YC3、YC4,冷藏备用。
1.2.2 肠道菌群的体外培养
体外培养试验分为3组;BC组,GAM培养基,作为对照组;TA组,GAM培养基中添加0.5%(质量体积分数)复合海藻酶解物;TD组,GAM培养基中添加0.5%(质量体积分数)海带酶解物。每组准备玻璃大试管4支,分装培养基9 mL/支,放入硬蜡3~5 g/支,同时做污染控制组3支(GAM培养基),115 ℃高压20 min灭菌。冷却至室温后,添加过滤除菌的脱氧氯化血红素和维生素K,最终浓度分别为12.5和2.5 mg/L,随后加入1 mL(10%比例添加)已配制好的肠道菌液YC1、YC2、YC3、YC4至各组的4个大试管中,蜡封,上下颠倒充分混匀。污染控制组使用灭菌的GAM培养基做平行操作。各组在25 ℃、100 r/min下培养24 h,在污染控制组清亮无浑浊前提下对试验组进行采样,将每个试管颠倒混匀后从中取3 mL,-80 ℃保存。
1.2.3 指标测定与分析
SCFAs的定性定量分析、肠道菌群培养物的16S rDNA扩增子测序与以及SCFAs与肠道菌群的关联分析均委托武汉迈维代谢有限公司进行。16S rDNA扩增子测序使用NovaSeq PE250方案,经过Reads拼接过滤,操作分类单元(operational taxonomic units,OTUs)聚类,进行物种注释及丰度分析、α多样性分析和β多样性分析等。SCFAs样品制备过程如下:1)样本解冻后,涡旋1 min混匀,12 000 r/min、4 ℃条件下离心10 min;2)取样本上清50 μL加入到对应的1.5 mL离心管中,加入100 μL 0.5%磷酸溶液,涡旋3 min;3)加入150 μL含内标的MTBE溶剂,涡旋3 min,冰浴下超声5 min,之后在12 000 r/min、4 ℃条件下离心10 min;4)离心完后吸取上层清液90 μL到有玻璃内衬管的进样瓶中,-20 ℃冰箱保存,待气相色谱-质谱联用(GC-MS/MS)分析。色谱分析条件如下:色谱柱为Agilent DB-FFAP(30 m×0.25 mm,0.25 μm);设置进样口温度200 ℃,检测器温度230 ℃,进样量为2 μL;升温程序为1 min内升温至90 ℃,随后以25 ℃/min升至100 ℃,再以20 ℃/min升至150 ℃,150 ℃保持0.6 min,然后以25 ℃/min升至200 ℃,200 ℃保持 0.5 min,运行3 min;设定分流比为1∶1;注流量为1.2 mL/min。
1.3 统计分析
数据以平均值±标准差表示,用SPSS 23软件进行方差分析和t检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 SCFAs合成量
由图1可知,大黄鱼肠道菌群在体外不同培养条件下均可以合成SCFAs。其中,使用GAM培养基培养时(BC组)乙酸的合成量达到5.660 mmol/L,乙酸、丙酸和丁酸的比例约为94∶5∶1;使用添加0.5%复合海藻酶解物的GAM培养基培养时(TA组)乙酸、丙酸和丁酸的比例变为92∶4∶4,丁酸的合成量可达0.266 mmol/L,极显著高于BC组的0.041 mmol/L和TD组(使用添加0.5%海带酶解物的GAM培养基培养)的0.075 mmol/L(P<0.01),且戊酸的合成量3.5倍于BC组(0.000 1 mmol/L),同时丙酸的合成量由BC组的0.291 mmol/L降至0.234 mmol/L,且合成SCFAs的总量增加,但不同个体肠道菌群合成丙酸能力差异较大;与BC组相比,GAM培养基中加入0.5%海带酶解物仅极显著增加了戊酸的合成量(P<0.01)。
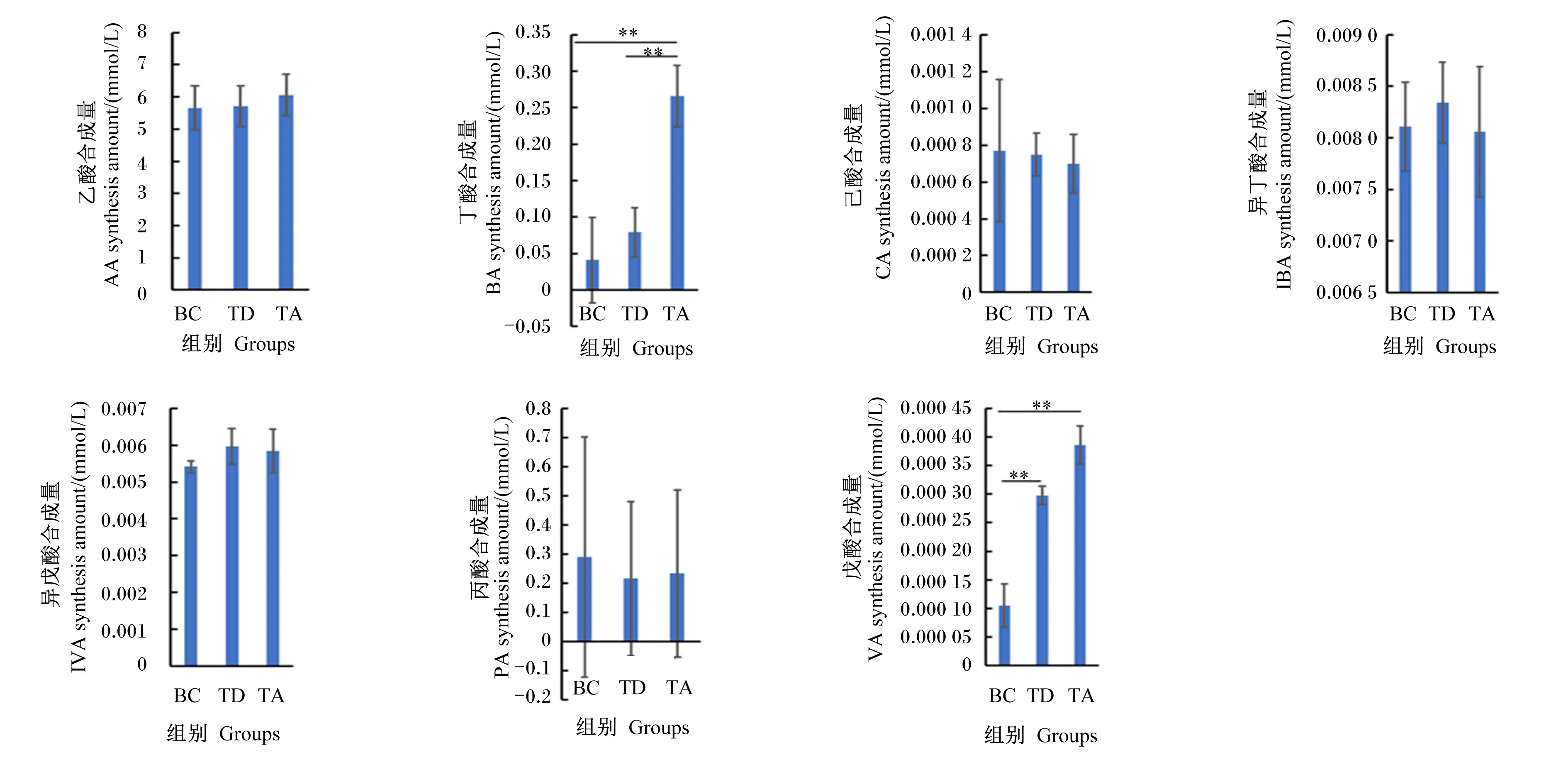
数据柱显示为“平均值±标准差”,P<0.01标注为“**”。
2.2 肠道菌群结构特征
2.2.1 分组差异性分析
大黄鱼肠道菌群体外不同培养条件下产生的丁酸和戊酸有极显著差异,肠道菌群的改变可能是造成这种差异的主要原因,因此使用16S rDNA扩增子测序技术对肠道菌群结构进行进一步研究。肠道菌群体外培养物经16S rDNA扩增子测序后,首先基于Unweighted Unifrac距离进行主坐标分析(principal co-ordinates analysis,PCoA),PCoA图中样本距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样本倾向于聚集在一起,群落结构差异很大的样本则会分开。PCoA图(图2)显示,TA组的样本基本聚集在相对独立的群落,与TD组和BC组样本距离较远;TD组和BC组样本群落间有距离,但距离较近。
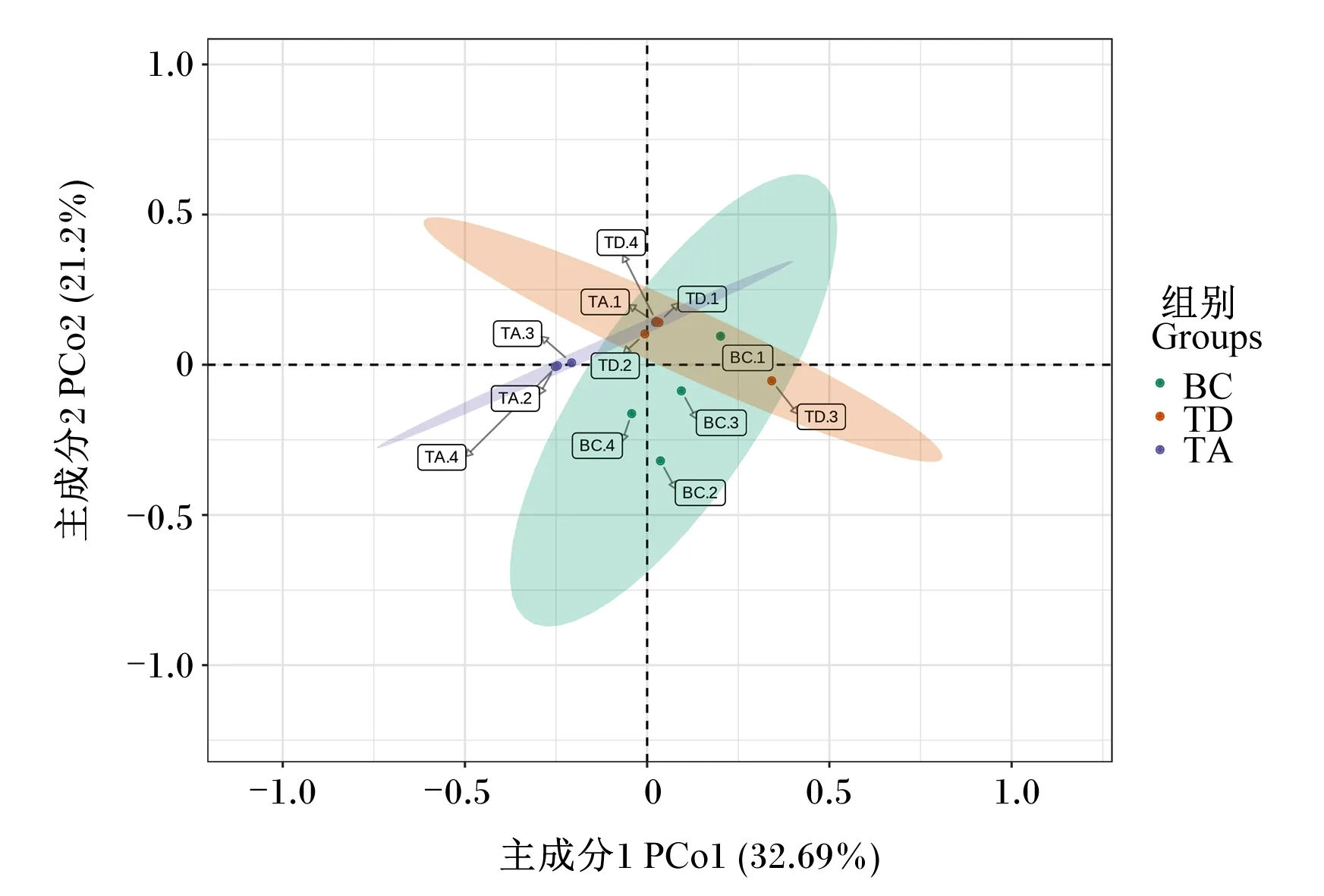
基于Unweighted Unifrac距离的PCoA,方差分析:P=0.004。图中的每个点表示一个样本,同一个组的样本使用同一种颜色表示,颜色区域代表置信区间。
使用非参数检验方法Anosim分析检验组间的差异是否显著大于组内差异,并基于Bray-Curtis距离值的秩次进行组间差异显著性检验。结果表明,BC组与TD组的组内差异大于组间差异(R=-0.146),TA组与BC组(R=0.240)和TD组(R=0.208)的组间差异显著,但显示统计分析的可信度不具有显著性(P>0.05),见图3。
2.2.2 样本差异性分析
使用α多样性指数进行组间样本的差异性分析,并使用可以直观反映组内物种多样性中位数值、离散程度、最大值、最小值、异常值的箱形图展示。Observed_species指数、Shannon指数、Simpson指数、Chao1指数、ACE指数和PD_whole_tree指数均显示3个组存在差异,除Simpson指数的中位数值中BC组>TD组外,其他各指数的中位数值均表现TA组>TD组>BC组,见图4。
2.2.3 菌群特征和变化
对大黄鱼肠道菌群同步进行BC组、TD组和TA组3种条件的体外培养,基于OTUs绘制韦恩图(图5)。对OTUs数量的统计、比较显示,BC组OTUs有653个,TD组有626个,TA组有945个;相较于BC组,TD组和TA组分别独有192和371个OTUs;相较于TD组,TA组独有347个OTUs。
对同一大黄鱼肠道菌群在体外不同条件下培养后的α多样性变化进行分析,结果(图6)显示,试验鱼1(Fish 1)肠道菌群的Observed_species指数、Simpson指数、Shannon指数、Chao1指数、ACE指数和PD_whole _tree指数明显不同于其他3条试验鱼(Fish 2、Fish 3和Fish 4),其他试验鱼的上述指数均表现为TA组大于BC组和TD组。
大黄鱼肠道菌群经GAM培养基体外培养(BC组)后,优势菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和梭杆菌门(Fusobacteriota),三者相对丰度之和占总测序丰度的98%以上;GAM培养基中添加0.5%海带酶解物(TD组)后,优势菌门转换为厚壁菌门、变形菌门,两者相对丰度之和占总测序丰度的90%以上;GAM培养基中添加0.5%复合海藻酶解物(TA组)后,优势菌门为厚壁菌门、变形菌门和拟杆菌门(Bacteroidota),三者相对丰度之和占总测序丰度的95%以上。其中,TA组中拟杆菌门和分类未定细菌门(unidentified_Bacteria)的相对丰度增加明显,但添加不同海藻酶解物后大黄鱼肠道菌群优势菌门转换也存在个体差异,见图7。对草鱼的研究显示,草鱼肠道菌群可分为2个功能组:功能组1(G1)由变形菌门组成,该功能组细菌编码更多的毒力因子(VF)基因和抗生素抗性基因(ARG);功能组2(G2)由梭杆菌门、厚壁菌门和拟杆菌门组成,该功能组细菌富集了编码降解阿拉伯木聚糖、果胶、黏蛋白、菊粉和纤维素的酶基因,可促进SCFAs的产生,G2/G1比值可以作为有效反映草鱼微生物群结构和功能特征的生物标志物[18]。据此,本试验对大黄鱼肠道菌群的G2/G1比值进行分析,结果显示TA组的G2/G1比值(中位数:4.44)显著高于BC组(中位数:0.99)和TD组(中位数:0.92)组(P<0.05),BC组和TD组之间无显著差异(P>0.05),见图7。

Bray-Curtis Anosim分析:R介于-1和1之间。R>0,说明组间差异显著;R<0,说明组内差异大于组间差异;P值表示统计分析的可信度,P<0.05表示统计具有显著性。BC组vs TD组,R=-0.146,P=0.741;BC组vs TA组,R=0.240,P=0.242;TD组vs TA组,R=0.208,P=0.128。
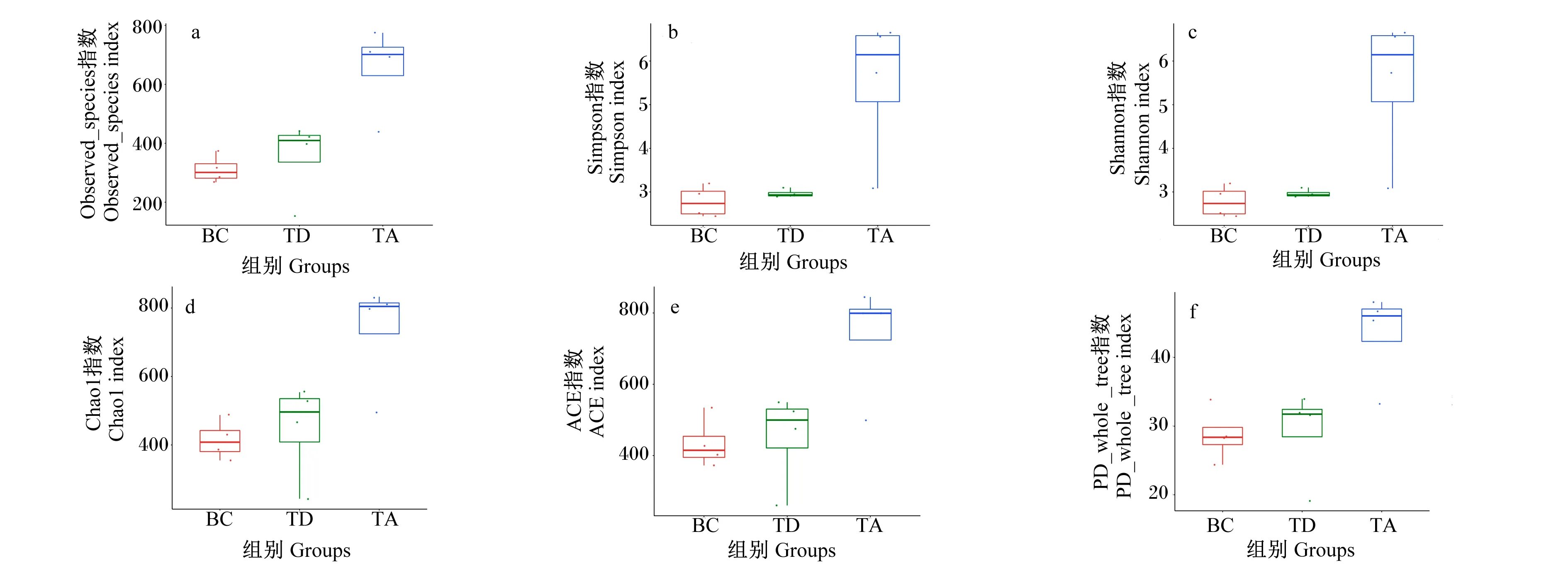
a:Observed_species指数组间差异箱形图;b:Shannon指数组间差异箱形图;c:Simpson指数组间差异箱形图;d:Chao1指数组间差异箱形图;e:ACE指数组间差异箱形图;f:PD_whole_tree指数组间差异箱形图。
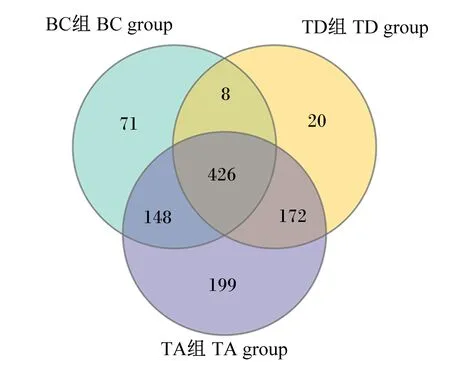
图5 大黄鱼肠道菌群体外不同条件下培养后基于OTUs的韦恩图
据所有样本菌群的定量信息,从组间和样本间2个层面对排名前35的菌属进行聚类,绘制热图(图8),发现在属水平上TA组物种相对丰度与BC组、TD组差异较大,TA组中普雷沃氏菌科未确定属(unidentified_Prevotellaceae)、毛螺菌科未确定属(unidentified_Lachnospiraceae)和魏斯氏菌属(Weissella)的相对丰度明显增加,乳球菌属(Lactococcus)、邻单胞菌属(Plesiomonas)、乙酰杆菌属(Cetobacterium)、气单胞菌属(Aeromonas)和弧菌属(Vibrio)等的相对丰度降低的较为明显,但同一组内不同样本间也有较大差异。
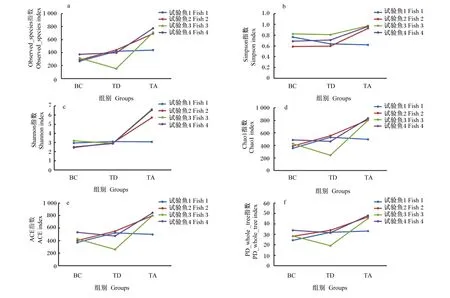
图6 同一大黄鱼肠道菌群体外不同条件下培养后α多样性变化
2.2.4 生物标志物分析
为了确定组间具有显著性差异的物种,从不同层级的物种丰度出发,利用Metastats方法对组间的物种丰度数据进行分析,筛选具有显著性差异的物种。在门水平上,BC组与TA组间具有显著性差异的菌群有拟杆菌门(P<0.01)、分类未定细菌门(P<0.01)、脱铁杆菌门(Deferribacteres)(P<0.05)、疣微菌门(Verrucomicrobiota)(P<0.05)和蓝细菌门(Cyanobacteria)(P<0.05);TD组与TA组间具有显著性差异的菌群有拟杆菌门、分类未定细菌门和其他细菌(other)(P<0.05)。通过群落结构差异统计分析对不同分组的大黄鱼肠道菌群进行深入研究,针对性的找出分组间相对丰度变化差异显著的物种,明确显著性差异物种在不同分组间的富集情况。使用LEfSe工具在组与组之间寻找具有统计学差异的生物标志物(biomarker),结果显示TD组与BC组间无具有显著性差异的菌群,但TD组和BC组与TA组在LDA得分(LDA score)>4时有99个具有显著性差异的菌群,在LDA score>6时有14个具有显著性差异的菌群,包括梭菌目未确定属(unidentifliedClostridia)、Muribaculaceae、毛螺菌科(Lachnospiraceae)、颤螺旋菌科(Oscillospiraceae)、肠道拉瓦异普雷沃氏菌属(Alloprevotella)、毛螺菌科未确定属、拟杆菌属(Bacteroides)、拉瓦异普雷沃氏菌属(Alloprevotela)、普雷沃氏菌科(Prevotellaceae)和分类未定细菌门等。

其他表示图中给出的这10个菌门之外的其他所有门的相对丰度之和。G1:功能组1,为变形菌门相对丰度;G2:功能组2,为梭杆菌门、厚壁菌门和拟杆菌门相对丰度之和。“*”表示与BC组相比差异显著(P<0.05)。
2.3 SCFAs合成与肠道菌群的相关性
2.3.1 丁酸与肠道菌群的相关性
丁酸是大黄鱼肠道菌群体外培养后不同分组间的主要差异代谢物,其合成量较大,且TA组与BC组和TD组存在极显著差异(P<0.01,图1)。使用Spearman相关系数评估TA组与BC组及TA组与TD组中丁酸与差异微生物的相关性,结果显示,与丁酸呈正相关的共有菌群为拟杆菌门的产酸拟杆菌(Bacteroidesacidifaciens)、单形拟杆菌(Bacteroidesuniformis)、普通拟杆菌(Bacteroidesvulgatus)、肠鼠杆菌(Muribaculumintestinale)、金氏类拟杆菌(Parabacteroidesgoldsteinii)和相对丰度较低的厚壁菌门的关节假丝酵母种SFB rat Yit亚种(CandidatusArthromitussp SFB rat Yit)以及变形菌门的别氏不动杆菌(Acinetobacterbereziniae),见图9。
2.3.2 戊酸与肠道菌群的相关性
戊酸也是大黄鱼肠道菌群体外培养后不同分组间的主要差异代谢物,TA组和TD组的戊酸合成量极显著高于BC组(P<0.01,图1),但戊酸合成量的较低,在0.000 1~0.000 3 mmol/L。使用Spearman相关系数评估BC组与TD组、BC组与TA组中戊酸与差异微生物的相关性,结果显示,与戊酸呈正相关的菌群有放线菌门(Actinobacteria)的假长双歧杆菌(Bifidobacteriumpseudolongum),拟杆菌门的产酸拟杆菌、赛多利拟杆菌(Bacteroidessartorii)、多形拟杆菌(Bacteroidesthetaiotaomicron)、单形拟杆菌、金氏类拟杆菌,脱铁杆菌门的黏液螺旋菌属69亚种(Mucispirillumsp 69),厚壁菌门克里斯滕森菌科未确定属(unidentified Christensenellaceae)的YE57菌(bacterium YE57)、毛螺菌科610菌(Lachnospiraceae bacterium 610)、毛螺菌科未确定属的鼠肠道宏基因组(mouse gut metagenome),梭菌目的Clostridiales bacterium enrichment culture clone 06_1235251_76,变形菌门的伯克霍尔德氏菌目YL45菌(Burkholderiales bacterium YL45),分类未定细菌门的姬鼠螺杆菌(Helicobacterapodemus)和疣微菌门的嗜黏蛋白阿克曼菌(Akkermansiamuciniphila),见图9(BC组vs TA组)。
BC组与TD组肠道菌群的差异较小,其中没有与戊酸呈正相关的菌群,与戊酸呈负相关的菌群有厚壁菌门的克里斯滕森菌属(Christensenella),变形菌门的丛毛单胞菌属(Comamonas)、盐单胞菌属(Halomonas)、假单胞菌属(Pseudomonas),见图10。
3 讨 论
本研究结果显示大黄鱼肠道菌群可以产生SCFAs,拟杆菌门和分类未定细菌门相对丰度增加可促进丁酸的合成,其中拟杆菌门拟杆菌属的细菌是合成丁酸的主要细菌。大黄鱼肠道菌群在体外厌氧条件下培养可以产生以乙酸为主的SCFAs,乙酸、丙酸和丁酸的比例约为94∶5∶1,GAM培养基中添加0.5%复合海藻酶解物后该比例变为92∶4∶4,丁酸合成量增加至约0.27 mmol/L,且合成SCFAs的总量增加。2020年,Cholan等[10]发现成年斑马鱼肠道中的菌群在体外可以合成SCFAs,丁酸合成量约为0.7 mmol/L,乙酸、丙酸和丁酸的比例约为90∶5∶5。菌群的组成及培养基的含量可能影响SCFAs的合成。研究显示,哺乳动物肠道菌群以厚壁菌门和拟杆菌门为主,厌氧条件下产生的乙酸、丙酸和丁酸的比例为60∶20∶20[5];成年斑马鱼肠道中最丰富的细菌门是拟杆菌门和梭杆菌门[10]。本研究中大黄鱼肠道菌群经体外厌氧培养后的优势菌门为厚壁菌门、变形菌门和梭杆菌门。据报道,厌氧条件下使用脑心浸液(BHI)培养时斑马鱼肠道菌群合成的SCFAs总量较使用吉福(Gifu)厌氧培养基(HIMEDIA)培养时明显增多[10]。本研究结果显示,GAM培养基中添加0.5%海带酶解物后,大黄鱼肠道菌群的优势菌门转换为厚壁菌门、变形菌门,两者相对丰度之和占总测序丰度的90%以上,梭杆菌门的相对丰度减少;GAM培养基中添加0.5%复合海藻酶解物后,大黄鱼肠道中的优势菌门转换为厚壁菌门、变形菌门和拟杆菌门,三者相对丰度之和占总测序丰度的95%以上,且其α多样性也增加。Li等[18]对草鱼肠道菌群功能的研究显示,由梭杆菌门、厚壁菌门和拟杆菌门组成的(G2)可促进SCFAs的产生,较高的G2/G1比值表明肠道菌群较为健康。本研究中,GAM培养基中添加0.5%复合海藻酶解物的TA组G2/G1比值显著增加,且SCFAs合成量也增加;GAM培养基中添加0.5%海带酶解物的TD组的G2/G1比值和SCFAs合成量均无显著变化,该表征与Li等[18]的研究相符。鱼类肠道菌群包括21个细菌门,变形菌门、厚壁菌门和蓝细菌门为优势菌门,这3个细菌门序列占所有序列的70%以上[19],梭杆菌门易在淡水鱼中检测到[20]。大黄鱼肠道中的优势菌门为变形菌门、厚壁菌门、螺旋体门(Spirochaetae)和拟杆菌门,同时发现少量放线菌门、浮霉菌门(Planctomycetacia)和蓝细菌门等细菌[3,21],不同采集地、饲喂方式和生长阶段样本的优势菌门不同[3]。在野生鱼类上的研究显示,宿主栖息地是其肠道菌群的主要决定因素,鱼种类(宿主)的差异对肠道菌群的影响不大[20],同时饲养模式[13]、饲养水域[11]、饲料组成[14-16]、投喂方式[17]和生长的不同阶段[11,22]也明显影响大黄鱼肠道菌群的组成。
本研究显示,GAM培养基中添加0.5%复合海藻酶解物显著增加了大黄鱼肠道菌群的丁酸合成量,该培养条件下大黄鱼肠道菌群中拟杆菌门和分类未定细菌门相对丰度的增加较为明显,其中,产酸拟杆菌、单形拟杆菌、普通拟杆菌、肠鼠杆菌、金氏类拟杆菌可能是使丁酸合成量增加的主要细菌。哺乳动物中,单形拟杆菌[23]、产酸拟杆菌[24]、普通拟杆菌[25]和金氏类拟杆菌[26]是主要的肠道共生菌,可以降解多聚糖,饮食中添加可溶性纤维可提高其相对丰度,有助于产生乙酸、琥珀酸以及少量的异戊酸、丙酸和甲酸,并促进丁酸的合成,具有增强肠道完整性以及降低炎症等作用[27]。肠鼠杆菌可以代谢糖龙舌兰素(agavins,AG)等高度支链化的果聚糖合成丁酸[28],其可能是利用复合海藻酶解物合成丁酸的主要细菌。本试验中制备复合海藻酶解物的复合海藻由29%的条斑紫菜、24%的石莼和47%海带组成。海带主要是由α-L-甘露糖醛酸(M)与β-D-古罗糖醛酸(G)2种单体为基础形成的分子质量在20~350 kDa的多聚甘露糖(PolyM)、多聚古罗糖(PolyG)、多聚甘露糖/古罗糖混合糖(PolyM/G)水溶性线性多糖褐藻酸,约占干重的45%,以及少量的海带多糖(laminarin)和褐藻糖胶(fucoidan,也叫岩藻聚糖);紫菜中主要为紫菜聚糖等具有支链的硫酸化程度较高的多糖和海藻蛋白,分别约占干重的15%和30%;石莼的主要含量为支链化和硫酸化程度较高的水溶性胶凝多糖,约占干重的15%[29]。GAM培养基中添加0.5%海带酶解物未显著增加大黄鱼肠道菌群的丁酸合成量,表明具有支链的硫酸化多聚糖可能是促进拟杆菌属细菌发育使丁酸合成量增加的主要原因。
丁酸在鱼类中具有减少中性粒细胞和M1型促炎巨噬细胞向伤口的募集的抗炎作用,丙酸则具有促炎作用[10],增加丁酸、减少丙酸合成量有益于大黄鱼肠道健康。大黄鱼是一种肉食性鱼类,为我国特有的经济鱼种,高密度的网箱养殖是其主要生产方式,目前其饲料主要为小杂鱼及富含蛋白质的饲料,由于不耐高血糖其饲料中缺乏碳水化合物和纤维等合成SCFAs的底物[30],饲料中添加富含高聚合度的硫酸化多糖的复合海藻酶解物可能会促进肠道中SCFAs的合成和肠道菌群α多样性,增强肠道健康,减少高密度养殖条件下疾病的发生。
4 结 论
本研究结果证实大黄鱼肠道菌群可以合成SCFAs,拟杆菌属细菌的相对丰度与丁酸的合成量呈正相关;在体外厌氧培养基中添加复合海藻(石莼、紫菜和海带组成)酶解物可以显著提高大黄鱼肠道中厚壁菌门、拟杆菌门、梭杆菌门相对丰度之和与变形菌门相对丰度的比值,并增加肠道菌群α多样性和丁酸合成量。

