槲皮素对高脂饲料饲养青鱼生长性能、抗氧化能力、脂代谢和肠道菌群的影响
王 婷 陈景龙 靳杰豪 明建华 邵仙萍 杨 霞 叶金云 吴成龙
(湖州师范学院生命科学学院,水生动物繁育与营养国家地方联合工程实验室,浙江省水生生物资源养护与开发技术研究重点实验室,湖州 313000)
在集约化水产养殖中,普遍采用提高饲料脂肪水平以节约蛋白质的策略,以达到节约生产成本、减少氮排放和保护养殖水体环境的目的[1-2]。然而,鱼类对脂肪的需求和利用能力受其生理条件的限制,饲料中脂肪含量过高往往会导致鱼体脂肪蓄积,引起鱼类脂代谢障碍与紊乱,导致营养性脂肪肝,造成氧化应激损伤,抗病力下降,甚至会引起暴发性死亡,这严重制约了水产养殖业的健康可持续发展[3-5]。因此,通过绿色饲料添加剂来调控鱼体的脂代谢,以降低其脂肪沉积,增强鱼体抗氧化应激能力已成为当前研究的热点。
槲皮素(分子式C15H10O7)是一种广泛存在于各种果蔬和中草药中的黄酮类化合物,具有抗炎、抗病毒、抗氧化以及抑制脂质过氧化等多种生理功能[6-7]。近年来,槲皮素作为一种新型的饲料添加剂在陆生动物中的研究较多。据报道,饲粮中添加适量槲皮素可改善海南褐蛋鸡产蛋中后期的蛋品质[8],促进猪肠上皮细胞对蛋白质的利用[9],调控断奶仔猪粪便微生物组成进而促进肠道健康,提高其生长性能[10]。目前,槲皮素在水产动物上仅有较少的研究报道,如饲料中添加适量槲皮素可促进团头鲂(Megalobramaamblycephala)[11]、草鱼(Ctenopharyngodonidella)[7]和牙鲆(Paralichthysolivaceus)[12]的生长,改善斑马鱼(Daniorerio)的焦虑行为和降低其细胞凋亡[13],增强克氏原螯虾(Procambarusclarkia)的抗氧化能力和免疫力[14],可抑制土霉素诱导克林雷氏鲇(Rhamdiaquelen)血浆皮质醇水平升高而引起的应激反应[15]。然而,槲皮素在高脂养殖鱼类上的相关研究还鲜见报道。
青鱼(Mylopharyngodonpiceus)是我国主养的淡水肉食性鱼类,其营养丰富,经济效益好,2022年我国青鱼养殖年产量高达71.55万t[16]。然而,在集约化的养殖生产中,人工养殖的青鱼脂肪过度沉积而导致脂代谢紊乱,造成营养性脂肪肝。这类鱼抗病、抗应激能力下降,死亡率升高,生长受阻。因此,本研究以青鱼为研究对象,在高脂饲料中添加不同剂量的槲皮素,研究其对高脂饲料饲养青鱼生长性能、抗氧化能力、脂代谢和肠道菌群的影响,为槲皮素在青鱼高脂饲料中的合理应用提供参考数据。
1 材料与方法
1.1 试验设计及饲料制备
槲皮素购自Sigma公司(美国),纯度≥95%。
以进口鱼粉、酪蛋白和豆粕为蛋白质源,玉米淀粉和面粉为糖源,鱼油和大豆油为脂肪源配制等氮不等能的饲料。试验设计2个对照组,即正常脂肪组(NFD组,粗脂肪5%)和高脂组(HFD组,粗脂肪15%),以及参考Xu等[7]和Dong等[17]的研究和预试验结果在高脂组饲料中分别添加300(HFDQ1组)、600(HFDQ2组)、900(HFDQ3组)和1 200 mg/kg(HFDQ4组)的槲皮素组成4个槲皮素添加组(HFDQ组),共配制6种饲料,饲料组成及营养水平见表1。将各种固体原料粉碎后过60目筛,通过逐级扩大法添加微量成分,然后加入鱼油和大豆油混匀,再用饲料造粒机制成粒径2 mm的颗粒饲料,置于烘箱中40 ℃烘干,用自封袋封装标注后于-20 ℃保存备用。
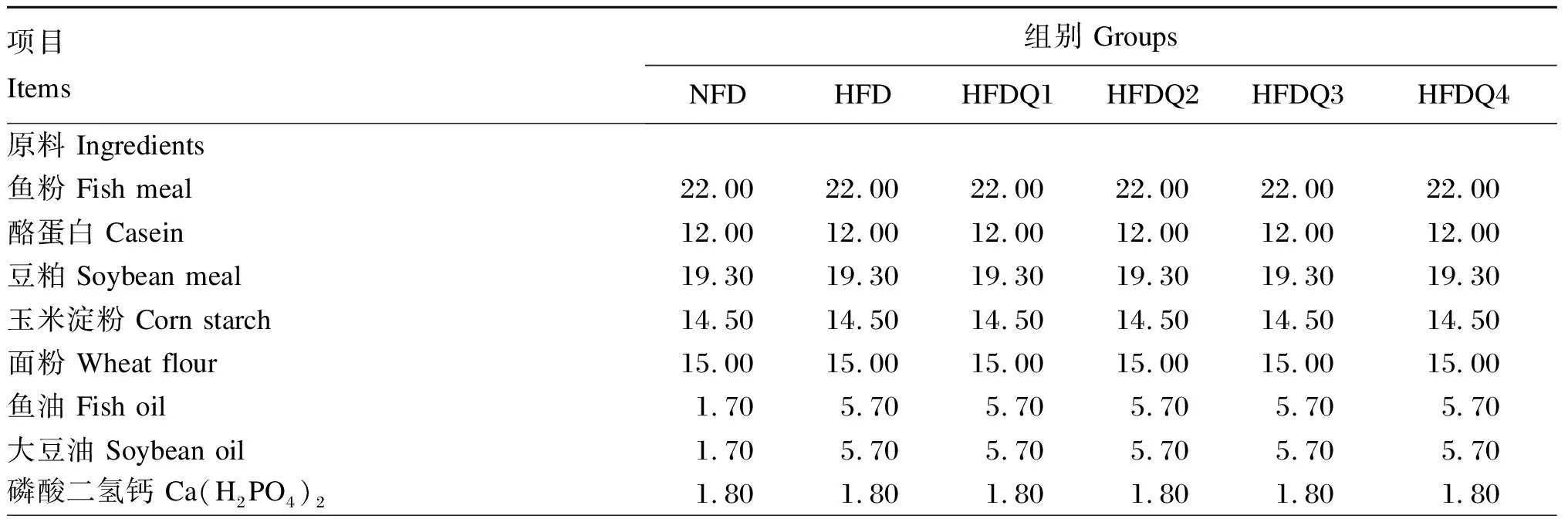
表1 饲料组成及营养水平(风干基础)
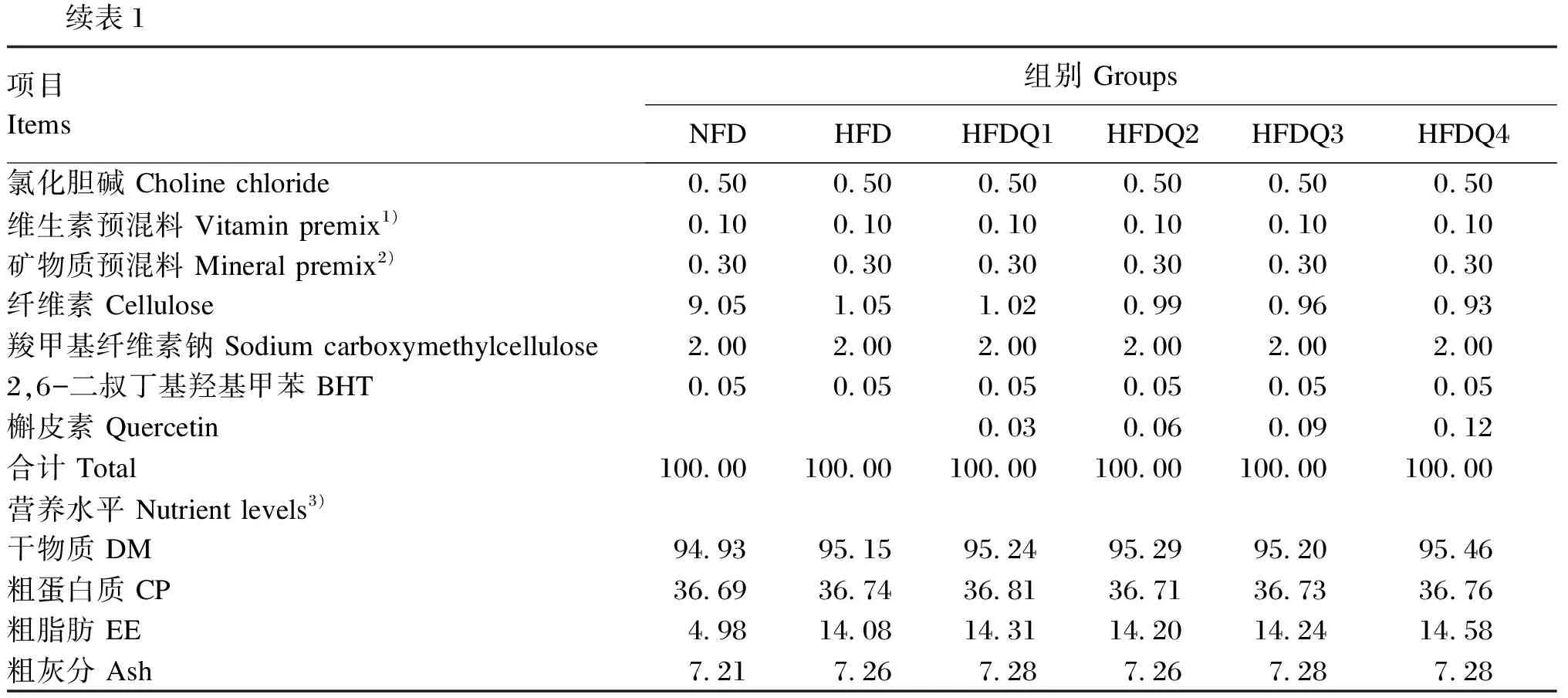
续表1项目 Items组别 GroupsNFDHFDHFDQ1HFDQ2HFDQ3HFDQ4氯化胆碱 Choline chloride0.500.500.500.500.500.50维生素预混料 Vitamin premix1)0.100.100.100.100.100.10矿物质预混料 Mineral premix2)0.300.300.300.300.300.30纤维素 Cellulose9.051.051.020.990.960.93羧甲基纤维素钠 Sodium carboxymethylcellulose2.002.002.002.002.002.002,6-二叔丁基羟基甲苯 BHT0.050.050.050.050.050.05槲皮素 Quercetin0.030.060.090.12合计 Total100.00100.00100.00100.00100.00100.00营养水平 Nutrient levels3)干物质 DM94.9395.1595.2495.2995.2095.46粗蛋白质 CP36.6936.7436.8136.7136.7336.76粗脂肪 EE4.9814.0814.3114.2014.2414.58粗灰分 Ash7.217.267.287.267.287.28
1.2 试验鱼和饲养管理
青鱼幼鱼购于湖州南浔菱湖水产养殖场。正式试验前,青鱼在室内循环水养殖系统中以NFD组饲料投喂驯养1周,然后选择健康的青鱼幼鱼540尾,初体质量为(10.57±0.41) g,随机分为6组,每组3个重复,每个重复30尾鱼,分别放养于室内18个养殖桶(重复)中。6组试验青鱼分别投喂上述6种饲料,每天饱食投喂2次(08:00、16:30),且每次投饲45 min后收集残饵并烘干称重,摄食饲料总量为投饲量减去烘干残饵量。每天吸污换水1次,换水量为原来的1/4~1/3,用气泵持续充气增氧,溶氧量≥6 mg/L,水温(27.0±1.5) ℃,pH 7.5~8.0。试验期8周。
1.3 样品采集与处理
养殖试验结束后,禁食24 h,将各桶青鱼称重计数。从每桶中随机取3尾青鱼,用100 mmol/L MS-222快速麻醉后,从尾静脉用一次性医用注射器采血。血样在4 ℃冰箱中静置8 h后,在4 ℃下以3 500 r/min离心15 min制备血清,于-80 ℃超低温冰箱冻存备用。鱼体采血后立即剖开腹腔,剥离出内脏和肝脏并称重,取适量肝脏用于生化指标分析,并在无菌条件下取适量的肠道内容物,用于肠道菌群分析;同时,另取适量肝脏和肠道用于制作组织切片。
1.4 检测指标及方法
1.4.1 生长性能指标的测定
增重率(WGR,%)=100×(鱼体末均重-
鱼体初均重)/鱼体初均重;
特定生长率(SGR,%/d)=100×(ln鱼体末均重-
ln鱼体初均重)/饲喂天数;
饲料系数(FCR)=摄食饲料总量(风干样重)/
(鱼体末重-鱼体初重);
成活率(SR,%)=100×末鱼尾数/初鱼尾数;
肝体指数(HSI,%)=100×每尾鱼末肝脏重/
每尾鱼末体重;
脏体指数(VSI,%)=100×每尾鱼末内脏重/
每尾鱼末体重;
肥满度(CF,g/cm3)=100×每尾鱼末体重/
每尾鱼末体长3。
1.4.2 血清和肝脏生化指标的测定
测定血清甘油三酯(TG)、总胆固醇(TC)、游离脂肪酸(NEFA)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量。
肝脏样品与生理盐水按1∶9(质量体积比)的比例进行冰浴电动匀浆,然后在4 ℃下以3 500 r/min离心15 min制备上清液用于分析。测定肝脏超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)活性和总抗氧化能力(T-AOC)以及丙二醛(MDA)含量。
以上指标测定均按照南京建成生物工程研究所试剂盒说明书操作。
1.4.3 肝脏和肠道组织形态结构的测定
肝脏和肠道于4%的中性甲醛中固定48 h后,送至杭州浩克生物技术有限公司进行脱水、透明、浸蜡包埋、切片和苏木精-伊红(HE)染色,然后进行显微观察并拍照。使用ImageJ软件测量各组肠道绒毛高度、绒毛宽度和肌层厚度。
1.4.4 肠道菌群分析
利用通用引物F338/R806(338F:5′-ACTCCTACGGGAGGCAGCA-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA基因V3~V4区域序列。PCR产物纯化后在上海派森诺生物科技股份有限公司的Illumina PE250平台上测序。测序结果使用QIIME 2对原始数据进行初步分析和质量筛选而得到优化序列,对有效操作分类单元(OTU)进行聚类分析,通过Chao1指数、Shannon指数和Simpson指数评估样本的alpha多样性。通过QIIME 2在门和属分类水平对菌群组成和结构进行差异化分析,并计算肠道菌群稳态指数,计算公式为:
稳态指数=[梭杆菌门(Fusobacteria)+厚壁菌门
(Firmicutes)+拟杆菌门(Bacteroidetes)]/
变形菌门(Proteobacteria)。
同时,利用PICRUSt2预测青鱼肠道菌群功能。
1.5 数据统计与分析
试验数据采用SPSS 25.0软件进行统计分析,NFD组与HFD组之间采用独立样本t检验分析;HFD组和HFDQ组则采用单因素方差分析(one-way ANOVA),若组间差异显著,则采用Tukey氏法进行多重比较,P<0.05表示差异显著。所有结果数据均表示为平均值±标准差(mean±SD)。
2 结果与分析
2.1 槲皮素对高脂饲料饲养青鱼生长性能的影响
由表2可知,与NFD组相比,HFD组青鱼末体重、WGR、SGR和SR显著降低(P<0.05),HSI、VSI和CF显著提高(P<0.05),而FCR无显著差异(P>0.05)。随着饲料中槲皮素添加量的增加,HFDQ组青鱼末体重、WGR、SGR和SR呈先升高后降低的变化趋势,且均当添加量为600 mg/kg时达到最高,并显著高于HFD组(P<0.05);而FCR、HSI和CF呈先降低后升高的变化趋势,且当添加量为600和900 mg/kg时达到较低水平,并显著低于HFD组(P<0.05);当槲皮素添加量为1 200 mg/kg时,VSI最低,并显著低于HFD组(P<0.05)。如图1所示,利用青鱼WGR与槲皮素添加量的折线模型拟合得出,青鱼高脂饲料中槲皮素的适宜添加量为597.13 mg/kg。
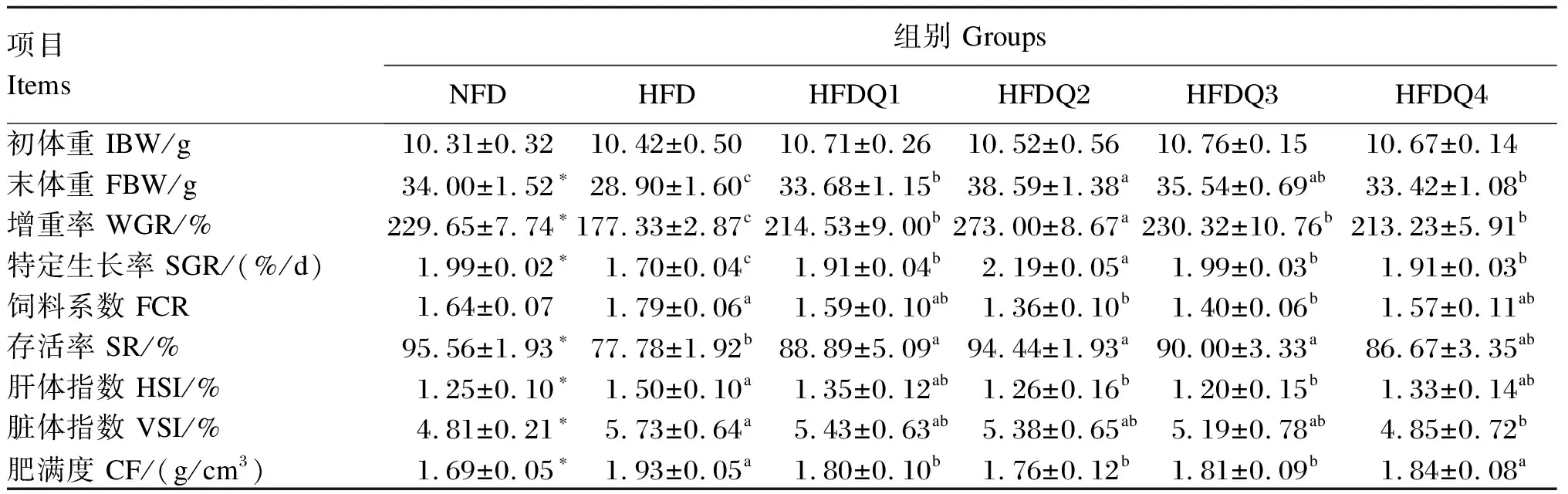
表2 槲皮素对高脂饲料饲养青鱼生长性能的影响

图1 槲皮素对高脂饲料饲养青鱼WGR的影响
2.2 槲皮素对高脂饲料饲养青鱼肝脏抗氧化指标的影响
由表3可知,与NFD组相比,HFD组青鱼肝脏SOD、CAT、GPx和GR活性及T-AOC显著降低(P<0.05),而肝脏MDA含量显著提高(P<0.05)。随着饲料中槲皮素添加量的增加,HFDQ组青鱼肝脏SOD、CAT、GPx和GR活性及T-AOC均呈先升高后降低的变化趋势,且当添加量为300 mg/kg时肝脏SOD和GPx活性最高,当添加量为600 mg/kg时肝脏GR活性和T-AOC最高,当添加量为900 mg/kg时肝脏CAT活性最高,并均显著高于HFD组(P<0.05);肝脏MDA含量呈先降低后升高的变化趋势,当添加量为900 mg/kg时,肝脏MDA含量最低,显著低于其他各组(P<0.05)。

表3 槲皮素对高脂饲料饲养青鱼肝脏抗氧化指标的影响
2.3 槲皮素对高脂饲料饲养青鱼血清脂代谢指标的影响
由表4可知,与NFD组相比,HFD组青鱼血清TG、TC、LDL-C和NEFA含量显著提高(P<0.05),而血清HDL-C含量无显著差异(P>0.05)。随着饲料中槲皮素添加量的增加,HFDQ组青鱼血清TG、TC和NEFA含量呈先降低后升高的变化趋势,而血清HDL-C含量呈先升高后降低的变化趋势,当添加量为900 mg/kg时,血清TG、TC和NEFA含量达到最低,显著低于HFD组(P<0.05);当添加量为300 mg/kg时,血清HDL-C含量最高,显著高于HFD组(P<0.05)。当槲皮素添加量为900和1 200 mg/kg时,血清LDL-C含量较低,显著低于HFD组(P<0.05)。
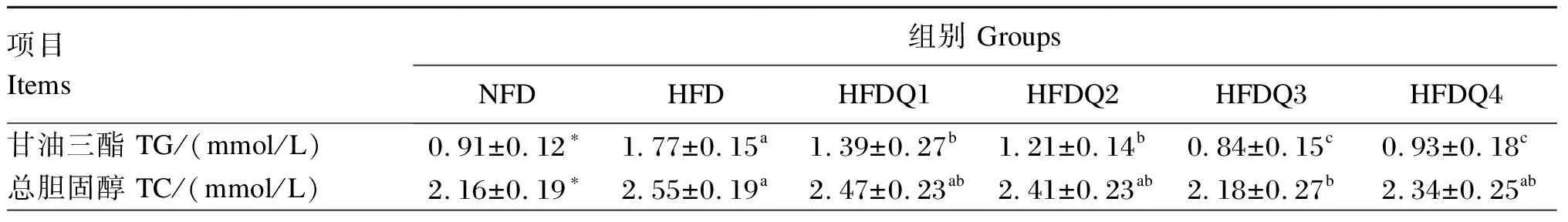
表4 槲皮素对高脂饲料饲养青鱼血清脂代谢指标的影响
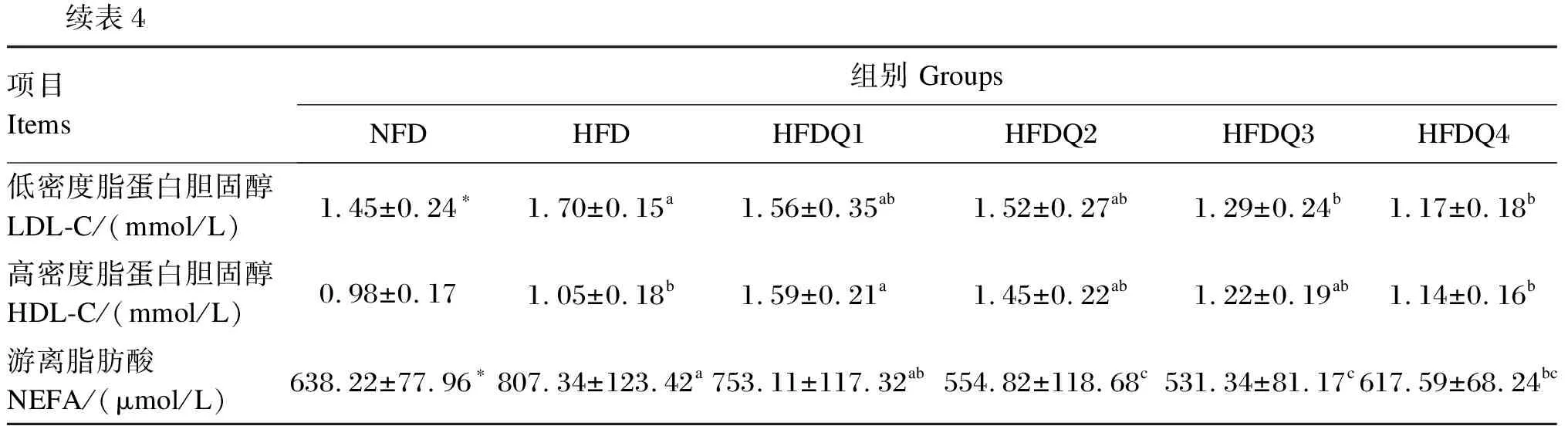
续表4项目Items组别 GroupsNFDHFDHFDQ1HFDQ2HFDQ3HFDQ4低密度脂蛋白胆固醇LDL-C/(mmol/L)1.45±0.24∗1.70±0.15a1.56±0.35ab1.52±0.27ab1.29±0.24b1.17±0.18b高密度脂蛋白胆固醇HDL-C/(mmol/L)0.98±0.171.05±0.18b1.59±0.21a1.45±0.22ab1.22±0.19ab1.14±0.16b游离脂肪酸NEFA/(μmol/L)638.22±77.96∗807.34±123.42a753.11±117.32ab554.82±118.68c531.34±81.17c617.59±68.24bc
2.4 槲皮素对高脂饲料饲养青鱼肝脏和肠道组织形态的影响
如图2所示,NFD组青鱼肝细胞分布均匀,细胞核和细胞膜的界限清晰;而HFD组肝细胞核溶解或缺失,部分出现空泡化。在高脂饲料中添加槲皮素后,肝细胞空泡化程度与HFD组相比有所下降,其中HFDQ1组肝细胞核溶解或缺失现象有所改善,但仍存在空泡化现象;而HFDQ2组、HFDQ3组和HFDQ4组肝细胞核较清晰,细胞空泡化现象也明显改善。

He:肝细胞 hepatocyte;N:细胞核 nucleus;HS:肝血窦 hepatic sinusoid;HPV:肝细胞空泡化 hepatocyte vacuolation;Ka:细胞核溶解 karyolysis。
如图3所示,NFD组青鱼肠黏膜组织结构完整清晰,绒毛排列紧密有序;而HFD组肠道绒毛高度降低,不够致密完整。在高脂饲料中添加槲皮素后,肠绒毛高度有所提高,排列也较致密。由表5可知,NFD组青鱼绒毛高度和肌层厚度显著高于HFD组(P<0.05),而2组之间绒毛宽度无显著差异(P>0.05);与HFD组相比,HFDQ组绒毛高度均显著提高(P<0.05),且HFDQ1组绒毛宽度和HFDQ1组、HFDQ2组、HFDQ4组肌层厚度也均显著提高(P<0.05)。
2.5 槲皮素对高脂饲料饲养青鱼肠道菌群的影响
2.5.1 槲皮素对高脂饲料饲养青鱼肠道菌群alpha多样性的影响
由表6可知,各组样本的覆盖率均高于99%,表明试验数据已经覆盖了大多数微生物物种。与NFD组相比,HFD组Chao1指数较高,Shannon指数和Simpson指数较低,但2组之间无显著差异(P>0.05)。与HFD组相比,随着饲料中槲皮素添加量的增加,HFDQ组Chao1指数、Shannon指数和Simpson指数呈先升高后降低的变化趋势,但各组之间均无显著差异(P>0.05)。

VH:绒毛高度 villus height;VW:绒毛宽度 villus width;MT:肌层厚度 muscular thickness;GC:杯状细胞 goblet cell。

表5 槲皮素对高脂饲料饲养青鱼肠道形态结构的影响
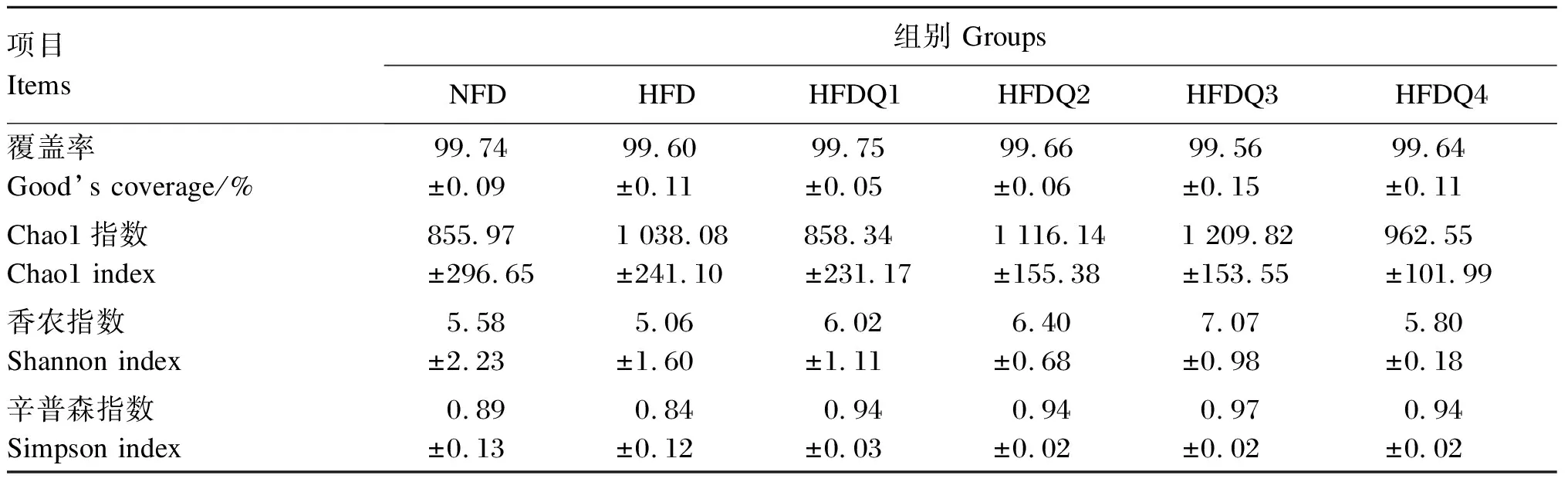
表6 槲皮素对高脂饲料饲养青鱼肠道菌群alpha多样性的影响
2.5.2 槲皮素对高脂饲料饲养青鱼肠道菌群组成和稳态指数的影响
如图4所示,在门水平上,青鱼肠道菌群主要有变形菌门、厚壁菌门、拟杆菌门、放线菌门(Actinobacteria)和梭杆菌门,其中变形菌门在6个组中的相对丰度分别为57.38%、71.43%、51.05%、60.69%、56.62%和69.29%。进一步统计分析发现(表7和图5),与HFD组相比,高脂饲料中添加槲皮素提高了厚壁菌门和拟杆菌门的相对丰度以及肠道菌群稳态指数,降低了变形菌门的相对丰度,但各组之间菌门的相对丰度和稳态指数均无显著差异(P>0.05)。
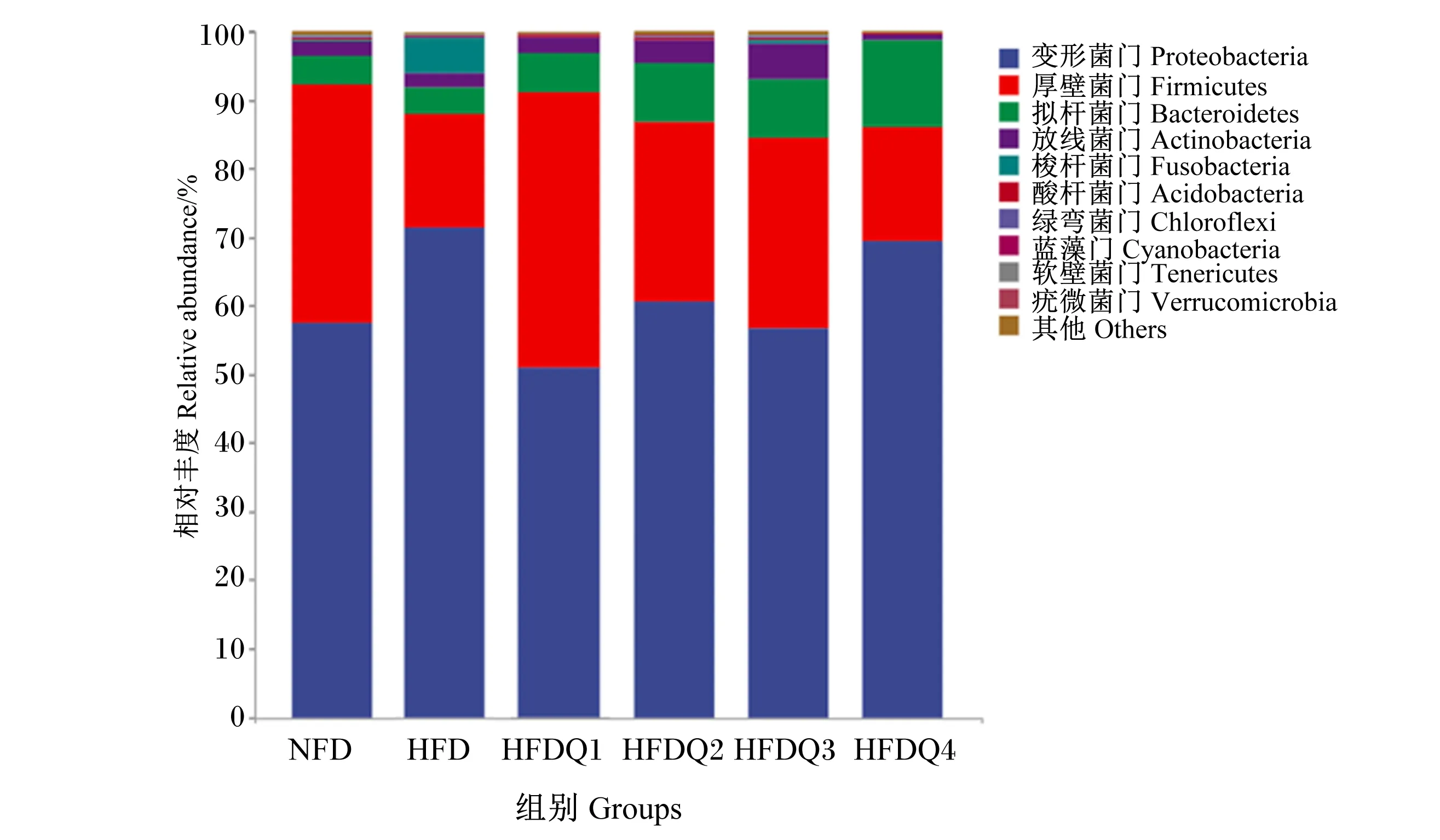
图4 槲皮素对高脂饲料饲养青鱼肠道菌群在门水平上相对丰度的影响
由表7可知,在属水平上,青鱼肠道菌群主要有乳球菌属(Lactococcus)、不动杆菌属(Acinetobacter)、邻单胞菌属(Plesiomonas)、红杆菌属(Rhodobacter)和气单胞菌属(Aeromonas)。其中,随着饲料中槲皮素添加量的增加,乳球菌属和红杆菌属的相对丰度呈先升高后降低的变化趋势,而不动杆菌属、邻单胞菌属和气单胞菌属的相对丰度则呈先降低后升高的变化趋势,但各组之间菌属的相对丰度均无显著差异(P>0.05)。
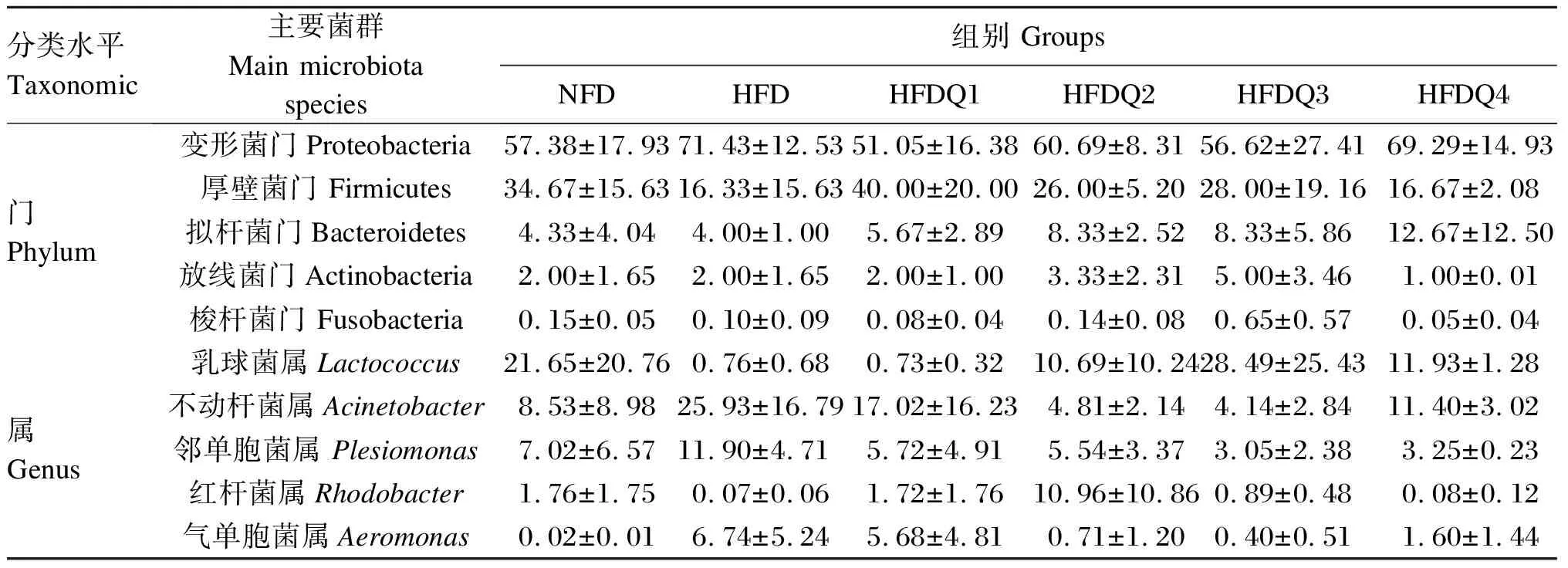
表7 槲皮素对高脂饲料饲养青鱼肠道菌群在门和属水平上相对丰度的影响
2.5.3 槲皮素对高脂饲料饲养青鱼肠道菌群的功能预测
基于PICRUSt2对6组青鱼肠道菌群样品进行功能预测,利用京都基因与基因组百科全书(KEGG)数据库对测序结果比对得到33种二级功能通路,其中参与代谢的通路最多,占比33.33%。根据每个样品中的通路丰度信息及其功能进行聚类分析,绘制成如图6所示的热图。结果显示,不同组青鱼肠道菌群在功能上存在差异,其中HFDQ1组、HFDQ2组和HFDQ3组青鱼肠道中与脂代谢、其他次生代谢物的生物合成、能量代谢以及外源生物降解和代谢等功能有关的通路丰度高于HFD组,而心血管疾病和免疫性疾病的通路丰度低于HFD组;HFDQ1组和HFDQ2组细胞生长与死亡、细胞运动、萜类和聚酮类化合物代谢、氨基酸代谢以及辅助因子和维生素代谢的通路丰度高于HFD组;HFDQ3组内分泌系统、复制和修复、核苷酸代谢、折叠、分类和降解、翻译、其他氨基酸代谢、聚糖生物合成和代谢、细胞群落-原核生物以及信号分子和相互作用的通路丰度高于HFD组。
3 讨 论
3.1 槲皮素对高脂饲料饲养青鱼生长性能的影响
研究表明,高脂饲料养殖团头鲂30 d可以显著提高其WGR,而饲喂60 d后其WGR与正常脂肪饲料相比无显著差异[18]。另外,也有研究报道,高脂饲料会降低大口黑鲈(Micropterussalmoides)[19]、草鱼[20]和日本黄姑鱼(Nibeajaponica)[21]的生长性能。本研究中,与NFD组相比,HFD组青鱼WGR、SGR和SR均显著降低,而HSI和VSI显著提高,说明高脂对青鱼的生长产生了不利影响。这可能与鱼体摄入的脂肪超出了自身的需求有关,造成其在肝脏和内脏中过度积累,导致内脏脂肪含量增加,肝脏脂肪变性,脂代谢紊乱,从而表现出生长性能下降[22-23]。
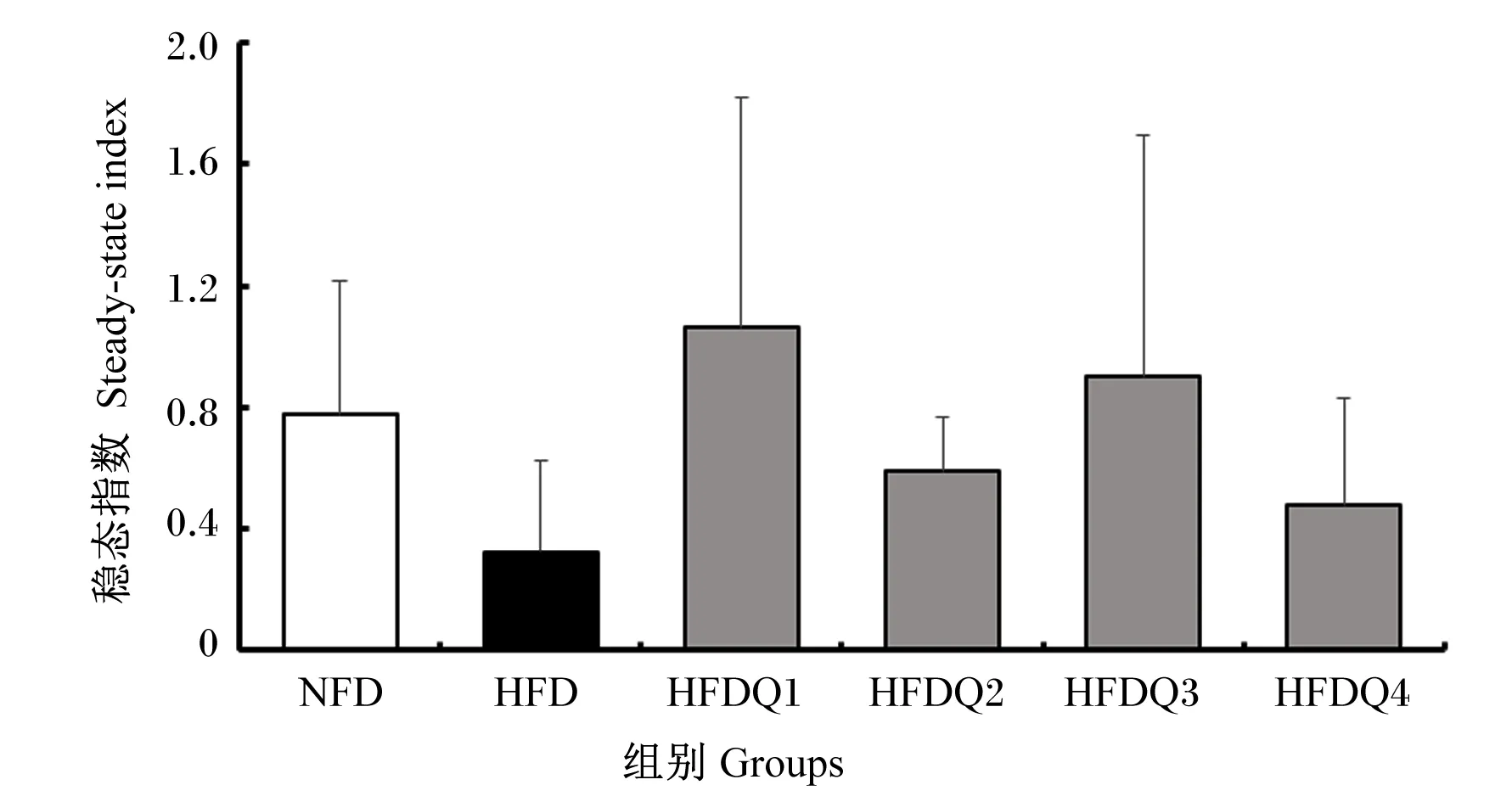
数据柱无标注表示差异不显著(P>0.05)。
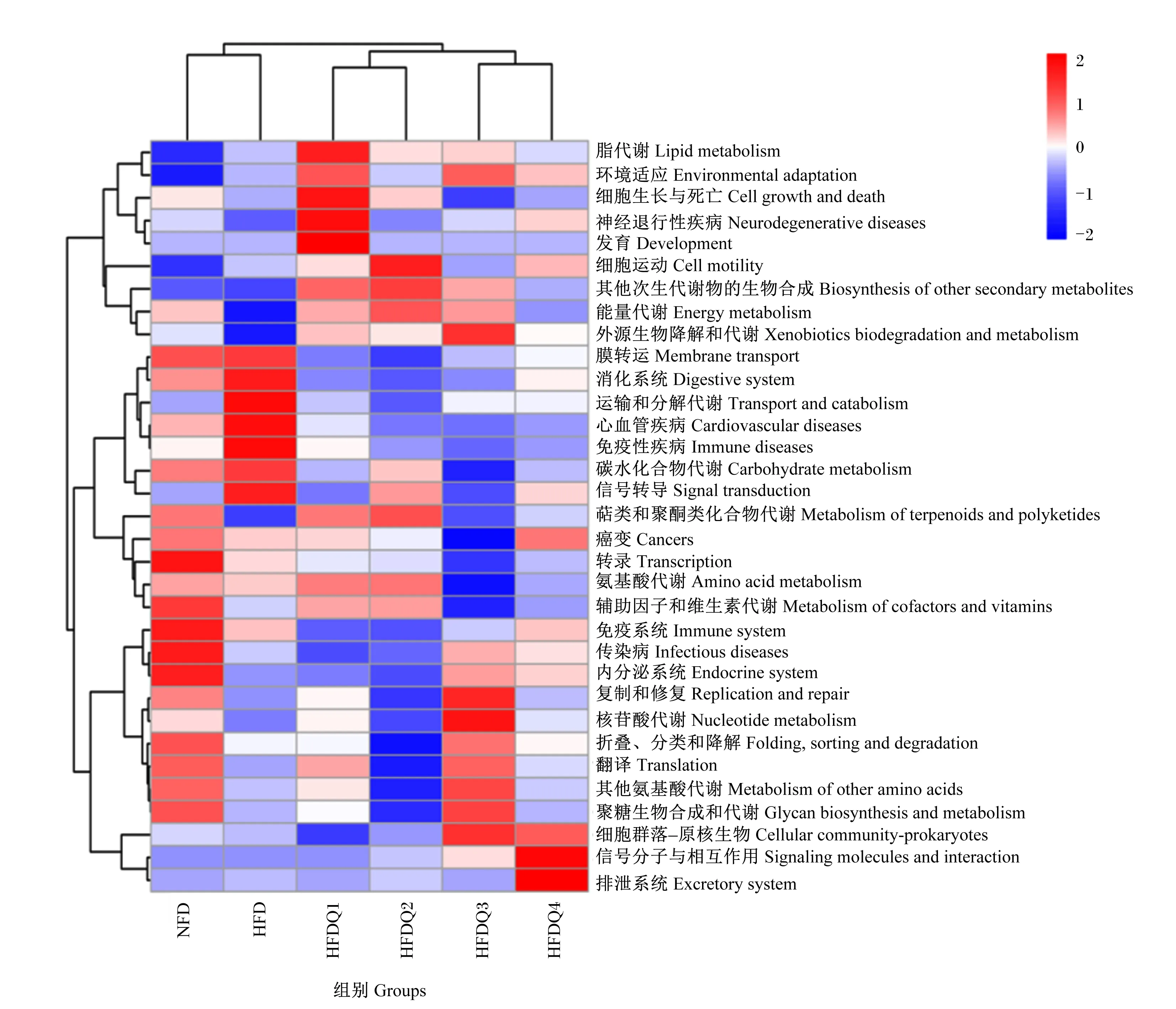
图6 槲皮素对高脂饲料饲养青鱼肠道菌群功能的预测
据报道,槲皮素对鱼类的生长具有促进作用。孙如意等[24]在饲料中添加100 mg/kg槲皮素可以显著提高黄河鲤(Cyprinuscarpio)的WGR和SGR,并降低FCR。李剑等[25]在饲料中添加200 mg/kg槲皮素可显著提高吉富罗非鱼(GIFTOreochromisniloticus)幼鱼WGR、SGR、蛋白质效率(PER)和CF,并降低FCR。Jia等[11]报道,高脂饲料中添加0.8%的槲皮素可以提高团头鲂的WGR。Dong等[17]研究也发现,高脂饲料中添加0.5和1.0 g/kg的槲皮素可以显著提高花鲈(Lateolabraxmaculatus)的WGR和SGR,降低FCR。本研究发现,高脂饲料中添加600和900 mg/kg槲皮素可显著提高青鱼WGR、SGR和SR,降低FCR、HSI和VSI,从而促进青鱼的生长。本试验结果与上述研究结果类似,但不同研究者得出的槲皮素添加量不同,这可能与鱼的品种和养殖环境有关,其促进生长的机制仍需进一步研究。
3.2 槲皮素对高脂饲料饲养青鱼肝脏抗氧化指标的影响
脂肪在鱼体中过度沉积会诱导氧化应激,产生大量的活性氧(ROS)自由基,若抗氧化系统未能及时清除这些自由基,则会对机体造成氧化损伤[26-27]。鱼类在进化过程中形成了抗氧化酶防御系统,如SOD可催化超氧阴离子歧化生成氧气(O2)和过氧化氢(H2O2),H2O2又在CAT和GPx的协同作用下转化为无害的水(H2O)和O2,从而保护机体免受氧化应激损伤[28];而MDA是脂质过氧化的重要产物,可作为衡量氧化应激程度的标志[29]。本研究发现,高脂饲料饲养青鱼肝脏SOD、CAT、GPx和GR活性及T-AOC显著降低,而肝脏MDA含量显著提高。这与在花鲈[17]、青鱼[30]和黄河鲤[31]上的研究结果一致,说明高脂饲料会引起鱼体抗氧化能力降低,引起机体氧化应激损伤。
槲皮素是一种强抗氧化剂,其分子结构中存在2个抗氧化基团,即B环中的邻苯二酚基团和AC环3位点上的羟基(—OH)基团[32],具有强抗氧化活性,能够有效清除体内自由基,从而减少机体氧化应激损伤[33]。研究表明,槲皮素可提高黄河鲤[24]、斑马鱼[34]、鲤鱼(Cyprinuscarpio)[35]和乌鳢(Channaargus)[36]肝脏中的抗氧化酶活性,降低肝脏MDA含量。本试验中,高脂饲料中添加600 mg/kg槲皮素可显著提高青鱼肝脏CAT、GPx和GR活性以及T-AOC,降低肝脏MDA含量,从而增强青鱼机体的抗氧化能力。Dong等[17]在高脂饲料中添加1 g/kg槲皮素也可显著提高花鲈肝脏CAT和SOD活性、T-AOC以及谷胱甘肽(GSH)含量,降低肝脏MDA含量。本研究与在花鲈[17]上的研究结果类似,说明槲皮素可以提高青鱼抗氧化酶活性,缓解高脂诱导而引起的氧化应激,进而维持肝脏的氧化还原稳态。
3.3 槲皮素对高脂饲料饲养青鱼血清脂代谢指标的影响

闫亚楠[38]报道,高脂饲料中添加0.4%和0.8%的槲皮素可以降低团头鲂血清TG和TC含量。刘超[39]也报道了用分蘖葱头槲皮素对高脂血症小鼠灌胃50 d后,可降低其血清TG、TC和LDL-C含量,从而降低血脂水平。同样,槲皮素还可通过降低高脂饲粮饲养小鼠血清和肝脏TG和TC含量,改善小鼠肝脏的脂肪变性[40]。本研究中,高脂饲料中添加900 mg/kg槲皮素可显著降低青鱼血清TG、TC、LDL-C和NEFA含量,表明槲皮素可降低高脂饲料饲养青鱼的血脂水平。
3.4 槲皮素对高脂饲料饲养青鱼肝脏和肠道组织形态的影响
肝脏组织形态观察是了解肝脏病理情况的重要手段之一。本研究中,肝脏组织切片显示,高脂饲料诱导了青鱼肝细胞损伤,如肝细胞空泡化、细胞核溶解或消失,这与在鲤鱼[41]和草鱼[42]上的相关报道类似。然而,在青鱼高脂饲料中添加600~1 200 mg/kg槲皮素后,可以减轻上述症状,表明槲皮素可改善青鱼肝细胞的脂代谢,有利于青鱼肝脏健康。这与以前的一些报道相吻合,如古送汗·买提尼亚孜等[40]研究发现,槲皮素可有效抑制高脂饲粮饲养小鼠肝脏脂滴的聚集;同样,槲皮素还可明显改善非酒精性脂肪肝炎大鼠肝脏脂质沉积和纤维化病变,减轻炎症细胞浸润[43-44]。
肠道是鱼类消化吸收营养物质的重要场所,肠绒毛在吸收营养物质和提高生长性能方面发挥着重要作用[45]。肠道绒毛高度、绒毛宽度和肠壁肌层厚度通常与肠道健康和营养吸收效率密切相关[46]。Liu等[47]报道,高脂饲料可诱导草鱼肠道绒毛发生结构性紊乱,如绒毛萎缩、粘连或脱落,且高脂显著降低草鱼幼鱼肠道绒毛高度和绒毛宽度。Zhao等[48]也研究发现,高脂饲料饲养斑马鱼的肠道绒毛萎缩,绒毛高度显著下降。在本研究中,与NFD组相比,HFD组青鱼幼鱼肠道绒毛高度和肌层厚度显著降低,而在高脂饲料中添加适量槲皮素可以提高青鱼肠道绒毛高度、绒毛宽度和肌层厚度,说明槲皮素可以改善高脂饲料饲养青鱼的肠道组织形态,有利于营养物质吸收。
3.5 槲皮素对高脂饲料饲养青鱼肠道菌群的影响
鱼类肠道菌群在维持肠道健康、促进肠道发育、抵御病原侵袭以及促进营养物质消化吸收和脂代谢等方面均具有重要的作用[49]。Liu等[47]研究表明,高脂饲料饲养草鱼肠道菌群Chao1指数和Shannon指数均有所降低。但也有报道称,高脂胁迫未显著改变大口黑鲈[50]、斑马鱼[48,51]肠道菌群的Chao1指数、Shannon指数、Simpson指数和ACE指数,本试验结果与之类似。罗君等[52]在基础饲料中添加0.381 g/kg的槲皮素-5′-磺酸钠可显著提高杂交石斑鱼肠道菌群的Simpson指数和Shannon指数。本研究中,高脂饲料中添加600和900 mg/kg槲皮素可提高青鱼肠道菌群的Chao1指数、Shannon指数和Simpson指数,这表明在高脂饲料中添加适量槲皮素有利于提高青鱼肠道菌群的alpha多样性。
本研究中,在门水平上,青鱼幼鱼肠道菌群主要为变形菌门、厚壁菌门、拟杆菌门、放线菌门和梭杆菌门。这与黄颡鱼(Pelteobagrusfulvidraco)[53]的肠道菌群组成类似。有研究指出,变形菌门是肠道炎症的特征微生物[54],拟杆菌门可作为衡量动物肠道健康的指标[55],而厚壁菌门和放线菌门在促进鱼体对营养物质吸收及代谢中起着重要作用[56-57]。肠道菌群稳态指数可作为评价鱼类肠道菌群结构特征的参数,能有效反映饲料对菌群组成的总体影响,其值较高表明鱼体的健康状况较佳[58-59]。本试验结果显示,在门水平上,高脂饲料中添加槲皮素提高了高脂饲料饲养青鱼肠道厚壁菌门和拟杆菌门的相对丰度以及肠道菌群稳态指数,而降低了变形菌门的相对丰度。在属水平上,主要有益菌为乳球菌属[60]和红杆菌属[61],主要有害或潜在有害菌为不动杆菌属[62]、邻单胞菌属[63]和气单胞菌属[62]。本试验结果显示,在属水平上,有益菌相对丰度随槲皮素添加量的增加有升高的变化趋势,而有害菌相对丰度呈下降的变化趋势。在门和属水平上的研究结果表明,槲皮素可以使一些有益菌的相对丰度提高,而使有害菌的相对丰度降低。以前也有类似的研究报道,Porras等[64]研究发现,槲皮素干预后显著降低了高脂饲料饲养小鼠肠道变形菌门的相对丰度,而提高了拟杆菌门的相对丰度。以上研究表明,槲皮素可调节高脂所诱导的肠道菌群紊乱,改善肠道菌群的组成。
青鱼肠道菌群的功能预测发现,在高脂饲料中添加适量的槲皮素,与脂代谢、其他次级代谢产物的生物合成、能量代谢、萜类和聚酮类化合物代谢、氨基酸代谢、辅助因子和维生素代谢、其他氨基酸代谢以及聚糖生物合成和代谢等有关代谢功能的通路丰度有所升高,免疫性疾病、心血管疾病等有关疾病的通路丰度有所降低,这表明槲皮素可以促进肠道菌群参与机体代谢过程,提高机体的抗病力。这可能与槲皮素提高了青鱼肠道门水平上厚壁菌门和放线菌门的相对丰度,降低了变形菌门的相对丰度有关。
4 结 论
高脂饲料饲养青鱼导致其生长性能下降以及氧化应激损伤,出现脂代谢和肝脏、肠道组织病理学异常以及肠道菌群紊乱;而在高脂饲料中添加适量槲皮素(600~900 mg/kg)可促进高脂饲料饲养青鱼的生长,增强其抗氧化能力,促进脂代谢,减少鱼体脂肪过度沉积,改善肠道菌群组成。

