基于动态共价交联水凝胶的电化学传感器监测三维培养细胞释放一氧化氮
白杨 刘雪娇 熊涵之 周贇璠 陈旭 杨文胜
(北京化工大学,化工资源有效利用国家重点实验室,北京 100029)
一氧化氮(NO)作为信号分子参与人体内多种生理和病理过程,与肿瘤的发生、转移和扩散进程具有密不可分的关系[1],因此,原位实时监测细胞释放的NO 对揭示致病机理和开发治疗药物具有非常重要的意义。细胞释放的NO 具有半衰期短、浓度低和反应活性高等特点,研究者已开发多种分析手段[2-5]用于检测生物体系中的NO,其中,电化学法因具有成本低廉、操作简单、性能稳定、分析响应快以及易于实现在体监测等优势而被广泛应用于监测细胞释放的活性小分子[6-7]。目前,对细胞释放NO 的监测研究主要是基于细胞在溶液中悬浮[8]或者基于二维(2D)细胞培养技术[9]。三维(3D)细胞培养能更大程度地模拟体内微环境,更真实地呈现细胞的状态和功能[10]。基于3D 细胞培养技术开发的NO 电化学检测近年来开始出现,Qin 等[11]将软骨细胞培养于表面固定了多肽-金纳米管的3D 多孔聚二甲基硅氧烷支架上,并实现了拉伸刺激下对3D 培养软骨细胞释放NO 的实时监测。Hu 等[12]基于蚕茧衍生的分层多孔碳纤维网络,设计了一种结合3D 细胞培养技术的NO 电化学传感器。
在生物体内,细胞处于动态的微环境,即细胞在黏附和生长过程中,由于形态或体积的改变,会对其所在的微环境施加局部应力,促使周围基质发生局部变形和重塑[13]。目前,已报道的用于开发电化学传感器的3D 细胞培养支架还不能够较好地模拟细胞微环境的动态特性,而基于动态共价键(包括硼酸酯键[14]、酰腙键[15]和亚胺键[16]等)能够实现水凝胶的可逆断裂和重组,进而模拟细胞所处的动态微环境,适应细胞所施加的局部应力,不影响也不限制细胞在3D 微环境中的形态改变[17]。
本研究以氧化海藻酸钠(OSA)与酰肼聚乙二醇(PEG-DH)通过缩合反应生成酰腙键,制得能够可逆断裂和重建的动态OSA/PEG-DH 水凝胶网络,实现了对细胞所处动态3D 微环境的模拟。OSA/PEG-DH动态共价交联水凝胶为3D 细胞培养平台,以MnTMPyP 为电化学传感元件,制备OSA/MnTMPyP/PEG-DH水凝胶,基于此构建的电化学传感器可以原位监测3D 培养的三阴性乳腺癌MDA-MB-231 细胞释放的NO(图1)。此传感器在检测NO 时具有较宽的响应范围和较低的检出限,其传感界面受损后10 min 即可自愈合,实现了对NO 电流响应的及时恢复。

图1 构建的电化学传感器用于监测3D 培养OSA/MnTMPyP/PEG-DH 动态共价交联水凝胶中的MDAMB-231 细胞释放NO 的示意图Fig.1 Schematic diagram of the electrochemical sensor for monitoring NO released by MDA-MB-231 cells 3D cultured in OSA/MnTMPyP/PEG-DH dynamic covalently crosslinking hydrogel
1 实验部分
1.1 仪器与试剂
MCR 301 流变仪(奥地利安东帕公司);SUPRA55 型扫描电子显微镜(德国蔡司公司);TSC SP5 激光扫描共聚焦显微镜(德国徕卡仪器有限公司);CHI660E 电化学工作站(上海辰华仪器有限公司);Nano-ZS 粒度仪(英国Malvern 公司);UVmini-1240 紫外-可见分光光度计(日本岛津公司)。采用三电极体系:未修饰或修饰的GCE(直径3 mm)为工作电极,铂丝作为辅助电极,Ag/AgCl 电极为参比电极。
海藻酸钠(Sodium alginate,SA,上海阿拉丁试剂有限公司);酰肼聚乙二醇(2000 Da,96%,上海芃硕生物公司);高碘酸钠(NaIO4,北京百灵威试剂公司);Mn(Ⅲ)内消旋四(N-甲基-4-吡啶基)卟啉五氯化物(MnTMPyP,85%,西格玛奥德里奇贸易有限公司);亚硝酸钠(NaNO2,99%,上海麦克林生化科技有限公司);其它试剂均为分析纯。磷酸盐缓冲溶液(PBS)采用NaH2PO4∙2H2O 和Na2HPO4·12H2O 配制;实验用水为去离子水。
1.2 实验方法
1.2.1 OSA及OSA/MnTMPyP/PEG-DH水凝胶的制备
将10 g SA 分散在50 mL 无水乙醇中,5.4 g NaIO4溶于50 mL 去离子水中,将二者混合,避光搅拌6 h后,通过加入与NaIO4等物质的量的乙二醇终止反应。搅拌1 h 后,加入20 g NaCl。加入200 mL 无水乙醇,抽滤,再用去离子水溶解沉淀,重复此操作步骤4 次,将制得的产物在40 ℃下真空干燥,得到OSA 固体。通过盐酸羟胺滴定法测量OSA 的醛基含量[18],测得制备的OSA 的氧化度约为50%。
取适量OSA 置于0.1 mol/L PBS(pH=7.4)中,超声溶解,得到40 mg/mL OSA 溶液,采用相同方法制得80 mg/mL PEG-DH 溶液。将MnTMPyP 用去离子水溶解后,加入到OSA 溶液中超声10 min,得到OSA/MnTMPyP 溶液。将等体积的PEG-DH 溶液与OSA/MnTMPyP 溶液超声混合,静置约1.5 h 后,得到OSA/MnTMPyP/PEG-DH 水凝胶,MnTMPyP 在水凝胶中的浓度为0.5 mg/mL。将等体积的OSA 溶液和PEG-DH 溶液超声混合,得到OSA/PEG-DH 水凝胶。
1.2.2 OSA/MnTMPyP/PEG-DH水凝胶修饰GCE的制备
GCE 依次用1、0.3 和0.05 μm 粒径的Al2O3粉末进行抛光打磨,分别用去离子水、无水乙醇、去离子水超声清洗3 次,将其置于氮气气氛下干燥,随后用UV 照射对GCE 进行消毒杀菌。将6 μL OSA/MnTMPyP/PEG-DH 溶液滴加于GCE 表面上,待其成胶,得到OSA/MnTMPyP/PEG-DHHG/GCE。采用相同方法制备OSA/PEG-DHHG/GCE。
1.2.3 NO标准溶液的制备
根据文献[19]的方法制备饱和NO 溶液。在整套装置中持续通入N240 min 后,进行NO 的制备。在4 mol/L NaNO2溶液中逐滴缓慢地加入2 mol/L H2SO4溶液,通过歧化反应生成NO 和NO2气体,用4 mol/L NaOH 溶液对副产物NO2气体进行吸收,最后用PBS 收集制备纯化后的NO 气体,室温下,饱和NO 溶液的浓度为1.8 mmol/L,在4 ℃可避光保存3 h,现用现配。
1.2.4 3D细胞培养
MDA-MB-231 细胞购自湖南丰晖生物科技有限公司,采用含有10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的L-15 培养基,于细胞培养箱内(37 ℃,100%空气)培养。在PEG-DH 溶液中加入MDA-MB-231 细胞悬液后,得到含有细胞的80 mg/mL PEG 溶液,将OSA/MnTMPyP 溶液与含有细胞的PEG-DH 溶液等体积混合,取6 μL 混合溶液(6.7×105cells/mL)滴涂在GCE 上,于培养箱中静置培养,使其在GCE 表面原位成胶,将其置于培养箱中进行3D 细胞培养,进行电化学测试。
1.2.5 电化学测试及原位监测细胞释放的NO
在0.1 mol/L PBS(pH 7.0)中添加不同浓度的NO,采用循环伏安(CV)和计时电流(i-t)法检测修饰电极的电流响应。采用i-t法检测OSA/MnTMPyP/PEG-DH 水凝胶中3D 培养的MDA-MB-231 细胞释放的NO,待电流信号稳定后,将佛波醇-12-肉豆蔻酸酯-13-乙酸酯(PMA)加入到电解液中,刺激MDA-MB-231细胞释放NO。
2 结果与讨论
2.1 材料表征
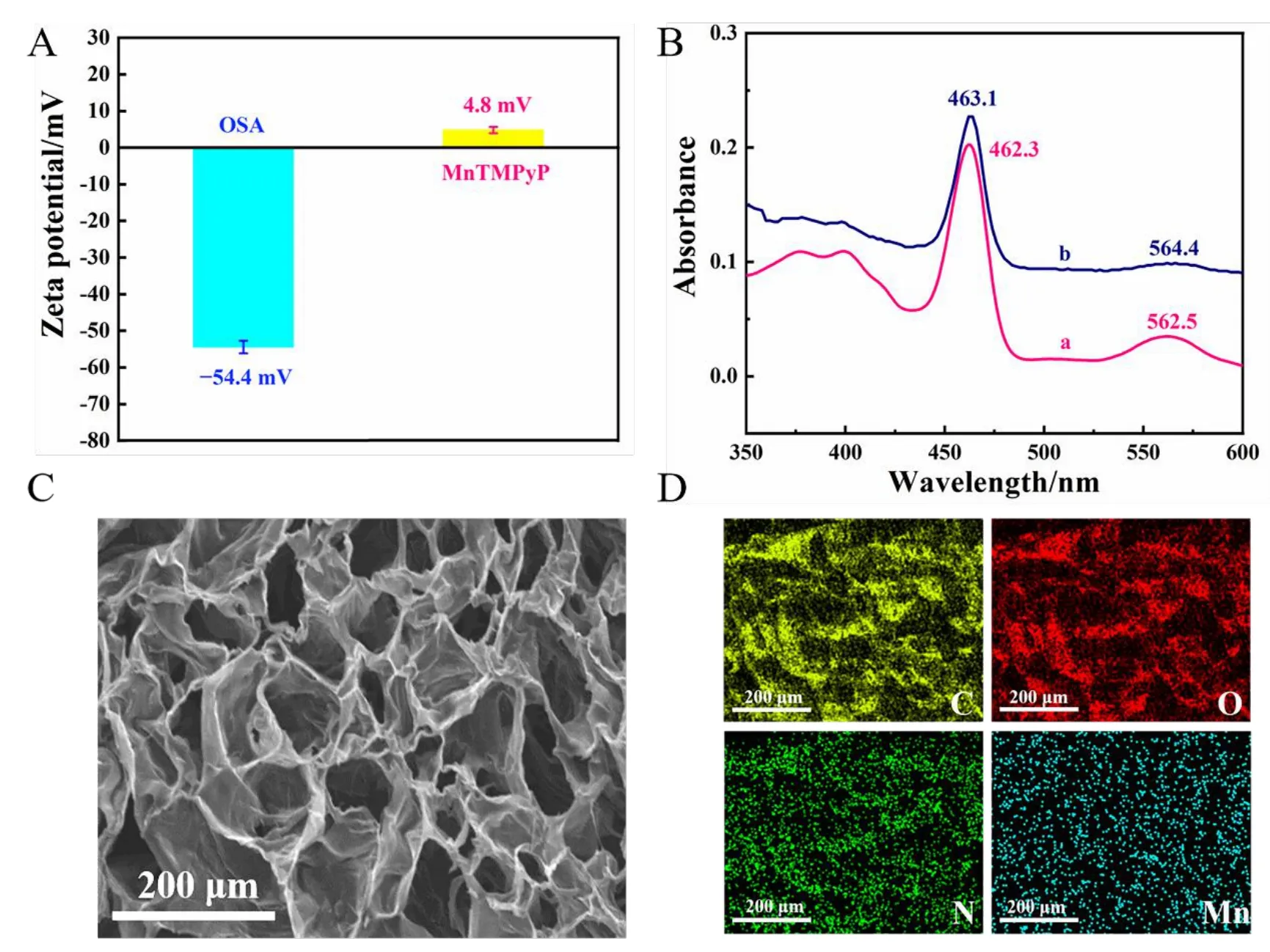
如图2A 所示,将PEG-DH 溶液与OSA 溶液进行等体积混合,在生理pH 值和室温条件下制得OSA/PEG-DH 水凝胶,制备反应机理见电子版文后支持信息图S1。采用红外光谱(FTIR)对制得的OSA 以及OSA/PEG-DH 水凝胶进行表征。如图2B 所示。相较于曲线a,曲线b 在1735 cm–1处出现了一个新的吸收峰,归属于OSA 的醛羰基对称振动吸收峰,在2860 cm–1处出现的吸收峰是另一个醛基特征峰(CO—H振动吸收峰),这表明成功制备了OSA[20]。曲线c 在3430 cm–1出现的宽吸收峰可归属于酰腙键上N—H的伸缩振动峰,曲线c 中不含有曲线b 的两处醛基特征峰,进一步说明OSA 参与反应,生成了OSA/PEG-DH水凝胶,醛基消失,表明OSA/PEG-DH 水凝胶被成功制备;曲线c 在1624 cm–1处出现的吸收峰可能既包含了C=N 的吸收峰,又包含了C=O 的吸收峰。

图2 (A)OSA/PEG-DH 水凝胶的制备过程照片;(B)海藻酸钠(SA,a)、OSA(b)和OSA/PEG-DH 水凝胶(c)的傅里叶变换红外光谱表征;(C)OSA/PEG-DH 水凝胶的自愈合过程照片;(D)采用应变扫描法测定OSA/PEG-DH 水凝胶的流变性能;(E)采用重复动态应变阶跃测试测定OSA/PEG-DH 水凝胶的自愈合特性Fig.2 (A) Preparation of OSA/PEG-DH hydrogel;(B) Fourier transform infrared spectroscopy characterization of(a)sodium alginate(SA),(b)OSA and(c)OSA/PEG-DH hydrogel;(C)Photographs of the self-healing process of OSA/PEG-DH hydrogel;(D) Detection of rheological properties of OSA/MnTMPyP/PEG-DH hydrogel using a strain sweep and (E) Detection of self-healing properties of the OSA/MnTMPyP/PEG-DH hydrogel using repeated dynamic strain step tests
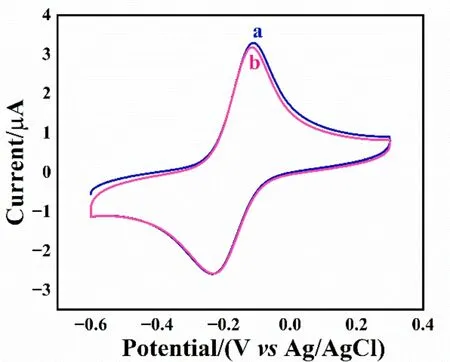
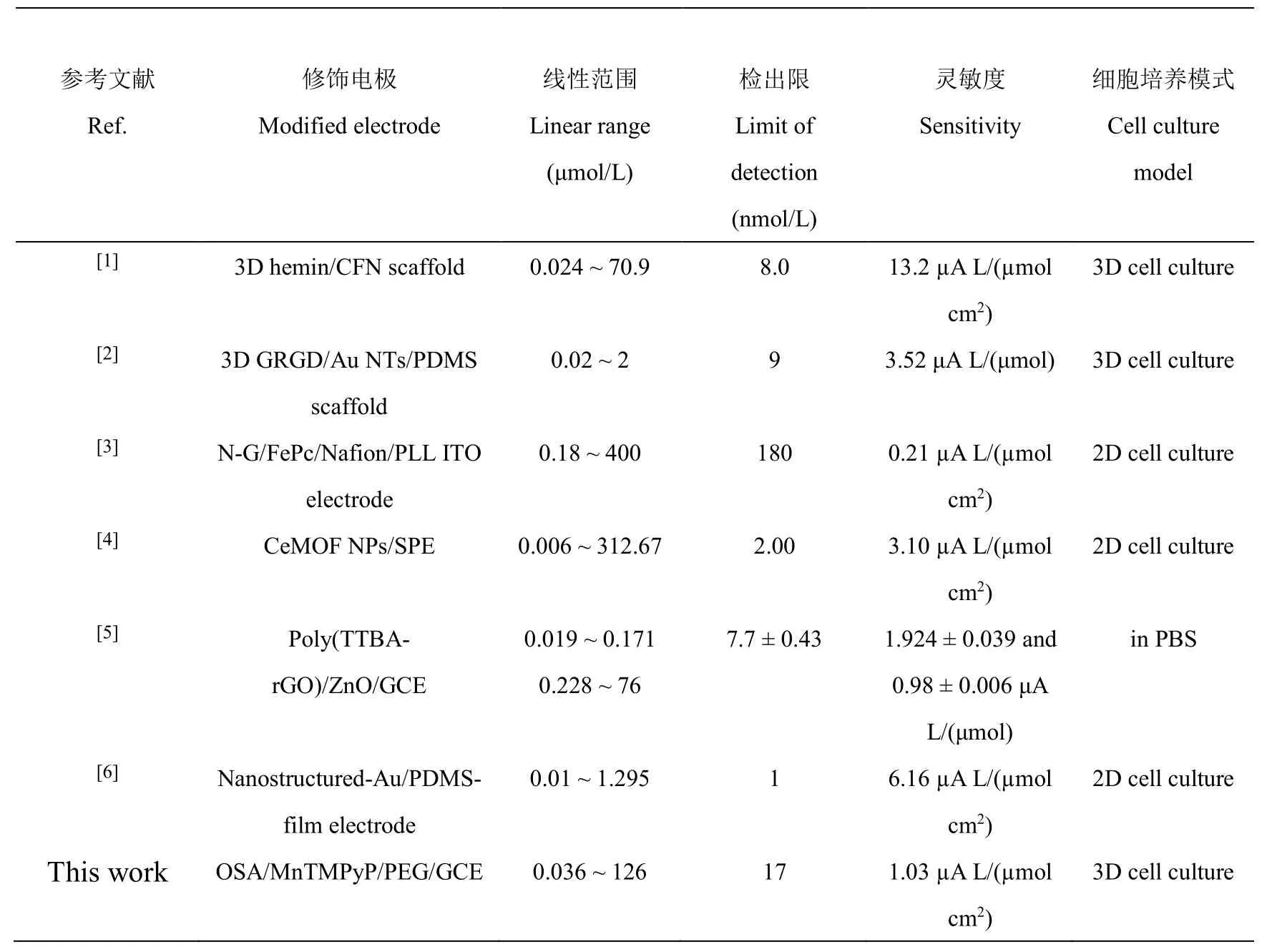
如图2C 所示,通过目视观察OSA/PEG-DH 水凝胶的自愈合过程。为了进一步表征OSA/PEG-DH 水凝胶的自愈合能力,先对OSA/PEG-DH 水凝胶进行固定频率为1 rad/s 的应变扫描测试。如图2D 所示,当应变为100%时,曲线出现交叉,表明在应变为100%时,水凝胶网络开始被完全破坏,并转化为溶胶态,即发生了溶胶-凝胶转变[21];当施加的应变超过100%时,G′′(损耗模量)>G′(储能模量),表明凝胶已转变为溶胶。根据图2D 的测试结果,设置小应变为1%、大应变为600%,进行固定频率为1 rad/s 的重复动态应变阶跃测试。如图2E 所示,当应变为1%时,G′>G′′,水凝胶呈现凝胶状态;当应变增加到600%时,G′ OSA 的Zeta 电位为–54.4 mV,说明OSA 处于负电位的状态,这可归因于OSA 链中存在部分解离的羧酸基团,即—COO–;MnTMPyP 的Zeta 电位为4.8 mV,说明其处于正电位状态(见电子版文后支持信息图S2A)。因此,MnTMPyP 与OSA 通过静电作用实现了非共价复合。在OSA/MnTMPyP/PEG-DH 水凝胶的紫外-可见吸收光谱(电子版文后支持信息图S2B)中,MnTMPyP 溶液的光谱出现强Soret 带(462.3 nm)和弱Q 带(562.5 nm)[22],OSA/MnTMPyP/PEG-DH 水凝胶的Soret 带和Q 带分别在463.1 和564.4 nm 处。OSA/MnTMPyP/PEG-DH 水凝胶与MnTMPyP 溶液的紫外-可见吸收峰的位置几乎完全重合,说明锰卟啉被成功复合在水凝胶中;与游离基卟啉相关的Soret 带未发生蓝移,说明复合水凝胶中MnTMPyP 的构型没有发生改变[23]。将OSA/MnTMPyP/PEG-DH 水凝胶冷冻干燥48 h 后,采用SEM 对其断截面进行形貌表征(电子版文后支持信息图S2C)。OSA/MnTMPyP/PEG-DH 水凝胶呈现3D 网络多孔结构,其孔径在50~100 μm 之间,而细胞直径通常在10~20 μm 之间,表明这种3D 网络多孔结构能够从空间上很好地容纳细胞,并包容细胞在3D 空间内进行有利的生长黏附、营养物质的运输和废物代谢。采用能量色散(EDS)对OSA/MnTMPyP/PEG-DH 水凝胶进行了元素分析(电子版文后支持信息图S2D),Mn(MnTMPyP 的特征元素)的EDS 元素分布图像表明,MnTMPyP 在OSA/MnTMPyP/PEG-DH 水凝胶中均匀分布。为了证明MnTMPyP 能够在水凝胶中稳定固定,对修饰OSA/MnTMPyP/PEG-DH 水凝胶的GCE进行了CV 测试(见电子版文后支持信息图S3)。记录了OSA/MnTMPyP/PEG-DHHG/GCE 在0.1 mol/L PBS 溶液(pH 7.0)中扫描1 圈(曲线a)和100 圈(曲线b)的循环伏安响应,可以观察到CV 曲线几乎没有明显变化,表明MnTMPyP 能够被稳定固定在OSA/MnTMPyP/PEG-DH 水凝胶中。 测定了不同修饰电极在0.1 mol/L PBS(pH 7.0)中的CV 响应(图3A)。在–0.5~0.3 V 的电化学窗口下,MnTMPyP/GCE(曲线a)在–0.217 和–0.067 V 处出现了一对氧化还原峰,根据公式E0=(Epa+Epc)/2,计算MnTMPyP 的形式氧化还原电位为–0.142 V。OSA/MnTMPyP/PEG-DHHG/GCE 也表现出一对相似的氧化-还原峰,但其氧化-还原峰峰差比MnTMPyP/GCE 的氧化-还原峰峰差大34 mV,说明OSA/PEG-DH水凝胶对MnTMPyP 和GCE 之间的直接电子转移存在影响。在OSA/PEG-DHHG/GCE 上仅检测到了充电电流,这表明OSA/MnTMPyP/PEG-DHHG/GCE 在CV 图中的氧化-还原峰来源于MnTMPyP 的活性中心,即Mn(Ⅲ)/Mn(Ⅱ)的还原和氧化[24]。 图3 (A)MnTMPyP/GCE(a)、OSA/MnTMPyP/PEG-DHHG/GCE(b)、OSA/PEG-DHHG/GCE(c)和GCE(d)在0.1 mol/L PBS(pH 7.0)中的循环伏安(CV)图,扫速为0.1 V/s;(B)OSA/MnTMPyP/PEG-DHHG/GCE(a、b)和OSA/PEG-DHHG/GCE(c、d)在0.1 mol/L PBS(pH 7.0)中加入30 μmol/L NO 前(a、c)后(b、d)的CV 图,扫速为0.1 V/sFig.3 (A) Cyclic voltammetry (CV) characterization of (a) MnTMPyP/GCE,(b) OSA/MnTMPyP/PEG-DHHG/GCE,(c)OSA/PEG-DHHG/GCE and(d)GCE in 0.1 mol/L PBS(pH 7.0),scan rate is 0.1 V/s;(B)CVs of OSA/MnTMPyP/PEG-DHHG/GCE(a,b)and OSA/PEG-DHHG/GCE(c,d)in the absence(a,c)and presence(b,d)of 30 μmol/L NO in 0.1 mol/L PBS (pH 7.0),scan rate is 0.1 V/s 采用CV 法分析了NO 在不同修饰电极上的电化学响应。如图3B 所示,未加入NO 时,OSA/MnTMPyP/PEG-DHHG/GCE 表现出典型的电容性行为(曲线a);加入30 μmol/L NO 后,OSA/MnTMPyP/PEG-DHHG/GCE 在0.90 V 处出现了一个明显的催化氧化峰(曲线b)。OSA/PEG-DHHG/GCE 对NO 无电化学响应(曲线d)。上述实验结果表明,OSA/MnTMPyP/PEG-DHHG/GCE 对NO 的催化氧化活性主要来自MnTMPyP。 通过i-t法(应用电位为0.9 V)评估OSA/MnTMPyP/PEG-DHHG/GCE 对NO 的电化学传感性能。如图4A 所示,NO 的浓度在0.036~126 μmol/L 范围内,电流响应随NO 浓度增加而增大,线性回归方程为y(μA)=0.073x(μmol/L)+0.121(R2=0.996)(图4B),检测NO 的灵敏度为1.03 μA·L/(μmol·cm2),检出限为17 nmol/L(S/N=3)。 图4 (A)传感器在含有NO 的0.1 mol/L PBS(pH 7.0)中的计时电流响应图(工作电位为0.90 V);(B)NO 电流响应与其浓度的线性关系曲线;(C)传感器在0.1 mol/L PBS(pH 7.0)中加入36 μmol/L NO前(a)后(b)的差分脉冲伏安(DPV)图,修饰电极表面受到机械损伤后(c)和分别经过5 min(d)以及10 min(e)自愈合后检测36 μmol/L NO 的DPV 曲线;(D)图C 中峰电流和峰电位的变化曲线Fig.4 (A)Amperometric response of the sensor at 0.9 V in PBS(pH=7.0)containing different concentrations of NO;(B) Linear relationship between the current response of NO and logarithm of NO concentration;(C)Differential pulse voltammetry(DPV)diagram of the sensor in 0.1 mol/L PBS(pH 7.0)before(a)and after(b)addition of 36 μmol/L NO,the electrochemical response of the modified electrodes to 36 μmol/L NO after mechanical damage(c),and self-healing for 5 min(d)and 10 min(e);(D)The corresponding curve of changes in peak current and peak potential in Fig.4C 通过差分脉冲伏安法(DPV)表征OSA/MnTMPyP/PEG-DHHG/GCE 在检测NO 时的自愈合性能。如图4C 所示,传感器对36 μmol/L NO 具有良好的电流响应(曲线b)。采用锋利的刀片割划水凝胶传感器表面后,立即对损伤后的传感器进行DPV 测试,发现其对36 μmol/L NO 的电流响应下降约22.4%(曲线c),与传感界面损伤之前相比,峰电位正移0.04 V(图4D)。将表面损伤后的传感器放置在室温下,不进行任何的外部干预,使其自愈合,5 min 后,传感器对36 μmol/L NO 的电流响应恢复到受损前的85.9%(曲线d);自愈合10 min 后,电流响应恢复到受损前的98.1%(曲线e),此时峰电位回到损伤前的位置。上述结果表明,传感器的传感界面在遭受损伤后能够在短时间内快速恢复其对NO 的传感能力。 通过i-t法(应用电位为0.9 V)考察了OSA/MnTMPyP/PEG-DHHG/GCE 的选择性。18 μmol/L 干扰物质(Glu、Lys、H2O2、Cl–、CA、AA、NO3–及NO2–)的电流响应均小于18 μmol/L NO 电流响应的8.0%(电子版文后支持信息图S4A),说明传感器对NO 有很好的选择性。OSA/MnTMPyP/PEG-DHHG/GCE在4 ℃下保存72 h 后,传感器的电流响应仍然保持在初始电流响应值的97.4%,表明此传感器具有良好的稳定性(见电子版文后支持信息图S4B)。在相同条件下制备的5 根OSA/MnTMPyP/PEG-DH HG/GCE对9 μmol/L NO 的电流响应的相对标准偏差(RSD)为3.6%,表明电极的制备重现性良好。采用同一根OSA/MnTMPyP/PEG-DHHG/GCE 对9 μmol/L NO 进行电化学检测,5 次检测结果的RSD 为2.0%,表明此传感器具有优良的检测重现性。 采用OSA/MnTMPyP/PEG-DH 水凝胶模拟细胞所处的动态3D 微环境,通过激光扫描共聚焦显微镜(LSCM)能观察到水凝胶内的细胞簇分布在不同高度,其整体呈现3D 的分布状态[25-26](图5A)。通过CCK-8 法评估OSA/MnTMPyP/PEG-DH 水凝胶的体外细胞毒性,发现3D 培养于水凝胶中的MDA-MB-231细胞经不同培养时间的细胞存活率均大于92%(电子版文后支持信息图S5),证明此水凝胶具有良好的生物相容性。 图5 (A)MDA-MB-231 细胞在水凝胶中的激光扫描共聚焦显微镜(LSCM)图像;(B)OSA/MnTMPyP/PEG-DH/cell HG/GCE(a)和OSA/MnTMPyP/PEG-DHHG/GCE(b)以及切割后的含有细胞的传感器(c)在PBS(pH=7.0)中经佛波醇-12-肉豆蔻酸酯-13-乙酸酯(PMA)刺激得到的计时电流图Fig.5 (A) Laser scanning confocal microscope (LSCM) image of MDA-MB-231 cells in hydrogel;(B) Amperometric responses of OSA/MnTMPyP/PEG-DH/cell HG/GCE (a),OSA/MnTMPyP/PEG-DH HG/GCE(b) and the sensor containing cells after cutting in PBS (c) under stimulation with phorbol-12-myristate-13-acetate (PMA) 通过检测MDA-MB-231 细胞释放的NO 考察所制备电化学传感器的实时检测性能。在1 mL PBS(pH=7.0)中,OSA/MnTMPyP/PEG-DH/cell HG/GCE 经PMA(1 μg/mL)刺激后产生的电流响应为434.4 nA(图5B 中曲线a),而不含细胞的传感器无任何电流响应,表明电流响应不是加入PMA 引起的,而是细胞经药物刺激后释放NO 导致的。为了考察在实际监测3D 培养细胞释放NO 过程中传感器的自愈合性能,将相同条件下制备的OSA/MnTMPyP/PEG-DH/MDA-MB-231cell HG/GCE 的表面进行切割后,置于PBS中进行i-t测试,600 s 后注射PMA(1 μg/mL),电流响应为421.7 nA(图5B 中曲线c),为未经切割处理的电极所得电流响应的97.1%,表明传感界面基本愈合。实验结果表明,此传感器能够对受损界面进行自修复从而实现NO 电流响应的快速恢复。基于动态共价交联水凝胶所构建的电化学传感器不仅能够模拟细胞生长所需要的动态微环境,而且传感界面因具有优异的自愈合性,能够修复外界潜在的机械损伤。 本研究制备了OSA/MnTMPyP/PEG-DH 水凝胶,基于此构建了电化学传感平台,实现了原位监测3D培养的MDA-MB-231 细胞释放的NO。OSA/PEG-DH 水凝胶通过动态酰腙键实现可逆的断裂和重组,模拟细胞所处的动态微环镜。MnTMPyP 作为传感器的敏感元件,通过对NO 的电催化氧化实现了对NO 浓度的定量分析。传感器对NO 的检测灵敏度为1.03 μA·L/(μmol·cm2),检出限为17 nmol/L(S/N=3),损伤后的传感界面对NO 的电流响应能及时恢复。本研究为模拟细胞动态微环境以及监测细胞行为等研究奠定了基础。 支持信息 Supporting Information 图S1 OSA/PEG-DH 水凝胶的制备机制Fig.S1 Schematic diagram of the gelation mechanism of OSA/PEG-DH hydrogel 图S2 (A)OSA 和MnTMPyP 的Zeta 电位表征;(B)(a)MnTMPyP 水溶液和(b)含MnTMPyP 水凝胶的紫外吸收光谱;(C)OSA/MnTMPyP/PEG-DH 水凝胶的SEM 和(D)元素分布图Fig.S2 (A) Zeta potentials of OSA and MnTMPyP;(B) UV-visible absorbance spectrums of (a) MnTMPyP in Milli-Q water and (b) OSA/MnTMPyP/PEG-DH hydrogel;(C) SEM image and (D) corresponding EDS mappings of OSA/MnTMPyP/PEG-DH hydrogel 图S3 OSA/MnTMPyP/PEG-DH HG/GCE 中在 0.1 mol/L PBS(pH 7.0)中的 CV 曲线(a)及连续扫描100 个循环之后的CV 曲线(b),扫速为0.1 V/sFig.S3 CVs obtained at the OSA/MnTMPyP/PEG-DH HG/GCE in 0.1 mol/L PBS (pH 7.0) before (a) and after (b)continuous scanned for 100 cycles,scan rate of 0.1 V/s 图S4 (A)OSA/MnTMPyP/PEG-DH HG/GCE 的选择性实验:在 0.1mol/L PBS(pH 7.0)中,修饰电极对18 μmol/L 的NO 和其他18 μmol/L 干扰物质的电流响应;(B)OSA/MnTMPyP/PEG-DH HG/GCE 的稳定性实验结果Fig.S4 (A) Interference test of OSA/MnTMPyP/PEG-DH HG/GCE: the current response upon 18 μmol/L NO and 18 μmol/L different interferents in 0.1 mol/L PBS (pH 7.0);(B) Storage stability of OSA/MnTMPyP/PEG-DH HG/GCE 图S5 OSA/MnTMPyP/PEG-DH 水凝胶的细胞毒性实验Fig.S5 Cytotoxicity test of OSA/MnTMPyP/PEG-DH hydrogel 表S1 不同电化学传感器检测细胞释放NO 的性能比较Table S1 Comparison of selected electrochemical sensors for NO detection released from cells. 参考文献: [1]HU F X,XIE X L,WANG D P,YANG H B,GU Y,CHEN B,ZHANG C M,RAO Q H,LI Q F,GUO C X.Sens.Actuators,B,2021,334:129594. [2]QIN Y,HU X B,FAN W T,YAN J,CHENG S B,LIU Y L,HUANG W H.Adv.Sci.,2021,8(13): 2003738. [3]XU H Y,LIAO C,LIU Y J,YE B C,LIU B H.Anal.Chem.,2018,90(7): 4438-4444. [4]WANG J W,YIN Y Y,RAO Q H,LI G,SUN W,HU F X,LI C M.ACS Appl.Nano Mater.,2022,5(2): 2451-2459. [5]KIM M-Y,NAVEEN M H,GURUDATT N G,SHIM Y-B.Small,2017,13(26):1700502. [6]ZHAO X,WANG K Q,LI B,WANG C,DING Y Q,LI C Q,MAO L Q,LIN Y Q.Anal.Chem.,2018,90(12):7158-7163.2.2 不同修饰电极的电化学表征及其对NO的电化学响应

2.3 传感器对NO的传感性能研究

2.4 原位监测3D培养MDA-MB-231细胞释放的NO

3 结论