2种方案对复发难治性急性髓系白血病的疗效及其对免疫功能的影响
张 娟,郑雯琦,柴俊月,崔婷婷,魏 娜,龚 颉
北京市第六医院血液科,北京 100007
复发难治性急性髓系白血病(acute myeloid leukemia,AML)是由骨髓原细胞和幼稚细胞恶性克隆,细胞增殖、分化和凋亡等过程异常导致的造血系统障碍疾病[1-2]。阿柔比星、阿糖胞苷联合粒细胞集落刺激因子(CAG)方案是治疗AML的主要方法[3]。阿扎胞苷可降低DNA甲基化水平,抑制恶性细胞增殖,杀死异常造血细胞,其对于复发难治性AML的治疗效果与强化疗相当,且患者的中位生存期更长[4]。维奈托克(venetoclax,VEN)为B细胞淋巴瘤/白血病-2基因(B-cell lymphoma-2,Bcl-2)抑制剂,于2018年被美国食品药品管理局批准用于治疗不适合高度诱导化疗的AML患者[5-6]。本研究用阿扎胞苷联合CAG方案和阿扎胞苷联合VEN 2种方案治疗复发难治性AML,探究二者的临床应用效果。
1 一般资料
回顾性分析收治的66例AML患者的临床资料,按治疗方案分为VEN组(VEN联合阿扎胞苷方案,30例)和CAG组(阿扎胞苷联合CAG方案,36例)。
纳入标准:①符合复发难治性AML的诊断标准[7];②肝、肾功能正常;③患者知情同意。
排除标准:①对2种方案不耐受者;②合并有其他类型恶性肿瘤者;③精神异常,无认知水平者;④合并严重感染性疾病者;⑤合并严重器质性疾病者。
2组间一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。

表1 2组患者一般资料的比较
2 方法
2.1 治疗方法
CAG组:第1~7天,皮下注射75 mg·m-2阿扎胞苷(规格为100 mg,德国拜耳制药公司);第1~14天皮下注射300 μg粒细胞集落刺激因子(规格为100 μg,齐鲁制药有限公司),每日1次,皮下注射10 mg·m-2阿糖胞苷(规格为0.5 g,Pfizer),每日2次;第1~4天静脉滴注20 mg阿柔比星(规格为10 mL∶20 mg,石药集团欧意药业有限公司),如患者出现白细胞计数>20×109个·L-1则暂停给予粒细胞集落刺激因子。
VEN组:阿扎胞苷使用方法同CAG组。口服VEN(规格为100 mg,爱尔兰AbbVie Ireland NL B.V.),第1天100 mg,第2天200 mg,第3~28天400 mg,28 d为1个周期。
2组治疗4周后,CAG组采用阿扎胞苷、高三尖杉酯碱、阿糖胞苷、阿柔比星联合治疗,VEN组采用阿扎胞苷、VEN、阿柔比星、阿糖胞苷联合治疗,再复发者或未缓解患者可采取姑息治疗。若2组患者急需造血干细胞移植或者有合适的移植供体,可以随时行移植程序。
2.2 观察指标
2.2.1疗效 完全缓解(complete remission,CR):治疗后,患者症状和体征完全消失,例如无白血病细胞浸润、贫血、感染等症状。血常规检查无白血病细胞,Hb≥100 g·L-1(男)、Hb≥90 g·L-1(女),PLT≥100×109·L-1,中性粒细胞≥1.5×109·L-1;行骨髓穿刺显示骨髓原始细胞百分比不超过5%,巨核细胞及红细胞数量正常,无髓外白血病。部分缓解(partial relief,PR):治疗后,症状、体征以及血常规中至少有一项未达到CR,骨髓穿刺结果显示骨髓原始细胞百分比为6%~20%。未缓解:治疗后,患者症状、体征、血常规检查结果以及骨髓穿刺结果均未达到上述标准。总缓解率=[(CR例数+PR例数)/总例数]×100%[8]。
2.2.2对比方法 在治疗前、治疗4周后,抽取患者空腹静脉血3 mL,用HA-360型全自动血细胞分析仪(艾康生物技术有限公司)检测Hb和PLT;用骨髓涂片测量骨髓原始细胞百分比;用DXC800型全自动生化分析系统(美国贝克曼库尔特),酶速率法检测乳酸脱氢酶(lactate dehydrogenase,LDH);用酶联免疫吸附试验检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α);用生化光电比色法检测肿瘤特异性生长因子(tumor specific growth factor,TSGF);用赛默飞A29001型流式细胞检测仪检测CD4+、CD3+,并计算CD4+/CD8+值。
2.2.3不良反应 参照国际肿瘤化疗药物不良反应分级标准[9],观察化疗所致不良反应发生率等情况。
2.2.4生存情况 根据欧洲白血病网评分系统将2组患者分为低危、中危或高危,具体如下:从缓解到复发的时间>18个月计0分,7~18个月计3分,≤6个月计5分;初始细胞遗传学inv_(16)或t_(16∶16)计0分;t(8∶21)计3分;其他计5分;是否进行造血干细胞移植,0分为否,2分为是;复发年龄35岁计0分,36~45岁计1分,>45岁计2分。比较患者1年生存率、无病生存率、1年生存期及无病生存期。
2.3 统计学方法

3 结果
3.1 临床疗效的比较
治疗4周后,VEN组的总缓解率(66.67%)显著高于CAG组(41.67%)(P<0.05)。结果见表2。

表2 2组临床疗效的比较
3.2 Hb、PLT和骨髓原始细胞百分比的比较
治疗4周后,2组的Hb和PLT均较治疗前升高(P<0.05),骨髓原始细胞百分比均较治疗前降低(P<0.05),且VEN组与CAG组治疗4周后比较,差异具有统计学意义(P<0.05)。结果见表3。
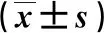
表3 2组Hb、PLT和骨髓原始细胞百分比的比较
3.3 肿瘤标志物的比较
治疗4周后,2组的LDH和TSGF均较治疗前降低(P<0.05),TNF-α较治疗前升高(P<0.05),且VEN组与CAG组治疗4周后比较,差异具有统计学意义(P<0.05)。结果见表4。
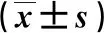
表4 2组肿瘤标志物的比较
3.4 免疫功能的比较
治疗4周后,2组的CD3+、CD4+及CD4+/CD8+值均较治疗前升高(P<0.05),且VEN组显著高于CAG组(P<0.05)。结果见表5。
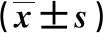
表5 2组免疫功能的比较
3.5 不良反应的比较
VEN组肝肾功能异常、骨髓抑制和恶心呕吐的发生率显著低于CAG组(P<0.05),其他不良反应2组比较差异无统计学意义(P>0.05)。结果见表6。
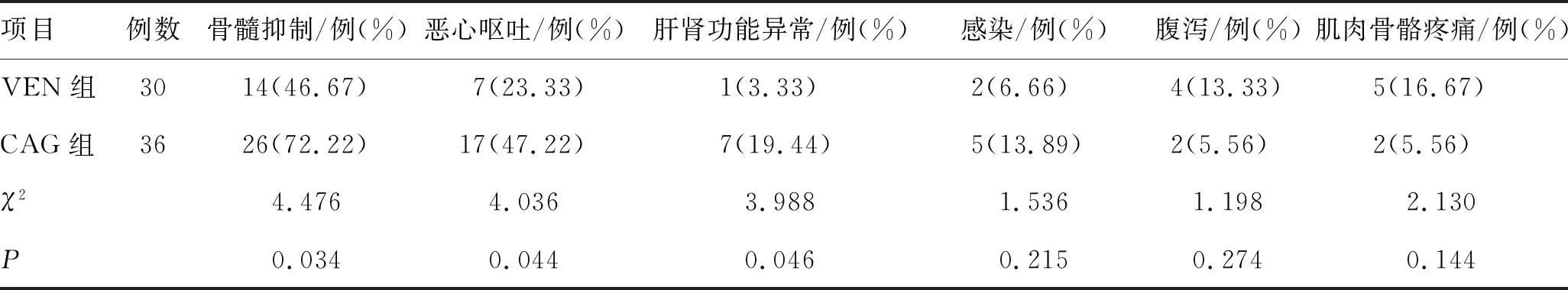
表6 2组不良反应的比较
3.6 预后情况的比较
随访1年,2组1年总生存率比较差异无统计学意义(χ2=2.475,P>0.05),VEN组无病生存率、总生存期及无病生存期均显著高于CAG组(χ2=4.830,t=8.000,t=5.157,P<0.05)。结果见表7。

表7 2组预后的比较
4 讨论
复发难治性AML患者预后差,长期生存率低于25%,传统化疗的缓解率低,临床治疗方案的选择受患者的原发性耐药性、器官功能下降的程度和药物累积毒性等因素的限制[10]。CAG化疗是一种将化疗、诱导分化和凋亡治疗有机结合的方案,为临床治疗AML的主要方式之一,但用于治疗复发难治性AML时易导致患者出现获得性耐药[11]。因此,探讨与新药Bcl-2抑制剂或去甲基化剂联合化疗的疗效将有助于为临床方案的选择提供依据。阿扎胞苷是一种具有RNA和DNA双重作用的去甲基化剂,可以抑制肿瘤基因的表达,起到杀伤肿瘤细胞的作用,但因其单独应用时具有反应效率低、持续性短等局限,故常与CAG方案联合应用[12]。VEN可使AML细胞快速凋亡,患者对其的耐受性高,且安全性好,近年来国外有较多研究证实VEN联合阿扎胞苷治疗的有效性,但在国内相关报道很少[13]。基于此,本研究用阿扎胞苷联合CAG方案和阿扎胞苷联合VEN 2种方案治疗复发难治性AML,比较二者的疗效和安全性。
本研究结果显示,治疗4周后,VEN组的总缓解率(66.67%)显著优于CAG组(41.67%),VEN组的Hb和PLT显著高于CAG组,骨髓原始细胞百分比显著低于CAG组,表明VEN联合阿扎胞苷具有良好的临床疗效。其原因有两个:一方面,VEN可以与Bcl-2直接结合,代替促凋亡蛋白BH3家族,恢复细胞的通信系统,发挥抗肿瘤作用[14];另一方面,两者发挥协同效应,主要机制可能为mcl基因是VEN内源性耐药的主要原因,而阿扎胞苷可以降低mcl-1的表达水平,VEN可以通过诱导AML细胞凋亡来改善机体对阿扎胞苷的反应,阿扎胞苷在治疗过程中可以激活NF-E2相关因子-2的抗氧化途径,产生的抗氧化酶对肿瘤细胞具有防止氧化损伤的作用,而VEN可以抑制NF-E2相关因子2的产生,因此其抗AML作用比单独应用阿扎胞苷更明显[15]。
白血病细胞可分泌LDH,当白血病细胞超载则导致LDH分泌量增加,LDH可以直接反映体内白细胞的水平[16]。TNF-α可以促进细胞的增殖和分化,是肿瘤免疫的关键因子,影响AML的进展[17]。肿瘤特异性生长因子(tumor specific growth factor,TSGF)是肿瘤标志物之一,能刺激恶性肿瘤血管生成及周围毛细血管增殖[18]。研究表明,当机体免疫功能减退时,体内CD3+、CD4+下降,CD4+与CD8+的平衡被打破[19]。本研究结果显示,VEN组LDH和TSGF显著低于对照组,TNF-α显著高于对照组,表明VEN联合阿扎胞苷治疗有助于患者免疫功能的恢复。阿扎胞苷通过抑制异常血细胞增殖,诱导AML细胞病毒模仿反应,使其更容易受到T细胞的影响,可降低血液中炎症因子的水平,进而提高免疫功能,而VEN能直接增强T细胞抗白血病的功能[20-21]。
本研究结果显示,VEN组肝肾功能异常、骨髓抑制和恶心呕吐的发生率低于CAG组。美国一项多中心研究结果显示,VEN在治疗145例老年AML患者中常见的不良反应为骨髓抑制和恶性呕吐等,对于预后较差、细胞遗传学较差的患者均具有低毒性及较好的耐受性[22],与本研究结果一致。
MORSIA E等[23]的研究结果显示,VEN联合阿扎胞苷治疗86例AML患者的总生存期为11(8~23) 个月,单因素分析结果显示,高危遗传学和TP53突变为影响预后的因素。本研究结果显示,VEN组无病生存率、总生存期及无病生存期均显著优于CAG组,表明VEN联合阿扎胞苷治疗可明显改善患者的预后。本研究的不足之处在于样本量小,缺乏对患者长期预后的比较和分析,后期可在此基础上扩大样本量进行研究。
综上所述,治疗复发难治性AML,VEN联合CAG方案的疗效更好,能够改善患者的免疫功能,并且降低不良反应的发生率,患者的预后更佳。

