编织型药物洗脱食管覆膜支架及其体外抑制细胞增生性能
王 玥,李金奉,王 璐,b,c,关国平,b,c
(东华大学 a.纺织学院,b.纺织面料技术教育部重点实验室,c.纺织行业生物医用纺织材料与技术重点实验室, 上海 201620)
食管是位于人体咽和贲门之间的细长消化管道,食管癌是全球癌症死亡的第六大常见原因[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是最常见的食管癌之一[2]。我国食管癌的发病率排在所有恶性肿瘤的第5位,致死率排在第4位,发病人数居世界首位[3]。食管癌晚期病人的食管管径约70%会被癌组织浸润,进而导致食管狭窄[4]。对于早、中期食管癌患者,可以采用内镜下扩张[5]、光动力学[6]等手段来缓解其食管狭窄症状;而对于晚期、高龄食管癌患者,多采用食管支架植入术[7]来打开或重建狭窄的食管管腔[8]。
目前临床上应用较为广泛的食管覆膜支架通常包括手工编织的支架和负载的流延膜。手工编织的支架多采用镍钛(NiTi)合金丝[9],而流延膜的材料包括硅胶、聚氨酯等。传统覆膜支架的生产工艺流程长、耗时多、生产效率低,产品质量的一致性不易控制。此外,有研究[10]表明,食管支架植入术后最常见、最严重的远期并发症为食管再狭窄,其发生比例可达30%~40%。发生食管再狭窄的直接原因是覆膜强度不足而破裂,间接原因包括癌组织的生长、正常组织因机械刺激而发生的异常增生[11-12]。
解决食管再狭窄,一方面需要提高覆膜强度,另一方面可考虑开发药物洗脱支架[13]。治疗食管狭窄的药物洗脱支架(drug eluting stent,DES)已被证明可以缓解支架诱导的组织增生或肿瘤生长[14]。药物洗脱支架常用药物为雷帕霉素、紫杉醇和五氟嘧啶(5-FU)[5]。理想的药物洗脱支架可抑制肿瘤生长而不影响内皮修复过程[15],其药物释放时间应维持在2周以上[16]。载药覆膜支架要持续维持均匀的力学强度、良好的柔顺性,就要在覆膜支架材料选择和结构设计方面做深入研究[17]。郭庆海[18]以乙烯酸乙烯酯共聚物为载体、5-FU为增生抑制药物,所制备的食管支架没有出现严重局部炎症反应和毒性反应。有的药物洗脱支架不但可以抑制组织增生,还可以抗肿瘤[19],可使术后食管再狭窄率降至5%~10%[20]。载体材料可选择聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)、聚乳酸(polylactic acid,PLA)等[21]医用可降解高分子材料,其可以较好地控制降解时间,从而控制药物释放速率。载药覆膜的制备工艺主要有浸渍法、喷涂法、热压法、静电纺丝法[22]。
本文采用机械编织的方法一次成型食管覆膜支架,以PLGA为载体材料、雷帕霉素(Rapamycin,RAPA)为细胞增生抑制药物,对该覆膜支架进行涂层、载药,并对一体化编织食管覆膜支架和载药覆膜支架进行较系统的测试和表征,以期为进一步开发生产效率高、产品质量稳定、覆膜强度高,以及具有细胞增生抑制效果的食管覆膜支架产品提供参考。
1 材料与方法
1.1 试验材料
直径为0.2 mm的镍钛合金丝(广东富江医学科技有限公司);线密度为333 dtex的涤纶长丝(贝尔泰新纤维制品有限公司);30/50/60邵尔硬度的硅胶混炼胶(上海锦上化工有限公司);四氢呋喃(柯林斯(Collins));PLGA75/25(n(LA) ∶n(GA)=75∶25)和PLGA50/50(n(LA) ∶n(GA)=50∶50)(济南岱罡生物降解材料),其中,LA为乳酸,GA为羟基乙酸;雷帕霉素、二氯甲烷、乙腈和无水乙醇(罗恩试剂);磷酸缓冲盐(phosphate buffer saline,PBS)溶液(自制);BioMine stent(Meril);Supralimus stent(Sahajanand);FireBird stent(上海微创医疗器械有限公司);成纤维细胞L929和肿瘤细胞DU145(中科院细胞库);DMEM基础培养基、MEM基础培养基、青霉素-链霉素和胰蛋白酶(Gibco);AM/PI活/死细胞染色剂(1000 T、凯基生物科技有限公司);Cell Counting Kit-8试剂盒(500 T、上海翊圣生物科技有限公司);细胞培养瓶和24孔与96孔细胞培养板(康宁生命科学有限公司)。
1.2 覆膜支架的设计与制备
1.2.1 一体化编织食管覆膜支架的制备
一体化编织食管覆膜支架的制备流程如图1(a)所示,采用32锭编织机将涤纶复丝与NiTi合金丝编织成一体化食管覆膜支架(Y-ES)。先对NiTi合金丝进行热定型处理,再将NiTi合金丝缠绕至锭子。通过绕纱机将涤纶单丝并股缠绕到锭子上,将缠有涤纶复丝与NiTi合金丝的锭子按图1(b)所示的方式排列,其中,蓝色粗线代表NiTi合金丝,黑色细线代表涤纶复丝。

图1 一体化编织食管覆膜支架制备示意图Fig.1 Schematic diagram of the preparation of integrated braided esophageal covered stents
1.2.2 硅胶食管覆膜支架的制备
硅胶食管覆膜支架的制备流程如图2所示。采用32锭编织机,用NiTi合金丝编织内径为9 mm的裸支架(N-ES)。利用硝酸-氢氟酸清洗裸支架表面30 min,再在超声波清洗器中用去离子水清洗3次,50 ℃烘干。分别取邵尔硬度为30、50、60的硅胶各5 g,并置于45 mL的四氢呋喃中进行溶解,得到硅胶溶液。再将N-ES支架浸渍在硅胶溶液中以制备传统的硅胶食管覆膜支架。硬度为30、50、60的硅胶食管覆膜支架分别记为C30-ES、C50-ES和C60-ES。
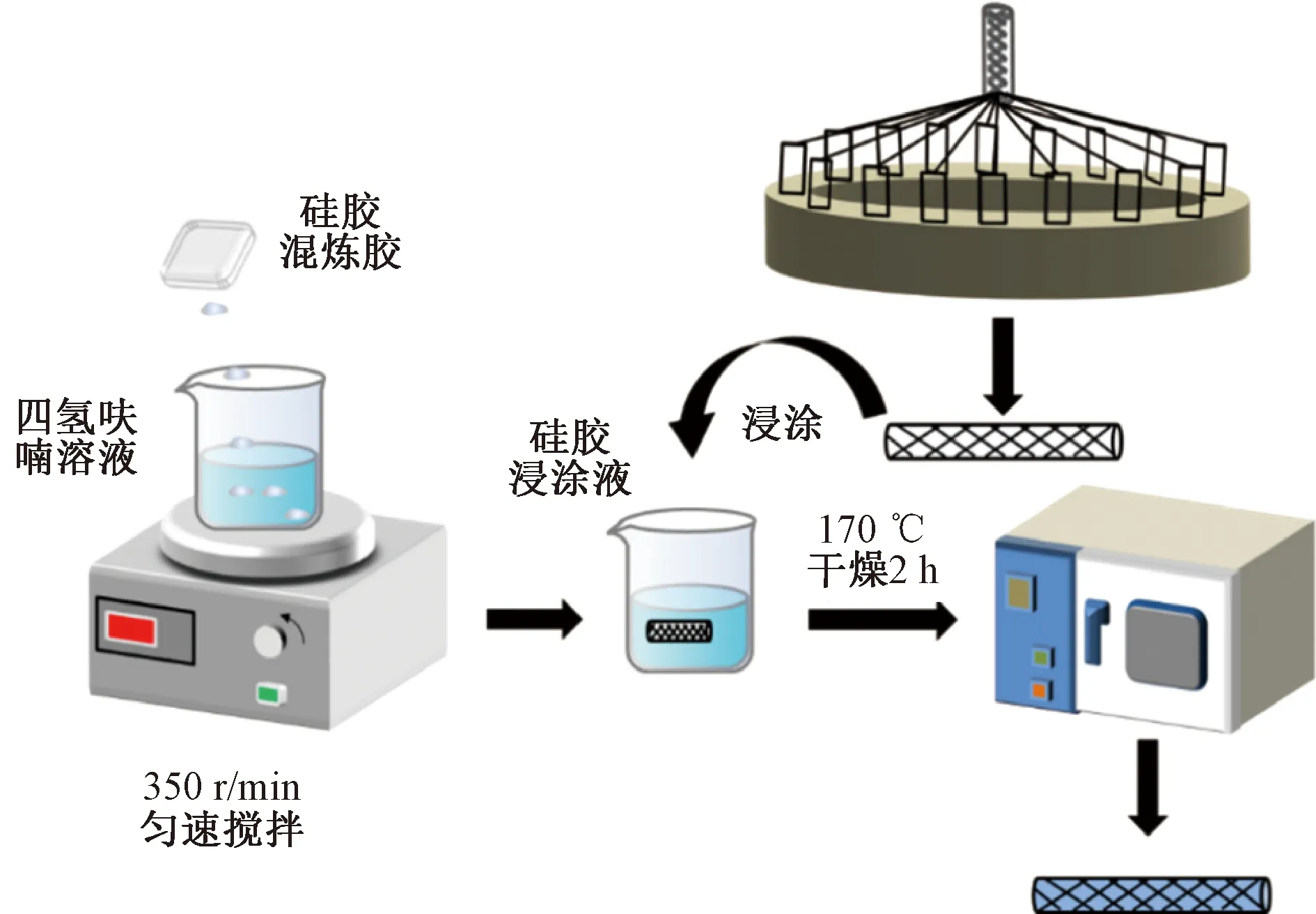
图2 硅胶食管覆膜支架制备示意图Fig.2 Schematic diagram of the preparation of silicone esophageal covered stents
1.2.3 一体化编织食管载药覆膜支架的制备
将直径为9 mm、长度为20 mm的Y-ES支架在二氯甲烷中浸泡2 h后通风处理2 h,再置于超声波清洗器中清洗3遍,再次通风处理2 h,在50 ℃的条件下干燥。在遮光条件下,分别称取1.2 g PLGA75/25和PLGA50/50并置于2个100 mL的离心管中,分别向2个离心管中加入0.06 g雷帕霉素(RAPA),再加入60 mL二氯甲烷进行溶解,即制得载药溶液[23]。
将预处理过的Y-ES支架垂直放入载药溶液中,并将离心管放置在摇床中,以转速60 r/min振荡2 h。试样取出后放在37 ℃的干燥箱中干燥2 h,即制得2种一体化编织食管载药覆膜支架,记为PLGA75/25-RAPA-Y-ES、PLGA50/50-RAPA-Y-ES。
1.3 覆膜耐疲劳性能测试
植入的食管覆膜支架在体内会受到食管的生理性蠕动和吞咽食物的摩擦,因此,覆膜的耐疲劳性能是决定覆膜失效、食管再狭窄的关键。利用笔者课题组自主研发的覆膜强度评价装置[24],对Y-ES、C30-ES、C50-ES和C60-ES的覆膜耐疲劳性进行测试。测试参数:试样长度为7 cm,隔距为5 cm,测试头移动距离为1.5 cm,移动速度为1 m/min。测试头为医用不锈钢小球,测试头直径为9.3 mm。测试完毕,用体式显微镜(PXS8-T型,尼康株式会社)分别观察4种覆膜的形态变化。在上述覆膜强度测试前后,使用人体生物管道径向压缩仪(LLY-06D型,莱州电子仪器有限公司)对4种覆膜支架的径向支撑力进行测试,每种支架测试3个不同位置点,测试结果取平均值。
1.4 覆膜支架表面形态观察
取一体化编织食管载药覆膜支架,用扫描电镜观察支架表面形态及载药情况。取药物释放试验后的一体化编织食管覆膜支架,同等条件下观察覆膜支架的表面形态及药物释放情况。
1.5 水接触角测试
利用OCA15EC型接触角测试仪对PLGA75/25-RAPA-Y-ES、PLGA50/50-RAPA-Y-ES的表面亲水性进行测试。
1.6 体外药物释放试验
配制pH值分别为7.4和6.5,浓度为0.15 mol/L的PBS溶液。取4支10 mL的离心管,分别加入4 mL PBS溶液,其中,1支加入pH=7.4的PBS溶液,另外3支加入pH=6.5的PBS溶液。
将PLGA50/50-RAPA-Y-ES试样分别置入盛有pH=6.5和7.4的PBS溶液的离心管中,完全浸没,将离心管置于37 ℃、60 r/min摇床上振荡。每24 h后将样品分别转移至与原条件相同的PBS溶液下继续进行药物释放试验。将PLGA75/25-RAPA-Y-ES、PLGA50/50-RAPA-Y-ES分别置入盛有pH=6.5的PBS溶液的离心管中,将离心管放于37 ℃、60 r/min摇床上振荡。每24 h后将样品分别转移至另一个盛有pH=6.5 的PBS溶液的离心管中,相同条件下继续进行药物释放试验。
检测药物释放24 h的PBS溶液中的药物释放量。向溶液中加入乙腈溶液以充分溶解药物,制得乙腈体积分数为40%的PBS溶液,涡旋后用紫外分光光度计测量吸光度,根据标准曲线测得对应药物浓度。重复以上操作,直至药物完全释放。雷帕霉素的累积释放量及累积释放率的计算如式(1)和(2)所示。
(1)
(2)
式中:M为雷帕霉素累积释放量,μg;r为雷帕霉素累积释放率,%;ρi为第i次取样时溶液中雷帕霉素的质量浓度,μg/mL;Vi为第i次取样时雷帕霉素溶液的体积,mL;ρn为第n次取样时溶液中雷帕霉素的质量浓度,μg/mL;Vn为第n次取样时雷帕霉素溶液的体积,mL;m为支架上的总载药量,μg。
1.7 载药覆膜体外抑制细胞增生试验
为了体外释放药物操作方便,本文制备规格为10 mm×10 mm的涤纶(PET)平纹织物作为载体覆膜来替代一体化编织食管覆膜支架主体,并用上述步骤制备了以PET平纹织物为载体的载药覆膜(PLGA75/25-RAPA-PET、PLGA50/50-RAPA-PET)以及非载药覆膜(PLGA50/50-PET)。采用CCK-8和活/死细胞染色法进行载药覆膜的体外抑制细胞增生试验。A组为PLGA75/25-RAPA-PET、B组为PLGA50/50-RAPA-PET、C组为PLGA50/50-PET对照组、D组为培养皿空白组,将A、B和C组样品制备成直径为14 mm的圆片并进行灭菌处理。试验选用L929成纤维细胞系和DU145肿瘤细胞系,培养基分别为DMEM(含10% 胎牛血清及1%的双抗)和MEM(含10% 胎牛血清及1%的双抗)。
CCK-8试验参照试剂盒说明书进行。试验设置1、3、7 d共3个时间点,每个时间点每组设置3个平行样(n=3)。到培养时间后,吸出24孔板中培养基,用PBS溶液清洗每个样品3次。避光条件下,采用CCK-8和基础培养基的体积比为10∶90配制CCK-8试剂,将两者混合均匀后,每孔中加入500 μL CCK-8试剂,将24孔培养板放回培养箱继续培养2 h。
培养完成后,转移24孔板中的液体到96孔板中,24孔板的每个孔取3次,每次100 μL。在波长450 nm处,用酶标仪测量吸光度。吸光度越大,意味着活细胞数量就越多。体外细胞抑制率[25]计算如式(3)所示。
(3)
式中:RIR为细胞抑制率,%;At为试验组450 nm处的吸光度;Ac为空白组450 nm处的吸光度。
为了进一步观察体外细胞增殖情况,对A、B和C组样品进行活/死细胞染色。将L929和DU145种植在样品上分别培养1和3 d后,取出培养板,吸出培养基,用PBS溶液清洗样品3次。黑暗条件下配置活/死染色液,V(PBS溶液)∶V(染色剂)=2 000∶1。在PBS溶液中先加PI后再加AM染液,混合均匀后加入试验孔中,每孔加入200 μL染色液,放入37 ℃培养箱中45 min后,避光条件下将染色液吸出,用PBS溶液清洗样品3次,在荧光显微镜下观察活/死细胞情况。
1.8 数据的统计分析
2 结果与讨论
2.1 覆膜支架的结构与外观
一体化食管覆膜支架(Y-ES)、金属裸支架(N-ES)、硅胶覆膜支架(C-ES)的形态结构如图3所示。Y-ES结构规整、致密,涤纶长丝有序交错,NiTi合金丝规则分布并与涤纶丝均匀交织为一体,管径匀称(见图3(a))。N-ES结构规整、管径一致、孔尺寸均匀(见图3(b))。C-ES的硅胶膜能够均匀地将金属丝及其交织点完全包裹,裸支架的孔被封闭,覆膜并未对金属支架的结构和直径产生明显影响(见图3(c))。

图3 3种编织型食管支架样品外观Fig.3 Appearance of three braided esophageal stents samples
一体化食管覆膜支架表面在未清洗、已清洗、载药和药物释放后的扫描电镜图如图4所示。清洗前支架附着有明显的杂质(见图4(a))。清洗后的覆膜支架表面清洁、光滑,NiTi合金丝外观无变化,表面杂质已去除(见图4(b))。载药涂层支架表面有均匀光滑的载药涂层(见图4(c))。药物释放试验后的覆膜支架结构仍然保持原样,但样品表面载药涂层可见明显脱落(见图4(d))。

图4 一体化食管覆膜支架表面的扫描电镜图Fig.4 SEM images of integrated esophageal covered stent
2.2 食管覆膜耐疲劳性能测试
4种食管覆膜支架在疲劳测试前后的外观形态如图5所示。由图5可知:疲劳测试前后Y-ES结构无明显变化;在疲劳测试前,C-ES覆膜均匀,膜结构完整,表面无明显气泡;在疲劳测试后,C-ES表面的硅胶覆膜有不同程度褶皱和破损,且受损程度由大到小依次为C30-ES、C50-ES、C60-ES。

图5 4种食管覆膜支架疲劳测试前后的外观形态(×100)Fig.5 Appearance of four esophageal covered stents before and after fatigue test(×100)
4种食管覆膜支架疲劳测试前后的径向支撑力变化如图6所示。由图6可以看出:C30-ES、C50-ES和C60-ES径向支撑力在疲劳测试后显著变小(p<0.05),而Y-ES的力学性能依然保持稳定。由此表明一体化覆膜支架具有良好的力学性能稳定性,这降低了支架在临床使用后由于径向支撑力变化而发生移位的风险[26]。
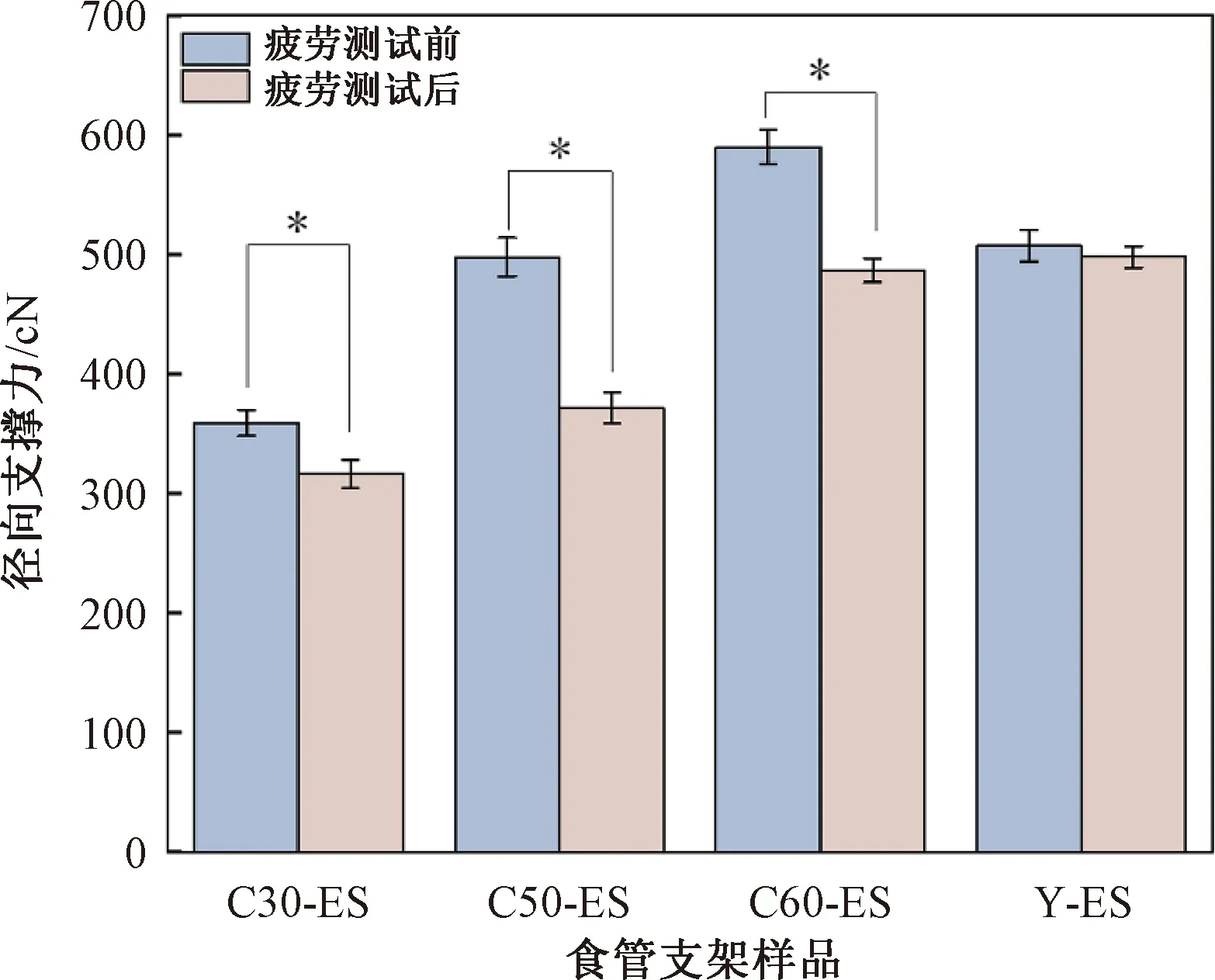
图6 4种食管覆膜支架疲劳测试前后的径向支撑力Fig.6 Radial retention forces of four esophageal covered stents before and after fatigue tests
2.3 载药覆膜支架的水接触角
研究[27]表明,植入性材料亲水性好意味着较好的生物相容性。比较了不同规格PLGA涂层的覆膜支架表面的亲疏水性,结果如图7所示。由图7可知,PLGA75/25-RAPA-Y-ES表面表现为疏水性,PLGA50/50-RAPA-Y-ES表面表现为亲水性。由此说明PLGA-RAPA涂层的亲疏水性与载体PLGA的规格有关。由于GA的亲水性比LA好,而PLGA50/50中GA的比例较高,因此其亲水性较好。

图7 不同规格PLGA载药涂层的水接触角Fig.7 Water contact angle of the drug coatings with different specifications of PLGA
2.4 体外药物释放情况分析
2.4.1 溶液pH值对体外药物释放的影响
药物的扩散、溶解及PLGA的降解受到体液pH值的影响,从而影响药物的释放行为。设计了2种不同的pH溶出环境,pH=6.5的PBS溶液模拟食道生理环境,pH=7.4的PBS溶液模拟人体正常体液。基于之前的试验结果,药物释放试验选择PLGA50/50-RAPA-Y-ES为研究对象,在其他条件不变的情况下,两种PBS溶液对该载药覆膜支架的药物累积释放率的影响如图8所示。由图8可知,pH=7.4环境下的药物累积释放速率略高于pH=6.5的环境,原因是较低的pH值环境不利于PLGA降解,故低pH值会减缓药物释放速率[28]。

图8 不同pH环境下载药覆膜支架的药物释放曲线Fig.8 Drug release curves of drug-coated stents in different pH environments
2.4.2 PLGA规格对体外药物释放的影响
载体PLGA中PL与GA的摩尔比会影响其降解速度及药物扩散速率。在药物释放环境为pH=7.4的PBS溶液中,PLGA75/25-RAPA-Y-ES和PLGA50/50-RAPA-Y-ES的药物释放结果如图9所示。由图9可知,PLGA50/50-RAPA-Y-ES的药物累积释放率显著高于PLGA75/25-RAPA-Y-ES。造成这一结果的原因有两方面:一方面,由于GA含量高且亲水性好,更容易吸附水分子,药物扩散更加容易;另一方面,GA含量高、相对分子质量小,载体自身的降解速度快,导致药物累积释放率高。

图9 不同载体规格的载药覆膜支架药物释放曲线Fig.9 Drug release curves of drug-coated eluting stents with different carrier specifications
2.5 药物释放动力学分析
本研究的药物释放方式主要是通过可降解载体的溶解和药物的扩散,扩散是药物释放的主要形式。相关研究[29]表明,体外药物释放动力学有降解型药物释放(药物释放曲线为线性,释放速率基本不变)、扩散型药物释放(药物释放曲线为抛物线,释放速率逐渐减小)。
本研究制备的2种一体化编织载药食管覆膜支架与商用雷帕霉素支架的药物累积释放率曲线如图10所示。
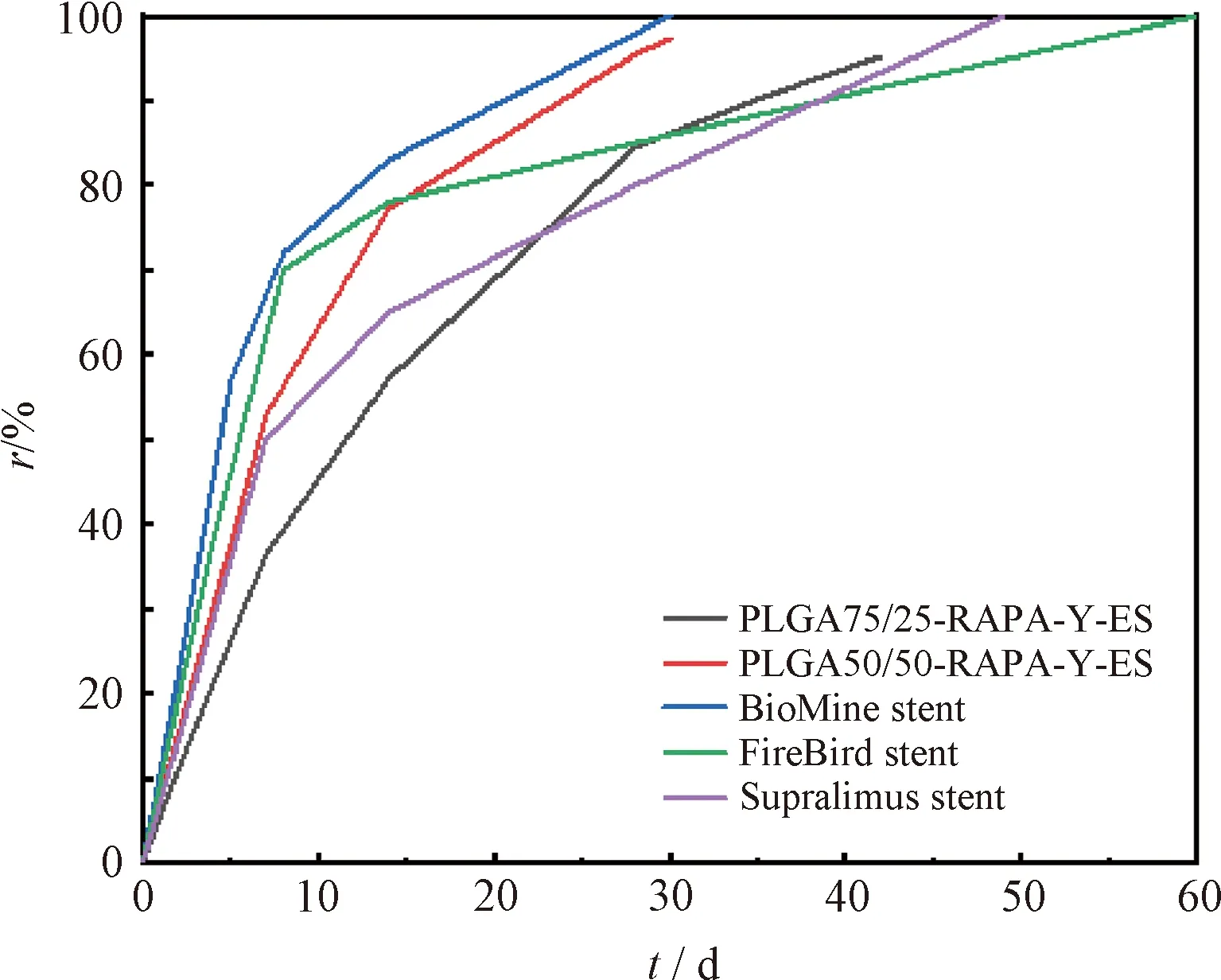
图10 几种雷帕霉素药物洗脱支架药物释放曲线Fig.10 Drug release curves of several rapamycin drug-eluting stents
其中,BioMine stent[30]所用载体为PLLA(poly(L-lactide)acid)和PLGA,Supralimus stent载体是PVP(polyvinyl pyrrolidone)和PLGA,FireBird stent[31]载体是聚烯烃类聚合物。由图10可知,5种药物支架的药物释放速率均呈现先快后慢的趋势。其中,本研究制备的载药涂层与BioMine stent涂层结构相似,且载体均为可降解聚合物,药物释放模式为溶出和溶蚀扩散。本研究制备的2种载药覆膜支架与商用支架呈现相同的缓释特性,未见突释现象。PLGA75/25-RAPA-Y-ES的药物释放时间超过42 d,而PLGA50/50-RAPA-Y-ES的药物释放有效时长可达30 d以上,两者的释药速率介于3种商用支架之间。体外释放过程用OriginPro 2021软件进行模型拟合[32],包括Zero Order、First Order、Higuchi和Ritger-Peppas等4种模型,拟合结果如表1所示。由表1可知,PLGA载雷帕霉素体系的体外药物释放行为更接近Higuchi模型,其R2值分别达0.995(PLGA75/25)和0.953(PLGA50/50),拟合度最高。

表1 药物体外释放拟合模型Table 1 Fitting models of drug release in vitro
2.6 载药覆膜体外抑增生性能
为了便于细胞试验操作,在探究载药涂层抑制细胞增生性能时,选择PLGA-RAPA-PET作为研究对象。将成纤维细胞和肿瘤细胞种植到各个样品上后,通过CCK-8试剂盒对细胞增殖情况进行考察,CCK-8试验结果如图11所示。由图11可知,在整个试验过程中,A组(PLGA75/25-RAPA-PET)和B组(PLGA50/50-RAPA-PET)的吸光度均比C组(PLGA50/50-PET)和D组(空白组)低,存在显著性差异。吸光度越大意味着活细胞数量越多,药物对成纤维细胞和肿瘤细胞的生长都具有显著抑制作用,且随着时间的延长,两组细胞的抑制率都呈增大趋势。由此可见,细胞增殖抑制率结果如图12所示。由图12可知,培养7 d时,A、B组两种细胞的抑制率均高于88%。进一步通过活/死细胞染色观察细胞存活情况(见图13),随着时间的增加,PLGA75/25-RAPA-PET组和PLGA50/50-RAPA-PET组中死细胞的数量明显增加。但是,大部分细胞在PLGA50/50-PET表面能够良好生长,细胞形态正常,说明该样品的生物相容性良好,细胞能正常增殖分化,但细胞相容性不及空白对照组(培养板)。
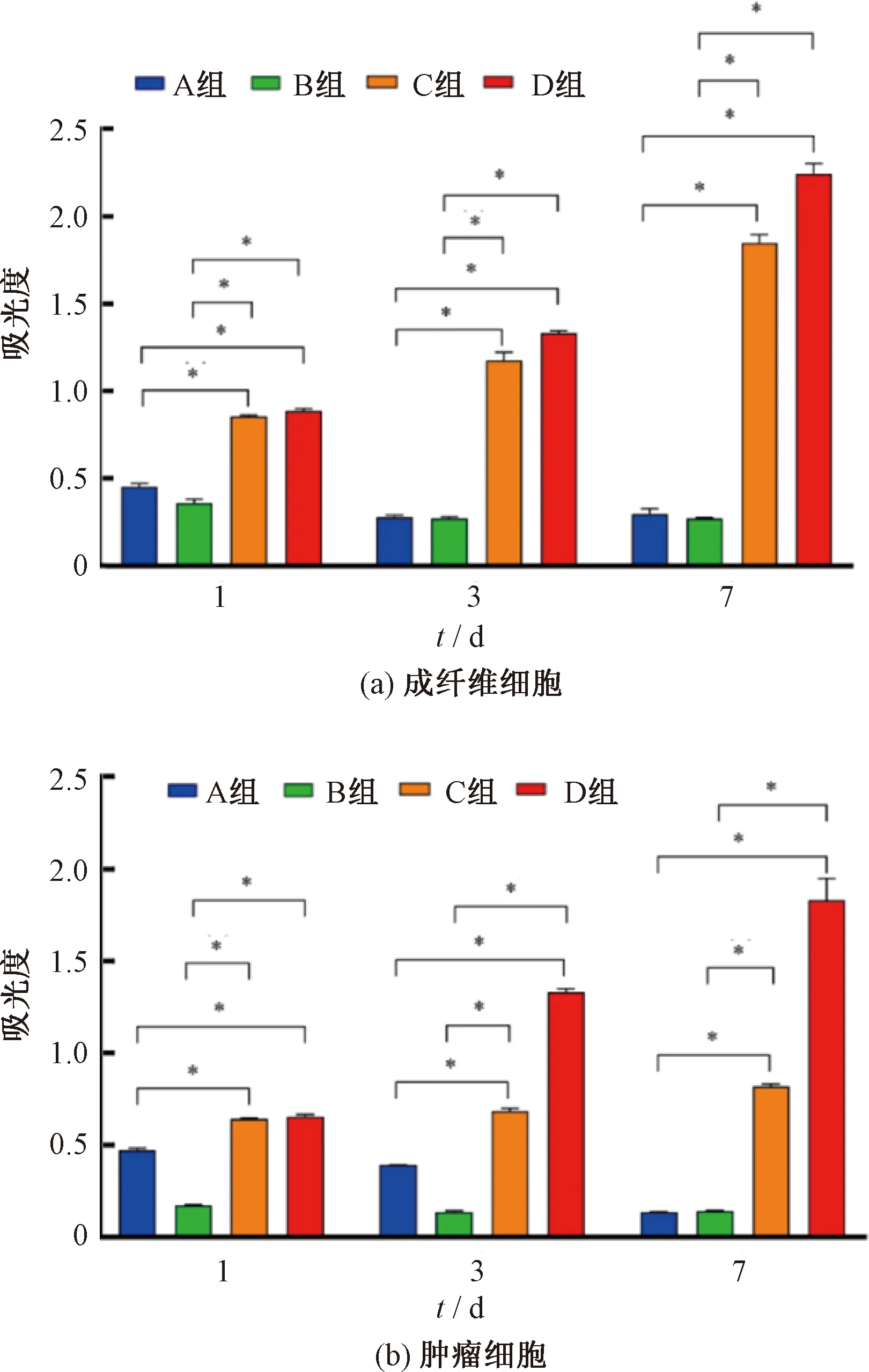
图11 CCK-8试验结果Fig.11 Results of CCK-8 assay
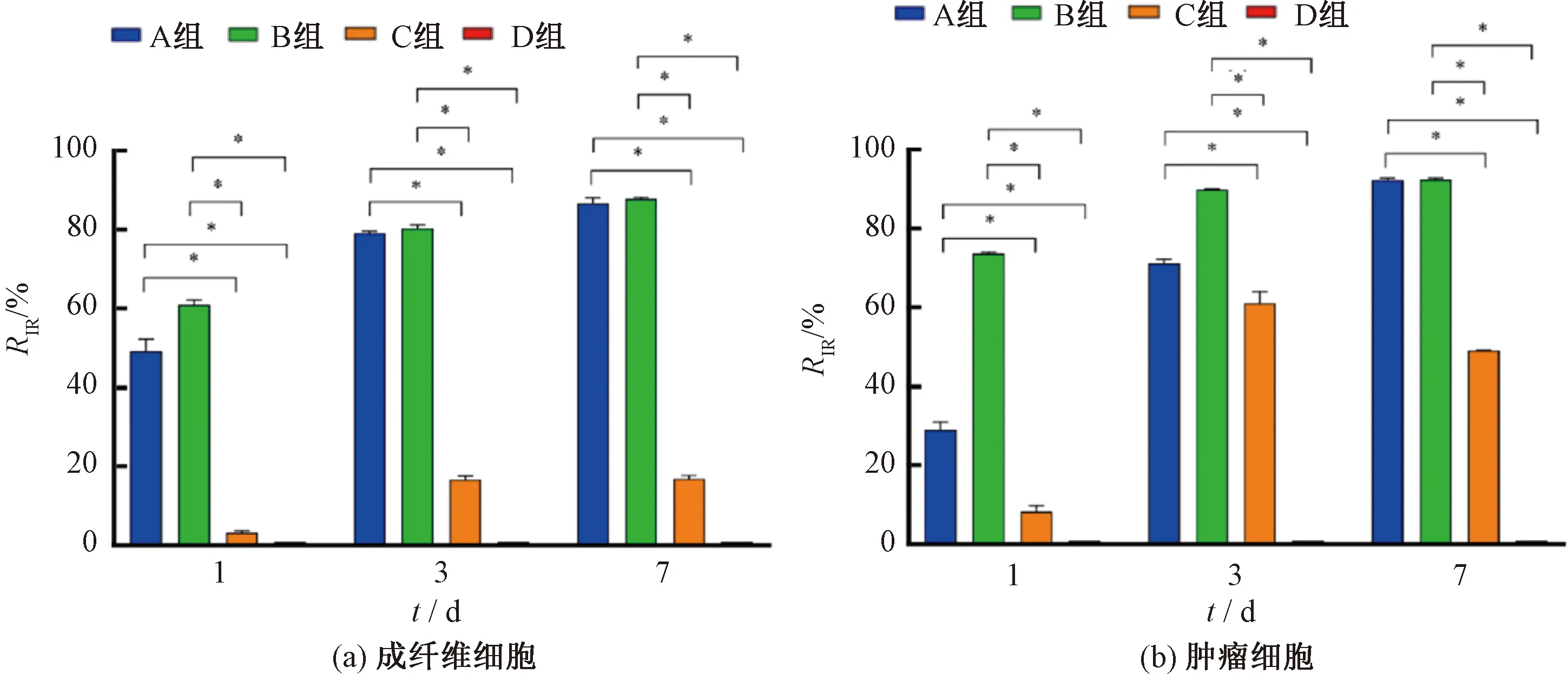
图12 细胞增殖抑制率结果Fig.12 Results of proliferation inhibition rate
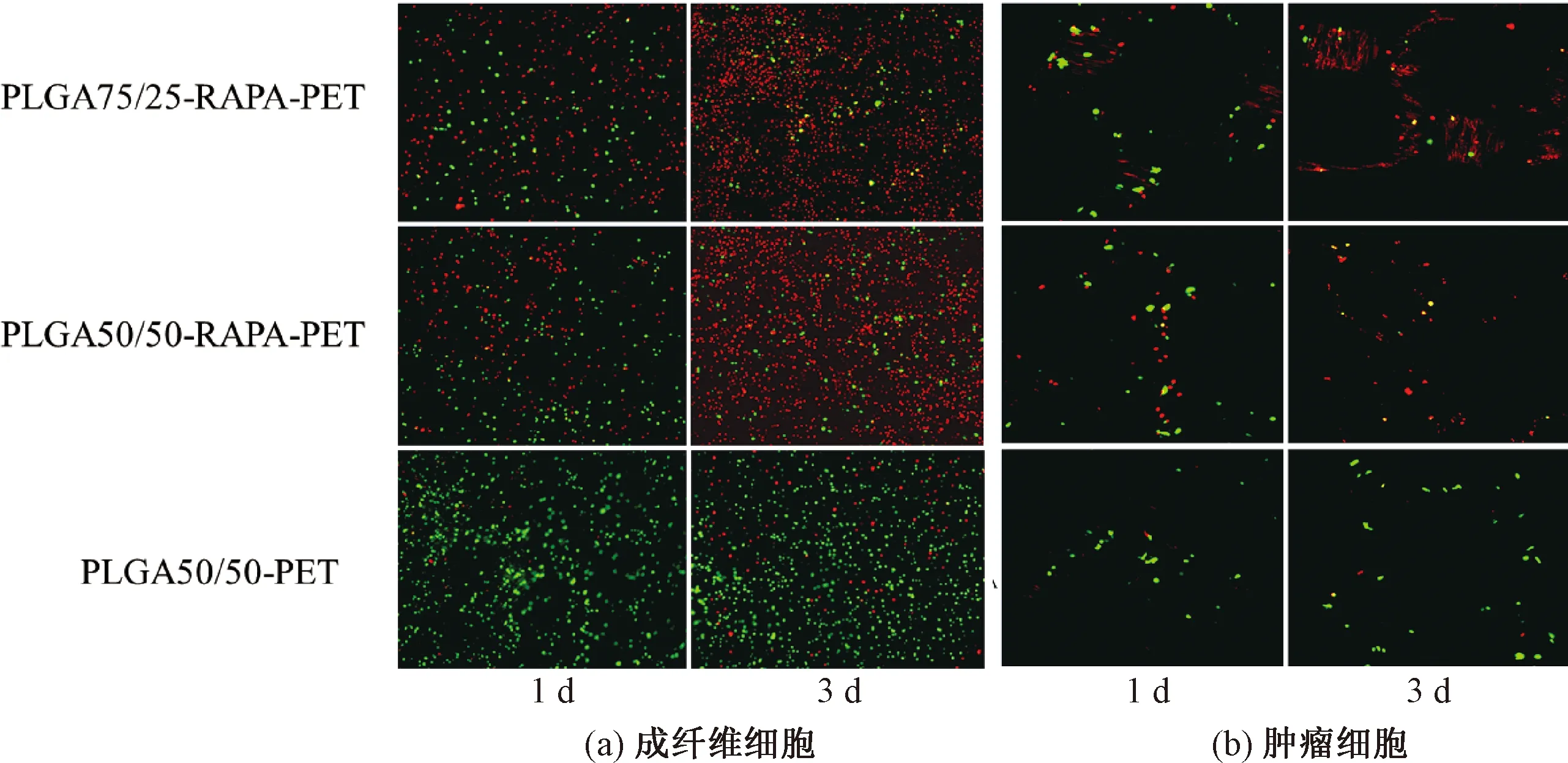
图13 活/死细胞染色结果Fig.13 Results of live &dead staining
3 结 语
本研究设计并制备了一种编织型一体化载药覆膜支架,其管壁平整、直径稳定。疲劳测试结果表明,与硅胶覆膜支架相比,一体化覆膜支架的覆膜外观形态未见明显破损,并且未明显降低该覆膜支架的径向支撑性能。以PLGA50/50为药物载体、雷帕霉素为模型药物,采用浸渍法构建的药物涂层均匀稳定。体外药物释放符合Higuchi模型,药物释放主要依赖扩散效应。药物释放曲线与商用雷帕霉素药物洗脱支架一致,释药效果基本可以达到商用水平。体外细胞试验结果表明,载药覆膜具有显著的抑制细胞增殖作用,包括成纤维细胞和肿瘤细胞。由此可知,开发的载药一体化食管覆膜支架具有双重预防食管再狭窄的功能,即高强覆膜的屏蔽作用和抑制组织异常增生功能。研究结果可为开发下一代新型食管覆膜支架产品提供新的思路和试验依据。
——雷帕霉素

