RGFP966通过PI3K/AKT通路抑制胃癌细胞增殖
董正宇,张先稳,张 林
1扬州大学医学院,江苏 扬州 225001;2盐城市第二人民医院肿瘤内科,江苏 盐城 224003;3扬州大学附属苏北人民医院肿瘤科,江苏 扬州 225001
胃癌是我国最常见的恶性肿瘤之一,早期胃癌常无明显症状,临床症状明显时常已进展到晚期,因此病死率极高[1]。胃癌的发病机制较复杂,目前手术及术后放化疗是其临床主要的治疗方式。但因手术切除范围较广、切除不彻底,化疗药物细胞毒性强、易耐药等缺点,术后患者生活质量差,因此迫切需要寻求新的治疗药物[2]。近年来随着表观遗传学的发展,越来越多的研究发现,表观遗传修饰与胃癌的发生发展密切相关[3]。组蛋白去乙酰化酶(histone deacetylase,HDAC)对染色体的结构修饰以及基因表达调控发挥着重要作用[4]。现已有研究证明高选择性的HDAC3抑制剂RGFP966对肝癌、结直肠癌、前列腺癌等肿瘤细胞具有抑制作用[5-7],但RGFP966 对胃癌细胞的作用及其机制尚无报道,本研究主要探讨RGFP966对胃癌细胞MKN-45和MGC-803增殖能力的影响,并探讨其可能的作用机制。
1 材料和方法
1.1 材料
人胃癌细胞MKN-45 和MGC-803(ATCC 公司,美国);胎牛血清、DMEM 培养基(Gibco 公司,美国);RGFP966(MCE 公司,美国);CCK-8 试剂(武汉Abbkine 公司);细胞周期检测试剂盒(武汉Elabscience 公司);Ki-67 抗体、c-Myc 抗体、Cyclin A2 抗体(Abcam 公司,英国);Cyclin D1 抗体(Cell Signaling Technology 公司,美国);PI3K抗体、p-PI3K抗体、AKT 抗体、p-AKT 抗体(武汉爱博泰克生物科技有限公司)。
1.2 方法
1.2.1 细胞培养
人胃癌细胞MKN-45和MGC-803使用含有10%胎牛血清、1%青霉素和链霉素的完全DMEM 培养基,放入5%CO2、37 ℃恒温培养箱中培养,2~3 d 换液,使细胞维持在对数生长期。RGFP966 溶解于DMSO中,调整浓度为10 mmol/L于-20 ℃储存。
1.2.2 CCK-8实验
收集对数生长期的细胞,使用细胞计数板计数,然后接种于96孔板中,每个孔接种约3 000个细胞,待细胞贴壁后分别加入0、40、80 μmol/L的RGFP966进行处理。放入培养箱中培养24、48 h,然后每孔加10%的CCK-8 试剂,培养箱中孵育约2 h,使用酶标仪测定450 nm 处吸光度值。利用公式计算RGFP966 对胃癌细胞增殖能力的影响。计算公式为:细胞活力(%)=[(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)]×100%。
1.2.3 细胞克隆形成实验
收集对数生长期细胞,使用细胞计数板计数,接种于6孔板,每孔接种约400个细胞,待细胞贴壁后,分别加入0、40、80 μmol/L 的RGFP966 进行处理。放入培养箱中培养14 d,视情况换液,14 d 后用3%多聚甲醛固定,结晶紫染色,拍照计数,使用Image J进行分析统计。
1.2.4 细胞周期检测实验
收集对数生长期细胞,使用细胞计数板计数,接种于6 孔板,每孔接种约1×105个细胞,待细胞贴壁后,分别加入0、40、80 μmol/L 的RGFP966 进行处理。48 h后,吸除培养液,PBS清洗,1 500 r/min离心5 min,收集细胞沉淀,在细胞沉淀中加入70%预冷乙醇500 μL重悬,置于4 ℃冰箱固定过夜,第2天用PBS洗去固定液,然后200目筛网过滤,加入100 μL RNaseA 溶液,37 ℃水浴30 min,再加入400 μL PI染液,置于4 ℃避光孵育30 min,使用流式细胞术检测。
1.2.5 Western blot
收集对数生长期细胞,使用细胞计数板计数,接种于6 孔板,每孔接种约1×105个细胞,待细胞贴壁后,分别加入0、40、80 μmol/L 的RGFP966 进行处理。48 h后使用RIPA裂解液提取蛋白,分别加入蛋白酶抑制剂和磷酸酶抑制剂,使用考马斯亮蓝G250测定蛋白浓度。然后加入5×上样缓冲液,95 ℃金属浴10 min,SDS-PAGE凝胶电泳,使用PVDF膜转膜,用5%脱脂牛奶或5%牛血清白蛋白封闭1 h。4 ℃孵育一抗过夜,第2天TBST清洗3遍,每次10 min。室温孵育二抗2 h,TBST清洗3次,每次10 min,曝光。
1.3 统计学方法
使用Graphpad Prism 9.0软件进行分析,符合正态分布的计量资料用均值±标准差()表示,采用ANOVA法进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 RGFP966抑制胃癌细胞的增殖
RGFP966 有抑制胃癌细胞MKN-45、MGC-803增殖的效果,且呈剂量依赖性,此外RGFP966 处理48 h时细胞活性明显低于处理24 h时(图1)。
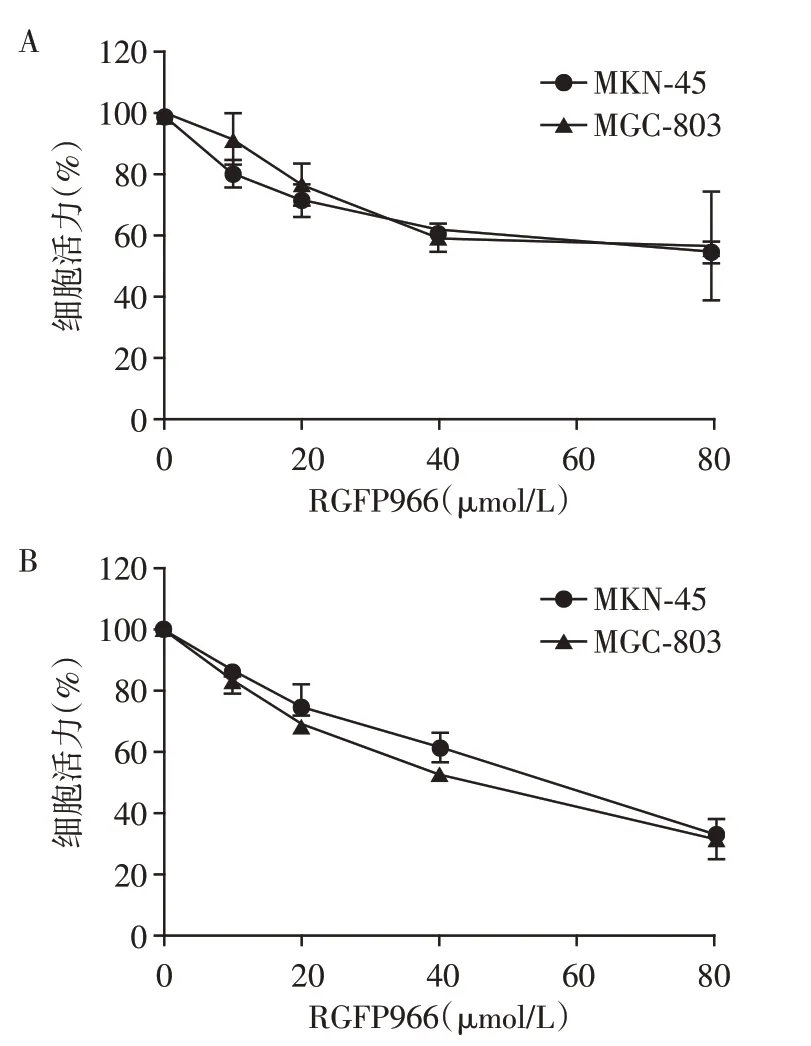
图1 RGFP966对胃癌细胞MKN-45和MGC-803增殖能力的影响Figure 1 Effects of RGFP966 on the proliferation of gastric cancer cells of MKN-45 and MGC-803
2.2 RGFP966抑制胃癌细胞的集落形成能力
RGFP966 有抑制胃癌细胞MKN-45、MGC-803集落形成的能力(图2A),且呈剂量依赖性。不同浓度RGFP966 处理细胞的集落形成数量的差异有统计学意义(图2B)。

图2 RGFP966对胃癌细胞MKN-45和MGC-803集落形成能力的影响Figure 2 Results of clonal formation of MKN-45 and MGC-803 cells treated with RGFP966
2.3 RGFP966诱导胃癌细胞发生G0/G1期阻滞
RGFP966处理后胃癌细胞G0/G1期占比上升,S期与G2/M 期均减少,这说明细胞发生G0/G1 期阻滞,进而影响胃癌细胞的增殖能力(图3A),且呈剂量依赖性,差异有统计学意义(图3B)。

图3 RGFP966对胃癌细胞MKN-45和MGC-803细胞周期的影响Figure 3 Detection of cell cycle changes in gastric cancer cells MKN-45 and MGC-803 after treatment with RGFP966
2.4 RGFP966 抑制胃癌细胞增殖及细胞周期相关蛋白的表达
RGFP966抑制胃癌细胞增殖相关蛋白的表达,与对照相比,Ki-67 和c-Myc 的表达被抑制(图4A、B)。此外RGFP966 抑制胃癌细胞周期相关蛋白的表达,与对照相比,Cyclin A2、Cyclin D1表达被抑制(图4C、D)。
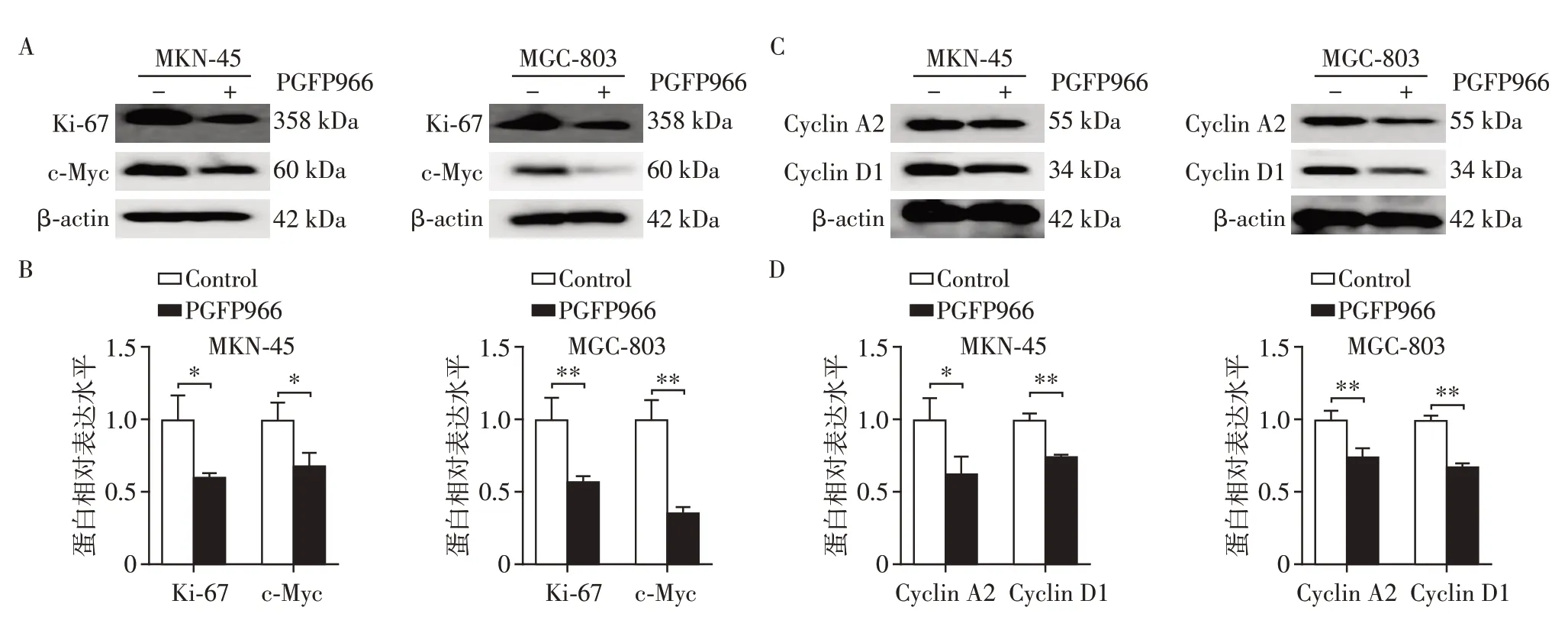
图4 RGFP966对胃癌细胞MKN-45和MGC-803增殖及细胞周期相关蛋白表达量的影响Figure 4 The effects of RGFP966 on the proliferation and exprssion of cyclin-related proteins in gastric cancer cells of MKN-45 and MGC-803
2.5 RGFP966抑制PI3K/AKT通路
与对照相比,RGFP966 处理后,PI3K 与AKT 总体水平没有明显变化,但p-PI3K、p-AKT表达均被抑制(图5)。因此推测RGFP966 可能通过PI3K/AKT通路抑制胃癌细胞的增殖能力,并将细胞阻滞在G0/G1期。
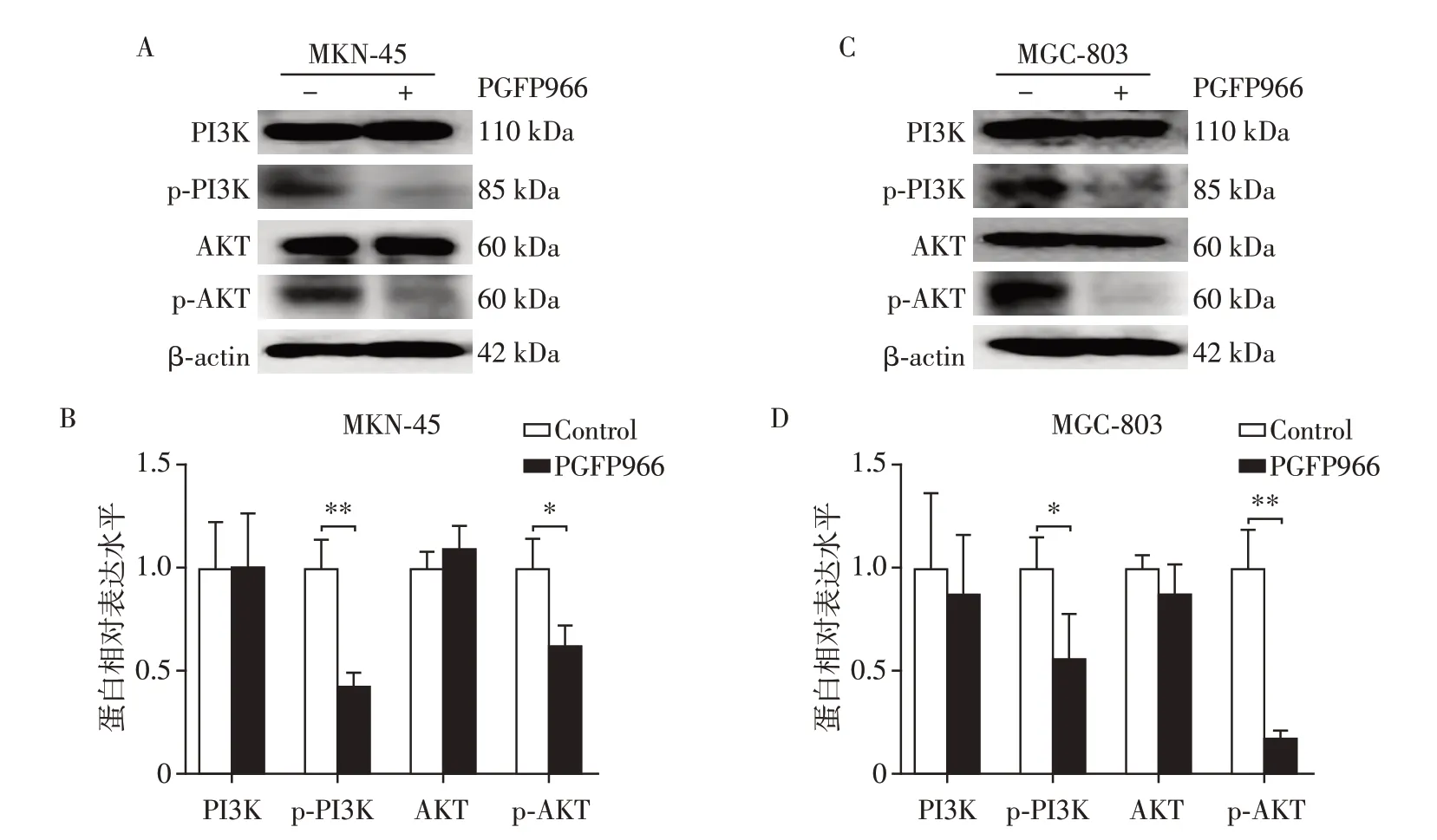
图5 RGFP966对胃癌细胞MKN-45和MGC-803 PI3K/AKT通路相关蛋白表达的影响Figure 5 The effects of RGFP966 on the expression of PI3K/AKT pathway related proteins in gastric cancer cells of MKN-45 and MGC-803
3 讨论
胃癌是消化系统最为常见的恶性肿瘤之一,虽然幽门螺杆菌感染被认为是造成胃癌的主要因素,但也有大量文献表明胃癌的发生发展涉及抑癌基因失活和原癌基因激活[8]。随着基因组学的发展,生物标志物以及相关信号通路也为胃癌患者的精确诊断和治疗开辟了新的道路[9]。这些基因的异常表达以及信号通路改变都会以多种方式参与胃癌的发生,其中胃癌的异常增殖能力则受到多种基因调控,而细胞周期变化也在胃癌的恶性增殖中发挥着重要作用[10]。这些分子的异常为治疗胃癌、抑制胃癌的恶性增殖提供了重要思路。
随着对胃癌发生发展机制的深入了解,许多分子靶向药物已成为近年的研究热点。但这些药物不能完全抑制胃癌的发展,并因为胃癌细胞代偿信号通路的建立、靶蛋白的变化以及肿瘤微环境的变化等,导致现有靶向药物大多存在明显耐药现象,因此对于新药的需求极为迫切[11]。RGFP966作为一种高选择性的HDAC3抑制剂,近年已有文献证明其具有明显的抗癌作用,但其在胃癌中的作用机制尚不明确。因此本研究采用不同浓度的RGFP966对胃癌细胞MKN-45、MGC-803进行处理,结果显示RGFP966可以抑制胃癌细胞的增殖,并诱导胃癌细胞在G0/G1期阻滞,其作用机制可能是PI3K/AKT通路被抑制。
胃癌作为恶性肿瘤,其癌细胞具有极强的增殖能力和集落形成能力。本研究通过CCK-8实验、细胞克隆形成实验在体外证明RGFP966可以抑制胃癌细胞的增殖能力,且呈剂量依赖性,此外RGFP966作用48 h 时的细胞活力低于24 h 时。Ki-67 是细胞增殖相关蛋白,其主要存在于细胞核中,与细胞分裂周期密切相关,已有文献证明Ki-67 高表达与胃癌患者的不良预后相关,因此抑制Ki-67 则成为一种可行的胃癌治疗方案[12]。c-Myc 是癌症中最常失调的基因之一,其可以促进癌症细胞的无限增殖,在癌症的形成、维持和发展中均起到至关重要的作用,因此抑制c-Myc 的表达也是治疗胃癌的新思路[13]。本研究表明RGFP966 可以抑制胃癌细胞Ki-67 和c-Myc 的表达,进一步抑制胃癌细胞的增殖能力。
细胞分裂在肿瘤发展中起着至关重要的作用,有丝分裂间期则是细胞增殖的核心事件,其主要分为DNA 合成前期(G1 期)、DNA 合成期(S 期)、DNA合成后期(G2 期)。其中G0/G1 期细胞开始为下一次分裂合成DNA准备所需的前体物质、能量和酶类等[14]。本研究通过流式细胞术发现RGFP966 可以诱导胃癌细胞发生G0/G1期阻滞。细胞周期蛋白是调节细胞周期的蛋白家族,在不同阶段中发挥着不同作用,其中细胞周期蛋白Cyclin A2是激活细胞分裂周期的重要调节因子[15]。Cyclin D1 可与蛋白激酶结合,形成复合物进一步调节G1到S期的转变[16]。本研究发现RGFP966 可以通过抑制Cyclin A2 和Cyclin D1 的表达,进一步调控胃癌细胞周期,抑制胃癌的增殖能力。
PI3K 和其下游AKT 是调节细胞生长和存活至关重要的分子。既往文献证明靶向抑制PI3K/AKT通路可以抑制癌细胞的增殖能力[17-18]。为了进一步探究RGFP966抑制胃癌细胞增殖能力的具体机制,本研究检测PI3K/AKT 通路相关蛋白表达情况,结果显示RGFP966 处理48 h 后,PI3K 和AKT 的表达量没有明显改变,但p-PI3K和p-AKT的表达量均被抑制。以上结果显示RGFP966 抑制胃癌细胞的增殖能力可能是通过PI3K/AKT通路来实现的。
综上所述,RGFP966 可能通过PI3K/AKT 通路抑制胃癌细胞的增殖能力,并诱导胃癌细胞在G0/G1 期阻滞。本研究初步揭示了RGFP966 抑制胃癌细胞的增殖能力及可能机制,但其对胃癌的抑制作用可能还存在其他方式,需要进一步研究。

