多参数流式细胞术在浆细胞疾病中的临床应用*
杨柯,赵强,蔡永刚,蔺莉(甘肃省中心医院血液内科,兰州 730050)
浆细胞(plasma cell,PC)疾病是一组以血清或尿中检出单克隆副蛋白和/或在骨髓(bone marrow,BM)中存在单克隆浆细胞为特征的异质性血液疾病,主要包括多发性骨髓瘤(multiple myeloma,MM)、意义未明单克隆免疫球蛋白增多症(monoclonal gammopathy of unknown significance,MGUS)、浆细胞白血病(plasma cell leukemia,PCL)、轻链淀粉样变性(amyloidosis,AL)、淋巴浆细胞性淋巴瘤(lymphoplasmic cell lymphoma,LPL)/Waldenström巨球蛋白血症(WM)、POEMS综合征和孤立性浆细胞瘤(solitary plasmacytoma,SP)等[1]。虽然MM仍被定义为不可治愈,但随着蛋白酶体抑制剂和免疫调节剂等新药的出现,MM的治疗前景发生了根本性改变,因此,创新的高灵敏度微小残留病/可测量到的残留病(minimal/measurable residual disease,MRD)检测方法变得越来越重要[2]。多参数流式细胞术(multiparameter flow cytometry,MFC)尤其二代流式细胞术(next generation flow cytometry,NGF)在浆细胞疾病的诊断与鉴别诊断、进展风险、预后评估及MRD检测中具有重要价值。鉴于最近对诊断标准的更新和强调实现疾病严格完全缓解的重要性,本文将MFC在浆细胞疾病中的临床应用作一综述。
1 MFC在浆细胞疾病中的检测技术应用
1.1抗体组合及标本要求 欧洲流式联盟(Euro Flow)推荐NGF抗体组合为2管八色方案,管1为CD38/CD138/CD27/CD45/CD19/CD56/CD81/CD117,管2为CD38/CD138/CD45/CD19/CD56/CyIgκ/CyIgλ,在诊断时最少获取5×105(50万)个细胞[3]。NGF进行MRD检测时需2×107(2 000万)个细胞,其中1×107(1 000万)个细胞用于管1表面标记物染色,1×107(1 000万)个细胞用于管2细胞内标记物和胞质免疫球蛋白轻链同时染色。在90%的病例中,需3.6 mL BM抽吸物才能获得至少2×107个细胞[4]。值得注意的是,BM抽吸物易被外周血稀释[5],MM病灶的斑片状分布也可能会产生假阴性结果[6],髂骨第一管抽取样本用于MFC检测,可降低样本稀释风险[7]。MFC对非浆细胞群体的识别,如CD117+++肥大细胞、有核红细胞、CD117+髓系前体和CD19+CD45lowCD38+B细胞前体,有利于判断样本质量和血液稀释程度。
1.2分析性能要求 为了克服传统MFC检测的局限性,Euro Flow制定了标准化操作程序,以及创新的自动数据分析软件,灵敏度可达到10-6,并显示出与NGS良好的一致性(86%)[5]。Euro Flow要求MRD检测下限(lower limit of detection,LOD)为2×10-6,即10×106个BM细胞中检出20个克隆性浆细胞,定量下限(lower limit of quantification,LOQ)为5×10-6,即10×106个BM细胞中检出50个克隆性浆细胞[8]。国际骨髓瘤工作组(the International Myeloma Working Group,IMWG)将MM最低MRD灵敏度定为10-5,虽然NGF和NGS均可达到10-6灵敏度,然而,实现这样的灵敏度水平在技术上仍具有挑战性[9]。
2 MFC在浆细胞疾病诊断与鉴别诊断中的临床应用
2.1克隆性浆细胞和正常浆细胞鉴别的临床应用 正常浆细胞CD38表达水平高于其他BM中有核细胞亚群,但CD38对浆细胞表达无特异性,MM细胞通常倾向表达较低水平的CD38,因此需使用CD45、CD38、CD138和光散射参数(SSC)组合来识别。大多数正常骨髓浆细胞(BMPCs)的免疫表型为CD38bright/CD19+/CD45dim/CD56-/CD27bright/CD81bright/CD117-,胞质轻链(cKappa/cLambda)呈多克隆表达(kappa:lambda比例约为1~4)(图1)[10]。与正常浆细胞相比,克隆性浆细胞常出现CD19、CD27、CD38、CD45和CD81表达下调以及CD56、CD28、CD5、CD117和CD200过表达[11],除了CD117几乎不在正常浆细胞上表达外,上面定义的大多数异常表达都可以在正常浆细胞中出现[12]。在克隆性浆细胞上还可观察到CD13、CD33和黏附分子CD44(以及CD44的变异亚型)、CD49d和CD221异常表达。因此,由MFC识别的克隆性浆细胞应通过多个异常表型的同时存在来确认。
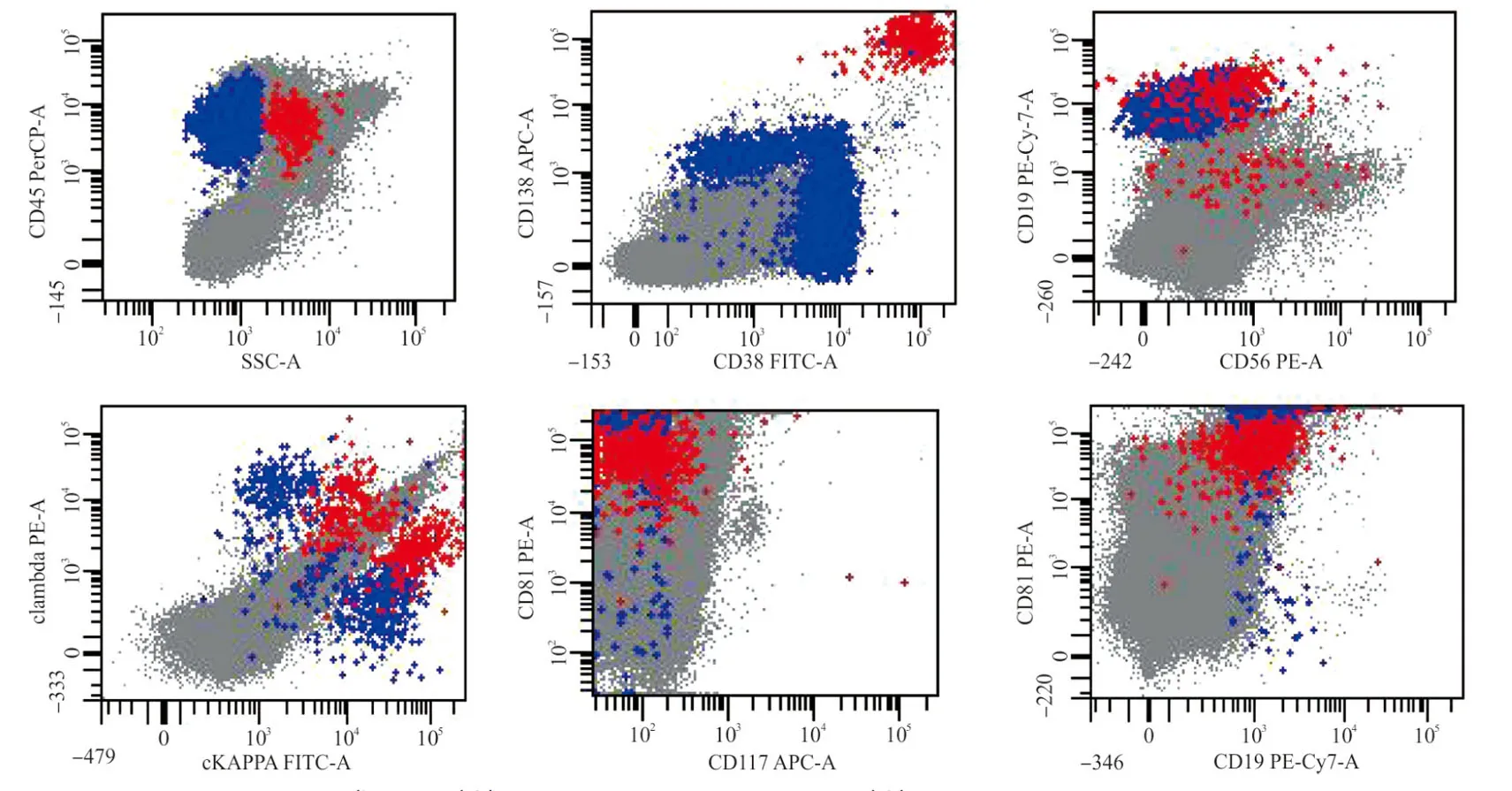
注:正常浆细胞免疫表型为CD45dim/CD38bright/CD138+/CD19+/CD56-/CD81bright/CD117-,胞质轻链cKappa、cLambda呈多克隆表达(红色细胞群);蓝色细胞群为CD19+ B淋巴细胞。图1 正常BM 浆细胞的免疫表型
2.2MGUS、SMM和活动性MM(active multiple myeloma,aMM)中的临床应用 MFC在浆细胞疾病中最重要的应用是从正常浆细胞中区分克隆性浆细胞,这对于鉴别MGUS、SMM和aMM以及识别反应性浆细胞增多症、具有广泛浆细胞分化的B-NHL(如MZL和LPL)和罕见的IgM型MM至关重要。研究表明,正常浆细胞占BM浆细胞比例(nPCs/BMPCs)阈值为3%时有助于区分MGUS和MM,在98%的MGUS中有超过3%的nPCs/BMPCs,而在MM中不到2%[13],与MM相比,MGUS中存在更高比例的nPCs/BMPCs[14]。nPCs/BMPCs阈值为5%时不仅有助于区分MGUS和aMM,还可以提示较高的进展风险[15]。还有研究表明,异常浆细胞占BM浆细胞比例(aPCs/BM)和浆细胞/CD117+前体细胞比值是区分MGUS和MM最有影响力的参数[16]。
CD56、CD20、CD45和CD117等抗原表达模式在MGUS中与MM类似,与MGUS相比,CD200在MM中表达频率更高[17],CD27在MM中弱表达以及CD19丢失更常见,CD19在MGUS中表达强度低于正常浆细胞,但高于MM[18]。一些研究还发现了免疫表型特征对MM细胞遗传学异常的预测价值,如CD28表达与t(14;16)和del(17p)相关;CD117表达与t(4;14)、del(13q)和非超二倍体核型相关;CD20和CD23表达与t(11;14)相关等。然而,由于敏感性和特异性不足,这些发现临床应用依然有限。
2.3孤立性浆细胞瘤中的临床应用 研究表明,在49%(17/35)的孤立性骨浆细胞瘤(solitary plasmacytoma of bone,SBP)患者和38%(11/29)的髓外浆细胞瘤(extramedullary plasmacytoma,EMP)患者中可检测到克隆性浆细胞,其中71%的SBP患者最终进展为MM,而未检出克隆性浆细胞的SBP患者仅为8%(风险比17.4,P<0.001),EMP中没有观察到显著差异[19]。因此,在SBP患者中,基于MFC检测存在克隆性浆细胞成为定义进展风险最重要的预后标志物。
2.4AL淀粉样变性中的临床应用 MFC可用于确认导致淀粉样蛋白轻链沉积的潜在克隆性浆细胞的存在(图2),这种克隆性浆细胞几乎存在于所有AL患者中。有研究报道,AL淀粉样变性患者的浆细胞表型与MM患者相似,基于MPC-1、CD45和CD49e等标记可对浆细胞亚群进一步表征,其中中间型浆细胞(MPC-1+CD45-CD49e-)是AL淀粉样变患者诊断和随访的预后标志物[20]。在35例新诊断的AL患者中研究证实,BM浆细胞比例是一个重要预后因素,BM浆细胞<1%和≥1%组患者2年OS分别为90%和44%。在诊断时,nPCs/BMPCs以5%为阈值可确定一组OS延长的患者亚组,2年OS分别为88%和37%,在这些病例中,49%(17/35)的AL患者在诊断时有>5%的nPCs/BMPCs[21]。
2.5巨球蛋白血症中的临床应用 与MM类似,几乎所有WM患者在出现临床症状之前都经历了IgM-MGUS和冒烟型WM的良性阶段,但区分IgM-MGUS和冒烟型WM尚存在争议,IgM-MGUS和冒烟型WM的主要区别在于是否有淋巴浆细胞淋巴瘤浸润BM的形态学证据。目前尚未鉴定出特异性的WM/LPL标志物,从成熟的静息记忆B细胞持续分化成浆细胞是WM的主要标志(图3)。最近,B细胞上CD13的表达被提出作为WM标志物,但CD13的表达与浆细胞分化有关,也可在MZL或MM中表达[22]。迄今为止,关于WM/LPL的表型特征尚未达成共识,WM克隆B细胞最常见的免疫表型为:CD19+/CD22low+/CD23-/CD25+/CD27+/SmIgM+,CD79b和CD81在所有病例中呈阳性,CD27(51%)、CD38(50%)和CD200(62%)可观察到异质性双峰表达模式,CD305(LAIR1)在正常B细胞上呈双峰异质表达,但在69%的WM病例中不表达[23]。与大多数其他成熟B细胞肿瘤相比,WM不表达CD5、CD10、CD11c和CD103,但MZL除外。区分WM和MZL最有用的标记是SmIgM和CD79b(两者都在WM中过表达),CD305在MZL中上调[23]。WM中克隆浆细胞的抗原谱与正常浆细胞更相似,与MM明显不同,从IgM-MGUS到有症状WM患者显示CD19+/CD20+/CD45+/SmIgM+的BM浆细胞比例逐渐增加,同时CD56完全丢失[23]。浆细胞的不同抗原谱,以及MYD88突变状态(在IgM-MM中不存在)和t(11;14)(q13;q32)(在IgM-MM中发生率较高)对区分WM和IgM-MM有重要参考价值,可见,MFC是鉴别IgM疾病的有用工具。

注:克隆性浆细胞表型为CD38+/CD138+/CD19+/CD20part+/CD22part++,显示与克隆B细胞相似的kappa轻链限制(蓝色细胞群)。克隆性B细胞为CD19+/CD20+/CD22+/CD5-/CD10-/Kappa+(红色细胞群),患者同时有IgM单克隆蛋白,支持LPL的诊断。图3 1例具有浆细胞分化的小B细胞NHL
对244例新诊断的IgM单克隆球蛋白患者BM进行MFC分析,包括67例IgM-MGUS,77例冒烟WM和100例有症状WM,结果显示,从IgM-MGUS到冒烟和症状性WM,B细胞的比例逐渐增加,BM中B细胞比例>10%和B细胞克隆性程度(100%)对于排除IgM-MGUS具有高度特异性,但仍然没有一个基于MFC的标准可以完全区分IgM-MGUS和WM,表明该疾病的3个阶段之间有大量的重叠,包括遗传特征[24]。MFC也是一种预测WM患者预后的有价值的工具,冒烟型WM患者BM 中B细胞>10%并表现出完全轻链限制性比其他冒烟WM患者进展风险更高,相反,BM中B细胞<10%的症状性WM患者其疾病侵袭性较低,OS较好[24]。在42例WM患者中证实,BM中单克隆B细胞>5%可独立于血液学反应预测较短的无进展生存期(PFS)和总生存期(OS)[25]。
2.6浆细胞白血病中的临床应用 研究表明,PCL克隆性浆细胞与MM中CD38、CD138、CD2、CD3、CD10、CD13、CD16和CD15等抗原表达模式相似,不同的是,CD20在PCL中高表达,CD56、CD9、CD117和HLA-DR在PCL中低表达,与MM和MUGS相比,PCL中CD40表达降低[26]。CD49和CD56的阴性表达先前已被认为与更具侵袭性的疾病相关,并被认为是PCL可能的标志。CD28和CD27标记可能有助于区分原发性PCL和继发性PCL,CD28是MM肿瘤演变的标志物,在92%的继发性PCL病例中可检测到,而在原发性PCL中仅占33%,相比之下,CD56的表达情况(CD56-/dim)和CD19阴性表达两者无区别[27]。总之,与MM相比,PCL患者通常具有独特的预后特征和更差的预后。
3 MFC在循环浆细胞检测中的临床应用
MFC检测循环浆细胞(circulating plasma cells,CPCs)可能为MM的诊断和预后提供了一种有前途和微创的评估方法[28]。CPCs被认为是一个独立的预后因素,可有效反映肿瘤负荷,在诊断或诱导治疗后,高水平CPCs可以预测高危MM并提示较差的治疗反应和不良预后。MFC可在100%的NDMM、59%的MUGS以及18%的SP患者中检测到CPCs,MGUS、SMM和aMM的CPCs频率(中位数)分别从0.000 2%(0.008个/μL)增加到0.004%(0.16个/μL)和0.04%(1.9个/μL)[29]。较高数量的CPCs还与MGUS和SMM恶性转化风险增加相关[30],研究表明,MGUS患者存在≥0.058 CPCs/μL时,可定义为进展高风险组[29]。SMM患者存在CPCs时,中位进展时间仅为10个月,且CPCs在评估肿瘤负荷方面优于BM浆细胞[31]。通过NGF检测CPCs≥0.02%的SMM患者表现出超高的转化风险,PFS为11个月,对这些患者进行早期干预已被证明可以显著降低恶性转化率[30]。CPCs阈值为2%时可用作识别超高风险的NDMM,同时是一个不良预后因素[32]。对于符合移植的NDMM患者,外周血中CPCs的评价优于BM 浆细胞,是适合移植的NDMM患者诊断时最相关危险因素之一,CPCs≥0.01%可能是新的分期系统中的一个新的危险因素[33]。在接受自体移植的高危MM患者中,自体移植物中CPCs的存在与程度均与较差的PFS和OS相关[34]。此外,CPCs有助于PCL的诊断,还可用于MRD评估,有研究者认为,每个外周血中MRD阳性病例在BM中也可检测到MRD,提示CPCs可作为BM MRD持续性检测的替代物,但仍然有很高的假阴性率[35]。CPCs数量的增加会导致肿瘤更快、更广泛地扩散到整个BM及髓外部位,因此,致力于清除CPCs的新策略可改善患者结局。然而,PCs从BM迁移的原因和机制仍不清楚,最近研究表明,TP53的突变和涉及染色体调控和粘附的途径可能是CPCs形成的潜在机制[36]。
与BM浆细胞相比,CPCs显示出更多静止细胞的特征,对化疗药物具有更强的耐药性和更高的自我更新潜力,以及更不成熟表型,这表明CPCs可能构成并表现为MM干细胞特性。CTPCs在免疫表型上比BM浆细胞更不成熟,这体现在某些标记物的表达水平显著降低,如浆细胞在从次级淋巴组织迁移过程中获得的标记物CD38和CD138,以及将浆细胞锚定在基质结构上的黏附分子CD56、CD117和CD81以及激活/分化相关抗原CD27和Vs38c等,还表达较低水平的增殖相关标记物ki67[37]。
4 MFC在浆细胞疾病转化风险及预后评估中的临床应用
MFC可以用于预测MGUS和SMM转化为aMM的风险,也可以用于确定一小群预后良好的aMM患者即具有MGUS-like特征的患者,还可以提供预后信息,如定性预后参数:CD56、CD117、CD28、CD19、CD81、CD27、CD43等;定量预后参数:浆细胞占BM有核细胞比例(PCs/BM)、异常浆细胞占BM浆细胞比例(aPCs/BMPCs)和CPCs等。
4.1定性预后参数 已有研究试图根据浆细胞抗原谱对患者进行风险分层,但只有少数抗原被证明具有预后价值。CD56是神经细胞黏附分子(nerve cell adhesion molecule,N-CAM)异构体,已知参与MM细胞和BM基质锚定,CD56阴性表达(<10%)可加速MM细胞的转移扩散。CD56与MM预后的关系目前存有争议,研究表明,MM中CD56阳性与更高的溶骨负荷相关,其在克隆性浆细胞上表达是1个不良预后因素[38]。也有研究表明,CD56阴性是不良预后因素,与乳酸脱氢酶(LDH)、β2-微球蛋白水平升高相关,但未影响OS[39]。其他研究表明,CD56阴性可能与髓外受累、浆母细胞形态、PCL、非超二倍体染色体异常以及PFS有关,患者OS更差[40]。还有研究表明,CD56阴性与淀粉样蛋白显著相关,同时,淀粉样蛋白也是1个独立的不良预后因素[41],预后不良细胞遗传学IgH/FGFR3易位的发生率在CD56阴性的患者中也更为常见[42]。此外,存在≥2个高危细胞遗传学的患者中,CD56阴性可进一步识别PFS和OS较差的MM患者[43]。
CD117(原癌基因c-KIT)是一种酪氨酸激酶受体,在70%的MGUS患者和30%的MM患者中表达,疾病复发时常丢失。在MGUS和MM患者中,CD117阳性MM患者有更多的超二倍体核型以及更少的14号染色体易位,总体上预后较好,CD117阴性的患者表现为更高的BM浆细胞浸润,更多见的肾功能损害、贫血和临床晚期[44]。CD56和CD117双阴患者显示更差的预后。
CD28(T细胞共刺激受体)在约35%的MM病例中表达,对MM 浆细胞具有高度特异性,CD28与疾病进展相关,CD28可能参与BM基质内树突状细胞-浆细胞的相互作用,进而支持MM细胞的存活[45]。在新诊断MM(newly diagnosed MM,NDMM)中证实CD19、CD28表达和CD117缺失与显著较短的PFS和OS相关,并确定了三个独立的风险组:高风险(CD28+CD117-)、中风险(CD28-CD117-或CD28+CD117+)和低风险(CD28-CD117+)组,还揭示了CD19的不良预后作用[46]。大多数CD19阳性患者不表达CD117,这导致MM患者的预后更差,相比之下,CD20的表达在伴有t(11;14)的NDMM中是1个良好预后因素[47]。
CD19受CD81调控,CD81在45%的MM中表达,克隆性浆细胞中CD81的表达是aMM患者的独立预后因素,同时也是SMM患者进展风险标志[48]。基于CD19和CD81这两种抗原提出了一种新的正常浆细胞成熟轴,即浆细胞亚群从CD19+/CD81+到CD19-/CD81+和CD19-/CD81-逐渐分化,MM细胞也符合这种浆细胞分化模式,并在225例NDMM患者中发现,59%存在完全分化(CD19-/CD81-)克隆,38%存在中间分化(CD19-/CD81+)克隆,3%存在低分化(CD19+/CD81+)克隆,分化不良患者预后不佳[49]。
CD27是一种在浆细胞上高表达的肿瘤坏死因子受体,CD27阴性与较低的凋亡率相关,提示NDMM患者预后不良[50],CD27低表达还与高危遗传学异常相关并可作为MM进展的标志。然而,PCL中显示CD27高表达,这对地塞米松诱导的细胞凋亡具有保护作用,CD27在MM和PCL的差异表达尚不清楚。CD24同样是MM进展和生存的预后标志物,CD24表达升高的患者PFS和OS显著延长,但该研究又证实CD117、CD56和CD45没有预后价值,CD19的表达与PFS单独呈负相关,与OS无关[51]。此外,CD43[52]和CD155[53]也是NDMM的独立不良预后因素。先前有一些研究报道,具有髓系标记物如CD13或CD33表型的MM患者预后较差,但也有研究表明,差异未达到统计学意义[54]。
4.2定量预后参数 PCs/BM和aPCs/BMPCs与MGUS和SMM到MM的进展风险增加相关,已被确定为独立预后参数。研究表明,aPCs/BMPCs>95%的MGUS患者和SMM患者5年进展为aMM的累积概率显著高于aPCs/BMPCs<95%的患者[55]。在单因素分析中,诊断时相对较高比例的nPCs/BMPCs(>5%)与更好的PFS和OS相关,同时具有更低的BM侵犯、更高的血红蛋白水平和较低频率的免疫麻痹[14]。在322例MGUS患者中研究得出,异常浆细胞(A)与正常浆细胞(N)比值是决定进展为MM的关键预后变量,A/N>4患者组5年进展到MM的累积概率显著高于A/N<4患者组[56]。此外,S期浆细胞比例增加(>2%)与较短的PFS和OS密切相关。还有研究基于aPCs/BMPCs≥95%、DNA非整倍体和免疫麻痹进行多变量分析,aPCs/BMPCs≥95%和DNA非整倍体用于MUGS评估,aPCs/BMPCs≥95%和免疫麻痹用于SMM评估,结果显示,在MGUS中无、有1个或2个危险因素的患者,从MGUS进展到MM的5年累积概率以及SMM进展为有症状性疾病的风险依次递增[55]。基于MFC定义的DNA和细胞质轻链免疫球蛋白(DNA/CIg)指数也是无症状克隆性浆细胞疾病进展为MM的主要预后因素,还可以高度预测NDMM的PFS和OS[57]。
5 MFC在浆细胞疾病MRD检测中的临床应用
尽管MM患者可实现深度缓解(CR/sCR),但仍有部分患者会经历疾病复发,MFC能够准确识别和量化克隆性浆细胞,已成为MRD评估的首选检测方法之一。持续MFC MRD阴性的MM患者5年PFS和OS分别为81%和94%[58]。在sCR/CR和存在高危细胞遗传学异常的MM患者中,MFC MRD阳性组PFS明显低于MRD阴性组[59]。>2年持续CR的MM患者还显示出治愈或MGUS样的MRD模式[60],因此,提示MRD阴性可作为生存结果替代终点。
除了在细胞学分析中BM浆细胞百分比与MFC相比有较大差异外,NGF评估MM MRD的另一个主要局限与MM 浆细胞表型的高异质性,以及浆细胞表型根据患者的治疗方式发生“转移”有关[61]。已经广泛证明,使用免疫调节药物治疗的患者可能会发生浆细胞表型的变化,尤其使用Daretumab(达雷妥尤单抗)的患者。Daretumab(达雷妥尤单抗)是一种抗CD38 IgG1 kappa人单抗,与独特的CD38表位结合具有高亲和力,是复发/难治性疾病MM患者的有效药物治疗[62],CD38是MFC识别浆细胞的关键标志物,使用达雷妥尤单抗降低了MRD检测灵敏度,而CD138虽相对特异但不稳定,易随细胞老化或样本储存从细胞表面脱落。因此,新的标志物,如CD200、CD33、CD54、CD229、CD307、CD319、CD150和VS38,已被提议包含在MFC MRD抗体组合中[37]。CD229不能可靠地精确区分异常浆细胞和正常浆细胞,这限制了其临床实用性[63]。VS38c高表达可识别MM细胞,特别是在Daretumab治疗的患者中[64]。
MRD状态还能预测移植结果,研究表明,在295例接受自体干细胞移植(autologous stem cell transplantation,ASCT)治疗的NDMM患者中,ASCT后+100 d MRD阴性(灵敏度为10-4)的患者,其PFS和OS均显著延长。同样,移植后3个月和6个月检测到克隆性浆细胞与明显较短的PFS和OS相关,而在这些时间点未检测到克隆性浆细胞的患者疾病进展风险较低,5年OS为100%[65]。MRD状态在不符合条件的老年移植患者中也是最重要和最独立的预后因素之一。
MRD评估主要集中在BM浆细胞上,没有涉及到同样在预后中发挥作用的BM微环境,而且BM受累可能并不均匀,髓外也可能存在病灶,因此,基于MFC的MRD检查和影像学检查往往存在差异。“液体活检”技术的发展避免了BM取样中异质性缺陷,但敏感性较低。
6 结语
利用MFC进行免疫表型分析已成为恶性浆细胞疾病诊断和监测的常规手段。目前关于MFC在以下不同领域的临床应用已经达成共识:浆细胞疾病的鉴别诊断和分类,MGUS、SMM和MM的预后分层以及MRD监测;此外,MFC还有助于揭示MM的发病机制和化疗耐药性。MFC在即将到来的免疫治疗时代同样具有重要意义,特别是在定义和监测治疗靶点如CD38、SLAMF7、PD-L1、BCMA和许多其他尚未发现的靶点方面。然而,在最佳样本采集、最佳检测时间点、流程标准化以及不断发展的表面抗体靶向药物方面的挑战仍然存在,并将需要解决。

