宁夏枸杞根腐病不同发病时期根区土壤AMF 群落变化规律*
王佳玮,吕 燕,刘建利,孙钦飞,侯露露,刘 涛,王丽霞
(1 北方民族大学生物科学与工程学院,国家民委黄河流域农牧交错区生态保护重点实验室,宁夏特殊生境微生物资源开发与利用重点实验室,银川 750021)(2 西鄂尔多斯国家级自然保护区管理局)
宁夏枸杞(Lyciumbarbarum)是茄科枸杞属药用植物,也是宁夏、甘肃、内蒙古、新疆和青海等地重要的经济林果树种[1]。根腐病是枸杞的“癌症”,由尖孢镰刀菌(Fusariumoxysporum)[2-4]、腐皮镰刀菌(F.solani)[2,4]、串珠镰孢菌(F.moniliforme)[3]、锐顶镰刀菌(F.acuminatum)[3]、三线镰刀菌(F.tricinctum)[4]、厚垣镰孢菌(F.chlamydosporum)[4]、链格孢菌(Alternariaalternate)[4]、黄色镰刀菌(F.culmorum)[5]、木贼镰刀菌(F.equiseti)[5]造成,主要危害3 年龄以上的枸杞植株,造成植株死亡,发病率高达72.4%[2]。近年来,越来越多的研究表明植物根部病害的发生和土壤微生态密切相关[6-8],贾晨波等[9]报道,宁夏枸杞根腐病的发生也与土壤细菌、真菌多样性及其物种组成的变化有密切关系。
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是一种在土壤中广泛存在,可以与90%以上陆生植物根部形成共生关系的一种有益真菌,AMF与植物共生后能提高宿主对病虫害的抗性[10-12]。本课题组前期研究发现,宁夏枸杞根腐病植株根区土壤AMF 群落组成与健康植株具有显著差异[13]。但在宁夏枸杞根腐病的发病过程中,植株根区土壤AMF群落的详细变化规律仍需进一步深入研究。因此,本研究以宁夏枸杞根腐病植株不同发病时期的根区土壤为研究材料,分析在不同发病时期植株根区土壤AMF 变化规律,为后续开展应用AMF 防控根腐病奠定理论基础。
1 材料与方法
1.1 试验材料
于2019 年8 月,在宁夏银川西夏区芦花台农户自种枸杞园(东经106°9′,北纬38°39′)采集样品,根据表1 标准划分4 个宁夏枸杞根腐病发病时期。先清除植株周围地表的凋落物,在植株周围取直径1 cm 根系,抖落收集根系上散落的土为根区土。3株植株土壤混合为1 个样品,每个样品3 个生物学重复,每个时期采集3 个样品,共采集12 个土壤样品。将土壤样品和根系装入无菌自封袋中带回实验室。土壤样品过2 mm 筛,部分阴干,保存于4 ℃冰箱中用于土壤理化性质的测定和AMF 分离鉴定;根系样品保存于4 ℃冰箱中用于AMF 侵染率的测定。
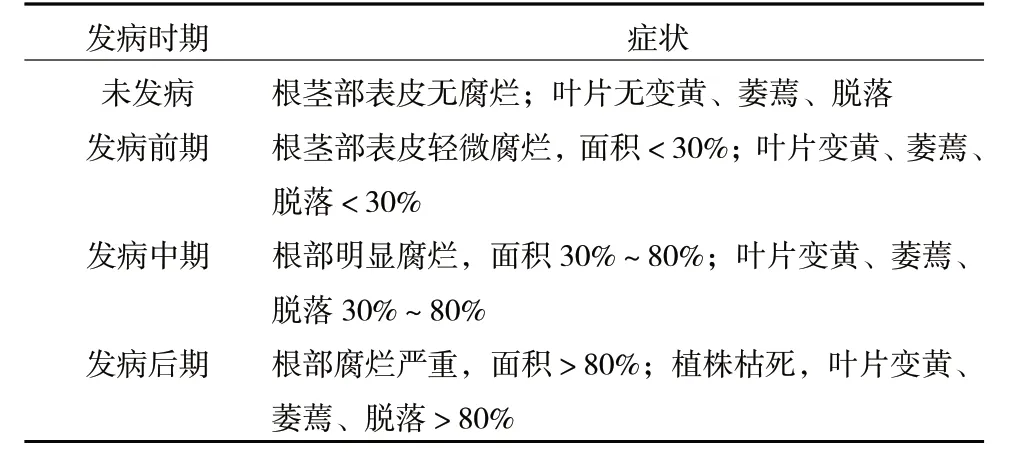
表1 宁夏枸杞根腐病发病时期划分标准[4]
1.2 试验方法
1.2.1 AMF 分离鉴定
采用湿筛倾析-蔗糖离心法[13]分离AMF 孢子,观察记录孢子大小、形态、颜色、表面纹饰、孢壁结构、连孢菌丝和内含物等特征,根据国际AMF保藏中心(INVAM)在http://invam.wvu.edu/和http://www.amf-phylogeny.com/上提供的最新分类描述及图片进行种属鉴定。
1.2.2 AMF 多样性测定
参照吕燕等[13]和刘海跃等[14]的方法对AMF 孢子密度、多度、相对多度及物种多样性指数进行计算。孢子密度(spore density,SD)=10 g 土样中孢子数量;多度(relative abundance,RA)=(AMF 某个属或某个种的孢子数/样品中AMF 总孢子数)×100%;分离频度(frequency,F)=(AMF 某个属或某个种出现次数/样品数)×100%;重要值(important value,IV),样品中AMF 某个属或某个种分离频度与多度之和的平均值,即IV=(F+RA)/2;根据重要值将AMF 优势度划分为4 个等级,即IV>60%为优势属(种),40%<IV≤60%为亚优势属(种),20%<IV≤40%为伴生属(种),IV≤20%为偶见属(种)。
香农-威纳多样性指数计算公式如下:
式中S 为某样品AMF 种类数,Pi为种i 所占比率。
辛普森指数计算公式如下:
式中S 为某样品AMF 种类数,Ni为种i 的个体数,N为全部物种的个体数。
1.2.3 AMF 定殖率测定
依据吕燕等[13]和Phillings 等[15]的方法,观察并计算AMF 定殖率,计算公式如下:
定殖率(%)=(有AMF 侵染的根段长度/根段总长度)×100
1.2.4 土壤理化性质测定
pH 值采用电位法测定,有机质(OM)含量采用重铬酸钾容量法测定,全氮(TN)含量采用凯氏定氮法测定,全磷(TP)含量采用酸溶-钼锑抗比色法测定,全钾(TK)含量采用氢氟酸高氯酸消煮法测定,铵态氮(NH4+-N)含量采用苯酚-次氯酸盐法测定,硝态氮(NO3--N)含量采用紫外分光光度法测定[16],速效磷(AP)含量采用钼锑抗比色法测定,速效钾(AK)含量采用醋酸铵-火焰光度计法测定,易提取球囊霉素相关土壤蛋白含量(Easily extractable glomalin related soil protein,EEGRSP)和总球囊霉素相关土壤蛋白含量(Total glomalin related soil protein,TGRSP)采用Braford 法测定[17]。
1.3 数据统计
利用SPSS 20.0 软件进行统计分析;采用美吉生信云平台工具(https://cloud.majorbio.com/)进行组间差异分析和PCoA 分析;运用R 语言(R×64 3.5.1)“vegan”包进行PERMANOVA 分析;运用微生太生科云平台(https://www.bioincloud.tech/#/)对AMF 与土壤因子进行RDA 分析和环境因子相关性分析。
2 结果与分析
2.1 宁夏枸杞根腐病不同发病时期根区土壤理化性质
宁夏枸杞根腐病不同发病时期根区土壤全氮、全钾、速效钾含量均存在显著性差异,而pH 值和有机质、全磷、铵态氮、硝态氮、速效磷含量均无显著性差异(表2)。土壤全氮含量随着宁夏枸杞根腐病发病程度的加重呈增加趋势,发病后期最高,为2.19 g/kg,分别为未发病(1.73 g/kg)、发病前期(1.61 g/kg)的1.27、1.36 倍;而土壤全钾、速效钾含量均随着宁夏枸杞根腐病发病程度的加重呈降低趋势,发病后期土壤全钾含量(1.99 g/kg)比未发病(4.29 g/kg)和发病前期(4.46 g/kg)分别降低了53.61%和55.38%,发病后期土壤速效钾含量(104.39 mg/kg)比未发病(198.83 mg/kg)和发病前期(210.41 mg/kg)均降低了约50%。因此,根区土壤全氮含量增高和全钾、速效钾含量降低可能与宁夏枸杞根腐病的发生有关。
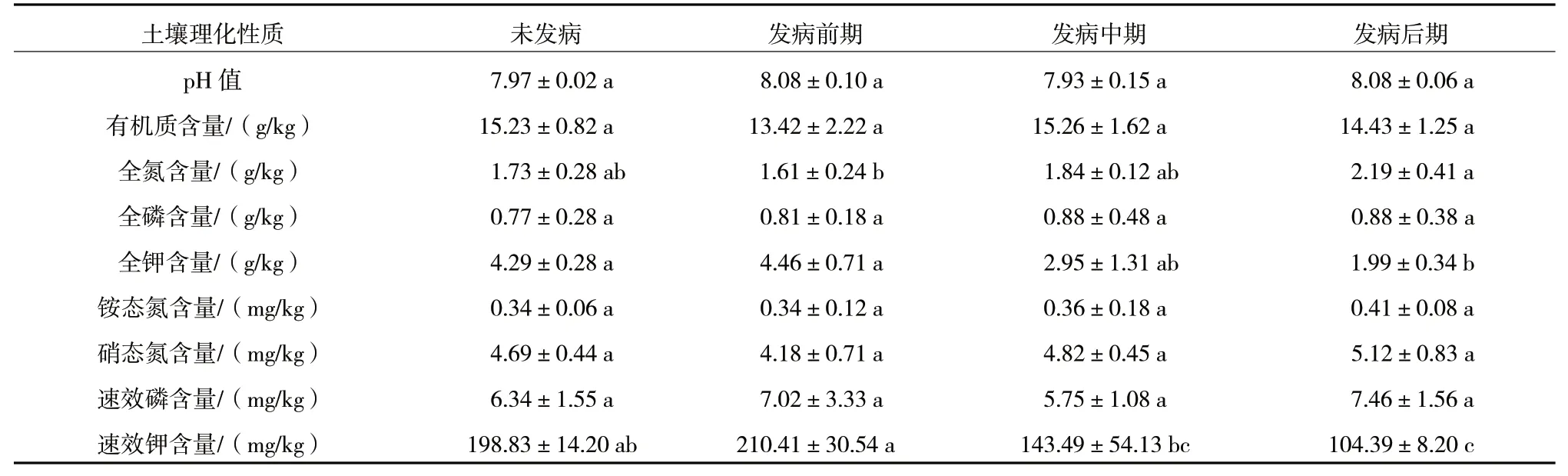
表2 宁夏枸杞根腐病不同发病时期根区土壤理化性质
2.2 宁夏枸杞根腐病不同发病时期根区土壤AMF孢子密度、定殖率和球囊霉素相关土壤蛋白含量
宁夏枸杞根腐病不同发病时期根区土壤AMF孢子密度、定殖率、EEGRSP 含量、TGRSP 含量在土壤中均有显著差异(表3)。AMF 孢子密度随着宁夏枸杞根腐病发病程度的加重呈先增加后降低的趋势,发病前期(14.50 个/g)和发病中期(12.83个/g)较高,比未发病(9.77 个/g)和发病后期(9.70个/g)增加了31.32%~49.48%。AMF 定殖率、EEGRSP 含量、TGRSP 含量均随着宁夏枸杞根腐病发病程度的加重呈增高趋势,发病中期AMF 定殖率(21.10%)分别是未发病(2.50%)和发病前期(7.72%)的8.44、2.73 倍;发病中期EEGRSP 含量(39.62 mg/g)分别是未发病(30.73 mg/g)和发病前期(33.49 mg/g)的1.29、1.18 倍;发病后期TGRSP 含量(72.65 mg/g)分别是未发病(66.63 mg/g)和发病前期(63.94 mg/g)的1.10 倍左右。因此,枸杞根腐病的发生会导致根区土壤AMF 孢子密度、定殖率、EEGRSP 含量、TGRSP 含量的变化,AMF孢子密度先增加后降低,在发病前期和中期显著增加,在发病后期又降低至和未发病时无显著差异;AMF 定殖率、EEGRSP 含量均在发病中期达到最高值,发病后期维持相对恒定,而TGRSP 含量在发病后期达到最高值。
2.3 AMF 孢子形态
在4 组样品中共分离6 属16 种,包括无梗囊霉属(Acaulospora)4 种:蜜色无梗囊霉(A.mellea)、皱壁无梗囊霉(A.rugosa)、细凹无梗囊霉(A.scrobiculata)、孢果无梗囊霉(A.sporocarpia)(图版1-1~4);伞房球囊霉属(Corymbiglomus)1 种:簇孢伞房球囊霉(C.corymbiforme)(图版1-5);多样孢囊霉属(Diversispora)1 种:橙黄多样孢囊霉(D.aurantia)(图版1-6);球囊霉属(Glomus)6 种:双网球囊霉(G.bireticulata)、宽柄球囊霉(G.magnicaule)、黑球囊霉(G.melanosporum)、多梗球囊霉(G.multicaule)、网状球囊霉(G.reticulatum)、地表球囊霉(G.versiforme)(图版1-7~12);根孢囊霉属(Rhizophagus)1 种:明根孢囊霉(R.clarus)(图版1-13);隔球囊霉属(Septoglomus)3 种:缩隔球囊霉(S.constrictum)、沙荒隔球囊霉(S.deserticola)、黏质隔球囊霉(S.viscosum)(图版1-14~16)。
2.4 宁夏枸杞根腐病不同发病时期根区土壤AMF群落组成
宁夏枸杞根区土壤中AMF 群落优势属在根腐病不同发病时期有所差异。未发病和发病中期优势属均为球囊霉属,多度分别为49.0%和34.9%,发病前期和发病后期优势属均为隔球囊霉属,多度分别为34.5%和33.5%(图1-A)。单因素方差分析显示(图1-B),隔球囊霉属、根孢囊霉属、球囊霉属和无梗囊霉属在不同发病时期多度均差异显著(P<0.05),所有发病时期球囊霉属和无梗囊霉属均比未发病时低;隔球囊霉属刚好相反,所有发病时期均高于未发病时;根孢囊霉属则先增高后降低。因此,根腐病发病时期改变了宁夏枸杞根区土壤中AMF 群落组成,其中隔球囊霉属、根孢囊霉属、球囊霉属和无梗囊霉属在宁夏枸杞不同发病时期多度存在显著差异,但多度变化规律不尽相同。
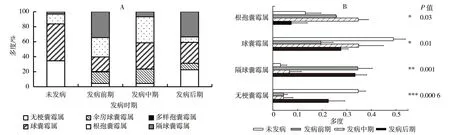
图1 属水平宁夏枸杞根腐病不同发病时期根区土壤AMF 群落组成
根腐病发病时期改变了宁夏枸杞根区土壤中AMF 群落优势种,未发病为蜜色无梗囊霉,发病前期和发病中期为明根孢囊霉,发病后期为缩隔球囊霉(表4)。蜜色无梗囊霉、宽柄球囊霉、黑球囊霉、地表球囊霉、明根孢囊霉、缩隔球囊霉等6 个种在所有的时期都发现,且重要值较高(表4),单因素方差分析显示(图2),5 个种在不同发病时期多度差异显著(P<0.05),黑球囊霉、宽柄球囊霉和蜜色无梗囊霉所有发病时期重要值均比未发病时降低;缩隔球囊霉刚好相反,所有发病时期均高于未发病;地表球囊霉和明根孢囊霉则是先增高后降低。而簇孢伞房球囊霉和双网球囊霉只在发病时期出现;孢果无梗囊霉、多梗球囊霉和网状球囊霉进入发病期后逐渐消失(表4)。
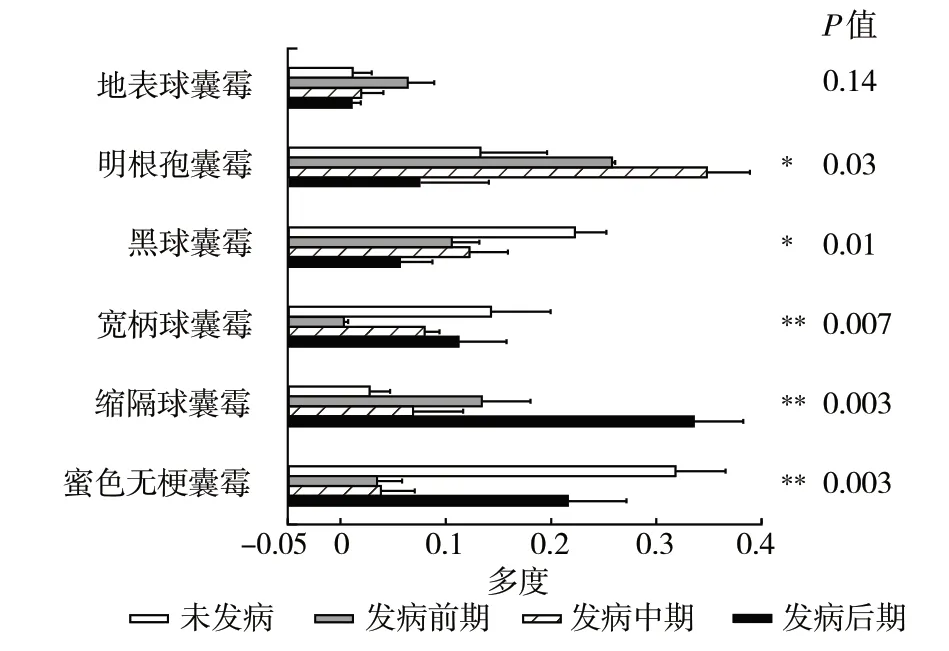
图2 种水平宁夏枸杞根腐病不同发病时期根区土壤AMF差异物种
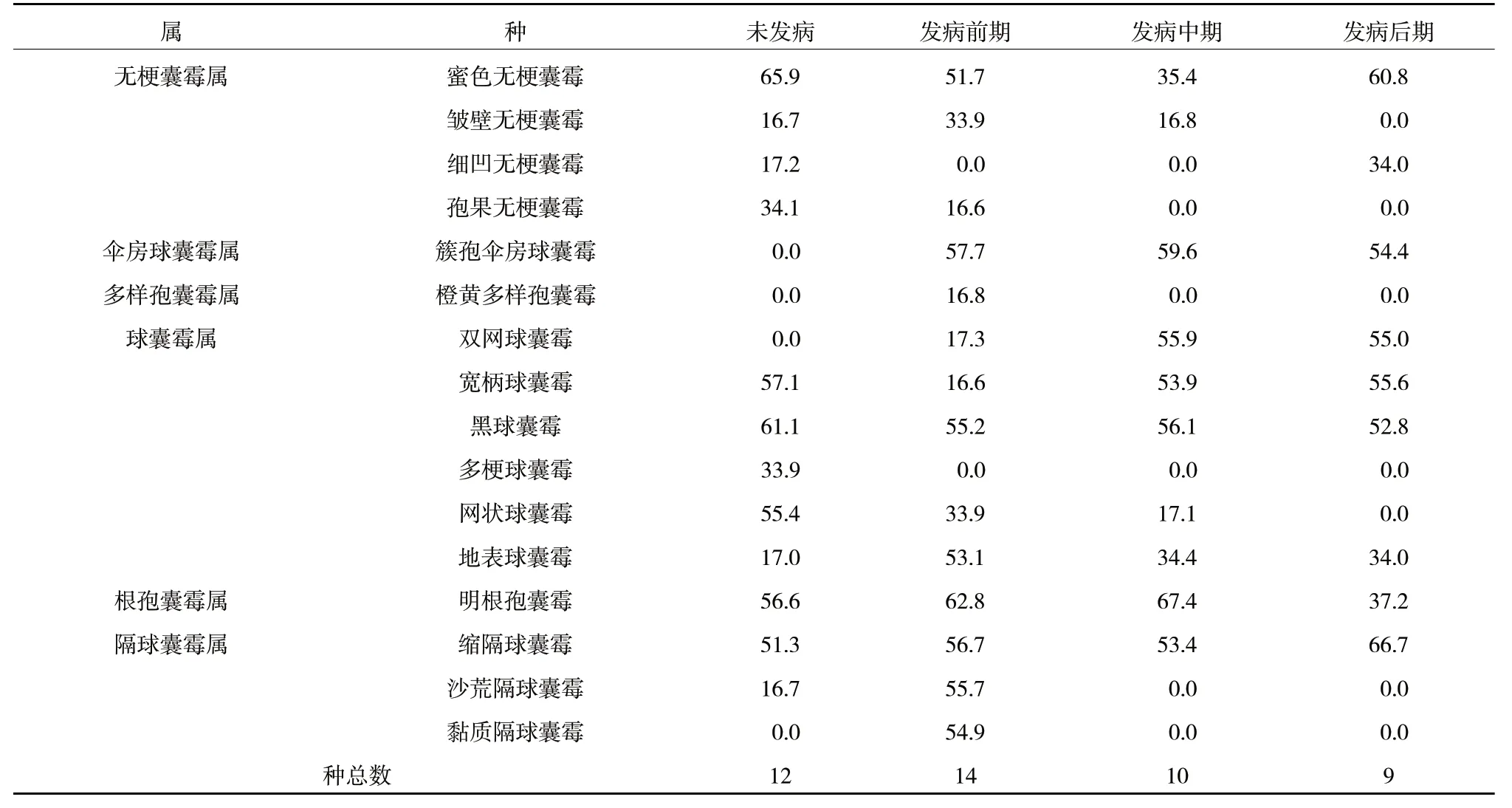
表4 宁夏枸杞根腐病不同发病时期根区土壤AMF 种重要值 %
2.5 宁夏枸杞根腐病不同发病时期根区土壤AMF群落α-多样性
宁夏枸杞根区土壤中AMF 群落α-多样性指数随着根腐病发病时期不同有所差异,物种多度、香农-威纳指数和辛普森指数均以发病前期最高,而其他时期之间差异均不显著(表5)。因此,根腐病发生导致宁夏枸杞根区土壤中AMF 群落α-多样性指数先升高后下降,以发病前期最高。
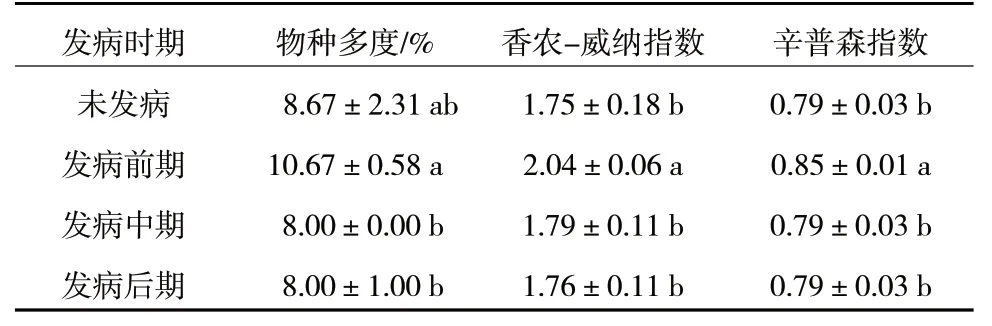
表5 宁夏枸杞根腐病不同发病时期根区土壤AMF 群落α-多样性
2.6 宁夏枸杞根腐病不同发病时期根区土壤AMF群落β-多样性
基于Bray_Curtis 距离的主坐标分析(PCoA)4个发病时期宁夏枸杞根区土壤AMF 群落β-多样性结果显示,4 个发病时期根区土壤AMF 群落组成存在差异(R2=0.893,P=0.001),发病时期对AMF群落差异解释度为50.47%(图3)。
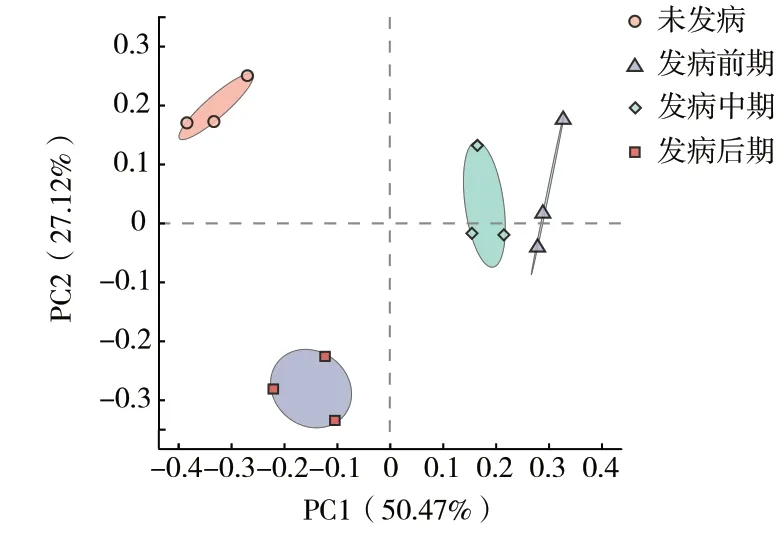
图3 宁夏枸杞根腐病不同发病时期根区土壤AMF 群落PCoA 图
2.7 宁夏枸杞根腐病不同发病时期根区土壤AMF群落与土壤理化因子RDA 分析
对土壤理化因子各项指标与不同发病时期根区土壤AMF 群落进行冗余分析(RDA),速效钾和全钾含量是影响不同发病时期宁夏枸杞根区土壤AMF 群落的主要因子,2 个排序轴(RDA1 和RDA2)对物种变量的解释量分别为34.46%和29.25%,累计解释量为63.71%。速效钾含量和全钾含量促进未发病、发病前期AMF 群落建成,而抑制发病中期、发病后期AMF 群落建成(图4)。
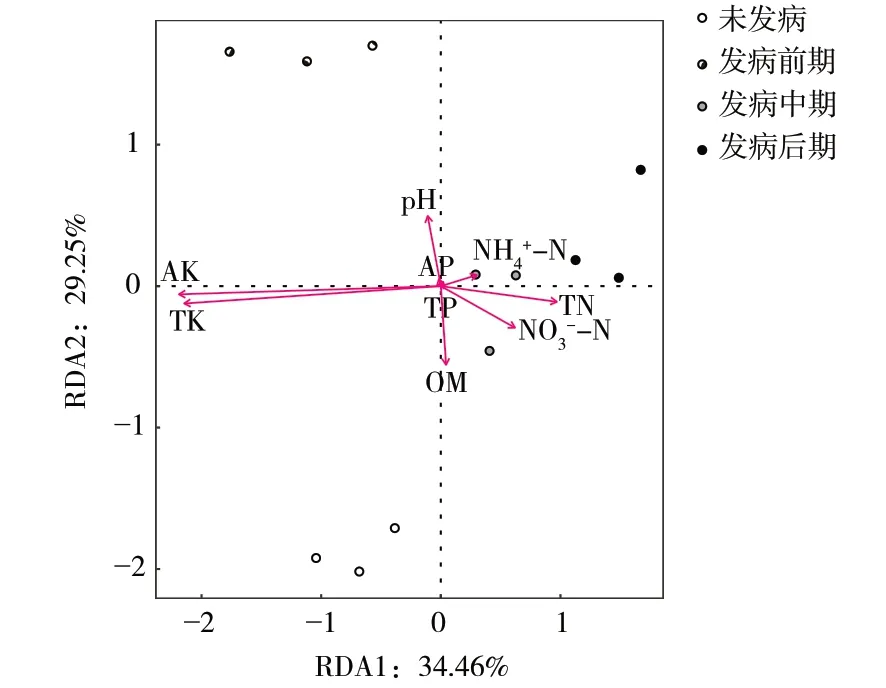
图4 宁夏枸杞根腐病不同发病时期根区土壤AMF 群落与土壤理化因子RDA 分析图
3 讨论
研究表明,植物病害的发生和相关微生物群落的失调密切相关[18],植物病害的发生也会引起相关微生物群落发生变化,也会对根系AMF 群落组成产生影响。玉米纹枯病[19]、三七根腐病[20]、星油藤根腐病[21]、生姜姜瘟病[22]、纽荷尔脐橙根腐病[23]等研究表明,病害发生造成AMF 侵染率、根际土壤孢子密度降低。而本研究表明,AMF 定殖率随着宁夏枸杞根腐病的发生而增高,在发病中期达到最高值,分别是未发病、发病前期的8.44、2.73 倍,发病后期维持相对恒定;孢子密度在发病前期和中期显著增加,比未发病和发病后期增加了31.32%~49.48%,且发病后期降低至和未发病无差异。这一结果与前人的研究不同,可能是因为不同的病害类型和不同的土壤质地、宿主类型会引起AMF 的不同应答,宁夏枸杞种植园土壤偏盐碱[1],而与本试验结果不一致的病害大多是南方酸性土壤发生的病害;另外,田间调查发现,宁夏枸杞根腐病在3 年龄以上的植株才开始发病[2-5],病原菌在土壤里的潜伏周期较长,侵染过程较慢,发病时间相对来说较长,因此,宿主植物有充足的时间招募包括AMF 在内的土壤益生微生物来抵御病原菌侵染[24],从而致使AMF 孢子密度和侵染率都较未发病时增加。
球囊霉素相关土壤蛋白(Glomalin related soil protein,GRSP)是由AMF 产生的具有良好热稳性的特殊糖蛋白,能够促进土壤团聚体形成,保持团聚体稳定性,增加土壤有机碳库,提高植物抗逆能力[25]。关于植物病害的发生对AMF 释放代谢物GRSP 的研究较少。程申等[23]研究结果表明,根腐病的发生可降低GRSP 含量,尤其是总球囊霉素相关土壤蛋白(TGRSP)含量。本研究结果表明,宁夏枸杞根区土壤中易提取球囊霉素相关土壤蛋白(EEGRSP)和总球囊霉素相关土壤蛋白(TGRSP)含量均随着根腐病的发生而增高,EEGRSP 含量在发病中期达到最高值,TGRSP 含量在发病后期达到最高值,总体在发病后期维持相对恒定。有研究表明,土传病害的发生和不同土壤质地有关[26],可能是AMF 通过产生GRSP,改善土壤质地,增加通透性,从而改变整个土壤微环境,抑制病原菌繁殖。
AMF 是土壤微生物中重要的类群,土著AMF长期存在于土壤中,已适应土壤的生态条件且具备良好的生存优势,病原入侵前植物与AMF 建立共生体可提前诱导寄主建立抗病防御体系,有助于预防土传病害的发生[27]。本研究发现,所有根腐病发病时期宁夏枸杞根区土壤中球囊霉属和无梗囊霉属多度均比未发病时降低;隔球囊霉属刚好相反,所有发病时期多度均高于未发病时;根孢囊霉属则是先增高后降低。在未发病时,土壤中含量较高的球囊霉属和无梗囊霉属,可能作为后续开发防控枸杞根腐病的AMF 菌剂候选菌。其他植物病害防控研究也有报道,球囊霉属和无梗囊霉属AMF 具有很好的生防潜力[11-12]。
土壤是土壤微生物依存的基质,土壤理化性质会影响包括土传病害在内的所有微生物种群增长及群落构建[28]。北苍术根腐病[29]、石柱黄连根腐病[30]、香蕉枯萎病[31]、辣椒疫病[32]等研究发现,罹病植株土壤理化性质与健康植株有显著差异,但差异规律在各个病害上并不完全一致。可能因研究样地土壤、栽培农艺措施(尤其施肥量)、病原菌种类、宿主植物及其参与物质循环的根区微生物群落不同而结果不同。本研究发现,根腐病发生与宁夏枸杞根区土壤中全氮、全钾、速效钾含量有关,土壤全氮含量增高和全钾、速效钾含量降低,有可能促进宁夏枸杞根腐病的发生。氮元素过多容易造成植物生长过快,茎秆细弱,纤维素、木质素减少,组织柔嫩,体内可溶性非蛋白态氮含量过高也容易造成土壤酸化、土壤板结硬化、透气性差,致使土壤微生物由细菌型向真菌型转变,容易遭受病虫害感染;而钾元素能使植株的叶片和枝干更加强壮,提高植株抗病、抗寒、抗旱、抗倒伏、抗盐能力[33]。因此,在宁夏枸杞种植过程中降氮增钾有利于防控根腐病。
4 结论
(1)根腐病发生显著影响宁夏枸杞根区土壤AMF 定殖率、孢子密度、群落组成、多样性、球囊霉素相关土壤蛋白含量,但变化规律不一致。
(2)在宁夏枸杞根区土壤降氮增钾,接种球囊霉属和无梗囊霉属AMF 可能防控根腐病的发生。

