普通大蓟马MuRhodopsin基因的全长克隆及生物信息学分析
金海峰,王朝政,侯清芳,咸利民,张华剑,吴少英
(1. 海南大学 三亚南繁研究院,三亚 572025; 2. 海南大学 植物保护学院,海口 570228;3. 海口海关技术中心,海口 570311)
昆虫的颜色视觉是其接受外界信息的主要途径之一。昆虫视觉系统能够接收并对范围内特定波长光做出反应,除了接收直射光源外,还包括反射光源及偏振光源,从而提高对颜色和空间辨别能力[1]。自19世纪80年代发现昆虫视觉对紫外光具有敏感性后,发现包括蜜蜂(Apoidea)、蝴蝶(Papilionoidea)、果蝇(Drosophilidae)和蛾类(Hepialidae)等多种昆虫具有良好的紫外视觉能力,它们可以利用颜色、对比度和光偏振角度等特性调控昆虫的定向搜寻、觅食、种内交流和昼夜节律等行为,这对于其生长发育和生态适应性具有重要意义[2]。昆虫视觉形成过程中的关键因子-敏感视蛋白可协同其他视蛋白调控昆虫的颜色视觉,也可独立介导特定波长趋性行为。视觉视蛋白是动物接收光的关键蛋白质,先前研究表明昆虫视蛋白分为3个主要分支:紫外线敏感短波长(SW)视蛋白、蓝光敏感的中波长(MW)视蛋白以及长波长(LW)视蛋白,其中光谱敏感变化范围从蓝紫色至绿色再到红色(果蝇中的Rh2),迄今为止调查的大多数昆虫都至少存在其中一种视蛋白[3-5]。视紫红质(Rhodopsin)是由视蛋白(opsin)和视黄醛(11-顺式视网膜色素基团)组成结合蛋白,为介导光信号转导通路最重要的G蛋白偶联受体。其中,视蛋白296位赖氨酸(K296)残基与11-顺式视网膜色素基团通过Schiff共价键链接,在光子的刺激下,11-顺式视黄醛转变成全反式视黄醛,视蛋白构象也随之发生改变,呈活化状态。再次吸收光子后,Schiff 键被水解,视蛋白上的全反式视黄醛解离,K296 和 E113 形成的盐桥限制了脱辅基视蛋白分子构象,呈现非活化状态[6]。Rhodopsin不仅参与视觉形象及昼夜节律调节,还与抗药性、迁飞等行为有关[7-9]。目前,已知模式昆虫黑腹果蝇(Drosophila melanogaster))中含有7种RH视蛋白,是果蝇识别不同颜色的主要载体,存在于不同光感受器中,不同视紫红质对特定波长光质敏感性不同,除了与发色团构型及结合位点外,还与视蛋白氨基酸序列有关,氨基酸序列改变可能会导致改变吸收的光谱波长范围及敏感性[10-12]。Rh1作为黑腹果蝇中主要存在的Rhodopsin类型,也是研究最广泛的一种。主要表达在R1-R6 感光细胞中[13-14]。R7细胞中表达的Rh3 和Rh4对紫外光敏感[15-16]。对蓝光和绿光敏感的Rh5和Rh6则表达在R8细胞中[17-19]。并且Rh3/Rh5以及Rh4/Rh6总是对应地分布在一个小眼上下排列的R7和R8之中[20]。在果蝇头顶部的3个单眼中发现对紫光敏感的Rh2[21-23];在燕尾蝶(Papilio glaucus)中证实存在6个视蛋白(PglRh1-6)其中PglRh5和PglRh6是从蝴蝶克隆的第一个UV和蓝色视蛋白同系物;在西花蓟马和棕榈蓟马中也至少存在7种视蛋白[24-25];视蛋白在完全变态昆虫中已经有较深入的研究包括膜翅目[26]、双翅目[23]、鳞翅目[27]和鞘翅目[28],以及一些甲壳类动物[29-30]、节肢类动物(Branchiopoda、Ostracoda)[31-33]和3种螯肢动物[34-35]也有相关报道。
普通大蓟马为缨翅目蓟马科重要植食性害虫,主要分布于我国华南、华中大部分地区[36-38],通常隐匿于花中,锉吸植物组织汁液,给豆科、禾本科等农作物外观品质及产量造成较大影响[39-42]。在海南,普通大蓟马已然成为豇豆为主的豆科作物上“头号害虫”,豇豆(Vigna unguiculata)作为 “南菜北运”重要的瓜菜品种,事关冬季海南菜农的经济收入、北运消费者的身心健康及地方政府绿色农产品产业体系发展。目前,对普通大蓟马危害主要依靠化学防治策略,但高繁殖力及短世代周期增长了其对农药的抗性,据报道,2013—2017年,海南不同地区抗性监测普通大蓟马对新烟碱、菊酯类等其他杀虫剂抗性增长迅速,97% 高效氯氰菊酯由86.81 mg·L-1增长到290.88 mg·L-1[43-44]。研究发现,田间悬挂蓝色黏虫板对普通大蓟马具有较高的防控效果,其对 470 nm波长蓝光趋性较高,但相关分子机制尚不明确[45-46]。因此本研究拟通过克隆普通大蓟马的Rhodopsin基因全长序列,对该基因序列进行分子生物学信息分析,旨在为研究普通大蓟马视蛋白分子功能及开发田间绿色光控技术奠定实验基础。
1 材料与方法
1.1 供试昆虫 供试的普通大蓟马于2022年11月采自于海南省三亚市崖州区坝头基地豇豆作物花中,利用细毛笔挑取成虫,转移至组培瓶制作的饲养罐中,利用新鲜的豇豆进行饲喂,在培养箱进行继代饲养。饲养条件设置为:温度为(26 ± 1)℃,湿度为70% ± 5%,光周期为14 L:10D。将含有卵的豇豆转移至新的养虫罐中,标记为下一代,连续饲养10代后进行后续实验。
1.2 试剂 Trizol®Reagent购自于美国 Ambion公司;反转录试剂盒(PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit)、DNA Marker(DL2000 DNA Marker)购自于日本 TaKaRa公司;PCR扩增试剂盒(GreenTaqMix (with ddH2O))、连接转化试剂盒(5×Ta/Blunt Zero Cloning Mix)购自于南京诺唯赞生物科技股份有限公司;PCR纯化回收试剂盒、质粒纯化回收试剂盒购自于美国 Omega Bio-Tek公司;核酸染料(SuperRed/GelRed)购自于北京天根生化科技有限公司,Stbl-2 感受态细胞购自于上海唯地生物技术有限公司,其余试剂均为国产分析级。
1.3 普通大蓟马Rhodopsin基因的克隆 挑取同代刚羽化、大小相同、活动敏捷的普通大蓟马雌成虫20头,于液氮罐中迅速冷却后置于冰上充分匀浆,利用 Trizol®Reagent 提取总RNA, 测定 RNA的吸光度,并计算A260/A280值及浓度;以获得的普通大蓟马总RNA为模板,反转录试剂盒PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit反转录为cDNA;根据普通大蓟马转录组测序数据,检索Rhodopsin基因通过ncbi 网站比对结果,根据CDS区域设计引物(表1),以反转录的cDNA为模板,利用GreenTaqMix进行PCR扩增目的基因,反应体系如下:cDNA模板 3 μL、引物对各2 μL、ddH2O 18 μL、GreenTaqMix 25 μL、总体系为 50 μL。反应条件:95 ℃ 预热 3 min;95℃ 30 s,58.6 ℃ 15 s, 72 ℃ 1 min,扩增 35个循环;72 ℃ 5 min延伸后产物在 4 ℃保存。取 2 μL PCR 产物进行 1% 琼脂糖凝胶电泳(110V,25min),观察目的条带。将PCR产物利用PCR纯化回收试剂盒Cycle Pure Kit 进行纯化回收,取1 μL回收产物进行浓度和纯度的测试,-20 ℃保存备用。利用链接转化试剂盒5×Ta/Blunt Zero Cloning Mix将纯化回收产物连接至T载体获得重组质粒后,转入到Stbl-2 感受态细胞中,使用含10 mg·mL-1氨苄卡那霉素的 LA 固体培养基进行培养。挑取阳性单克隆菌落,经菌液 PCR 后通过琼脂糖凝胶电泳筛选出阳性克隆后提取重组质粒,送至北京擎科生物有限公司进行测序。
1.4 普通大蓟马Rhodopsin基因的序列分析 将测序所得核苷酸序列在NCBI网站进行Blast结果比对,挑取同源性较高其他昆虫物种的视蛋白基因,利用 DNAMan 9.0 和 MEGA 4.0 软件进行序列同源性比对并用邻接法(neighbor-joining method,NJ)构建系统进化树;利用Protparam (http://www.expasy.org/tools/protparam.html)预测其分子质量及稳定性等理化特性;利用Tmhmm(http://www.cbs.dtu.dk/services/TMHMM)进行跨膜区分析;利用在线软件ScanProsite(https://prosite.expasy.org/scanprosite)预测视蛋白Rhodopsin的结构域分布和功能位点,利用在线软件SOPMA(https://prabi.ibcp.fr/htm/site/web/home)对Rhodopsin基因的氨基酸序列的二级结构预测,利用SWISSMODEL(https://swissmodel.expasy.org)对该蛋白的三级结构进行预测。
2 结果与分析
2.1 普通大蓟马MuRhodopsin基因的序列分析根据全长引物的PCR结果,PCR扩增获得MuRhodopsin的全长cDNA(图1)。MuRhodopsin基因全长1140 bp(不含终止密码子),共编码380个氨基酸,其中 G+C 含量为 52.63%,A+T含量为 47.37%。推测该基因的蛋白相对分子质量为42 733.3 Da,理论等电点为8.47,体外半衰期为30 h,不稳定系数为28.38,正电荷氨基酸残基(Arg+Lys)有20个,负电荷氨基酸残基(Asp+Glu)有24个,总平均亲水性为 0.42,脂肪系数为 90.87。

图1 普通大蓟马Rhodopsin基因的RT-PCR产物电泳检测
2.2 普通大蓟马MuRhodopsin基因序列同源性分析 氨基酸序列比对结果表明普通大蓟马MuRhodopsin与棕榈蓟马(XP_034238557.1)及西花蓟马(XP_026285526.1)Rhodopsin具有较高相似度,分别为96.33%和94.07%,其中高度保守区域占91.6%,相似区域占5%,不相同氨基酸位点为第29、131、178、181、356氨基酸位(图2)。多重序列比对及系统进化树同源性分析表明普通大蓟马MuRhodopsin与棕榈蓟马与西花蓟马Rhodopsin蛋白聚为一支三,说明Rhodopsin在昆虫属的分类阶元上具有高度保守性(图3)。

图2 缨翅目不同蓟马 Rhodopsin 氨基酸序列比对
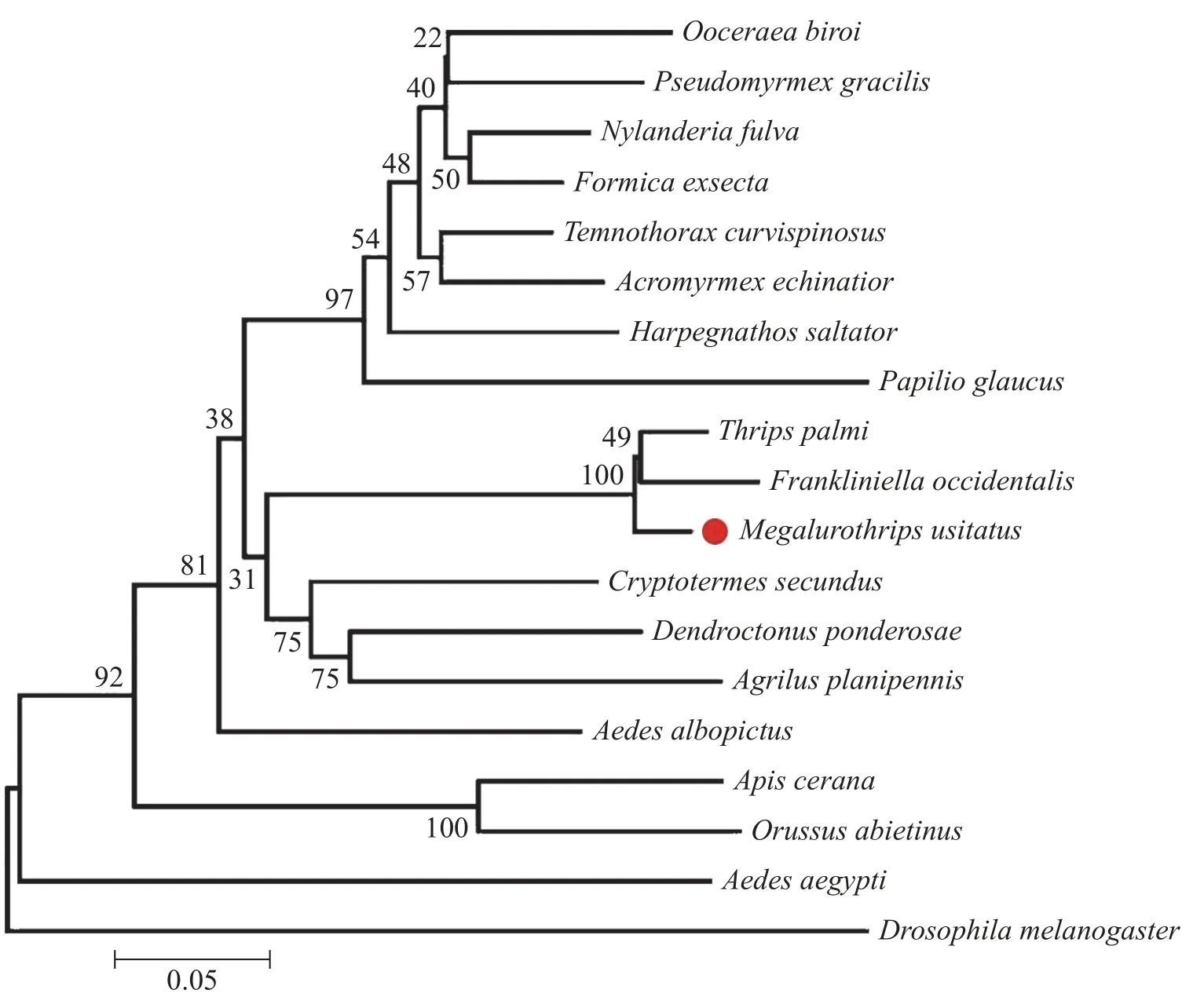
图3 不同昆虫的Rhodopsin蛋白序列生物进化分析
2.3 普通大蓟马Rhodopsin蛋白生物信息学分析普通大蓟马Rhodopsin蛋白序列二级结构预测结果表明,Rhodopsin蛋白中α螺旋约占 42.89%,延伸链约占20%,β折叠约占 2.89%,随机卷曲结构约占34.21%(图4)。蛋白跨膜区分析预测结果表明该视蛋白在第54~79、90~112、128~149、169~189、217~238、280~300、313~334氨基酸位具有 7 个跨膜结构域,其中包括4个由膜外向膜内的跨膜区( 56~79、128~149、 217~238、315~334氨基酸位),其余3个跨膜区为由膜内向膜外(图5)。ScanProsite 对Rhodopsin蛋白对功能位点分析发现,其包含了1个G蛋白偶联受体区域(70~332氨基酸位点),6个N-豆蔻酰化位点(19~24、130~135、133~138、139~144、198~203、302~307氨基酸位点),3个N-糖基化位点(23~26、199~202、299~302氨基酸位点),3个酪蛋白激酶II磷酸化位点(25~28、271~274、370~373氨基酸位点),4个蛋白激酶C磷酸化位点(80~82、165~167、262~264、377~379氨基酸位点)以及视色素结合位点(316~332氨基酸位点),说明Rhodopsin属于典型的G蛋白偶联受体(图6)。利用SWISSMODEL对Rhodopsin蛋白进行蛋白结构预测,该模型的构建基于6i9k.1.A(2.10 Å)为模板进行完成,分析序列相似性为56.29%,模型质量评估值为 0.82±0.05,定性模型能量分析值为-4.02,说明该预测结构模型符合拉马钱德兰图模型评估合理性(图7)。

图4 普通大蓟马Rhodopsin蛋白二级结构预测

图5 普通大蓟马Rhodopsin蛋白跨膜结构分析

图6 普通大蓟马Rhodopsin mRNA全长及氨基酸序列
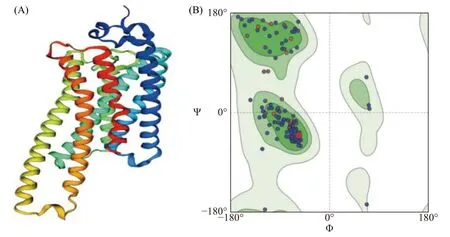
图7 普通大蓟马视蛋白Rhodopsin基因三级结构模型预测(A)及模型拉马钱德兰图(B)
灰色阴影区域为 7 个跨膜拓扑结构区域(54~79、90~112、128~149、169~ 189、217~238、280~300、313~334氨基酸位);红色下划线区域为6个N-豆蔻酰化位点(19~24、130~135、133~138、139~144、198~203、302~307氨基酸位点);蓝色下划线区域为3个N-糖基化位点(23~26、199~202、299~302氨基酸位点);绿色下划线区域3个酪蛋白激酶Ⅱ磷酸化位点(25~28、271~274、370~373氨基酸位点),黄色下划线区域4个蛋白激酶C磷酸化位点(80~82、165~167、262~264、377~379氨基酸位点);黑色虚线为昆虫视蛋白motif位点(84~89、149~152、254~257氨基酸位点);红色五角星为视蛋白与视黄醛结合位点(322氨基酸位点)。
3 讨 论
许多昆虫依靠视觉线索寻找合适的寄主植物作为食物和产卵地点。植食性昆虫正确定位寄主对其种群发展极其重要,首先植物可为成虫提供不同的营养价值,为其繁殖及栖息提供前提保障。因其无法长距离飞行寻找食物,就缨翅目而言,虽然个体较小,但其仍然具备为数众多的复眼,说明其具备有高效的视觉系统,在较短的距离上,颜色和其他视觉则发挥更重要的作用[47]。不同蓟马物种对应不同颜色的寄主表现出不同颜色趋性,例如食草蓟马Limothrips denticornis和Stenothrips graminum被证实对绿色敏感[48]。大量研究也已经证实蓟马对黄色(570~590 nm)、蓝色(420~470 nm)和紫外线(小于400 nm)等波长敏感[48],对特定波长光的敏感特异性是由视蛋白决定的,具有特定吸收光谱的视蛋白通过视蛋白与发色团结合形成视色素——视紫红质(Rhodopsin)[17]。由于发色团单一,通常为视黄醇氧化后的视黄醛异构体衍生物,视蛋白分子生物特点对其特定光谱敏感类型及生物学功能特点具有决定性作用。西花蓟马和棕榈蓟马中已经发现至少存在7种视蛋白[49],包含3个长波光视蛋白(LWS-opsin)基因和2个短波光视蛋白(SWS-opsin)视蛋白基因,SWS-UV和SWS-B。其中SWS-UV视蛋白在90位(相对于牛视紫红质)具有保守的赖氨酸残基,是节肢动物视蛋白对紫外光(UV)敏感的特异突变位点[50]。
通过克隆出普通大蓟马Rhodopsin基因全长序列(ORF),发现共编码380个氨基酸,具有7个跨膜螺旋结构,包含G蛋白偶联受体区域及相关功能位点区域,具有视蛋白基因一般特性,与缨翅目其他2种蓟马Rhodopsin氨基酸序具有高度保守性,包含氨基酸长度一致,其保守区域占90%以上,包含5个不相同氨基酸位点,利用分子系统进化树分析3种蓟马的Rhodopsin基因高度同源,说明蓟马类害虫视紫红质存在一定进化差异,从而对应光谱敏感性及功能可能存在影响;其余同目或同科其他物种昆虫也具有同一进化分支,白纹伊蚊与其他蚊子、小地老虎与其他鳞翅目昆虫的UV-opsin基因序列比对及进化分析也具有较高的同源性[7,51],表明视蛋白基因在同种物种同源性较高,在不同昆虫物种间进化较为保守。在昆虫视蛋白氨基酸序列存在着相关保守基序,包括最为常见的LRTPXN序列,在普通大蓟马Rhodopsin中LRTPSN位于84~89位氨基酸,在白纹伊蚊中的UV-opsin位于86~91位,都位于domain 1与domain 2之间[51];其余的DRY、QAKK基序分别位于普通大蓟马Rhodopsin的149~152位、254~257位。其中DRY与QAKK在与G蛋白受体结合并受其活化调控具有重要作用[5]。位于普通大蓟马Rhodopsin的第322位氨基酸—赖氨酸(K)为与发色团(视黄醛)的重要结合位点,不同昆虫视蛋白结合位点位置不同,例如,白纹伊蚊及小地老虎的UV-opsin位于325位,但都基本位于第七跨膜区内,视蛋白与发色团结合区域的差异会对形成的结合蛋白—视紫红质分子功能及对吸收光谱波长敏感性存在影响[2,7,51-52]。
视蛋白作为视觉系统中重要蛋白分子,不仅参与图像形成、光感定位等相关视觉反应,还对节律调控、繁殖及抗药性的产生等发挥作用[53-54]。本研究通过克隆普通大蓟马Rhodopsin的基因及分析,仅了解其基本序列特征等相关生物学信息,下一步应利用视网膜电位技术(ERG)、基因表达量分析、复眼荧光染色电镜观察等技术手段验证及明确该视蛋白光谱敏感性范围。能够为后续解析该视蛋白视觉分子机制形成特征及挖掘其非视觉分子功能提供一定的数据支撑。

