XppI调控水稻白叶枯病菌致病力的潜在机制
于燕燕,夏影影,吴可建,占昭宏,陶 均
(海南大学 热带作物学院/海南省热带生物资源可持续利用重点实验室,海口 570228)
稻属黄单胞菌水稻致病变种(Xanthomonas oryzaepv.oryzae,Xoo)是水稻白叶枯病病原菌,通过水孔或气孔进入水稻维管束,并在此大量繁殖、堵塞维管束,严重影响了水稻(Oryza sativa)的产量[1]。生命活动的进行依赖于蛋白质活性的精细调控,在此过程中蛋白质空间构象不断改变从而实现蛋白质活性变化[2]。蛋白构型变化直接改变蛋白质的空间构象和功能,但蛋白质的刚性肽键不能自由旋转,需要在肽基脯氨酰顺反异构酶(peptidyl-prolyl cis-trans isomerase, PPIase)的作用下才能从反式构型转变为稳定性更高的顺式构型[3]。PPIase分为三类,即FK506结合蛋白(FK506 Binding Proteins, FKBP)、亲环蛋白和细蛋白[4-5],它们加速目标蛋白质的正确折叠,是蛋白质折叠过程中的限速酶[6-8]。由PPIase介导的蛋白折叠变构是生命活动的必需过程,在动物、植物和微生物的生命活动中均起到非常重要作用[9-15]。例如,在幽门螺旋杆菌(Helicobacter pylori)中,PPIase调控镍转运蛋白活性,调节细胞的镍稳态[16];拟南芥(Arabidopsis thaliana)亲环蛋白AtCYP71通过控制蛋白顺反异构调控器官形成过程中的染色质重构[17];免疫亲和素CYP28可能通过其PPIase活性调控由光系统II(PSII)复合体与光捕获复合体II(LHCII)组成的PSII-LHCII超复合体(SCs)的组装和积累[18]。在柑橘黄单胞菌(Xanthomonas citri)与柑橘(Citrus reticulata)的互作中,柑橘黄单胞菌TAL效应蛋白PthAs通过抑制柑橘亲环素CsCyp对RNA聚合酶Ⅱ的异构化,激活宿主的转录,增强柑橘的溃疡病变[19]。这些结果表明,PPIase在生物体生长发育和应对外界环境中发挥重要作用。但XooPPIase的功能及其在致病过程中的作用尚无报道。因此,笔者通过体外酶活测定分析了XppI是否具有PPIase活性,通过构建xppI突变体及其互补菌株分析了XppI是否调控Xoo的致病力,还分析了xppI突变是否影响Xoo的胞外酶含量、运动性及抗氧化能力,期望解析XppI调控病原菌致病力的机制,为白叶枯病害的防治提供理论支撑。
1 材料与方法
1.1 植物、菌株及质粒 供试植物是水稻(Oryza sativa)‘TP309’,本实验所使用的菌株和质粒如表1所示。

表1 菌株和质粒来源
1.2 引物 实验所用引物见表2。

表2 实验引物
1.3 XppI蛋白的体外表达与纯化 以Xoo野生型菌株PXO99A基因组为模板,以xppIqeF/xppIqeR为引物,扩增xppI基因片段,BamHI/HindIII酶切后连接到相同酶切的pQE80L载体上,测序验证正确后获得XppI-His融合表达载体pQE80L-xppI,然后将pQE80L-xppI转化BL21(DE3)细胞[23]。菌株37 ℃过夜培养后,按1∶100体积比转接到500 mL的新鲜溶菌肉汤(Luria Bertani, LB)液体培养基继续培养至OD600达0.6~0.8后,加入250 μL 1 mol·L-1异丙基-β-D-硫代半乳糖苷(Isopropylbeta-D-thiogalactopyranoside, IPTG),并于25 ℃、90 r·min-1条件下诱导培养5~6 h。4 ℃离心收集菌体后进行超声破碎(超声功率比40%、超声5 s、间隙5 s、总时间10 min),取上清,SDS-PAGE电泳观察蛋白诱导表达情况。将目的蛋白按照BEAVER公司的BeaverBeadsTMIDA-Nickel Kit 试剂盒(Cat. No. 70501-K10)进行纯化,SDS-PAGE检测纯化效果。
1.4 XppI蛋白的异构酶活性检测 通过糜蛋白消化法测定XppI蛋白的异构酶活性。将25 μL XppI-His蛋白(25 μmol·L-1)、25 μL 糜蛋白酶(5 g·L-1)、145 μL 50 mmol·L-1Tris-HCl缓冲液(pH7.5)和10 μL 1 g·L-1的底物N-Suc-Ala-Ala-Pro-Phe-p-nitroanilide混匀加入96孔板中,以BSA蛋白作为对照,25 ℃下测量反应液在390 nm处的吸光值变化[24]。
1.5 敲除突变体和互补菌株构建 基因敲除:以PXO99A基因组为模板,扩增xppI基因上下游片段,分别用HindIII/BamHI,BamHI/EcoRI酶切上下游片段,然后再连接到HindIII/EcoRI酶切的pK18mobSacB上,获得敲除载体pK18-xppI。电击转化pK18-xppI至PXO99A中,经过2步同源重组方法获得突变体菌株ΔxppI[23]。
基因互补:以PXO99A基因组为模板,扩增xppI基因片段,HindIII/EcoRI酶切后克隆到相同酶切的广宿主载体pHMⅠ,获得互补载体pHMⅠ-xppI。电击转化pHMⅠ和pHMⅠ-xppI进ΔxppI感受态细胞,获得ΔxppI-pHMⅠ及互补菌株CΔxppI菌株[23]。
1.6 黄单胞菌的生长表型测定 马铃薯蔗糖琼脂(Potato Saccharose Agar, PSA)培养基中28 ℃、180 r·min-1培养野生型、突变体和互补菌株36 h,稀释菌液OD600至0.5±0.005。(1)按1∶1 000(体积比)的比例转接到50 mL新鲜PSA液体培养基中,28 ℃、200 r·min-1培养,每隔2.5 h 测OD600值直至稳定期;(2)将菌液进行10倍梯度稀释,点接PSA(蛋白胨 10 g·L-1,蔗糖 10 g·L-1,谷氨酸钠1 g·L-1,琼脂 15 g·L-1)与M4M(Na2HPO4.2H2O 7.52 g·L-1,KH2PO43 g·L-1,柠檬酸钠 0.5 g·L-1,(NH4)2SO41 g·L-1,酶水解干酪素 2 g·L-1,MgSO4.7H2O 0.2 g·L-1,葡萄糖 2 g·L-1,琼脂 15 g·L-1)固体培养基,28 ℃静止培养48~72 h,观察3种菌株之间生长是否有差异。
1.7 致病力分析 野生型、突变体和互补菌株在PSA培养基中28 ℃、180 r·min-1培养36 h,将菌液OD600调至1.0,剪叶法接种60 d龄的‘TP309’水稻叶片,每种菌株至少接种10片叶片,14 d 后观察并测量病斑长度[25]。
1.8 胞外纤维素酶、淀粉酶和蛋白酶活性检测PSA培养基中28 ℃、180 r·min-1培养野生型、突变体和互补菌株36 h,调OD600至1.0,分别取2 μL不同菌液接种到含0.5% 羧甲基纤维素、0.1% 可溶性淀粉或2% 脱脂奶粉的PSA固体培养基上,28 ℃培养箱中倒置培养3 d。用0.1%刚果红染色含纤维素的平板30 min,再用1 mol·L-1NaCl的溶液洗2次,每次10 min,观察水解圈直径(cm);用1∶100的 I2/KI(0.08 mol·L-1I2,3.2 mol·L-1KI)溶液染色含淀粉的平板 10 min,观察水解圈直径(cm);直接观察脱脂奶粉的水解圈(cm)[26]。
1.9 游动性检测 PSA培养基中28 ℃、180 r·min-1培养野生型、突变体和互补菌株36 h,调OD600至1.0,用无菌牙签分别蘸取菌液10 s后,垂直接种于游动培养基(0.03% 蛋白胨,0.03% 酵母提取物,0.25% 琼脂)中并立即拔出。在28 ℃培养箱中正置培养4 d,测量菌体游动圈的直径(cm)[27]。
1.10 蠕动性检测 取上述稀释菌液2 μL等间距接种到蠕动性培养基(1%蛋白胨,0.5%酵母提取物,2%葡萄糖,0.6%琼脂)表面上,在28 ℃培养箱中正置培养4 d,测量菌圈的直径(cm)[27]。
1.11 过氧化氢胁迫耐受性分析 PSA培养基中28 ℃、180 r·min-1培养野生型、突变体和互补菌株36 h,调OD600至0.5±0.05,分别加入80 mmol·L-1、100 mmol·L-1、120 mmol·L-1(终浓度)的H2O2,混匀后静置处理30 min。取1 mL处理好的菌液离心并用无菌ddH2O洗2遍后进行梯度稀释点板。在28 ℃培养箱中倒置培养3 d,观察不同处理菌的生长情况并拍照[28]。
2 结果与分析
2.1 体外分析XppI是否具有肽基脯氨酰顺反异构酶(PPIase)活性 为分析Xoo基因组是否编码PPIase,利用大肠杆菌PPIase SlyD(NP_417808.1)搜索Xoo蛋白组,共获得了2个同源蛋白,XppI和XopAZ。XopAZ为预测的Ⅲ型效应蛋白,XppI功能未知。为验证XppI是否为PPIase,首先在大肠杆菌中表达并纯化XppI蛋白(图1-A);然后利用α-糜蛋白酶耦联法[25]测定其PPIase活性。如图1-B所示,XppI蛋白存在时,反应产物的吸光值(A390)显著升高;但BSA存在时,吸光值没有显著变化,这表明XppI具有PPIase活性。
2.2XppI对Xoo生长的调控作用 为了分析XppI是否调控Xoo的生长繁殖与致病力,首先构建了xppI的突变体ΔxppI及其互补菌株C-ΔxppI。为了更好地分析,野生型PXO99A和ΔxppI也转入空载体pHMⅠ。比较3个菌株(PXO99A-pHMⅠ、ΔxppI-pHMⅠ和C-ΔxppI)在PSA液体培养基中生长情况。结果显示,野生型、突变体及互补菌株生长没有显著差异(图2-A)。由于细菌在不同类型培养基上的生长情况可能不同,将3种菌株梯度稀释后分别点在丰富性培养基PSA和基本培养基M4M上进行生长对比实验。结果如图2-B所示,这3个菌株在PSA和M4M固体培养基上的生长同样没有明显差异。因此,正常情况下XppI不调控Xoo生长。
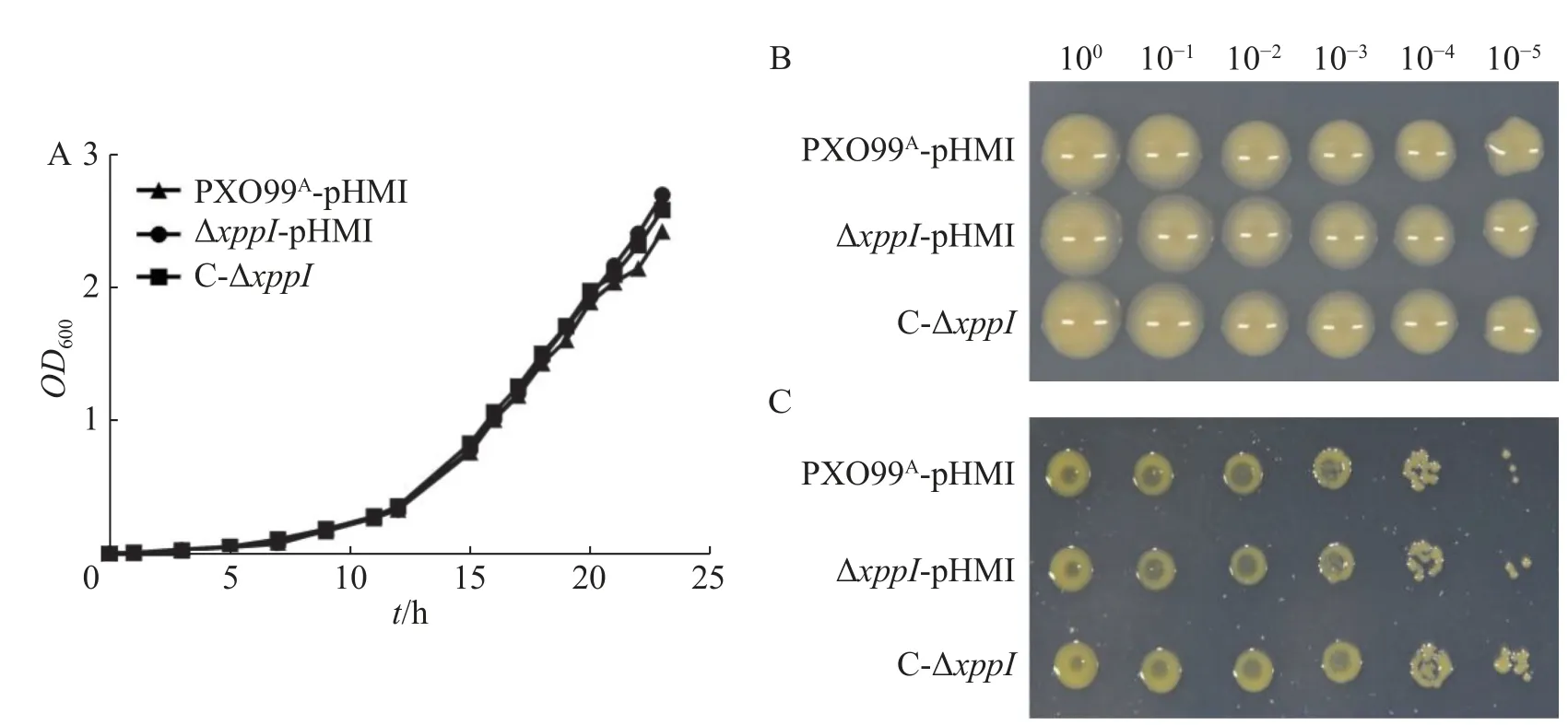
图2 XppI不调控Xoo的生长
2.3xppI突变对Xoo致病力的影响 PPIase调控多种蛋白构型变化,可能影响病原菌的致病力。因此将野生型、突变体和互补菌株接种水稻叶片,14 d后的病斑表型如图3所示。与野生型相比,xppI突变菌株致病力显著降低,互补xppI后,部分恢复了致病力,说明XppI正调控Xoo的致病力。
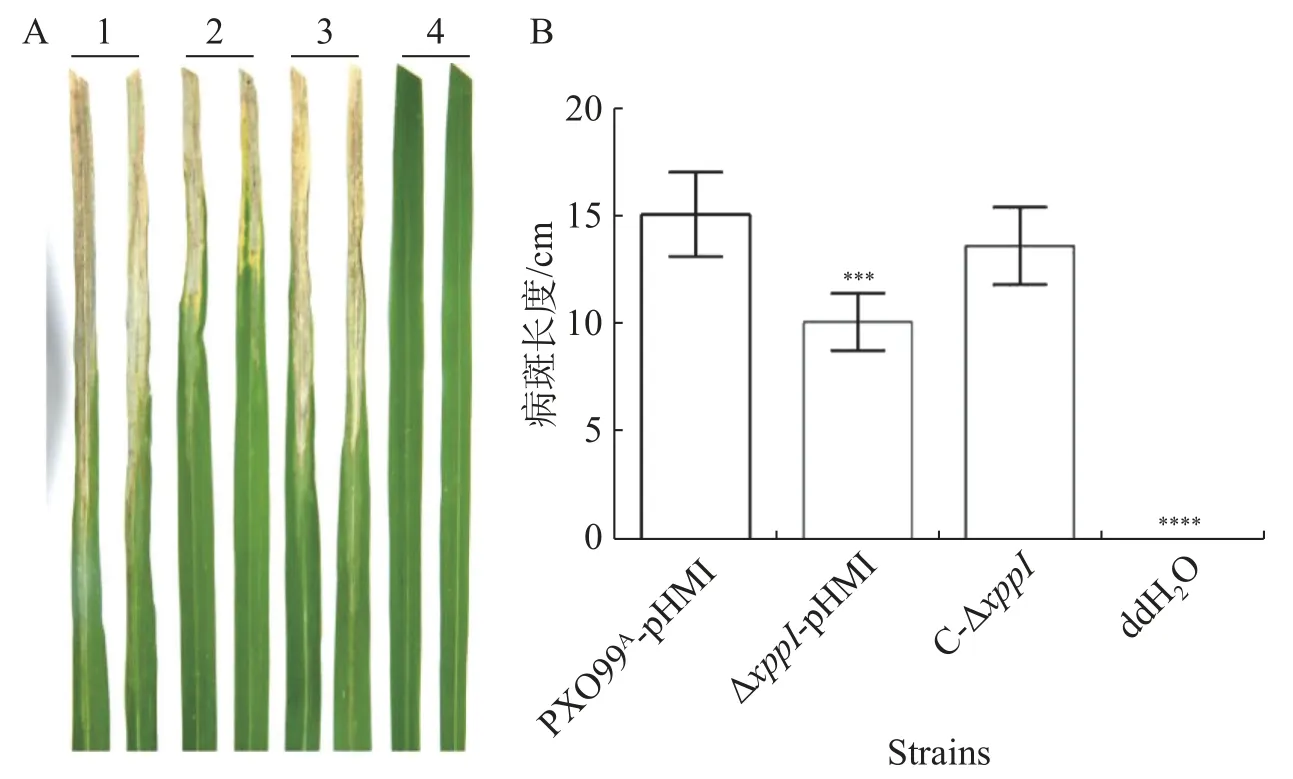
图3 XppI调控Xoo致病性
2.4xppI突变对Xoo运动能力的影响 病原菌的运动能力是其致病的重要决定因素,在侵染初期具有重要作用[29-30]。通过细菌游动性和蠕动性实验分析,发现野生型、突变体和互补菌株的运动能力均无明显区别(图4),说明XppI并不调控细菌鞭毛和菌毛的运动能力。
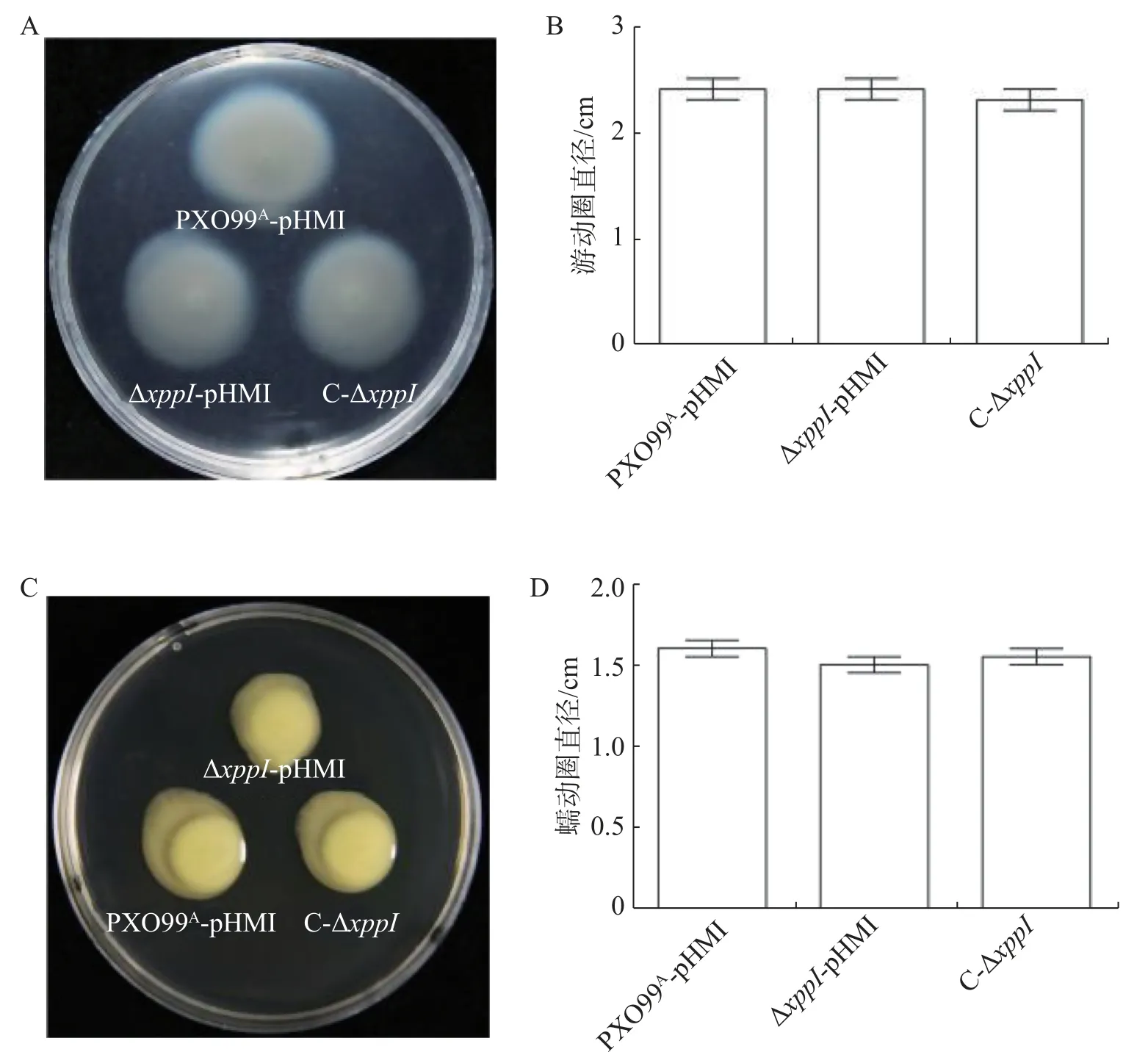
图4 xppI突变不影响Xoo的运动能力
2.5xppI突变对Xoo胞外酶活性的影响 病原菌分泌的胞外酶可降解植物细胞壁,有利于病原菌的成功入侵[31]。通过比较xppI突变体菌株、互补菌株及野生型菌株各种胞外酶活性发现,xppI突变并没有引起这些胞外蛋白酶、淀粉酶和纤维素酶活性变化(图5),由此推测XppI并不通过调控胞外酶的活性或分泌来影响Xoo的致病力。

图5 xppI突变不影响多种胞外酶的活性
2.6xppI突变对Xoo抗氧化能力的影响 氧化-抗氧化系统在植物与病原菌的互作过程中具有重要作用。活性氧(reactive oxygen species, ROS)在植物的生长和免疫方面均具有重要作用,植物在病原菌入侵的质膜附近会产生高浓度的ROS来毒害病原菌,并引发一系列防御反应,同时病原菌也进化出了降解酶来降低高浓度活性氧的影响[32]。为探究XppI是否参与氧化胁迫响应,分别用0、80 、100 、120 mmol·L-1的H2O2处理菌液,观察生长情况。随着H2O2浓度的增强,野生型、突变体和互补菌株的抗氧化胁迫能力均呈现降低的趋势,但是突变xppI后抗氧化胁迫能力明显降低,互补xppI后抗氧化胁迫能力有所回升,但仍略低于野生型(图6)。这说明XppI与病原菌的抗氧化胁迫响应有关。

图6 xppI突变降低Xoo抗氧化能力
3 讨 论
本研究旨在探究XppI在Xoo中的功能。通过生物信息学预测XppI为肽基脯氨酰顺反异构酶,并通过糜蛋白消化实验验证了XppI具有肽基脯氨酰顺反异构酶活性(图1)。在大肠杆菌中,肽基脯氨酰顺反异构酶SlyD影响双组份调控系统活性,slyD缺失降低耐酸性和耐渗透压能力,从而降低了大肠杆菌对环境的适应能力[33]。在酿酒酵母中,肽基脯氨酰顺反异构酶Fpr3与蛋白磷酸酶1相互作用,影响酵母的生长速率[34]。在人细胞中,肽基脯氨酰顺反异构酶Pin1是糖尿病血管疾病关键通路的共同激活因子,可通过诱导促氧化适配器p66的线粒体易位引起线粒体氧化应激,并参与p66依赖的ROS产生,触发有害途径并导致血管并发症[35]。在Xcc8 004中,肽基脯氨酰顺反异构酶MipXcc是周质折叠因子,负责胞外蛋白酶PrtA的正确折叠,突变mipXcc后Xcc几乎丧失胞外蛋白酶[36]。此外,延伸因子LepA也具有脯氨酰异构酶活性,通过异构化核糖体L11蛋白、促进GTP的水解[37]。肽基脯氨酰顺反异构酶的调控功能多样,在细菌生长、抗胁迫、抗氧化和胞外酶合成等方面发挥重要作用。
为探究Xoo中肽基脯氨酰顺反异构酶XppI的具体功能,本研究从细菌的生长、胞外酶活性、抗氧化能力等方面进行了研究,发现xppI基因缺失对于菌体本身的生长、运动性和胞外酶活性无显著影响(图2,图4和图5),与Xcc和酵母中的表型不同[35-36],表明不同PPIases可能调控不同蛋白的构型变化进而调控不同的细胞活动。xppI缺失导致Xoo抗氧胁迫能力的降低(图6),降低Xoo的致病力(图3),这与Pin的功能类似[35]。因此,XppI可能通过其PPIase活性、调控Xoo响应宿主活性氧胁迫,从而间接调控Xoo的致病力。
在植物与病原微生物互作的过程中,植物的免疫系统会响应被入侵部位的活性氧信号,来抑制病原菌的入侵;与此同时植物病原菌需要清除活性氧,来破坏植物防卫反应的信号传递并降低活性氧对自身的毒害作用[38]。活性氧的清除主要依靠超氧化物歧化酶和过氧化氢酶等清除酶的作用,XppI可能直接或间接调控这些酶的活性。下一步将寻找XppI的作用靶标,明确XppI的具体调控通路及作用机制。

