Plackett-burman 法优化荞麦多糖提取工艺及体外抗氧化活性研究
张志威,周文喜,孟晶晶,秦雪姿,倪 娜,王 华
(1.内蒙古民族大学,内蒙古通辽 028043;2.通辽市农牧科学研究所,内蒙古通辽 028000)
荞麦是一年生草本植物,又名乌麦、三角麦等,目前有2 个栽培品种,分别是甜荞(F.esculentum)和苦荞(F.tataricum),分布范围广泛,栽培历史悠久[1-2]。内蒙古是荞麦的主产区之一,通辽地区的荞麦种植面积居全区首位,种植面积为20.48 khm2,总产量0.20 亿kg,主要集中在库伦旗,产量约占全国总产量的1/3。另外,荞麦在奈曼旗和科尔沁左翼后旗等地也有不小的种植面积和产量[3]。
据已知数据,荞麦中谷蛋白含量低,主要蛋白质是球蛋白,必需氨基酸中赖氨酸含量较高,蛋氨酸含量低,膳食纤维含量也极为丰富,与普通稻米相比,可以高出10 倍以上,并且荞麦比普通谷物含有更多种类和含量的微量元素[4]。荞麦不仅营养丰富,还富含多糖、黄酮、糖醇等生物活性物质,并具有抗氧化、降脂、抑菌、抗炎等生物功能活性[5-10]。
目前,对于荞麦的研究绝大多数都集中在黄酮类物质和蛋白质,对多糖的研究鲜有报道。因此,试验选用通辽当地广泛种植的品种——通荞3 号为研究对象,采用Plackett-burman 试验和Box-behnken试验优化荞麦多糖提取工艺,对其体外抗氧化能力进行了相关研究。以期为通辽地区荞麦资源的进一步开发和利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
荞麦(通荞3 号),通辽市农牧科学研究所提供。将种子研磨过筛,置于4 ℃冰箱中备用。
石油醚(60~90 ℃)、无水乙醇,均为分析纯,天津大茂试剂有限公司提供;中性蛋白酶(50 000.0 U/g),北京索莱宝科技有限公司提供;果胶酶(≥50.0 U/g)、纤维素酶(≥15 000.0 U/g),国药集团化学试剂有限公司提供;DPPH 自由基清除能力试剂盒、总抗氧化能力试剂盒(FRAP 法)、总抗氧化能力试剂盒(ABTS 法),南京建成生物工程研究所提供。
1.2 仪器与设备
XM-P30H 型无级调功超声波清洗机,小美超声仪器(昆山) 有限公司产品;RE-2000B 型旋转蒸发器,上海亚荣生化设备仪器有限公司产品;5804R型高速冷冻离心机,德国艾本德股份公司产品;Infinite M200 型多功能酶标仪,瑞士帝肯公司产品;SA224S 型电子天平,赛多利斯科学仪器(北京) 有限公司产品;冷冻干燥机,北京博医康实验仪器有限公司产品。
1.3 试验方法
1.3.1 荞麦多糖提取流程
干燥荞麦粉→石油醚回流脱脂→干燥→80%乙醇回流脱色→干燥→加酶和适量蒸馏水置于超声波清洗机→离心→上清液减压浓缩→离心→取沉淀,加适量蒸馏水溶解→糖液减压浓缩→-20 ℃预冷,-80 ℃冷冻→真空冷冻干燥→荞麦粗多糖。
1.3.2 荞麦多糖的含量测定及计算
荞麦多糖测定采用苯酚- 硫酸法,依据相关行业标准进行试验操作[11],绘制标准曲线。得线性回归方程Y=0.870 8X-0.007 2,R2=0.999 3。
1.3.3 荞麦多糖得率计算
取一定量样品液按照上述试验步骤操作。重复3 次取平均值。根据标准曲线测定吸光度,按照下列公式计算荞麦多糖得率。
1.4 单因素试验设计
准确称取苦荞粉5.0 g,放入200 mL 锥形瓶中,在其他条件相同的情况下,依次采用不同中性蛋白酶添加量、纤维素酶添加量、果胶酶添加量、料液比、pH 值、提取温度、超声波功率进行提取工艺优化,分析不同试验条件对多糖得率的影响。
1.5 Plackett-burman 试验设计
在单因素试验的基础上,以荞麦多糖得率为响应值,使用Design Expert.V 8.0.6.1 进行Plackettburman 试验的设计试验设计。
Plackett-burman 试验因素与水平设计表1。
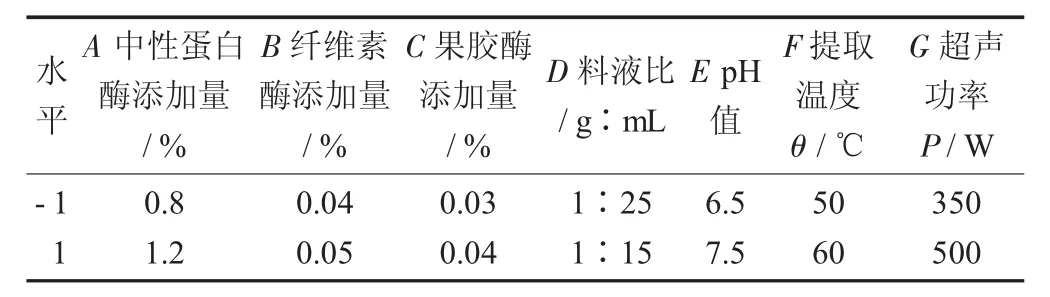
表1 Plackett-burman 试验因素与水平设计
1.6 最陡爬坡试验设计
据上述试验选出显著因素,观察其正、负效应,设计合理的步长,增加试验的密集度,从而获得最佳提取工艺区域的方法,将此最佳结果作为响应面试验的中心点展开试验[12]。
1.7 响应面试验设计
根据上述试验结果,采用Design Expert.V 8.0.6.1进行Box-behnken 试验设计,荞麦多糖得率作为响应值,设计各因素及其对应水平。
Box-behnken 试验因素与水平设计见表2。
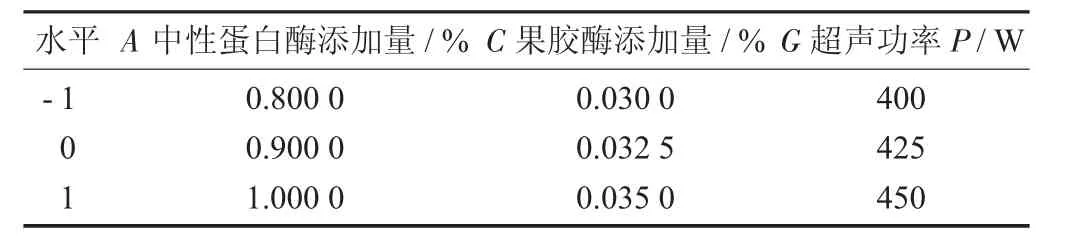
表2 Box-behnken 试验因素与水平设计
1.8 荞麦多糖体外抗氧化试验设计
1.8.1 荞麦多糖对DPPH 自由基清除能力的测定
根据教小磐等人[13]的试验方法稍加改动。待测样品于波长517 nm 处测定吸光度,并根据以下公式计算DPPH 自由基清除率。
式中:Ax——不同多糖溶液吸光度;
A0——对照溶液吸光度。
1.8.2 荞麦多糖对ABTS+自由基清除能力的测定
参考沈成龙等人[14]的方法适当调整,待测样混匀后置于室温反应6 min,于波长405 nm 处测定吸光度,根据以下公式计算ABTS+自由基清除率。
式中:Ax——不同多糖溶液吸光度;
A0——对照溶液吸光度。
1.8.3 荞麦多糖还原能力测定
Fe2+还原能力测定依据孙朋真等人[15]的方法稍作修改。配制不同质量浓度的荞麦多糖溶液于试管中,分别加入提前配制的FRAP 工作液,混匀后于37 ℃条件下孵育3~5 min,于波长593 nm 处测定吸光度。
2 结果与分析
2.1 单因素试验
2.1.1 中性蛋白酶添加量的确定
中性蛋白酶添加量对荞麦多糖得率的影响见图1。
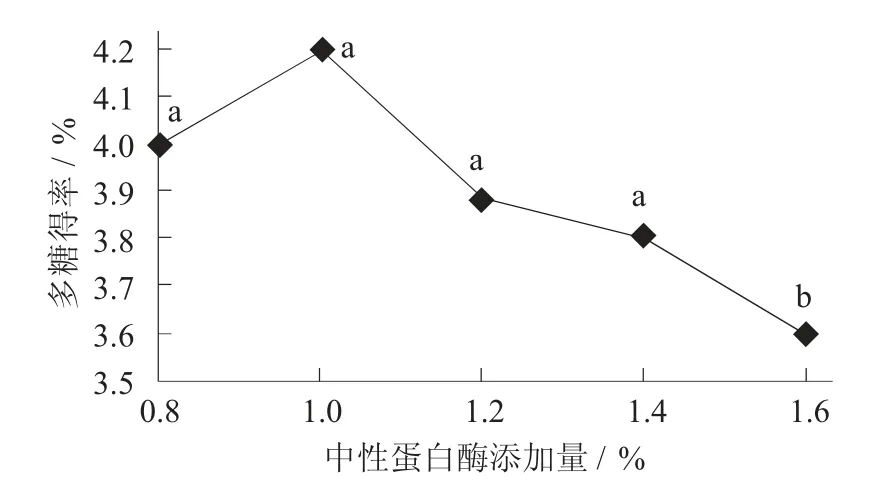
图1 中性蛋白酶添加量对荞麦多糖得率的影响
从多糖提取的角度来说,中性蛋白酶可以水解与多糖结合的蛋白质,提高得率[16]。随着加酶量增加,荞麦多糖提取率迅速上升,1.000%时达到最大值,多糖得率为4.200%,而后出现下降。可能是由于随着增加酶的添加量,加深酶解程度,酶解液黏度增加,导致多糖附着各类杂质形成沉淀,影响荞麦多糖的得率[17]。因此,中性蛋白酶添加量1.000%时为最为适宜。
2.1.2 纤维素酶添加量的确定
纤维素酶添加量对荞麦多糖得率的影响见图2。
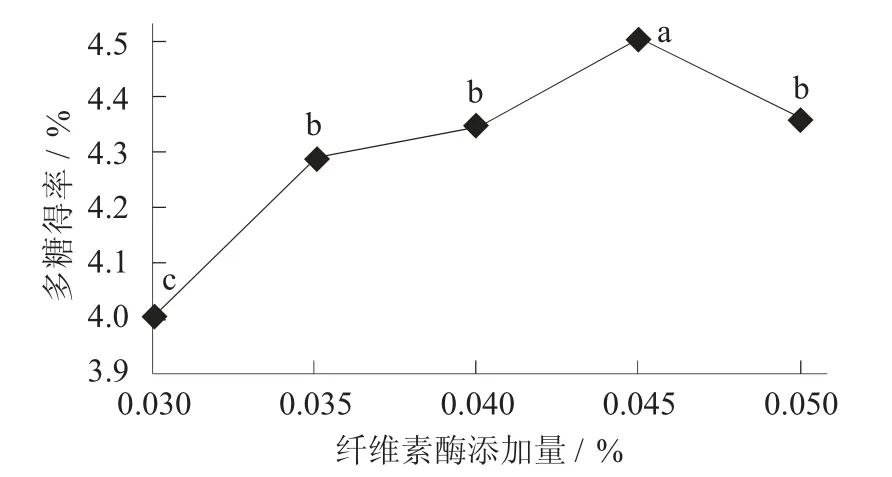
图2 纤维素酶添加量对荞麦多糖得率的影响
纤维素酶能破坏荞麦细胞壁,有利于提取荞麦多糖。随着添加量增加,得率先增加后减少。纤维素酶添加量为0.045%时,多糖得率最高;在0.045%~0.050%时,多糖得率开始下降,可能是因为酶分子饱和,不易结合底物,从而减缓了细胞壁的水解速度[18]。此外,过多的酶会增加体系黏度,阻碍荞麦多糖溶解,从而降低多糖得率。因此,纤维素酶添加量以0.045%为最宜,多糖得率为4.510%。
2.1.3 果胶酶添加量的确定
果胶酶添加量对荞麦多糖得率的影响见图3。
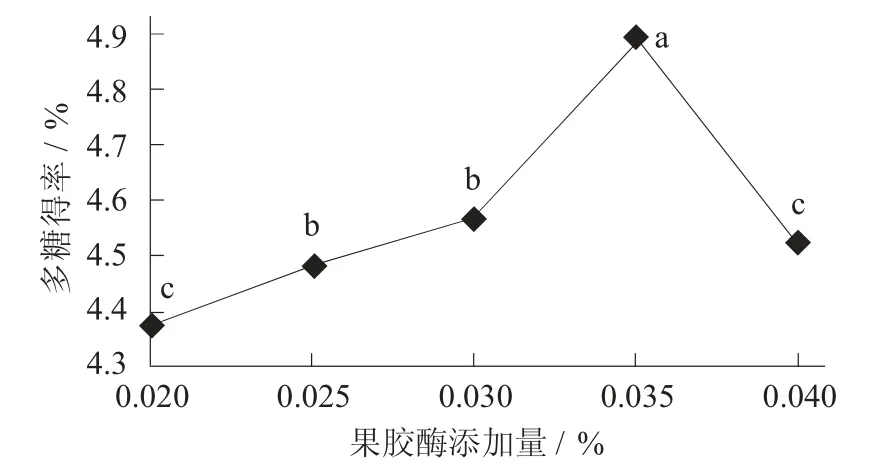
图3 果胶酶添加量对荞麦多糖得率的影响
由图3 可知,当果胶酶添加量到达0.035%时,荞麦多糖得率最高。在0.020%~0.035%时,荞麦多糖得率呈现上升趋势;当果胶酶添加量大于0.035%,荞麦多糖得率呈下降趋势。分析出现下降的现象,可能与上述出现的情况大致相同;也可能是体系中3 种酶的添加量变大时,导致各种酶之间出现拮抗作用[19]。果胶酶添加量为0.035%时,多糖得率为4.890%。
2.1.4 料液比的确定
料液比对荞麦多糖得率的影响见图4。
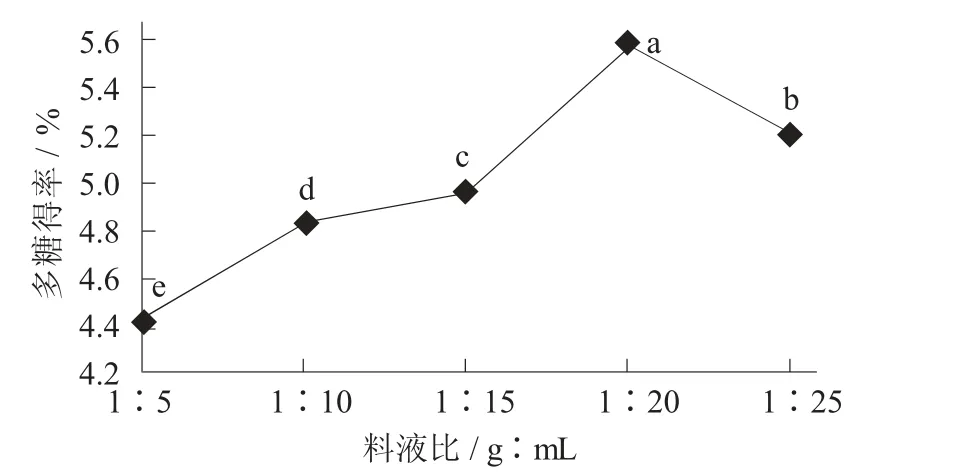
图4 料液比对荞麦多糖得率的影响
随料液比的变化,荞麦多糖得率呈先上升后下降的趋势,在料液比为1∶20(g∶mL) 时,出现得率峰值,为5.580%。分析其原因可能为1∶20(g∶mL) 之前,荞麦种子中的多糖未得到较好的溶解,才表现出多糖得率较低的现象。相反,当提取液剂量增大会导致提取率降低的现象。
2.1.5 pH 值的确定
pH 值对荞麦多糖得率的影响见图5。
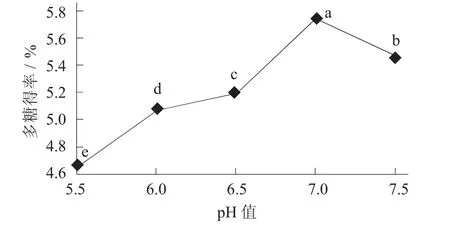
图5 pH 值对荞麦多糖得率的影响
由图5 可知,荞麦多糖得率随着pH 值的增大而增大,当pH 值达到7.0 时多糖得率最大,达到5.740%左右;当pH 值继续增大,得率不再增加,反而会有所下降。可能是因为在其最适pH 值条件下,体系中的复合酶更易与底物结合,有利于酶促反应的发生[20-21]。
2.1.6 提取温度的确定
提取温度对荞麦多糖得率的影响见图6。
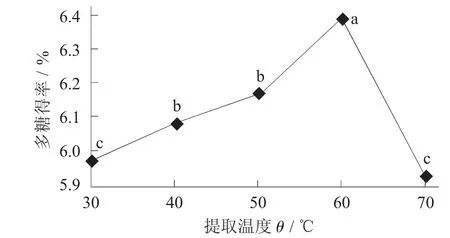
图6 提取温度对荞麦多糖得率的影响
由图6 可知,提取温度为30~60 ℃时,多糖得率随温度的升高而增大,在60 ℃时多糖得率出现峰值。在60 ℃以后,多糖得率又出现大幅度下降的现象,可能原因是溶剂中尚未溶解的荞麦粉末为60~70 ℃时发生糊化,高温影响多糖的结构和活性,导致多糖的变性;过高的温度导致体系中复合酶的变性失活,从而导致荞麦多糖的得率降低[22]。考虑到能源成本与复合酶活性问题,荞麦多糖的提取温度60 ℃时为最佳,此时荞麦多糖得率为6.400%。
2.1.7 超声功率的确定
超声功率对荞麦多糖得率的影响见图7。
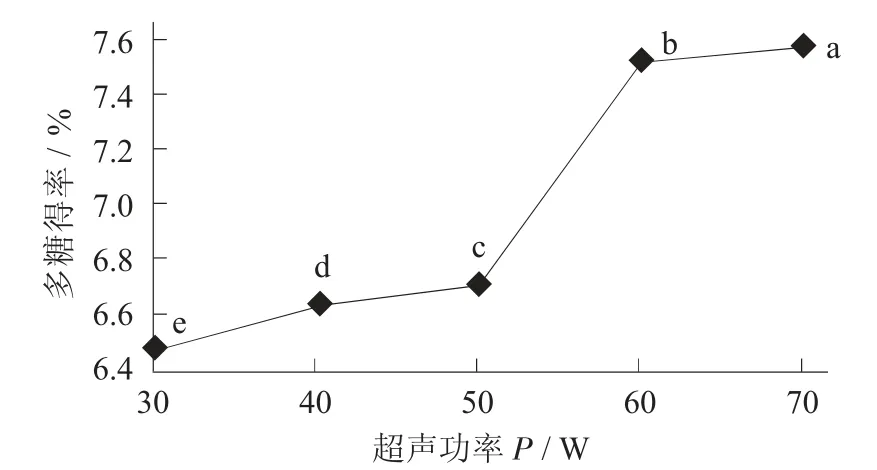
图7 超声功率对荞麦多糖得率的影响
由图7 可知,随着超声功率的不断增大,荞麦多糖的得率呈现先逐渐增大后降低的现象。在超声功率为425 W 时多糖得率为7.500%,是各水平超声功率下的最高值,说明此功率下多糖可以得到最充分的溶解;在超声功率为200~350 W 时,多糖得率随功率的增加而增加,原因是随着超声功率的加大,荞麦植物组织细胞壁逐渐破碎,荞麦多糖逐渐溶于溶剂当中[23];大于425 W 时,多糖得率出现下降趋势,可能是由于超声功率过大打断糖苷键,多糖结构被破坏,在后期收集中出现损失,从而导致荞麦多糖得率的下降[24]。因此,在超声提取荞麦多糖时,以超声功率425 W 较为适宜。
2.2 Plackett-burman 试验
采用Design Expert.V 8.0.6.1 对Plackett-burman试验设计与分析,对7 个影响因素进行显著性分析,以高水平(+1) 和低水平(-1) 表示,响应值为多糖得率。
Plackett-burman 试验设计及结果见表3,Plackett-burman 模型方差分析见表4。
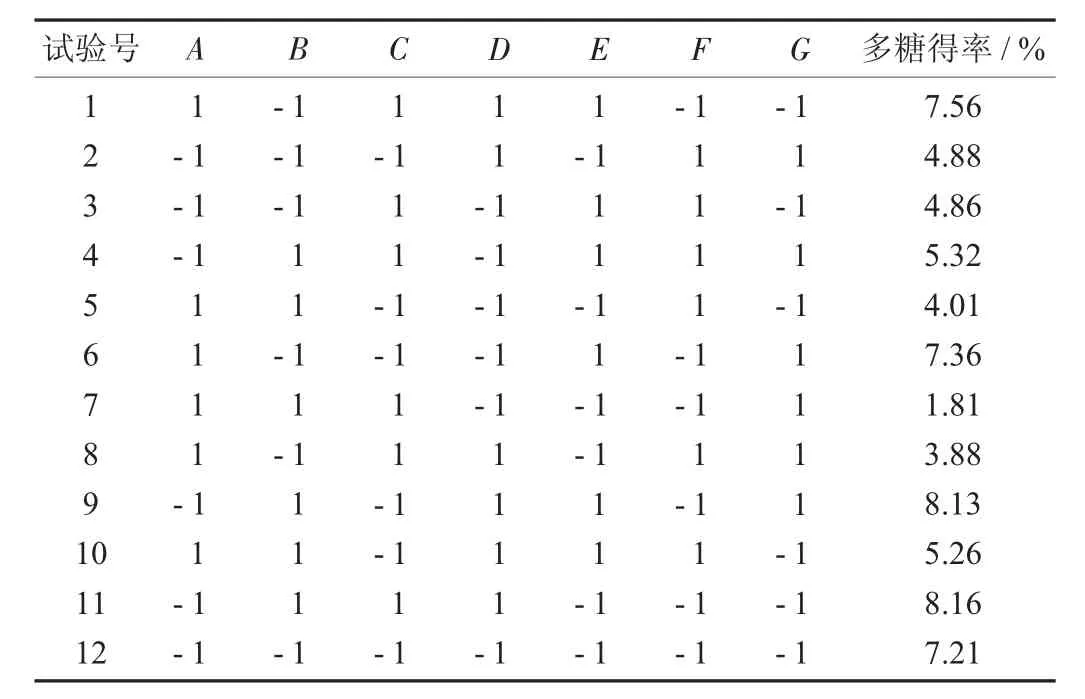
表3 Plackett-burman 试验设计及结果
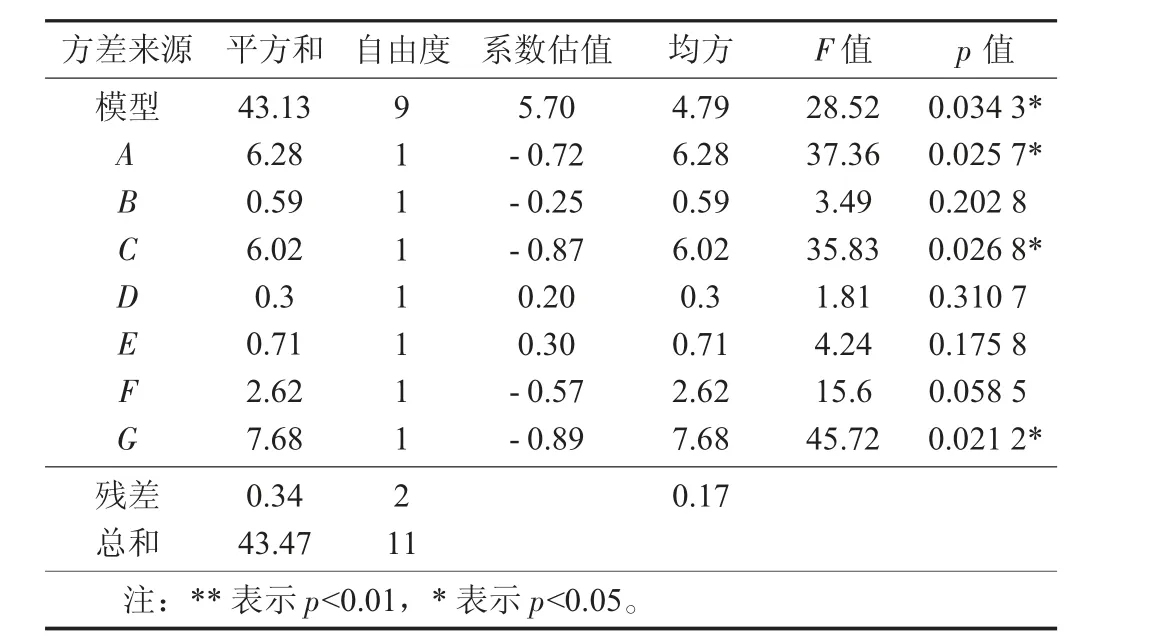
表4 Plackett-burman 模型方差分析
由表3 可知,中性蛋白酶添加量(A)、果胶酶添加量(C) 和超声功率(G) 对多糖提取影响显著(0.01<p<0.05)。因此,选择A、C、G作为最陡爬坡试验的考查因素。
2.3 最陡爬坡试验
从Plackett-burman 试验结果可知,A、C、G3个因素对试验结果影响较大且为负效应,因此适当降低各因素的水平,进行最陡爬坡试验,确定爬坡方向和合理步长,从而快速接近最佳区域[25]。
最陡爬坡试验设计与结果见表5。
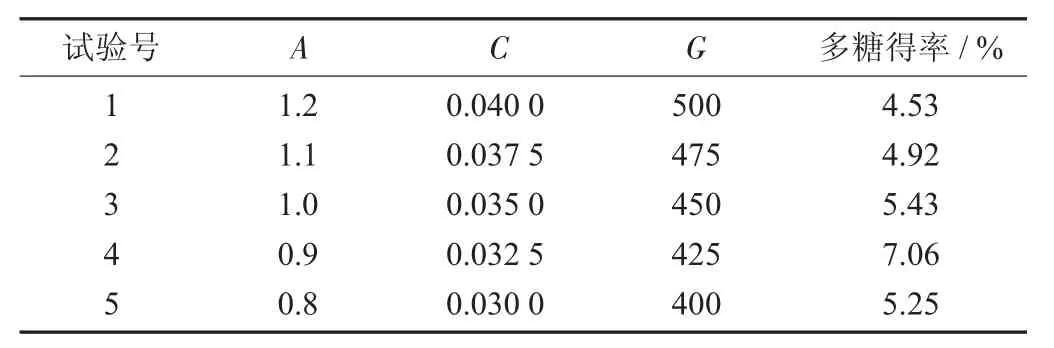
表5 最陡爬坡试验设计与结果
由表5 可知,最佳的组合为试验号4,即中性蛋白酶添加量为0.900 0%,果胶酶添加量为0.032 5%,超声功率为425 W,故以试验号4 的条件为Boxbehnken 试验设计的中心值。
2.4 响应面试验
响应面试验设计与结果见表6。
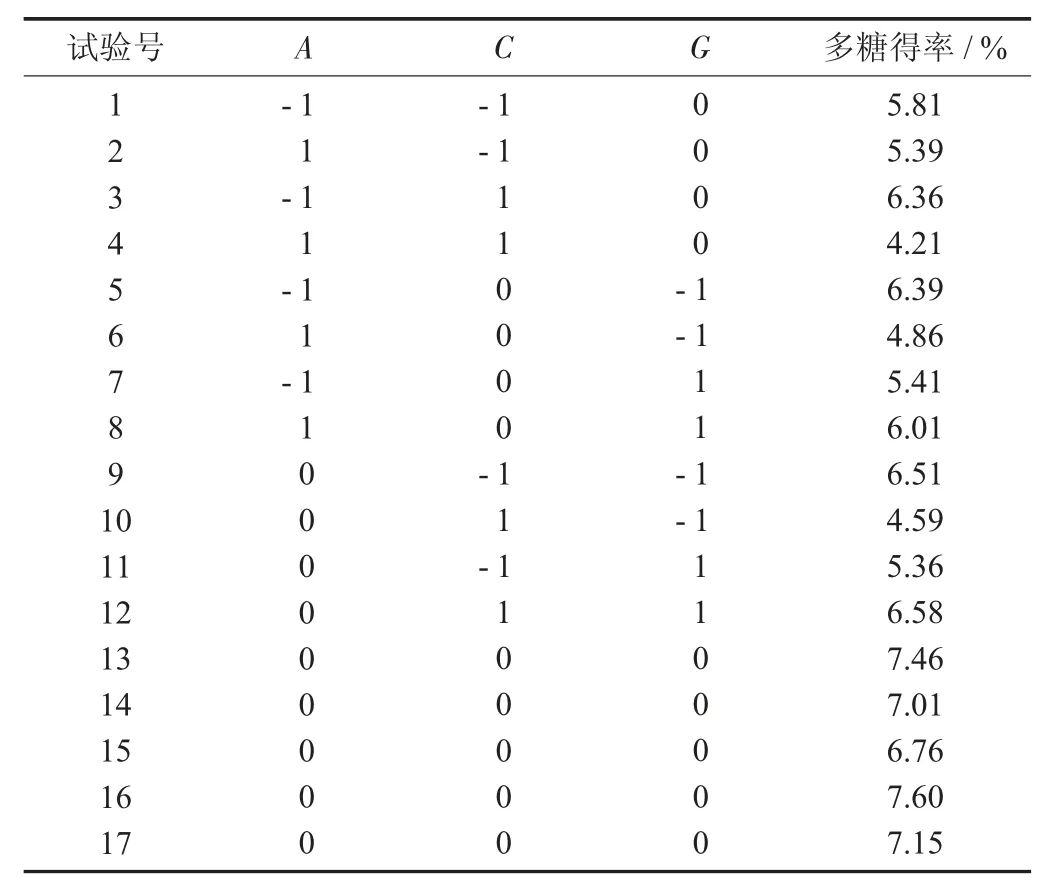
表6 响应面试验设计与结果
2.4.1 响应面试验方差分析
以Plackett-burman 试验和最陡爬坡试验结果为基础,利用Design Expert.V 8.0.6.1 软件进行响应面试验方差分析。
响应面试验方差分析见表7。
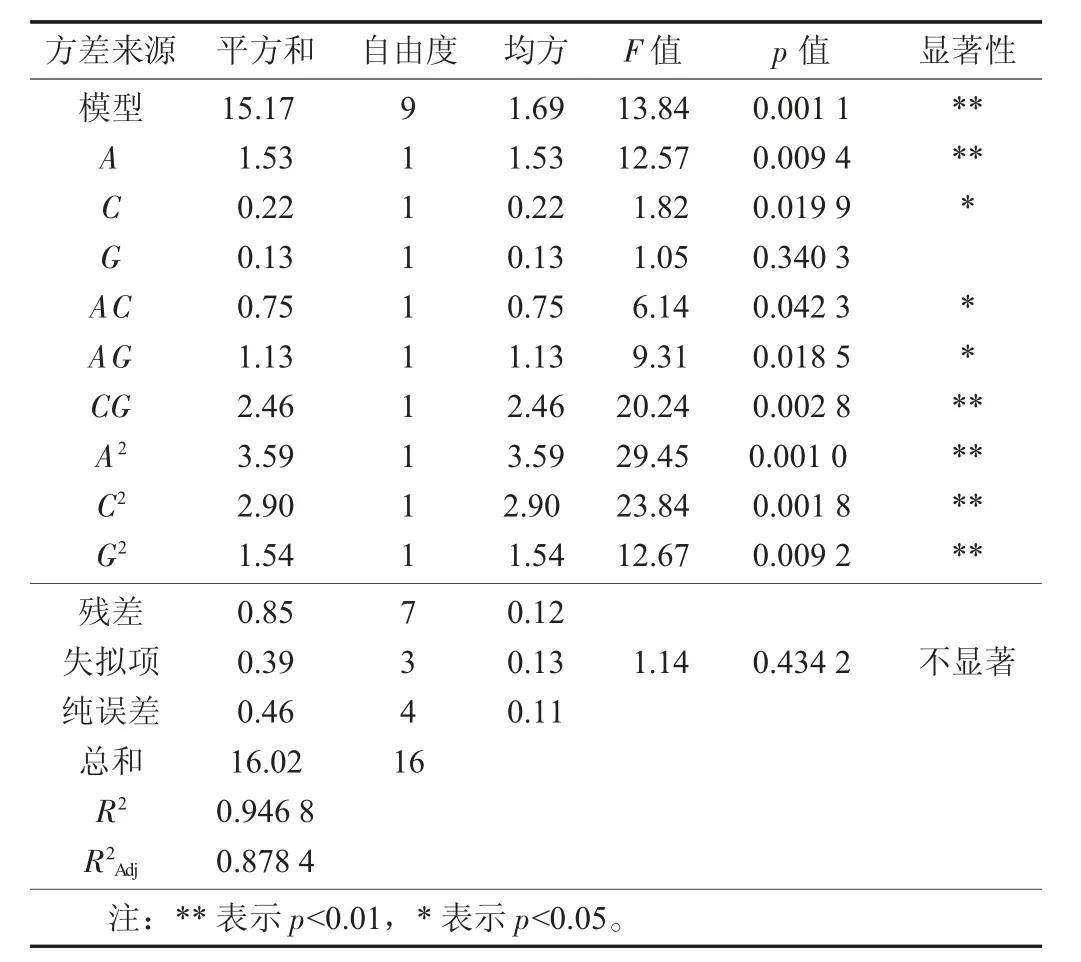
表7 响应面试验方差分析
分析数据得方程:
由表8 可知,A,CG,A2,C2和G2极显著,C,AC和AG显著。影响荞麦多糖得率因素先后顺序为A>C>B。总体分析,回归模型p<0.01,表明该模型极显著;同时,回归模型的失拟项不显著(p>0.05),R2Adj=0.878 4,说明该模型能解释87.84%的响应值变化,可用于超声波辅助复合酶法提取荞麦多糖提取工艺优化。
2.4.2 两因素交互作用影响提取工艺的响应面分析
做出响应曲面,分析中性蛋白酶添加量(A)、果胶酶添加量(C)、超声功率(G) 对荞麦多糖得率的影响。
中性蛋白酶添加量、果胶酶添加量交互作用对多糖得率的响应面和等高线见图8,中性蛋白酶添加量、超声功率交互作用对多糖得率的响应面和等高线见图9,果胶酶添加量、超声功率交互作用对多糖得率的响应面和等高线见图10。
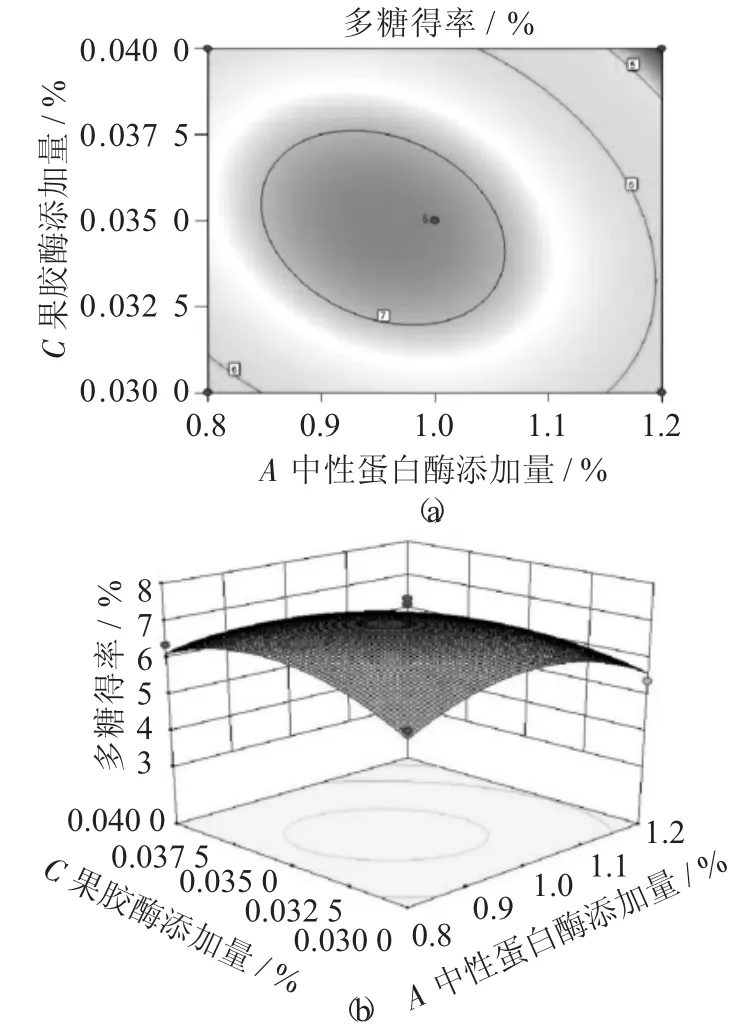
图8 中性蛋白酶添加量、果胶酶添加量交互作用对多糖得率的响应面和等高线
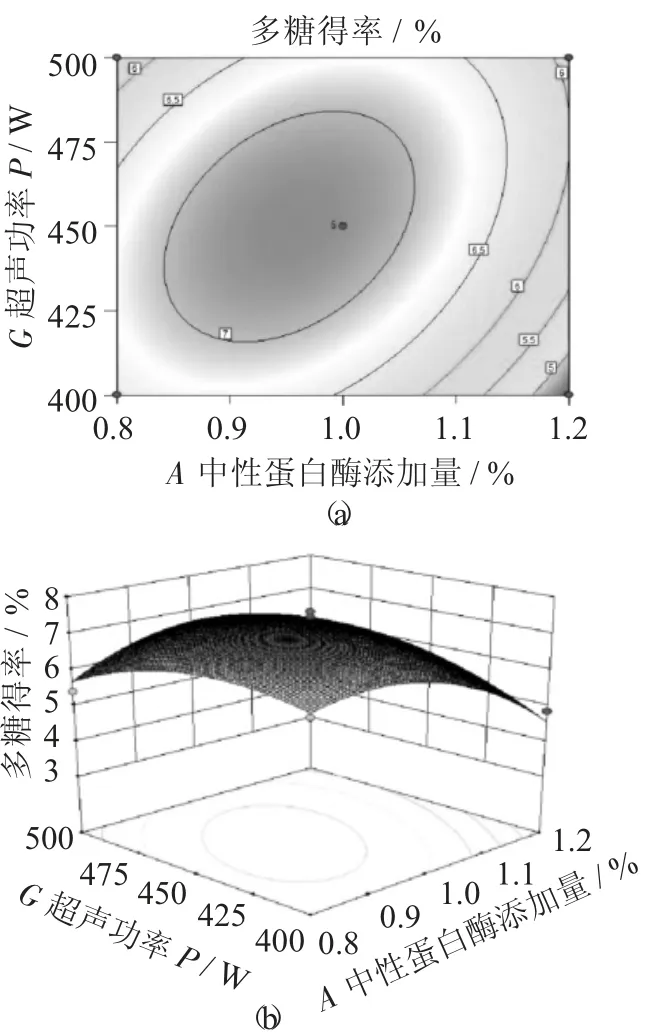
图9 中性蛋白酶添加量、超声功率交互作用对多糖得率的响应面和等高线
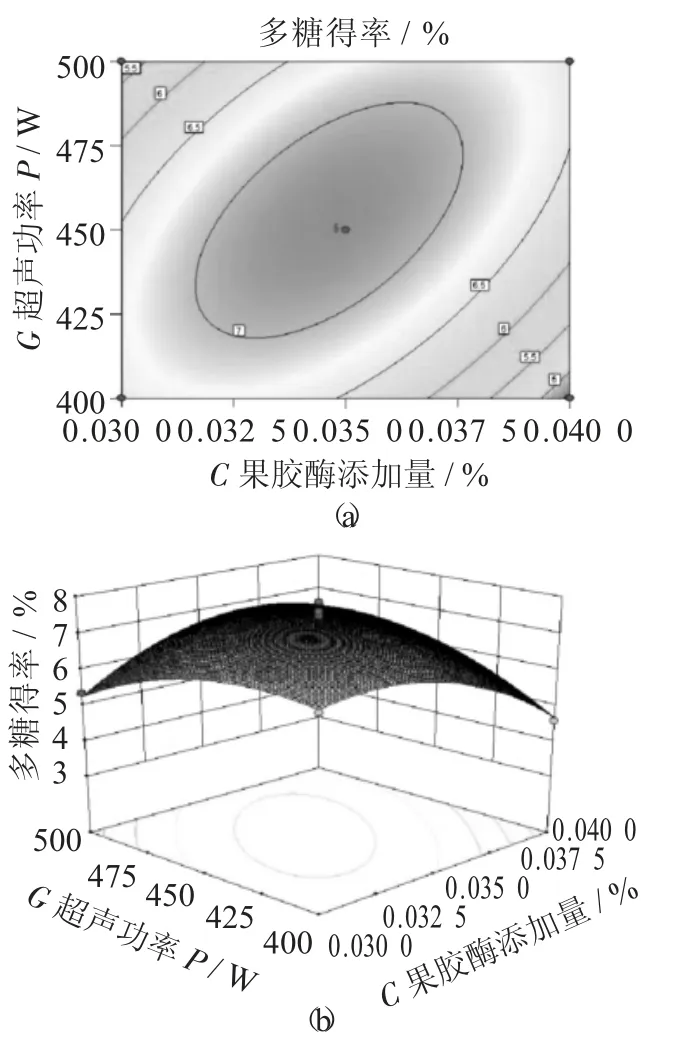
图10 果胶酶添加量、超声功率交互作用对多糖得率的响应面和等高线
由图8 ~图10 可知,响应面图评估三者之间交互作用对荞麦多糖得率的影响,曲面有极大值,工艺最优参数在试验范围内,等高线图近似于椭圆形,说明各因素交互作用较显著,与上表结果一致。
2.4.3 验证试验
以荞麦多糖得率为最终优化值,经Design Expert.V 8.0.6.1 软件预测可得最佳提取工艺为中性蛋白酶添加量0.900 0%,纤维素酶添加量0.045 0%,果胶酶添加量0.032 4%,料液比1∶20(g∶mL),pH值7.0,提取温度60 ℃,超声功率424 W,荞麦多糖得率为7.25%。为验证其可靠性,重复试验3 次,多糖平均得率为7.11%,相对误差为0.14%,与预测值基本一致。说明该模型可行,具有实际操作意义。
2.5 荞麦多糖体外抗氧化能力测定
2.5.1 荞麦多糖对DPPH 自由基清除能力
荞麦多糖及维C 对DPPH 自由基的清除作用见图11。
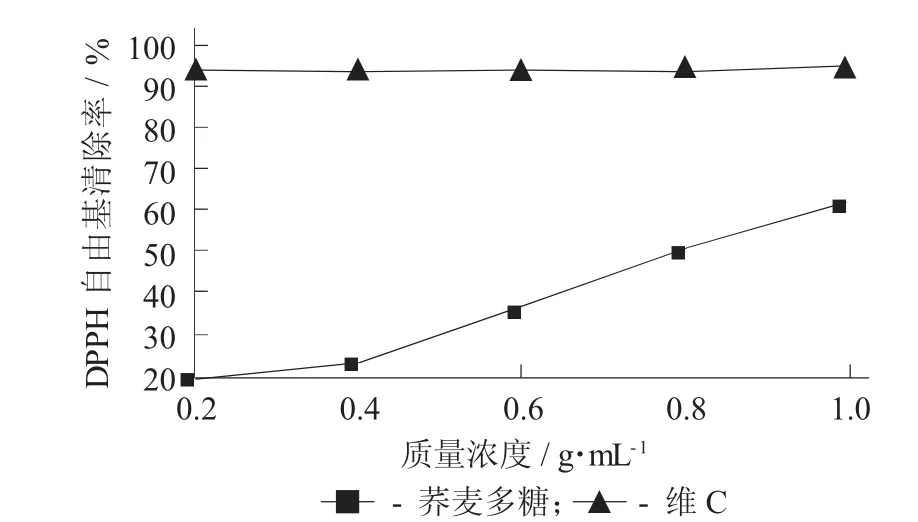
图11 荞麦多糖及维C 对DPPH 自由基的清除作用
由图11 可知,在0.2~1.0 g/mL 范围内,维C 对DPPH 自由基有较高清除能力,最高清除率可达94.89%。随着不断增加样品质量浓度,荞麦多糖对DPPH 自由基清除率呈上升趋势,在样品质量浓度为1.0 g/mL 时,荞麦多糖对DPPH 自由基清除率可以达到62.31%。整体来看,维C 对DPPH 自由基清除能力要强于荞麦多糖。
2.5.2 荞麦多糖对ABTS+自由基清除能力
荞麦多糖及维C 对ABTS+自由基的清除作用见图12。
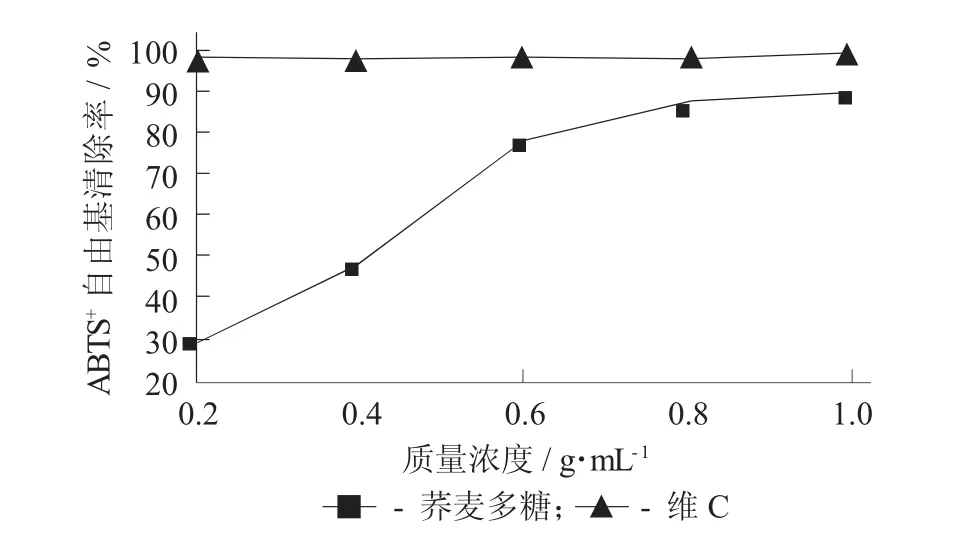
图12 荞麦多糖及维C 对ABTS+自由基的清除作用
由图12 可知,低于0.6 g/mL 时,荞麦多糖对ABTS+自由基清除率大幅度上升,在0.6~1.0 g/mL,荞麦多糖对ABTS+自由基清除率上升缓慢,在1.0 g/mL时,达到最大清除率88.78%。相较于不同质量浓度荞麦多糖和维C 对ABTS+自由基的清除作用,在1.0 g/mL 时荞麦多糖的清除率更接近维C。由此可知,荞麦多糖对于ABTS+自由基有着良好的清除作用。
2.5.3 荞麦多糖铁离子还原能力
荞麦多糖及维C的还原能力见图13。
由图13 可知,随着样品质量浓度升高,维C的还原能力快速增加;荞麦多糖在各个质量浓度条件下的还原力均较弱于维C。在样品质量浓度为0.8 g/mL 时,荞麦多糖和维C的还原能力最为接近,分别是76.28%和96.99%。荞麦多糖还原能力最大值出现在1.0 g/mL 时,为76.76%。
3 结论
通过单因素试验、Plackett-burman 试验、最陡爬坡试验和Box-behnken 试验优化超声波辅助酶法提取荞麦多糖的最佳提取工艺。结果表明,中性蛋白酶添加量0.900 0%,纤维素酶添加量0.045 0%,果胶酶添加量0.032 4%,料液比1∶20(g∶mL),pH 值7.0,提取温度60 ℃,超声功率424 W,此结果可充分验证该试验模型的可靠性。对通荞3 号多糖进行了体外抗氧化能力研究,结果表明虽然多糖清除自由基和还原能力弱于维C,但是荞麦多糖对DPPH 自由基和ABTS+自由基有明显清除能力,并且对铁离子具有一定的还原性。该研究为荞麦多糖提取工艺提供了技术参考,为进一步开发和利用通辽当地荞麦资源提供了理论依据。

