闽北风吹肉制成中微生物组成及多样性变化
范 俐,秦鑫宇,周聪麟,李 力
(武夷学院茶与食品学院,福建南平 354300)
闽北风吹肉(又称闽北腊肉) 是以新鲜猪肉为原料,经过腌制、风干等多道工序加工而成,香气浓郁、滋味鲜美、风味独特而深受广大消费者的喜爱[1]。风吹肉因水分较少而限制了有害微生物的滋生,保存期较长[2]。微生物发酵是影响风吹肉制品成熟度、口感风味的重要环节[3]。微生物对蛋白质、脂肪、碳水化合物进行降解[4-5],形成酸、醛、酮、酯、次黄嘌呤、短肽等物质,使腊肉制品呈现特殊的风味。
通过从家庭作坊式生产的风吹肉制品,结合高通量测序技术(High-throughput sequencing,HTS),研究闽北风吹肉风干过程中微生物菌群组成及多样性,查找影响风味的关键菌群。HTS 可快速、准确、全面地反映不同样品中微生物群落的组成,鉴定一些低丰度及不可培养的微生物[7],还可以提供实用的基因组成和相关分布[8]。董蕴等人[9]基于变性梯度凝胶电泳和MiSeq 高通量测序技术综合分析发现恩施地区腊肉中优势菌群主要是葡萄球菌属、嗜冷杆菌属和假交替单胞菌属。周莹等人[10]采用高通量测序技术对不同加工阶段的徽派腊肉中微生物进行分析,发现成熟中期和成熟结束的腊肉中主要优势菌为葡萄球菌、盐弧菌和放线菌。李彦虎[11]分析陕西传统腊肉制品中微生物多样性,发现环丝菌属、肉杆菌属、乳杆菌属等为优势细菌属。目前,对闽北风吹肉中微生物菌群的研究仍未见报道。
1 材料与方法
1.1 试验材料
采用自制传统闽北风吹肉进行试验。以长条新鲜冻猪肉(长30~40 cm,宽3~5 cm),共12 条,约10 kg,在常温洁净水中浸泡解冻3 h,沥干水分进行腌制。
腌制原料及用量见表1。

表1 腌制原料及用量/g
将处理的猪肉条放进铝盆中,以白酒涂抹均匀,加入老抽均匀涂抹,最后将食盐、白砂糖、十三香混合后倒入涂抹,揉搓15 min 左右,用保鲜膜封上盆口,放入4 ℃的冰箱中冷藏腌制4 d,腌制期间每隔1 d 翻一次肉,4 d 后用将肉挂在通风良好,干净卫生的环境中风干,风干16 d。
1.2 试验方法
1.2.1 样品采集
风吹肉风干期间,采集0,4,8,12,16 d 样品(五平行),用无菌锡纸包裹,在装入密封袋中,分别编号A,B,C,D,E,经液氮冷冻后,存于-80 ℃冰箱中,备用。
1.2.2 基因组DNA 抽提
风吹肉样品中总DNA 的抽取选用E.Z.N.A.Soil DNA Kit(Omega Bio-tek,Norcross,GA,U.S.),参照使用说明从样品中提取DNA。使用Qubit 2.0 分光光度计定量DNA,并通过0.8% 琼脂糖凝胶电泳确定DNA 提取的完整性。
1.2.3 PCR 扩增
以稀释后的基因组总DNA 为模板,靶向扩增细菌16S rRNA 基因,扩增引物分别为27F/1492R。选用真菌特异性引物ITS1/ITS2 对ITS 区域进行扩增。PCR 反应采用3 份(3 个平行) 20 μL 的混合液,其中包括5×FastPfu 缓冲液4 μL、2.5 mmol/L dNTPs 2 μL、2 个引物(5 μmol/L) 各0.8 μL、0.4 μL FastPfu 聚合酶、10 ng 的模板DNA、补水至20 μL。PCR 反应条件:预变性为95 ℃,5 min,然后95 ℃,30 s;58 ℃,30 s;72 ℃,45 s,共27 个循环,72 ℃退火10 min,于4 ℃条件下保存。用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司) 切胶回收PCR 产物,Tris-HCl 洗脱,并进行质量检测及建库。
1.2.4 测序数据处理
使用UPARSE version 7.1(http://drive5.com/uparse/) 以98.65%的相似性截断值对OTU 进行聚类,利用UCHIME 识别并删除嵌合序列。采用RDP 分类器(http://rdp Classifier) 分析各16S rRNA 基因序列与Silva(SSU132) 16S rRNA 数据库的系统进化关系,置信阈值为70%。扩增子测序由上海百泽龙生物技术有限公司完成。使用Biozeron 云平台(http://www.cloud.biomicroclass.com/CloudPlatform) 对微生物进行α 多样性和β 多样性分析。
2 结果与分析
2.1 高通量测序数据统计与分析
按照98.65% 相似性对非重复序列(不含单序列) 进行OTU 聚类,在聚类过程中去除嵌合体,生成OTU 表格。
细菌和真菌高通量测序结果统计见表2。

表2 细菌和真菌高通量测序结果统计/个
根据表2 可知,细菌中共获得7 870 个OTUs,涵盖16 个门,217 个属,683 个种;真菌中共获得5 957 个OTUs,涵盖3 个门,97 个属,189 个种。
样品中细菌(a) 和真菌(b) 群落共享和独有的OTU 的韦恩图分析见图1。
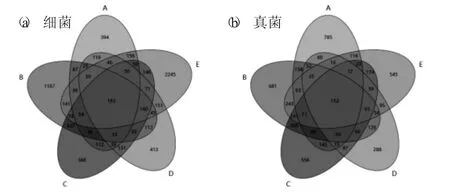
图1 样品中细菌(a) 和真菌(b) 群落共享和独有的OTU 的韦恩图分析
由图1 可知,各时期样品中细菌(a) 和真菌(b) 群落共享和独有的OTU 数目不同,说明不同时期样品中微生物分类有明显差异。
2.2 不同风干时期腊肉中微生物群落α 多样性分析
腊肉样品细菌(a) 和真菌(b) 群落α 多样性见表3。

表3 腊肉样品细菌(a) 和真菌(b) 群落α 多样性(a) 细菌
由表3(a) 可知,细菌中Chao1 和ACE 指数在风干A,B,C 期不断增大,说明在这3 个时期里,风吹肉中细菌数目和种类在不断增加;D 时期有所降低,E 时期指数又增大,可能E 时期一些耐盐菌恢复生长繁殖。Shannon 和Simpson 指数在A,B,E时期显著升高说明此时物种的丰度和均匀度很高。
由表3(B) 可知,真菌中Chao1,ACE,Shannon 和Simpson 指数与细菌中的变化相似,A,B,C,E 时期指数增大,说明风吹肉中真菌丰度和均匀度在提高,但总体低于细菌丰度和均匀度,与OTU 数据表结论一致。

(b) 真菌
2.3 样品中基于属水平的菌群组成
对风吹肉微生物中主要优势菌属(前20 位) 进行分析。
腊肉样品中优势细菌(a) 和真菌(b) 菌属(前20) 及其在样品中的相对丰度见表4。
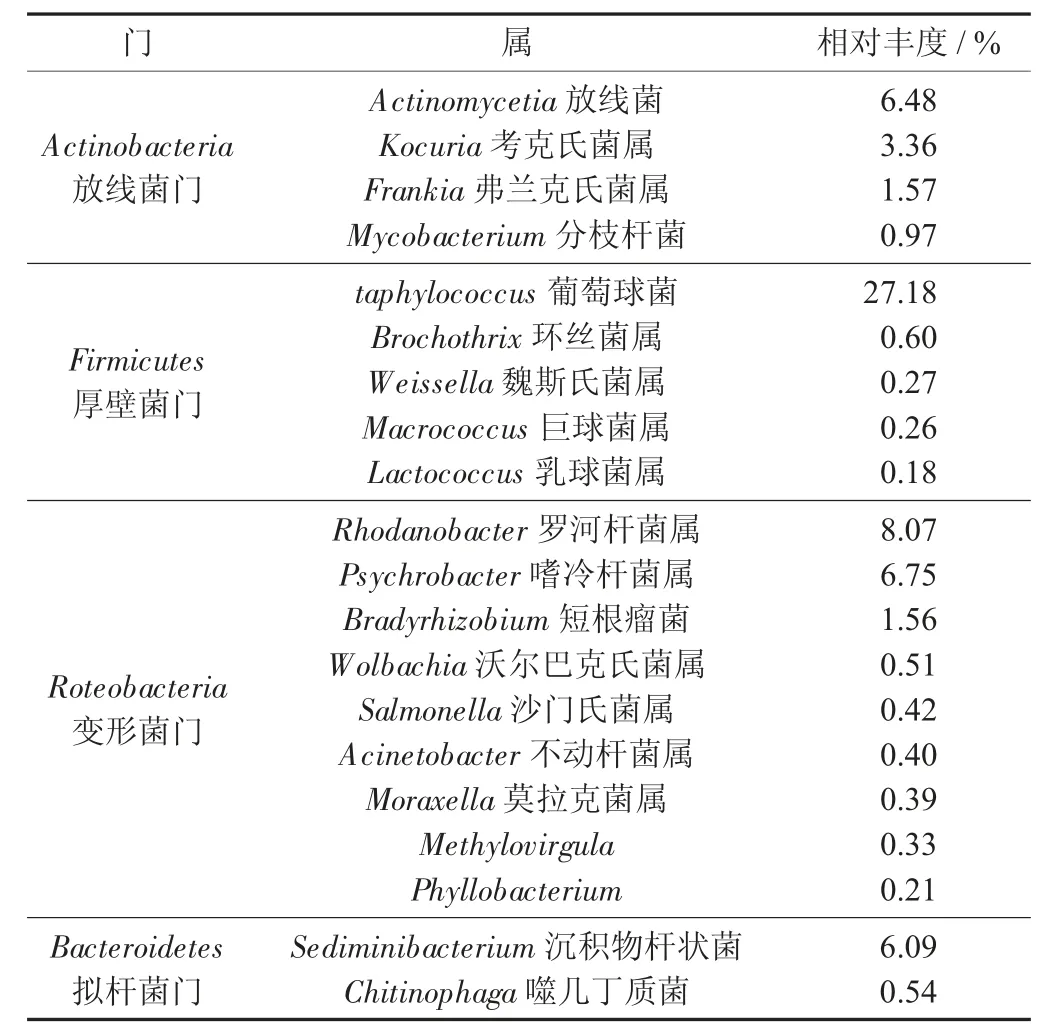
表4 腊肉样品中优势细菌(a) 和真菌(b) 菌属(前20)及其在样品中的相对丰度(a) 细菌
由表4 可知,细菌群落共检测出16 个门类,其中放线菌门、厚壁菌门、变形菌门、拟杆菌门占绝对优势。在属水平上,相对丰度大于1%的主要优势菌为放线菌(36.5%)、葡萄球菌属(27.2%)、罗河杆菌属(8.1%)、嗜冷杆菌属(6.7%)、沉积物杆状菌属(6.1%)、考克氏菌属(3.4%)、弗兰克氏菌属(1.6%)、短根瘤菌属(1.6%)。这结论与母雨等人[12]研究结果相同,即盘县火腿中发现葡萄球菌属为优势菌属;有些研究表明魏斯氏菌属(0.27%)、巨球菌属(0.26%)、乳球菌属(0.18%) 是腊肉发酵中重要菌属[7,13],但在研究中其含量较少,可能因环境及风干天数不同的条件影响。
真菌群落中共检测出3 个门类,排名前20 的菌属分属于子囊菌门和担子菌门,在属水平上,相对丰度大于1%的主要优势菌为德巴利氏酵母属(68.9%)、Kurtzmaniella(11.6%)、红酵母属(9.9%)、镰刀菌属(2.0%)、念珠菌属(2.0%)、交链孢属(1.3%),表明酵母菌为主要优势真菌,酵母菌属于兼性菌,在发酵时可吸收掉残存氧气,从而能够抑制腊肉氧化酸败,能阻止有害微生物的滋生,还对腊肉风味的形成有促进作用[14-17]。
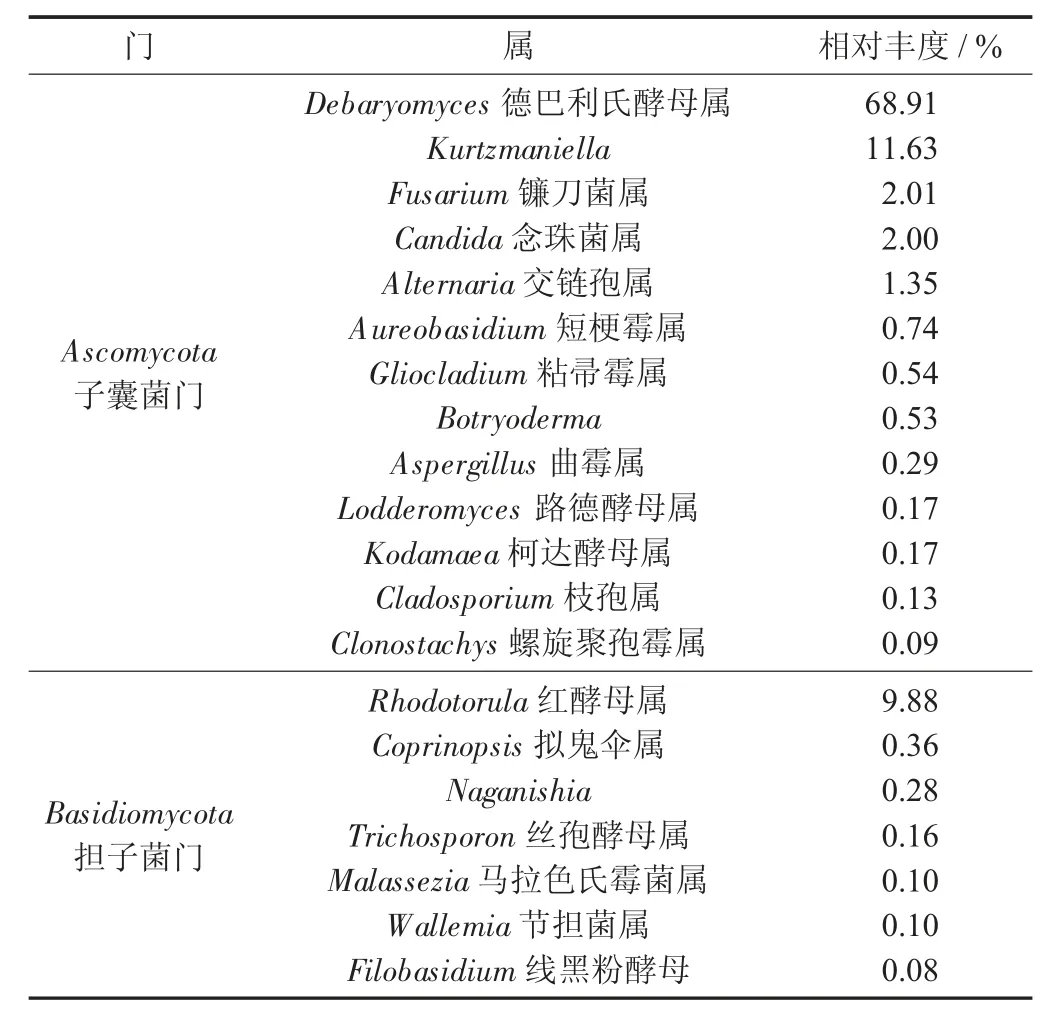
(b) 真菌
2.4 优势菌在属水平上的群落演替
为了揭示各时期样品中菌群丰度变化和群落动态演替规律,基于属分类水平,将样品中细菌和真菌相对丰度>1%的菌群绘制微生物群落分布柱形图。
不同时期腊肉样品中的细菌(a) 和真菌(b)物种分布见图2。
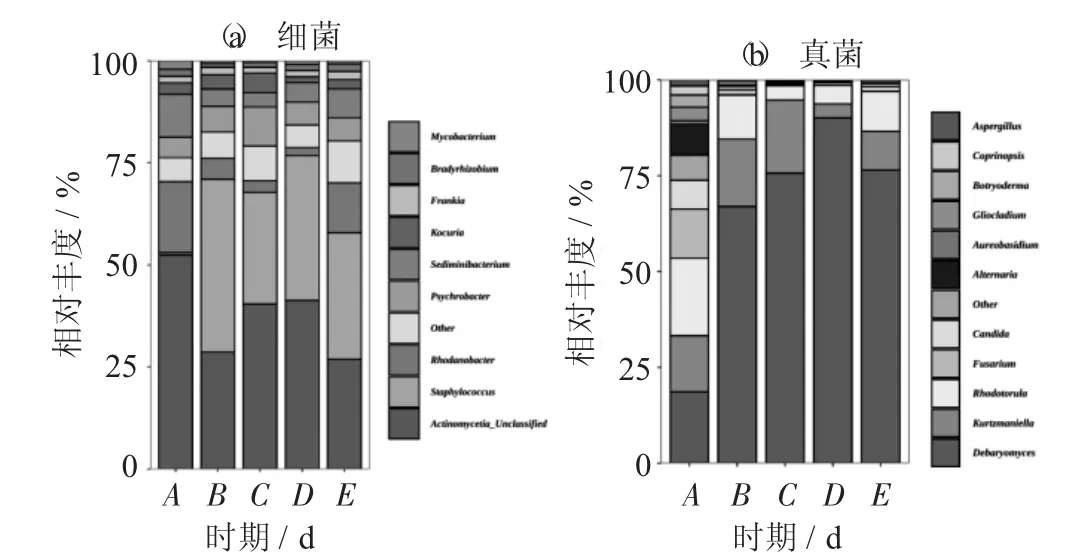
图2 不同时期腊肉样品中的细菌(a) 和真菌(b) 物种分布
由图2(a) 可知,在各时期的风吹肉样品中细菌群落演替比较明显。葡萄球菌属在风干的A 时期仅为0.6%,B 时期相对丰度达到42.6%,E 时期为31.0%;罗河杆菌属在A 时期样品中的相对丰度为25.6%,在B,C,D 这3 个时期中不断降低。说明葡萄球菌属、罗河杆菌属在风吹肉生产早期(1~4 d)有重要作用。
风干各时期中的真菌群落动态演替具有很强的可比性。由图2(b) 可知,A 时期群落多样性最大,B,C,D 期在不断减少,与前面Shannon 和Simpson指数相一致。其中,德巴利氏酵母菌属A 时期最低14.7%,D 时期最高90.1%,德巴利氏酵母菌可促进高级醇、乙酸酯和脂肪酸酯的生成[18]。Kurtzmaniella和红酵母属在整个过程中呈现出不规则的变化;A时期的镰刀菌属相对丰度为12.7%、念珠菌属为7.5%、交链孢属为8.0%,在后期风干过程中逐渐降低为零,可能与风吹肉含水量降低和盐分相对增加相关。
3 结论
采用高通量测序分析对闽北风吹肉中微生物多样性进行分析。结果表明,风吹肉中细菌共获得7 870 个OTUs,涵盖16 个门,217 个属,683 个种;真菌共获得5 957 个OTUs,涵盖3 个门,97 个属,189 个种。在5 个不同的风干时期都有各自独有的OTU,揭示了不同时期微生物群落的多样性。
风吹肉中的细菌主要优势菌门为放线菌门、厚壁菌门、变形菌门、拟杆菌门;优势菌属为放线菌属(Actinomycetia unclassified)、葡萄球菌属(Staphylococcus)、罗河杆菌属(Rhodanobacter) 以及嗜冷杆菌属(Psychrobacter);真菌主要优势菌门为子囊菌门和担子菌门;优势菌属为德巴利氏酵母属(Debaryomyces)、Kurtzmaniella及红酵母属(Rhodotorula)。从门水平和属水平来看,细菌的优势菌种多于真菌,α 多样性也发现细菌的群落多样性优于真菌,说明细菌在风吹发酵过程中比真菌发挥更重要的作用。

