SPP1在肾缺血再灌注诱导的急性肾损伤中的作用及机制
虞亘明,王鑫玮,骆金光,苏萧,陶怀祥,闻志远,关翰
1蚌埠医学院第一附属医院泌尿外科,安徽 蚌埠 233004;2蚌埠医学院慢性疾病免疫学基础与临床安徽省重点实验室,安徽 蚌埠233030
急性肾损伤(AKI)是一种常见的临床疾病,以肾小球滤过率突然下降为特征,表现为血清肌酐浓度升高或少尿,发生在各种临床环境中,包括败血症、肾毒性和急性心力衰竭[1,2]。在临床实践中,尽管AKI这一临床常见病受到高度重视,但仍是临床医生诊治的难题,临床上仍然无有效的方法治疗或预防急性肾损伤[3-5]。AKI具有严重的并发症,发病率和死亡率高,对健康构成巨大威胁[6,7]。主要并发症包括容量超载、电解质失衡、尿毒症和药物毒性。AKI发生时肾功能突然恶化,伴有含氮废物滞留、电解质和细胞外容量失调。临床表现为短时间内肾功能突然或持续下降,在分子水平上,AKI最常见的形式是急性肾小管坏死,其特征是肾小管上皮细胞死亡和一个或多个肾小管段功能障碍,严重者可发展至肾功能衰竭甚至死亡[8,9]。其病理生理机制涉及多种细胞机制,如肾实质细胞(上皮细胞和内皮细胞)功能障碍和免疫细胞浸润等[10-12]。肾缺血再灌注损伤(IRI)是肾脏在某些条件下经历缺血阶段再得到血液灌注,肾脏功能并未改善反而损伤加重的过程,也是引起急性肾脏损伤的主要原因[13,14]。AKI通过诱导肾小管上皮细胞和血管内皮细胞死亡破坏肾小管的结构和功能[15]。IRI的病理生理学非常复杂,涉及多个方面,包括管状上皮细胞的细胞代谢改变、钙超载、自由基生成、炎症和凋亡等最终导致终末期肾病[16]。分泌型磷蛋白-1(SPP1),也称为骨桥蛋白(OPN),是由人染色体4q22.1上编码的SPPL基因分泌的蛋白质,其与许多粘附受体结合基序相互作用,包括C端CD44v6结构域和凝血酶切割的N端整联蛋白结构域[17]。最近的研究表明SPP1是一种与肿瘤密切相关的细胞外基质蛋白,参与调节肿瘤细胞的侵袭、迁移、增殖、凋亡、和抑制血管生成[18,19]。然而,目前尚未见SPP1在AKI中的系统性研究报道,其在细胞和动物模型中的表达及意义也尚不明确。在我们的研究中,从GSE131454数据集中鉴定出,我们发现SPP1是与IRI相关性。本研究通过构建肾脏IRI大鼠模型及缺氧复氧细胞模型,观察SPP1表达变化,并SPP1在肾脏IRI中的作用。
1 材料和方法
1.1 一般材料
健康SD雄性大鼠12只,6~8周龄,体质量为180~200 g。饲养条件:恒温25 ℃,相对湿度50%,12 h昼夜节律,自由进食、饮水。大鼠适应性饲养1周后进行实验。本研究经蚌埠医学院第一附属医院伦理委员会批准通过(伦动科批字[2022]第066号)。
1.2 造模及分组
将12只大鼠随机分为IRI组和假手术组各6只。大鼠经麻醉后,固定于37 ℃恒温手术操作台上。沿大鼠腹部正中线作长约2 cm切口,轻柔分离双侧肾动静脉,使用无损伤显微血管夹钳夹肾蒂使肾脏缺血30 min,随后移除血管夹,肾脏恢复血流后缝合切口,待大鼠自然苏醒,IRI组再灌注24 h。假手术组仅做手术切口和缝合,不做其他处理。
1.3 血肌酐、尿素氮水平检测
IRI组大鼠再灌注24 h后与假手术组大鼠经眼眶后静脉采血后处死,收集血液约0.5 mL,8000 r/min、4 ℃、离心5 min取上清。用全自动生化分析仪检测血肌酐、尿素氮水平。
1.4 肾脏组织PAS染色法
各组大鼠处死后迅速取左侧肾脏,体积分数4%多聚甲醛固定、脱水、包埋,制备3 μm厚石蜡切片;剩余肾脏组织经液氮速冻后-80 ℃保存。石蜡切片二甲苯脱蜡、梯度乙醇脱水,流水冲洗;过典酸雪夫染色5 min,流水冲洗;盐酸乙醇分化,流水冲洗;梯度乙醇脱水、二甲苯透明,中性树胶封片,于倒置光学显微镜下观察。
1.5 肾脏免疫组织化学
取假手术组及IRI组肾脏组织在4%多聚甲醛溶液中固定组织48 h后,浸蜡后包埋,石蜡切片常规脱蜡,3%H2O室温孵育10 min,浸入柠檬酸盐缓冲液微波修复20 min,牛血清封闭20 min,加SPP1、a-SMA I抗4 ℃孵育过夜。Ⅱ抗孵育1 h后加入ABC复合物,暗室孵育30 min,冲洗后加入显色液,室温孵育显色10~30 min,加苏木精染色50 s,梯度乙醇脱水,利用二甲苯透明处理,中性树脂封片。显微镜下观察。
1.6 肾脏组织免疫荧光染色法
取假手术组及IRI组石蜡切片,二甲苯脱蜡、梯度乙醇脱水,流水冲洗;柠檬酸钠抗原修复20 min,体积分数0.3%Trition X-100 室温通透15 min,质量分数5%BSAA室温封闭1h;滴加SPP1抗体(1∶200)、caspase-3抗体(1∶100),LTL-Biotinylated(1∶200),4 ℃孵育过夜;滴加Alexa Fluor 488 标记的山羊抗兔IgG(1∶500)、TEXAS RED标记的链霉亲和素(1∶300),室温孵育1 h;PBS洗涤5 min×3次,滴加荧光封片剂,于高端全自动倒置荧光显微镜下观察。
1.7 细胞的培养和瞬时转染
我们使用ATCC细胞库(Manassas,VA,USA)的人肾小管上皮细胞(HK-2)进行实验。所有细胞培养在含有10%胎牛血清和1%青霉素-链霉素抗生素的DMEM培养基中并放置在37 ℃含有5%CO2和95%空气的加湿的细胞培养箱中培养。本实验使用成熟的小干扰RNA样本:由GenePharma公司(中国·上海)合成(si-SPP1)和阴性对照(si-NC),细胞按5×105/孔加入含有完全培养基的12孔板中于37 ℃、体积分数5%CO2培养箱中培养至细胞贴壁。显微镜下观察细胞融合度达70%左右时,按照说明书进行转染,采用Western blot法检测si-NC组、si-SPP1组细胞SPP1蛋白相对表达量。
1.8 缺氧复氧模型(H/R)的建立及分组
取对数生长期HK-2细胞,于37 ℃、体积分数5%CO2培养箱中培养。细胞按5×105/孔加入含有完全培养基的12孔板中,使用成熟的小干扰RNA样本分为si-NC组、si-SPP1组。经200 μmol/L CoCl2处理12 h使细胞缺氧后更换为完全培养基培养2 h使细胞复氧[20],分别为Control组、H/R组细胞。取si-NC组、si-SPP1组经200 μmol/L CoCl2处理24 h后更换为完全培养基培养2 h。分别为si-NC+Control组、si-SPP1+Control组、si-SPP1+H/R组。
1.9 蛋白免疫印迹实验
分别从Control 组、H/R 组细胞和si-NC+Control组、si-SPP1+Control组、si-SPP1+H/R组细胞中提取蛋白并进行BCA蛋白浓度测定。加入5×上样缓冲液(使用SDS-PAGE凝胶配制试剂盒配置10%的分离胶,电泳时的电压设置为80 V运行约30 min后观察彩色蛋白分子量标志物的条带分离后将电压调增至110 V。转PVDF膜时电流设置为200 mA运行90~120 min。封闭使用5%的脱脂奶粉,摇床2~3 h。孵育一抗使用的抗体分为:小鼠来源的(GADPH 1∶1000,碧云天),兔来源的SPP1(1∶1000,Abcam),兔来源的Caspase-3(1∶1000,碧云天),兔来源的Kim-1(1∶5000,Abcam)孵育二抗使用的抗体有:羊抗小鼠(1∶1000,碧云天),羊抗兔(1∶1000,碧云天)。最后使用Bio-Rad公司的曝光仪进行条带发光显影。
1.10 酶联免疫吸附测定(ELISA)
收集细胞培养上清,离心去沉淀,按照ELISA试剂盒说明书检测SPP1的分泌水平,主要步骤包括稀释捕获抗体包被至96孔酶标板,室温静置过夜,10%FBS封闭30 min,加入标准品和样本2 h,加入检测抗体1 h,加入HRP 孵育20 min,加入底物TMB 显色5~10 min,1 mol/L H2SO4终止反应,酶标仪450 nm测定吸光度值,绘制标准曲线计算样品浓度。
1.11 流式细胞术
分别为si-NC+Control组、si-SPP1+Control组、si-SPP1+H/R组细胞胰蛋白酶消化,PBS洗涤、重悬细胞,离心1000 r/min,4 ℃、5 min弃上清;PBS洗涤1次,离心后弃上清;加入495 μL AnnexinV结合缓冲液重悬细胞;加入1 μLAnnexin V-FITC和1 μL的PI染色液,轻柔涡旋混匀后,室温避光孵育20 min。上机检测细胞凋亡率。
1.12 统计学方法
本实验结果的统计图采用的是GraphPad Prism 6.01(GraphPad Software,Inc.USA)软件分析,组间的数据统计的差异性分析采用的是独立样本t检验和One-way ANOVA。所有实验均重复3次并以均数±标准差统计描述。P<0.05考虑差异有统计学意义。
2 结果
2.1 生物信息学分析
IR 在鼠肾脏中进行了全基因组长链非编码RNA和mRNA 微阵列分析。肾脏中lncRNA 和mRNA 的表达谱在Sham 组和IR 组之间存在显著差异,共有276 个差异表达(P<0.05,log FC>2)的lncRNA(201 个上调,75 个下调)和267 个mRNA(192 个上调,75个下调)被确定。此外,差异表达mRNA 的表达火山图和热图显示SPP1是显着上调的基因(图1)。
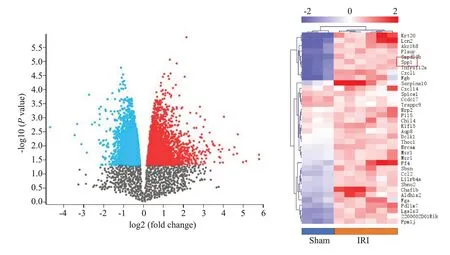
图1 IRI鼠肾脏全基因组长链非编码RNA 和数据集deg热图Fig.1 Heatmap of IRI murine kidney whole genome long chain non-coding RNA and dataset deg.
2.2 各组大鼠血清肌酐和尿素氮水平
与Sham组相比,IRI组血清肌酐、尿素氮水平明显上升,表明成功构建了大鼠缺血再灌注模型(P<0.05,图2)。
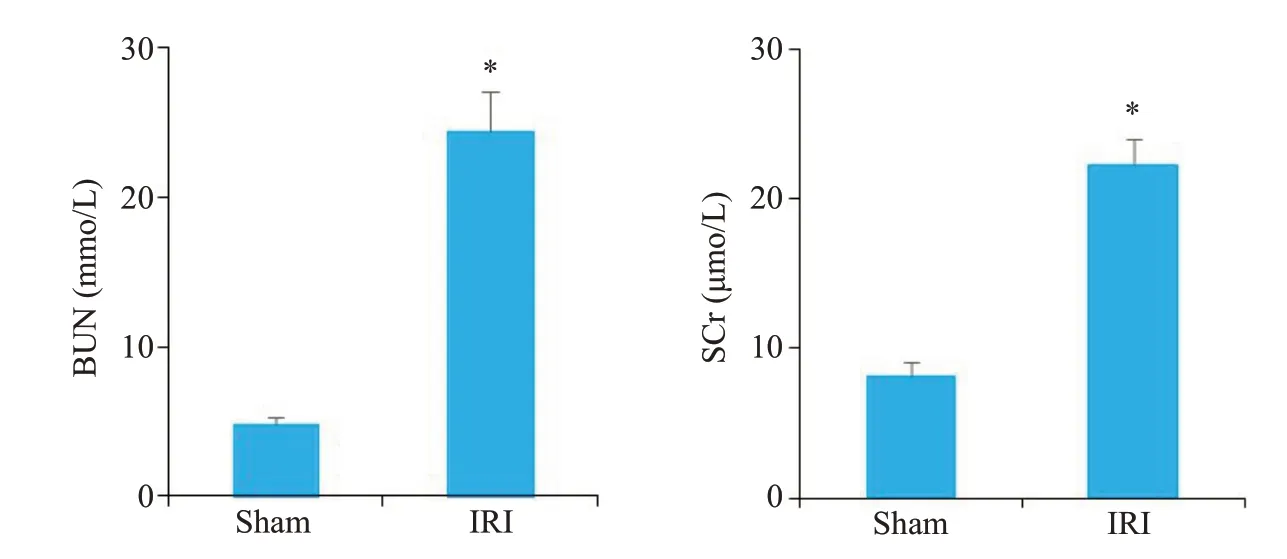
图2 各组大鼠血清肌酐及尿素氮的浓度测定Fig.2 Serum creatinine and urea nitrogen levels in each group.*P<0.05 vs sham.
2.3 各组大鼠肾脏组织病理水平比较
PAS染色结果显示,Sham组大鼠肾小管上皮细胞结构正常,肾小球及肾小管未见明显异常改变,细胞排列较为整齐,无明显改变,IRI组大鼠肾小管结构排列紊乱、松散、肾小管扩张、肾小管细胞坏死和蛋白管型的出现(P<0.05,图3)。
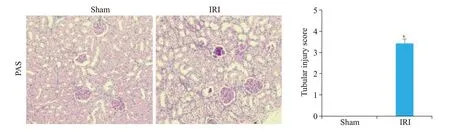
图3 大鼠肾脏组织病理学改变Fig.3 Histopathological changes in the rat kidney(PAS staining,original magnification:×200).*P<0.05 vs sham.
2.4 各组大鼠肾脏组织α-SMA、SPP1表达的免疫组化结果
免疫组织化学染色结果显示,α-SMA、SPP1在肾缺血再灌注损伤的大鼠肾小球基底膜和肾小管上皮细胞内均有显著表达,主要定位在细胞质,与Sham组相比,IRI 组α-SMA 表达明显增高,与Sham 组相比,IRI 组SPP1表达明显增高(P<0.05,图4)。
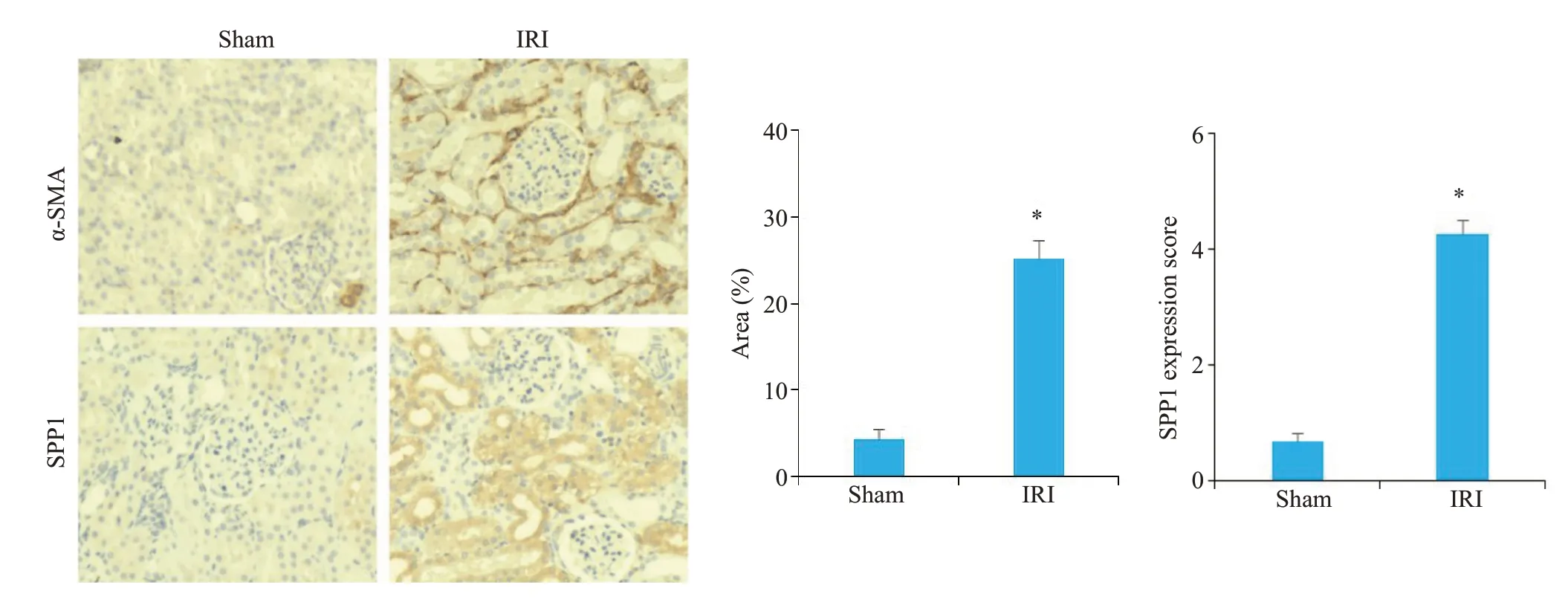
图4 各组大鼠肾脏组织a-SMA、SPP1表达Fig.4 Expression of α-SMA and SPP1 in rat kidney tissues in the two groups(immunohistochemical staining,×200).*P<0.05 vs sham.
2.5 各组大鼠肾脏组织Caspase-3、SPP1表达的免疫荧光结果
免疫荧光结果显示,Caspase-3定位于细胞质,IRI组肾组织中Caspase-3表达明显多于Sham组,SPP1定位于细胞质,IRI组肾组织中SPP1表达明显多于Sham组(P<0.05,图5)。
2.6 CoCl2处理后HK-2细胞Caspase-3、Kim-1、SPP1蛋白相对表达量比较及细胞上清液ELISA检测SPP1的分泌水平
H/R组细胞Caspase-3、Kim-1、SPP1蛋白相对表达量均高于Control 组(P<0.05,图6),H/R 组上清液细胞ELISA 检测蛋白表达量水平明显高于Control 组(P<0.05,图6)。
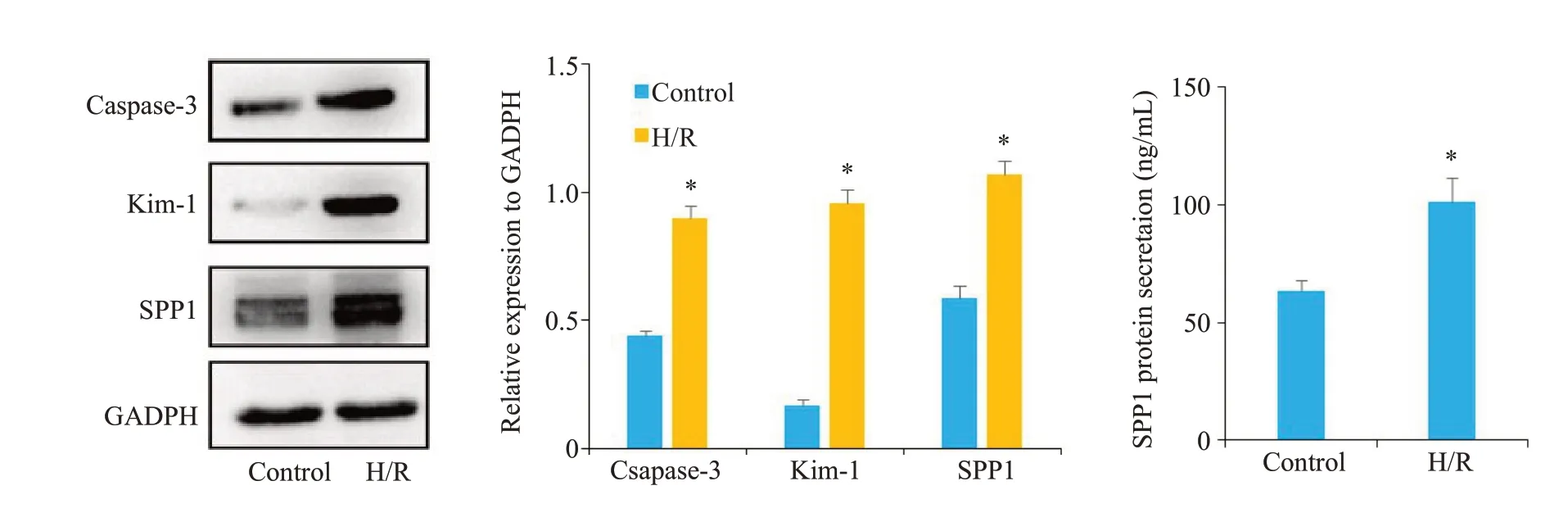
图6 Western blot实验检测H/R处理后的HK-2细胞Caspase-3、SPP1、Kim-1蛋白表达和上清液ELISA检测SPP1的蛋白分泌水平Fig.6 Western blotting for detecting caspase-3,SPP1 and Kim-1 protein expressions in HK-2 cells after H/R and ELISA for detecting SPP1 secretion level in the supernatant.*P<0.05 vs control sham.
2.7 si-SPP1敲低效率验证以及si-NC组、si-NC+H/R组、si-SPP1+H/R组细胞Caspase-3、KIM-1蛋白相对表达量比较
Western blot结果显示,si-SPP1组细胞SPP1蛋白相对表达量低于si-NC组。si-NC+H/R组细胞Caspase-3蛋白相对表达量高于si-NC 组,si-SPP1+H/R 组细胞Caspase-3蛋白相对表达量低于si-NC+H/R组,si-NC+H/R组细胞KIM-1蛋白相对表达量高于si-NC组,si-SPP1+H/R组细胞KIM-1蛋白相对表达量低于si-NC+H/R组(P<0.05,图7)。
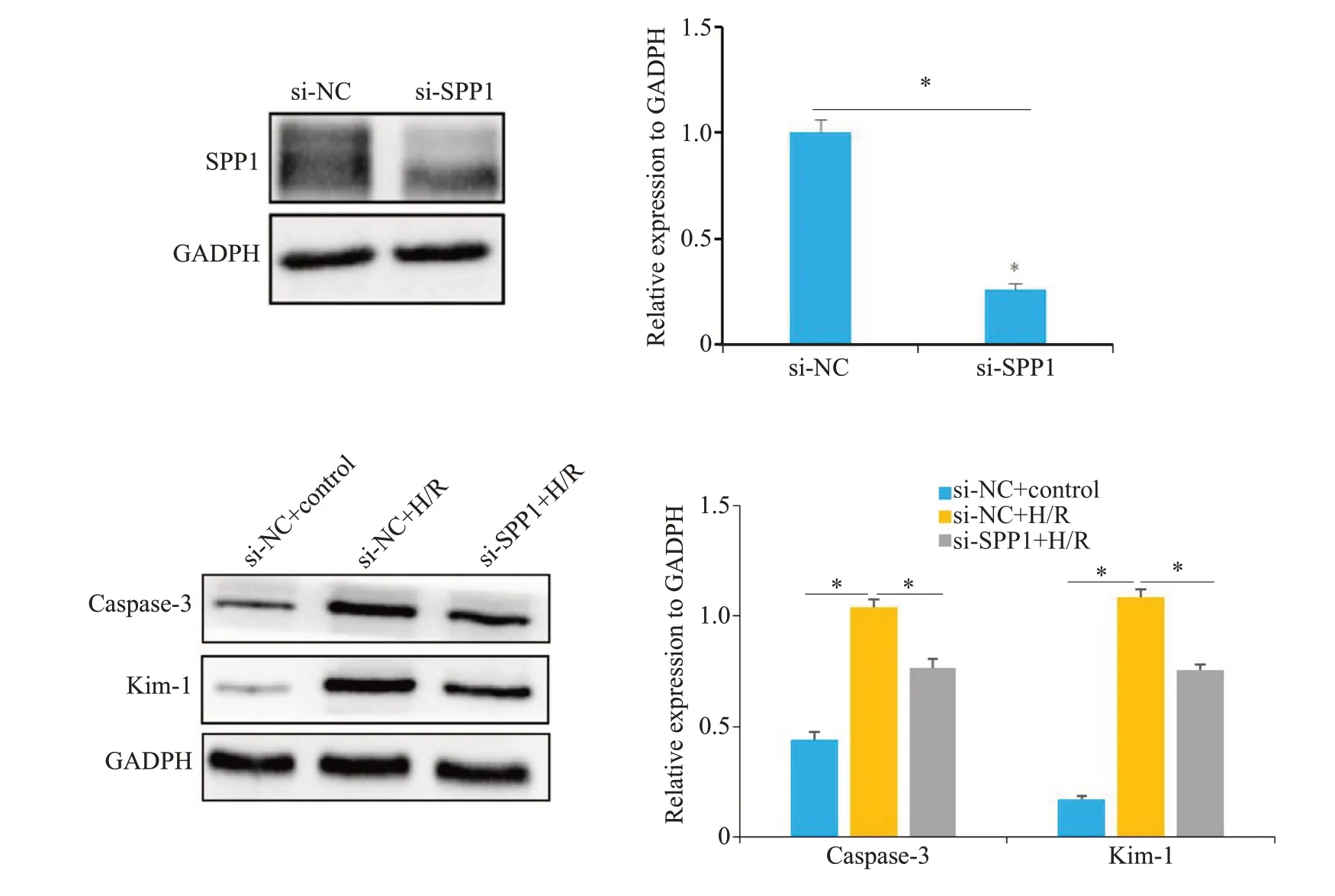
图7 Western blot 实验检测si-SPP1 组和si-NC 细胞组SPP1 蛋白表达的情况和si-NC 组、si-NC+H/R组、si-SPP1+H/R组细胞Caspase-3、Kim-1蛋白表达情况Fig.7 Western blotting for detecting SPP1 protein expression in si-SPP1 and si-NC cell groups and caspase-3 and KIM-1 protein expressions in si-NC,si-NC+H/R and si-SPP1+H/R groups.*P<0.05.
2.8 各组细胞凋亡率比较
流式细胞术结果显示,si-NC+H/R组、si-SPP1+H/R组细胞凋亡率均高于si-NC组,si-NC+H/R组高于si-SPP1+H/R组凋亡率(P<0.01,图8)

图8 流式细胞术检测si-NC组、si-NC+H/R组、si-SPP1+H/R组的细胞凋亡Fig.8 Flow cytometry detection of apoptosis in si-NC group,si-NC+H/R group and si-SPP1+H/R group,*P<0.05.
2.9 si-NC组、si-NC+H/R组、si-SPP1+H/R组细胞IκBa、p65蛋白相对表达量比较
si-NC+H/R组细胞IκBa蛋白相对表达量高于si-NC组,si-SPP1+H/R组细胞IκBa蛋白相对表达量低于si-NC+H/R组,si-NC+H/R组细胞p65蛋白相对表达量高于si-NC组,si-SPP1+H/R组细胞p65蛋白相对表达量低于si-NC+H/R组(P<0.05,图9)。
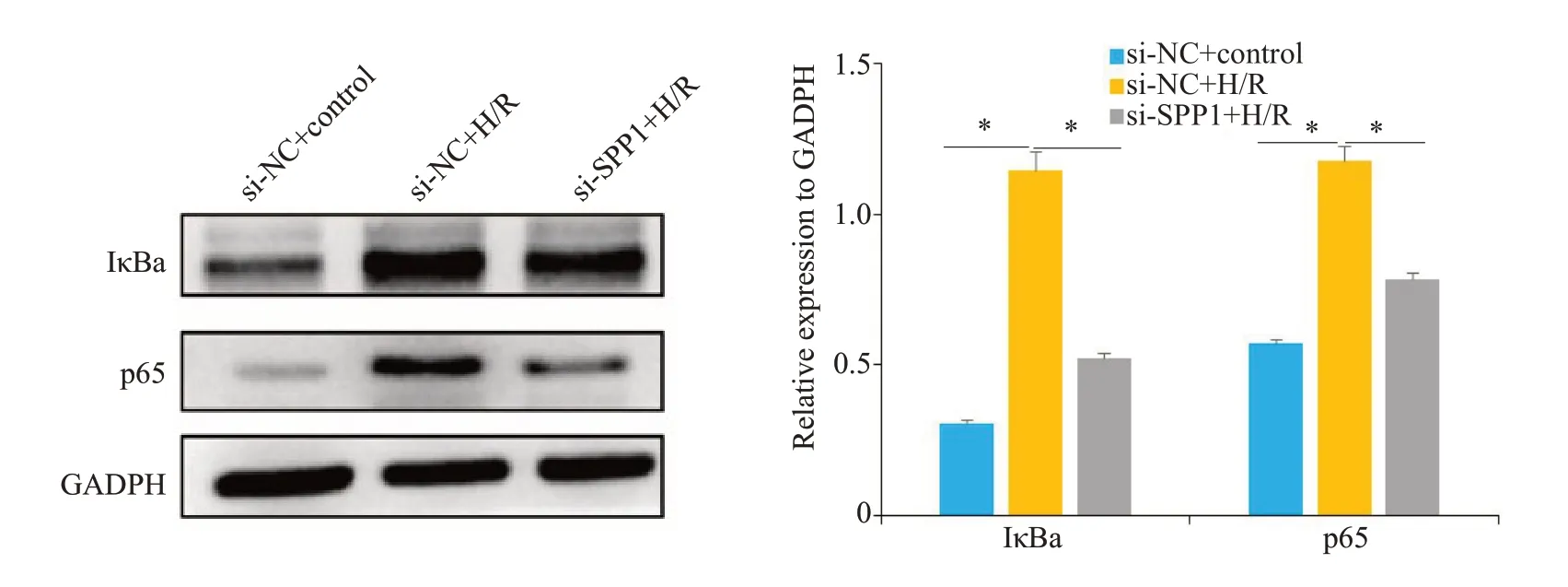
图9 Western blot实验和si-NC组、si-NC+H/R组、si-SPP1+H/R组细胞IκBa、p65蛋白表达情况Fig.9 Western blot experiments and cellular IκBa,p65 protein expression in si-NC group,si-NC+H/R group,si-SPP1+H/R group,*P<0.05.
3 讨论
临床上,肾IR 损伤常由各种重大手术和休克引起,是引起AKI 的主要病因之一,肾IR 损伤一般由机体全身或局部器官血流量供应障碍和代谢废物排出受阻所致、肾脏能量的供需失衡引起严重的组织缺氧[21]虽然近几年学者们提出了许多新的治疗策略,但在临床实践中使用的价值十分有限。SPP1被称为骨桥蛋白,由SPP1基因编码[22]。最初在骨骼中发现,但现在已知在几种不同的组织中表达,例如胃肠道上皮、外分泌腺和远端肾小管[23]。该蛋白在肿瘤发生,侵袭和转移中也起着重要作用,其可以调节宿主免疫,并且增强肿瘤细胞的增殖[24]。己经证实,SPP1在各种类型的癌症中表达上调如结肠癌等[25]。但关于SPP1与缺血再灌注关系的研究较少,最近的一项研究表明,SPP1在急性心肌梗死缺血再灌注损伤中的表达降低,SPP1在心肌梗死缺血再灌注损伤起到可能起到保护作用[26]。还有文章报道SPP1参与调控大鼠脑缺血再灌注急性期炎症反应[27],在I/R后上调,SPP1在整个急性期持续波动,以及一个必要的microRNAmiR-340-5p下调,可能参与了脑缺血再灌注急性期。此外,缺血诱导的Spp1表达降低可损伤新生血管形成,而Spp1过表达可促进新生血管生成[28],推测SPP1可能与IRI存在一定关系,但SPP1在肾脏IRI中的作用目前尚未见报道。本研究通过细胞实验和体内动物实验探究SPP1对AKI的作用和影响。
目前研究较为常见的急性肾损伤通常由肾脏缺血再灌注的引起,由于细胞对损伤刺激的敏感性不同,损伤既可以导致肾脏细胞死亡,也能够仅引起细胞损伤[29]。细胞对缺血缺氧高度敏感,缺血性AKI 引起的细胞凋亡反应在急性肾损伤病理生理中发挥重要作用[30,31]。为明确SPP1在IRI中的表达意义,参考本研究造模方法[32],本实验制备了大鼠肾脏IRI模型和细胞缺氧复氧模型,结果显示,IRI组大鼠的血清中的肌酐和尿素氮的表达明显升高,以及代表肾脏小管损伤标志物的Kim-1蛋白均升高,以及PAS染色结果均显示IRI组损伤增加,证实我们成功构建了大鼠IRI模型,大鼠肾脏SPP1表达升高,HK-2细胞H/R后表达也升高,初步证实了在AKI后SPP1在肾脏表达明显升高,这提示SPP1可能在肾脏中AKI发挥重要作用,在此基础上,我们的免疫荧光染色结果显示SPP1 以及代表凋亡程度Caspase-3蛋白显著增加,以及细胞缺氧复氧Western blot实验结果显示细胞SPP1,Caspase-3蛋白均升高,本研究表明SPP1可能通过凋亡途径作用于AKI。
为进一步探讨SPP1在肾脏IRI中的作用,本研究通过瞬时转染siRNA 下调HK-2 细胞中SPP1 表达,Western blot和流式细胞术结果显示,si-SPP1+H/R组细胞Caspase-3蛋白相对表达量及细胞凋亡率均低于si-NC+H/R组细胞,结果显示下调SPP1表达可抑制H/R肾小管上皮细胞HK-2凋亡,表明SPP1可能促进肾小管上皮细胞IRI,诱导细胞凋亡,参与肾脏IRI的发生。
NF-κB是一种常见的信号通路,广泛参与了细胞内生命活动的调节。研究表明,NF-κB调节通路在细胞增殖和凋亡过程中起着重要作用[33]本实验发现肾脏IRI后激活了NF-κB信号通路,干扰SPP1可以下调NF-κB信号通路中IκBa和p65的表达来减轻肾缺血再灌注组织的细胞凋亡,其机制可能与降低NF-κB通路表达有关,表明SPP1的表达加重肾缺血再灌注组织损伤。
综上所述,IRI大鼠肾脏组织及H/R肾小管上皮细胞HK-2 中SPP1 表达上调增加细胞凋亡,然而下调SPP1表达可抑制H/R肾小管上皮细胞凋亡,其作用机制可能与下调NF-κB通路表达水平有关,为临床治疗AKI提供了新的靶点。
- 南方医科大学学报的其它文章
- 尿路上皮癌抗原1促进滋养细胞功能及对上皮-间质转化转化的调控作用
- Brain iron deposition increases in the bilateral substantia nigra of patients with medication-overuse headache: a quantitative susceptibility mapping analysis
- 益肺散结丸缓解小鼠癌因性骨骼肌萎缩的作用
- 环状RNA hsa_circ_0006834可作为肝细胞癌患者预后的潜在生物标志物
- 慢性间歇性低氧大鼠肾组织差异蛋白的定量分析:基于TMTPRM技术
- 不同滴度MOG-IgG 抗体在MOG 抗体相关疾病中的诊断和临床意义:一项单中心回顾性研究