土壤微食物网与森林土壤固碳的进展与思考
闫文德
(中南林业科技大学,湖南 长沙 410004)
森林生态系统是陆地最大的碳库,其中森林土壤全深度(Full depth)的碳储量至少是地上植被碳储量的3 倍[1]。如何将更多的碳,稳定在森林土壤碳库中,是缓解全球变暖、实现“碳达峰、碳中和”战略目标亟待思考的科学问题[2]。然而,森林土壤碳循环是一个极为复杂的生物地球化学过程,涉及到凋落物归还、有机质分解、腐殖质形成等众多环节,以及土壤生物区系(植物根系、微生物和动物群落)间复杂的相互作用[3]。其中,通过土壤生物和资源基质间取食关系所形成的复杂网络被定义为土壤食物网,是影响养分流动和物质循环等关键生态过程的基础[4]。随着近年来研究方法和技术的不断进步,以复杂的土壤食物网为研究对象,探索土壤生态系统的功能变化趋势,正逐渐受到越来越多的研究者关注。
土壤微食物网(Soil micro-food web)是土壤食物网的起点和基础组成部分,由功能众多的微小生物类群和部分中型动物(<2 mm)组成的消费者-资源关系网络[5]。相较于复杂的土壤食物网,微食物网营养级结构相对简单,主要包含:直接分解资源基质的微生物(细菌和真菌等)和植食性线虫构成初级消费者,捕食微生物的次级消费者(如:食微线虫和部分原生动物),以及更高级的捕食者(如:捕食-杂食性线虫、食线虫螨等)组成的三级营养结构[6]。通常而言,土壤微食物网涵盖的物种最为丰富,物质循环和能量流动最为频繁,更易于直观表征食物网中(非)营养级相互作用下的碳流[7],是影响森林生态系统地上-地下界面碳转化过程的重要枢纽。在推动“双碳”战略目标建设的背景下,探索土壤微食物网的相互作用,为林业经营管理和提升森林“固碳增汇”潜能提供了新的视角。但是,如何厘清土壤微食物网对土壤碳转化功能的调控机制,充分发挥其在森林固碳过程中的生态功能还任重道远。为此,以土壤微食物网的结构组成及其相互作用为出发点,综述现有研究中关于土壤微食物网对森林生态系统碳循环过程的影响,探讨其在森林固碳中的潜在作用,并展望未来可能的研究方向,以期为森林生态系统的碳管理以及如何应对气候变化提供科学支撑。
1 土壤微食物网结构组成对森林土壤碳库的影响途径
1.1 土壤微食物网的结构组成
随着分子生物学的快速发展和高通量测序技术的普及,土壤生态学的研究获得了显著进展,这为鉴别土壤生物组中“最隐秘、最活跃”部分的微小生物带来了前所未有的可能。然而,由于该部分微小生物集群的多样性丰富,生态位重叠的物种数量庞大,导致难以辨别物种间的取食偏好及其相互作用[8],致使针对土壤微食物网的研究存在诸多困难和不确定性。在此背景下,研究者们通过生物对食物资源的获取方式,将土壤微食物网大致划分为[9-11]:1)资源基质:包含凋落物、根系及其分泌物等来自植物地上和地下部分的碳源;2)营养级Ⅰ:初级消费者,包括直接参与有机质分解的细菌、真菌群落,以及从植物根系吸收养分的根瘤菌、菌根真菌和植食性土壤动物等;3)营养级Ⅱ:次级消费者,主要是捕食土壤微生物群落的食细菌线虫、食真菌线虫和原生动物等食微动物;4)营养级Ⅲ:捕食者,主要包括捕食-杂食性线虫和食线虫螨等。这些微小生物类群在土壤中相互依存和相互作用,形成一张庞大的食物网结构,共同参与有机质分解、养分循环和能量流动,对森林土壤生态系统的碳循环功能和碳稳定性发挥着至关重要的作用。
1.2 初级消费者对森林土壤碳库的影响途径
森林土壤的净有机碳输入主要取决于植物碳源的分配模式(Plant allocation patterns),包含了植物地上部分的凋落物碳输入(Litterfall carbon inputs)以及植物地下部分的根际碳输入(Rhizospheric carbon inputs)等途径[12-13]。植被类型往往是决定森林土壤碳库周转速率的关键因素[1]。按照土壤有机质周转速率的差异,通常可分为活性碳库(Labile carbon pool)和缓效或稳定的碳库(Stable carbon pool)[14],而探索森林土壤不同稳定性碳库间的转化机制,则是提升森林碳汇的主要途径(图1)[15]。

图1 土壤微食物网影响森林土壤碳库的主要途径Fig. 1 Primary pathways of soil micro-food web impacting soil carbon pool of forest ecosystem
作为土壤中的分解者(Decomposers),微生物群落是森林土壤碳库变化最主要的驱动力。一方面,微生物群落能通过分泌胞外酶(Extracellular enzymes)和微生物细胞内合成代谢(Microbial catabolism and/or anabolism)等途径,将土壤或植物根系的有机物质转化为较小的有机分子(如:糖类、脂肪酸类和氨基酸类等),并进一步矿化(Mineralization)分解为无机物质并释放能量[16]。该过程是森林土壤碳损耗(异养呼吸,Heterotrophic respiration)的主要途径,尤其是对位于土壤表层的新鲜有机质,较高的微生物活性和周转率会加速分解和矿化有机质,产生激发效应(Priming effects)进而释放大量CO2到大气中[17]。另一方面,微生物分解所产生较小的有机分子还能作为腐殖化过程(Humification)的前体物质,与微生物合成代谢产生的酚类、醌类物质或植物残体剩余的类木质素,进一步缩合、聚合形成腐殖物质(如:胡敏素、胡敏酸和富里酸等)[18]。这些腐殖质具有较高的分子量和化学稳定性,在土壤中具有相对长时间的滞留期,在土壤碳库的积累和稳定性维持方面发挥着重要的作用。此外,微生物死亡产生的微生物残体碳(Microbial necromass carbon)可能对土壤有机质的贡献超过了植物的直接来源(难降解部分),尤其是在植物根际区域更有利于微生物残体碳的形成[19]。因此,土壤微生物群落可以作为微生物碳泵(Microbial carbon pump)对森林土壤的碳储量进行调节(图1)[20]。
此外,取食植物根系及其分泌物的植食者(Herbivores),如:植食性线虫等,是土壤微食物网与地上植被联系最为紧密的部分,是促进植物碳向根部及根际土壤再分配的关键驱动力[21]。首先,植食性动物的取食、代谢和死亡途径能生成植物残体、排泄物和动物残体,直接诱导有机质向土壤的输入[21]。其次,土壤植食性动物与植物的相互作用,能够破坏根系结构,影响植物生长和根系分泌物渗出,进而改变植物-土壤界面的碳输入量[22]。此外,根际生境(动植物残体、根际分泌物和沉积物)的变化能进一步影响土壤微生物群落和土壤有机质的赋存条件和动态变化特征[3]。因此,深入研究根际环境的变化,以及根际植食者和微生物群落的相互作用,对于解析森林土壤碳库的动态变化过程具有重要意义。
1.3 次级消费者和捕食者对森林土壤碳库的影响途径
土壤原生动物和食微线虫是微食物网中数量最多的微生物捕食者(Microbivores),原生动物主要取食细菌,而食微线虫可以根据其食性分为食细菌线虫和食真菌线虫[23]。土壤食微动物通过与微生物群落的相互作用,影响土壤的生态过程和植物的生长机制,进而影响森林土壤碳储量和固碳潜力(图1)。一方面,食微动物通过选择性捕食作用,影响微生物群落的数量、结构和代谢活性,进而直接影响微生物群落主导的碳循环过程和土壤碳储量[24-25]。另一方面,食微动物的分泌物、排泄物和残体等,能够为微生物群落提供养分基质并刺激其生长[26]。此外,食微动物的捕食过程,尤其是食细菌动物对细菌群落的捕食能够加速释放其固持的养分(氮、磷等),并供植物根系吸收、促进植物生长[27]。与此同时,食微动物的捕食选择性,还能够调控植物有益或致病微生物群落(Beneficial or pathogenic microbes),进而影响植物健康状况[22,28]。因此,土壤食微动物不仅能直接调控微生物主导的土壤碳转化,还能通过影响植物的生长间接调控森林土壤碳库。
此外,通过食微动物向更高营养级水平的捕食-杂食动物(Predators-omnivores)传递能量,亦能对初级分解者及其驱动的生态过程产生反馈影响[29-30]。这些捕食者主要以土壤中微动物(线虫、原生动物等)为食,同时还可能与食微动物和植食性动物竞争来自于细菌、真菌和植物根系的食物资源,进一步加强了微食物网对森林土壤碳库的复杂调控[31-32]。然而,在深入探索食微动物和捕食者对森林土壤碳库影响途径的同时,仍存在诸多难点和困境。首先,捕食者的营养位可能因生态系统和土壤环境条件的不同而产生差异,使得特定区域的研究存在局限性[33-34]。其次是捕食者的取食偏好难以确认,如何确定物种间的取食-被取食关系及其能量来源存在困难[35]。尤其是森林土壤中的情况比其他环境中的情况更为复杂,许多物种的取食范围都相对广泛[36]。因此,如何更好的整合土壤微食物网,将其与土壤碳库变化的生态过程联系起来,对探索森林生态系统的固碳潜力具有重要意义。
2 土壤微食物网相互作用对森林固碳过程的影响途径
2.1 微食物网能量流动对森林土壤有机碳的传递
土壤微食物网的养分循环和能量流动,主要由微生物和植食性动物对资源基质(动植物残体、植物根系等)的取食、消耗和转化过程所驱动,并通过土壤生物群落间复杂的捕食-被捕食关系网络对有机碳进行传递(图2a)[30]。然而,如何量化土壤微食物网的能量流动和有机碳传递效率、如何厘清营养级间复杂的相互作用,以及如何准确捕捉不同功能群在土壤微食物网中的作用,仍然存在着诸多困境。
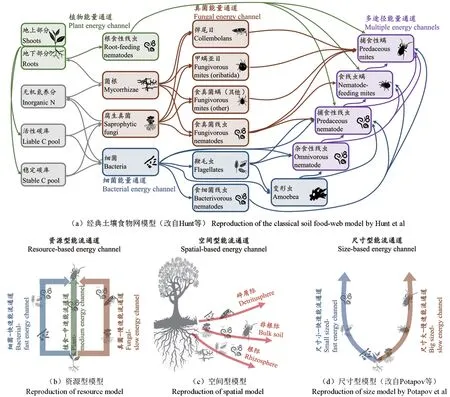
图2 土壤微食物网能量流动模型构建Fig. 2 Construction of the energy channels of soil micro-food web
通常而言,根据微食物网组分对资源基质(Resource-based energy channels)分解速率的差异,大多数研究将其能量通道划分为“快速”的细菌通道,“中速”的植物通道和“慢速”的真菌通道(图2b)[37-39]。尤其是微食物网中,营养物质和能量从一个物种到另一物种的传递是一个低效的过程,各级群落维持自身代谢活动需消耗大量的能量[40-41]。因此,由微食物网不同功能群和能量通道所产生的代谢速率差异,将直接影响森林土壤固碳的生态过程[42]。例如:主要由细菌、食细菌性的原生动物和线虫构成的细菌通道(Bacterial energy channel),因其偏好利用碳氮比(C/N)低的底物、世代较短、养分周转速率快,导致相对少量的碳传递至高营养级[38]。而由真菌、食真菌性的线虫和微节肢动物组成的真菌通道(Fungal energy channel),偏好利用C/N 高的底物、养分周转速率相对较慢,能传递相对较多的碳进入高营养级[43]。此外,由根际共生的微生物群落和植食性线虫等直接从植物根系获取能量的植物通道(Plant energy channel),养分周转速率及能量流动速率介于细菌和真菌通道之间[38]。然而,这一经典的能流通道模型却未考虑时空变换和营养位重叠,这可能限制了对土壤食物网能量流动和有机碳传递的深入理解。
尤其是在植物根系生物量较为发达的森林生态系统中,植物通道的影响域可能被严重低估,来自植物的能量通过根分泌物、根际微生物(细菌和真菌等)及植食动物的相互作用,可为许多本依赖碎屑供能的捕食者补充养分[44]。在此情景下,细菌、真菌和植物通道对微食物网顶级捕食者的贡献程度存在较大的未知和重叠(多途径能量通道,Multiple energy channels, 图2a)。 此外,有研究运用13C 标记的脂肪酸(Fatty acids,FAs)结构区分细菌和真菌对更高营养级捕食者的贡献度,发现所研究的每个捕食者都富集了大量的细菌脂肪酸,说明细菌能量通道对土壤微食物网高营养级的贡献可能被严重低估[45]。这些发现都直接或间接地指出了,单纯以细菌和真菌通道分别表示“快速”和“慢速”的能量通道所存在的弊端。为此,相关学者们针对土壤食物网能流模型的构建,还探索了结合空间差异和生物尺寸差异等因素进行共建[46]。例如:通过区分根际(Rhizosphere)、非根际(Bulk soil)和碎屑际(Detritusphere)建立空间分室能流模型(Spatialbased energy channels),能更为全面考虑资源可利用性差异,并将与不同基础资源相关联的消费者按照空间分类(图2c)[46]。同时,根据食物网中各组分的体型差异,构建基于尺寸的分室能流模型(Size-based energy channels)。例如:将体型微小的微生物和食微动物视为“快速”的能量通道,而体型较大的捕食者则被定义为“慢速”的能量通道(图2d),分别代表了土壤碳周转速率和碳储存量等不同的生态系统功能,且由食物网中个体大小分室间的多样性和稳定性来维持系统的平衡[47]。因此,基于资源、空间以及生物体尺寸,对微生物食物网的能量通道进行分类,能够更精确地量化微食物网取食-被取食过程中的能量流动,从而更为准确地定位生物群落在特定土壤层(空间)中对资源基质的利用效率以及碳循环的贡献。
2.2 微食物网营养级联对森林土壤碳储存的调控
土壤生物间的取食关系不仅影响食物网的连通性,甚至能跨营养级形成级联效应(Trophic cascading effect),扰动食物网的组成结构和相应功能群的密度,对土壤生态系统功能和碳循环产生深远影响[48]。在土壤微食物网的相互作用下,碳从基础资源逐层传递到更高的营养级,而高营养级的死亡又会将碳重新注入到网络的底层。在此背景下,由于资源供应的改变,导致高营养级物种、种群和群落的丰度和多样性的变化,则形成所谓的上行效应(Bottom-up effect)[49]。换言之,一切能影响森林土壤资源基质的因素,例如:森林植被类型的转化[50]、气候条件的改变[51]、植物凋落物量的变化[52],以及氮沉降等人类活动所造成的影响[53],均能通过改变土壤的物理化学性质和塑造特定的土壤微生物群落,产生不同程度的上行效应,影响森林土壤食物网和土壤碳储存。在森林土壤固碳过程中,植物凋落物中难降解部分(木质素、纤维素等)无疑是土壤有机碳形成和固定的重要因子之一[54];另一重要来源则是复杂的微生物残体碳,甚至在土壤有机碳组分中占到相当大的比例(27%~82%)[55]。因此,以土壤微食物网的上行效应为视角,可通过改善(调控)土壤资源基质或增加土壤微生物残体碳含量等途径,增强森林土壤的固碳潜力。例如:1)凋落物管理,可在林间挖壕沟填埋植被凋落物等方式,减缓其分解速率。一方面,在厌氧条件下,土壤酚类氧化酶活性极低,木质素等难降解物质几乎不分解[56-57]。另一方面,地下部分碳输入比地上部分更有利于微生物残体碳的形成,且更易受到土壤黏粒的物理化学保护使之更稳定[19]。2)近自然化改造,通过间作或混交提升森林植被的多样性,改善森林资源基质组成成分和土壤团聚体组成结构[58]。虽然植物和土壤的固碳能力可能存在着此消彼长的关系[59];但近期Chen 等[60]针对加拿大国家森林清查(NFI)数据库的研究表明,在年代际尺度上,森林植被的物种均匀度(Species evenness)和功能多样性(Functional diversity)从最小值到最大值分别使森林土壤有机层(Organic horizon)和矿质层(Mineral horizon)的土壤碳含量增加了30%和32%。此外,在高氮沉降区域,森林的经营可考虑间作豆科植物替代增施氮肥,能有效缓解土壤酸化等因素所产生的生物毒性,促进土壤食物网的复杂性和稳定性[61]。
从土壤微食物网下行效应(Top-down effect)的角度出发,捕食者通过抑制猎物的种群密度,使之维持在一定水平上以持续供应食物,对森林土壤碳储存产生着重要影响,捕食者的特征甚至决定着整个食物网的特征[62]。Srivastava 等[63]的研究发现,微生物群落多样性的增加虽不能决定资源基质的量,但能够显著促进资源的分解速率;而食微动物则可通过捕食作用调控微生物分解资源的速率[64]。因此,可以通过捕食者的取食过程,调控微食物网的结构组成和土壤微生物的真菌细菌比,进而影响森林土壤碳储存。例如:1)接种土壤生物,通过接种捕食者或改变生物群落的竞争机制,进而影响微生物对资源基质的分解效率。Geisen 等[24]通过接种模式原生生物多头绒泡菌(Physarumpolycephalum),发现在相对低温条件下(17 ℃)显著促进了微生物群落对凋落物的分解速率。Crowther 等[65]通过研究土壤动物(弹尾虫、线虫、等足类和千足类等)对真菌菌丝的牧食(Grazing),分析土壤动物对真菌降解木材的影响,发现捕食者能改变真菌群落组成和竞争机制,进而影响林木的腐烂率和养分循环。2)而与之对应的,还可采用网袋隔离法,通过限制资源基质中微生物群落和部分捕食动物间的交流,形成相应的下行效应。然而,网袋隔离具有很大的盲目性,被隔离的物种存在相当程度的不确定性,无法精准识别相应捕食者缺失对土壤碳循环功能变化的贡献[4]。尤其是土壤微食物网物种间的捕食-被捕食关系等相关基础研究薄弱,使得下行效应调控的布施面临极大的挑战。但目前研究者普遍认为的是,由于捕食作用对微生物生长的刺激,捕食者的数量和多样性决定着微生物的碳利用效率(Carbon use efficiency),有利于土壤稳定性碳(如微生物残体碳)[40,66]。因此,探索维持和促进土壤生物多样性的途径和方法,将可提升森林生态系统的固碳潜力。
此外,还需注意的是,土壤微食物网的上行效应和下行效应可能同时存在,亦可能同时消失,造成某些物种间的联系被掩盖。可粗略地总结为以下3 种情况:1)上行效应和下行效应的正负反馈相抵消。例如:食微线虫取食微生物群落,而捕食线虫通过捕食作用调控食微线虫的密度,造成食微线虫的生物量并未因微生物量增加而增加[67]。2)同一过程可能同时存在正负反馈。例如:食微动物通过取食微生物能降低微生物量,而通过接种效应运输和分散微生物又能刺激其生长[68]。3)微环境内的闭环效应。例如:土壤团聚体的保护机制,不利于捕食动物或食微动物的取食活动,造成微生物残体碳的积累[69]。因此,综合考虑上行和下行效应和环境因子的影响,能更好地理解在微食物网营养级联效应对森林土壤碳储存的调控机制。
2.3 微食物网复杂性和稳定性对森林土壤固碳能力的反馈
通常来说,一个健康、稳定的土壤食物网有助于维持森林土壤的固碳能力。然而,探索食物网的稳定性与复杂性(或多样性)的关系,以及如何量化表达其所涵盖的生态功能和生态系统稳定性,一直是生态学的研究难点[70-75]。构建食物网的复杂性在理论上是困难的,因为在随机模型(Random-pattern models)中复杂性往往导致系统的不稳定[76]。但现实环境中,常常存在越简单的系统越易被破坏的现象,例如:与多样化的自然生态系统相比,同质化的农业系统更容易出现种群密度的剧烈波动(如病虫害暴发)[77]。因此,在不考虑食物网结构的前提下,无法直接讨论其复杂性和稳定性的因果关系。鉴于此,学者们开始通过网络的连接性(Connectance index)判别二者之间的关系,并假设网络连接性随多样性的增加而减少,即可在食物网中获得稳定性[78-79]。这一假设似乎满足物种多样化的群落往往食物网络连接性更低的普遍现象。然而,单纯的考虑食物网中连接性的增减,却忽视了食物网中物种相互作用的强弱,尤其是弱相互作用(Weak interactions)对食物网稳定性的贡献[80]。例如:Schwarzmüller 等[81]的研究提出,在食物网底部觅食的大型物种(即所谓的“营养鲸”,“Trophic whales”)与资源供给生物的单位生物量相互作用最弱,却能缓冲外界的压力,保护食物网免受不稳定的影响。因此,食物网中复杂性(或多样性)在“慢速”能流通道(体型相对较大的物种,详见2.1)的倾斜分配可能是决定食物网稳定性的重要因素[75]。
区别于随机食物网的全局稳定性(Global stability),土壤微食物网往往呈现出在较小空间尺度(例如:单株植物根际)更强的局域稳定性(Local stability)特征,即系统较小干扰的假设下,回到平衡态的能力[82]。类似于空间分室能流模型的构建(详见2.1),微食物网的局域稳定性主要取决于资源基质类型等条件的变化[83]。然而,运用经典的随机矩阵(Random matrix theory)[84],分析物种丰富的土壤食物网,其稳定性会随空间尺度的增加而降低[82]。在土壤生态系统中,众多局域的(相对孤立的)微食物网,可能是通过弱相互作用而形成一张稳定的食物网,例如:外延的地下菌根网络(Mycorrhizal networks)在联系不同空间尺度的土壤生物群落中可能发挥着重要作用[85]。因此,在探索土壤微食物网的稳定性时,应考虑局域稳定性和全局稳定性之间的平衡以及空间尺度的重要性,有助于更好地理解土壤微食物网在应对外界干扰时,如何维持森林生态平衡和土壤碳库的稳定性。
考虑自然地理环境、气候条件和森林植被类型的差异,外界干扰对森林土壤微食物网稳定性和碳循环功能的影响可能发生显著变化。例如:Gongalsky 等[86]针对俄罗斯西部地区森林火灾的研究表明,所有过火区域的食细菌线虫对线虫总生物量的贡献均有所增加(27%~45%),说明火灾促进了“快速”的细菌能量通道的占比,可能加速土壤碳库的流失,而地理位置和森林类型所造成的降水量增加和土壤腐殖质层增厚能有效减缓火灾对土壤微食物网的影响。此外,干扰强度亦是森林土壤微食物网和有机碳稳定性的决定性因素。Pellegrini 等[87]提出高强度的火灾可通过燃烧森林土壤有机层和增加活动层深度导致土壤有机碳流失,而低强度的森林火灾后,土壤可富集芳香烃等难降解碳,改变土壤分解者的活性,促进森林土壤碳的积累。以受黏土保护和周转期长的微生物残体碳为视角,加速微生物的周转或更新效应(Renewal effect)能促进土壤有机碳的固定[42]。例如:邹晓明等[15]提出,在干旱季节对林地进行灌溉,可促进微生物的生长,再次干旱后微生物将大量死亡,周而复始能促进微生物残体的形成,从而有利于稳定性碳库的增加。然而,Allison[88]近期的观点却认为,在干旱趋于频繁和严重的背景下,微生物群落可能应对干旱而产生适应性进化并维持其活动,而受干旱影响的植物生产力下降、凋落物等地上部分碳输入减少,进而可能导致森林土壤碳损耗剧增。因此,土壤微食物网稳定性变化如何影响森林土壤碳循环仍存在相当程度的不确定性,仍需进行更多的基础研究和实地探索,厘清微食物网的演变机制、提升调控措施的针对性。
3 困境与展望
受益于脂肪酸图谱、同位素示踪、基因组学等相关实验技术的突破,土壤生态学者们在土壤微食物网的结构特征研究、生态功能解析、以及与土壤碳循环过程之间的关联性探究方面取得了显著进展。然而,要实现通过土壤微食物网精准调控森林土壤的固碳能力,仍然是一项任重而道远的挑战。主要体现在以下几个方面:
3.1 厘清多组分的微食物网结构特征
分子生物学技术的发展让大规模的土壤生物分类鉴定工作变得可能,然而微食物网的生物组成成分仍很难精准测定,存在许多不足之处需要思考和改进。1)分子生物学技术与传统形态分类学鉴定结果存在出入[89-90]。受土壤生物种类繁多、传统形态分类工作繁杂的限制,土壤生物(包括微生物、原生动物和线虫等)的基因数据库不全的局限性,如何将形态分类学和分子生物学技术有机结合,建立健全土壤生物基因组数据库,结合发展宏基因组学和宏表型组学,是一项工作量庞大且具有挑战性的任务[91]。2)分子生物学技术的定量方式存在不确定性。一方面,常规的测序手段只能获得物种的相对丰度,而特定物种的增加会导致其他物种相对丰度的降低,可能获得与真实结果相反的结论。目前常见的改进措施是通过内标菌株或荧光定量的方法测定物种的绝对丰度[92-93]。然而,若要以统一的定量单位,构建微食物网各营养级间的关系网络,还需辅助稳定同位素探针(DNA-SIP)和脂肪酸图谱(FAs-SIP)等技术方法。另一方面,测序时难以区分生物残体DNA 和活体DNA。常见的解决方案是在聚合酶链式反应(PCR)过程前,添加光敏性材料叠氮溴化丙锭(Propidium monoazide,PMA)排除细胞膜破损的残体DNA[94]。然而,该方法是否能区分细胞膜完整的残体微生物胞内DNA 仍不清楚。3)土壤病毒在微食物网中的地位往往被忽略。通常认为,病毒在微生物细胞内进行自我复制,并导致细胞溶解释放营养物质,这一过程类似于捕食行为,影响食物网的养分循环[95]。然而,近期DeLong 等[96]的研究发现一种浮游原生生物(Halteriasp.)能取食病毒,这一证据将可能重新定义病毒在食物链中的地位。因此,为厘清复杂的土壤微食物网,应当不断创新技术与方法,以深化对土壤微食物网不同组分对森林土壤碳库影响过程的认知。
3.2 解构多元化的微食物网关系网络
土壤微食物网内生物之间的关系网络是决定森林土壤生态系统稳定性和固碳效率的关键因素,亦是最难确定和定性的部分。1)土壤微食物网内物种数量庞大、营养位多变,物种间的捕食、共生、竞争、协作等关系复杂,导致微食物网的能量流动难以量化。一方面,基于测序结果或生物量构建的网络分析,难以区分物种间是相关关系还是因果关系。目前较常见的解决方案是借助稳定同位素探针技术和脂肪酸图谱分析种间关系,然而DNA-SIP 仍存在定量方面的缺陷、脂肪酸图谱则是无法精确辨别微生物和原生生物等群落的种群特征。另一方面,复杂的食性和取食偏好(尤其是杂食者的存在)使得不同能流通道传递效率的相对贡献难以确认。2)物种间相互关系的隐蔽性,即使是相邻营养级(捕食-被捕食关系)的两个物种亦可能出现不相关的假象,需进一步考虑相关群落的生长周期和演替状态,再进行综合评价[97]。3)构建静态的微食物网模型无法全面反映真实的动态过程。在微食物网稳定性平衡态的假设中,通常使用各功能群生物量的年际平均值作为相对平衡态,然而何种采样频率能在相对少的工作量下,获得最接近真实的平衡态仍未可知[98]。因此,亟待发展针对土壤生物活动的原位观测技术,实现自动化、多功能群、多参数的连续监测,探索人工智能算法在土壤微食物网模型构建中的应用,以解构土壤微食物网相互作用的动态过程,从而更准确地预测森林土壤生态系统的稳定性和固碳潜力。
3.3 探索切实有效的微食物网调控策略
土壤微食物网是驱动森林生态系统地上-地下碳转化的关键环节,如何将基础科学研究转化为实际的生态系统管理策略,是在林业生产实践中实现“双碳”战略目标的关键。然而,想要通过调控土壤微食物网实现森林固碳潜力的提升,往往存在诸多障碍和不确定性。1)从上行效应调控的视角出发,无论是凋落物管理、施肥等人工管理措施,或是混交、间种等近自然化改造途径,都能显著改变森林土壤的资源基质条件,从而调控土壤微食物网和碳循环功能[99]。然而,针对资源基质的调控措施在不同自然气候、土壤质地和植被类型等方面均存在差异,如何解决资源条件变化所导致的养分富集(或限制)?如何缓解动植物种群间竞争机制变化所产生的多样性丧失或病虫害风险?需要大量的基础实验和实地监测作为理论支撑。2)从下行效应调控的角度分析,通过接种菌根真菌、食微动物和捕食-杂食性动物群落等,虽能调控资源基质的利用效率和微食物网的结构组成,但土壤生物相互作用的复杂性和取食偏好的多样性,使得关键物种难以确认,尤其是实验室构建的取食关系是否能在自然界中真实存在仍存有疑惑。需进一步探索不同功能群和物种在土壤食物网中的生态位和生态功能,以实现更为精准的调控策略。3)就维持土壤微食物网稳定性对森林土壤固碳的影响而言,并非越稳定的微食物网越有利于森林土壤固碳。理论上,稳定的土壤微食物网物质循环缓慢、资源持续积累,可能不利于森林生态系统地上植被的生长,长效机制下可能会降低土壤外源碳的输入从而削弱森林土壤的固碳潜力。因此,需寻求植物生长和土壤健康等多因素间的特定平衡,以确保土壤微食物网的功能有助于森林生态系统的健康稳定发展。综上所述,尽管探索微食物网的结构特征和相互关系存在诸多限制,但它有望成为促进森林土壤碳固定的重要工具。通过不断创新技术和方法,以更好地理解微食物网的结构和功能,从而为实现森林生态系统碳管理的目标提供理论支撑,为森林生态系统的可持续经营提供科学指导,是实现“双碳”战略目标,应对气候变化,并提升森林生态系统碳储存能力的关键前沿。

