不同密度对杉木林根际土壤丛枝菌根真菌群落结构及共生格局的影响特征
王丽艳,李虹茹,黄文超,刘春江,吴巧花,罗坤水
(1. 江西省林业科学院,江西 南昌 330013;2. 江西南昌城市生态系统定位观测研究站,江西 南昌 330013;3. 上海交通大学 农业与生物学院,上海 200240)
杉木Cunninghamialanceolata是我国栽植面积最广的用材林树种,分布在南方16 个省(区),种植面积约占我国人工林面积的16%[1-2]。高密度经营人工林是全球性问题,威胁着全世界人工林的可持续管理。单一栽培和不当的管理措施同样导致了林分结构的简单化,生物多样性的减少以及中国人工林长期生产力的损失。解决这些问题最常用的措施是间伐,即密度控制,通过密度控制实现人工林环境条件的改善,可促进林下植被发育、生物量变化等。国内外学者对林分密度对土壤理化性质和林下植被的影响进行了大量的研究,集中在林下植被多样性、林下更新、林分结构[3]和土壤微生物[4-5]等方面。针对杉木林地微生物研究方面,从不同林分起源[6-7]、林龄[8]、树种组成[9]和采伐更新方式[10]等条件下林地土壤微生物的变化规律、根际菌根功能基因[11]开展了相关研究。全磷和铵态氮是两个最重要的调控不同林龄杉木根际和非根际土壤细菌和真菌群落组成的因子[8]。亚热带杉木纯林向多层混交林的转变通过调节微生物群落增强了土壤团聚体稳定性,改变了细菌群落和真菌多样性[9]。不同森林采伐和更新方式对微生物功能多样性的影响主要是由于采伐残体养分投入的差异,土壤养分是土壤微生物碳代谢活动的主要驱动因子[11]。
根际微生物能感知根系分泌物并影响寄主植物[12],增强植物抗逆性和耐性并促进植物生长。丛枝菌根真菌(AMF)隶属于球囊菌门是土壤微生物的重要组成部分,产生共生关系,AMF 在生态系统中起着重要作用,参与了养分运输、土壤结构改善、寄主抗病抗逆能力提高等生态功能。AMF 是通过提高林木的抗逆性来提高森林生产力。近年来,土壤微生物多样性及其生态功能的研究得到了越来越多研究者的关注,土壤作为世界上最大的生物多样性宝库,微生物多样性的丢失使土壤更加容易退化。通过高通量测序分析的土壤微生物多样性可在基因水平呈现,已应用于荒漠、草原、农田土壤微生物多样性[13]。不同林分密度改变了林下小气候、土壤水气热和理化性质以及林下植被,同时林下植被影响凋落物和根系分泌物组成。这些变化都会作用土壤微生物群落。AMF 在促进植物生长和健康生态系统的可持续性方面起着至关重要的作用。杉木与AMF 形成共生关系。然而,大多数研究只关注与不同林龄杉木人工林相关的AMF[14]。目前尚不清楚不同密度的杉木林如何调节AMF 群落,以及地上植被与微生物的相互关系和作用机制还不够清楚,因此,研究林分密度对土壤微生物结构、林下植被,以及地上地下相互作用关系有助于深刻认识密度变化中微生物生态网络的构成格局。本研究通过分析不同密度杉木林根际土壤AMF 群落多样性和群落结构的差异来间接了解AMF 群落对林分密度的响应。本研究在江西省永丰县官山林场选取4 个密度杉木人工林样地,基于高通量Illumina Miseq测序手段比较不同密度杉木林下土壤AMF 多样性和群落结构,结合土壤养分指标和林下植被多样性分析杉木根际土壤AMF 群落的影响因子,探究杉木人工林不同密度下土壤微生物的演变与林下植被及土壤养分的响应特征,深入理解AMF 与森林生态系统的关系,探究AMF 对林下植被和土壤特征的响应及其机制,以期为林业间伐抚育经营提供可靠依据。
1 材料与方法
1.1 研究区概况
研究区位于江西省吉安市永丰官山林场,气候属亚热带温暖湿润季风气候,年均温约16.3 ~19.5 ℃,冬暖夏热,无霜期长达240 ~307 d。日均温超过10 ℃的持续期为240 ~270 d,活动积温5 000 ~6 000 ℃。
1.2 研究方法
1.2.1 样地设计
2017 年10 月, 选择1990 年造林密度为3 300 株/hm2的,造林8 年后经过间伐密度调控为4种不同密度(3 300、2 700、2 250、1 950 株/hm2)杉木人工林为研究对象,该杉木林未进行林下种植。样地海拔107 ~118 m、坡向均为西南,坡度约15°。每块样地面积20 m×20 m 样方,每个造林密度设置3 组重复样地。样地基本情况如下表1。

表1 不同密度杉木林样地的基本情况Table 1 The basic condition of the sample of different density of C. lanceolata plantation
1.2.2 林下植被调查
采用丁凯等[15]样地法,分别对4 种不同密度林分设置20 m×20 m 标准样地,采用对角线法,在每个样方内选取3 个5 m×5 m 的样方调查灌木层,同时选取3 个1 m×1 m 的样方调查草本层,记录每种植物的名称、高度、株数、盖度等。
1.2.3 土壤样品采集
2019 年10 月,在4 个密度杉木样地用“抖落法”采集根际土壤,根际土壤为粘在细根上的土壤,在每个样方内选取10 株胸径和树高接近的杉木,剥开枯落物层并挖开上层覆土,剪下细根,将粘在细根上土壤用毛刷刷到自封袋中。每个密度取3 个重复样方,每个样方取10 份根际土壤,共获得120 份土壤样品。土壤通过2 mm 筛选后,其中一份保存于-80 ℃冰箱用于AMF 多样性测定,另一部分土样风干后测定土壤养分。土壤pH 值使用pH 计测定(水土比例1∶2.5);土壤全氮(Total nitrogen, TN)采用凯氏定氮仪法测定;土壤全磷(Total Phosphorus, TP)采用氢氧化氮消融-钼锑抗比色法测定;土壤全钾(Total potassium,TK)采用氢氧化氮消融-火焰光度计测定;土壤速效磷(Available phosphorus, AP)测定采用碳酸氢钠溶液提取浸提-钼锑抗比色法;土壤铵态氮(Nitrogen,NH4+-N)和硝态氮(Nitrogen, NO3--N)采用氯化钾浸提-比色法测定[16-17]。
1.3 土壤样品测序
土壤样品委托上海美吉生物医药科技有限公司基于Illumina MiSeq 高通量测序平台,根据相似度将序列聚类为操作分类单元(OTU),凭借OTU数据对AMF 进行多样性分析[8]。
1.4 数据处理与分析
1.4.1 林下植物多样性计算
以每个样方为单位,分别计算群落各层物种重要值,以Simpson 指数、物种丰富度、Shannon-Wiener 指数、Brillouin 指数、McIntosh 指数和均匀度指数Pielou 作为分析群落物种多样性的指标。
1.4.2 微生物多样性计算
Alpha 多样性指数包括反映群落丰富度(Community richness) 的指数:Sobs、Chao1、ACE。反映群落均匀度(Community evenness)的指数:Simpsoneven、Shannoneven。反映群落多样性(Community diversity)的指数:Shannon、Simpson 和Coverage。
1.4.3 数据统计分析
基于样本OTU 丰度进行不同密度杉木根际土壤AMF 群落物种组成Venn 韦恩图和群落组成分析,利用R 语言(version 3.3.1)工具统计和作图。使用层次聚类软件Cluster 3.03 版对不同密度中50个最丰富的OTU 进行分析。不同密度间差异,采用Bray-Curtis 距离算法ANOSIM 分析,检验组间差异是否显著大于组内差异,从而判断分组是否有意义[18]。采用置换多因素方差分析PERMANOVA(permutational MANOVA)和非参数多因素方差分析(nonparametric MANOVA)对总方差进行分解,分析不同分组因素对样品差异的解释度,并使用置换检验进行显著性分析[16]。Network 网络分析不同密度中OTU 和物种的共存关系,进行单因素相关网络和双因素相关网络,选取总丰度前50 的特征,并计算特征之间的相关系数,以反映特征之间的相关性,观察到显著的Spearman 相关性(P<0.05),关键分子种是那些表现出高介数中心值的物种。并使用Cytoscape_3.7.2 软件对共现网络进行可视化。利用半度量(Bray-Curtis)进一步通过冗余分析(Redundancy analysis,RDA)解析不同环境对AMF 真菌群落结构的影响。使用R语言vegan 包或QIIME 软件分析和制图。
2 结果与分析
2.1 不同密度杉木人工林根际土壤AMF 群落组成及结构
由AMF 群落相对丰度图1 可知,在不同密度杉木林根际土壤球囊霉属(Glomus_f_Glomeraceae)均为相对丰度最高的属,在D3(2 250 株/hm2)密度下,球囊霉属相对丰度为99.78%,而在D4(1 950 株/hm2)密度下,巨孢囊霉属(Gigaspora)相对丰度增加,为7.16%。其中,无梗囊霉属(Acaulospora)只存在于D1 密度杉木林。从分子种Species 水平的群落组成分析表明,随着林分密度变小,球囊霉属的Glomous-YAMFato2005-DVTX00084、Glomus-Glo32-VTX00124 种和巨孢囊霉属Gigaspora-decipiens-vtx00039 种相对丰度增大,分别是6.90%、5.89%和7.16%。

图1 种水平不同密度杉木根际土壤AMF 相对丰度Fig. 1 Percent of AMF community abundance in rhizosphere soils under C. lanceolata plantations of different density on species level
比对NCBI 数据库测序序列,本研究共得到163 个AMF-OTUs,分属于1 门1 纲5 目6 科8属,28 个种。8 个属OTU 数目占总OTU 数目的比例分别为:球囊霉属(Glomus-f-Glomeraceae)占97.24%,无梗囊霉属(Acaulospora)占2.09%,巨孢囊霉属(Gigaspora)占1.92%,其他占0.61%。
为研究4 种密度杉木林下根际土壤群落丛枝菌根真菌的差异,利用韦恩 Venn 图对不同密度杉木人工林下根际土壤的AMF 专属OTUs 和共享OTUs(3%进化距离)进行了热图分析。不同密度杉木根际土壤AMF 群落OTU 差异及共有物种如图2 所示,D1 密度中特有OTU 占总OTU序列数的27.87%(114),D2 密度特有OTU 占24.69%,D3 密度中特有OTU 占25.42%,D4 密度中特有OTU 占22.0%。4 种杉木密度下根际土壤共有OTU 数量为44(10.75%)。
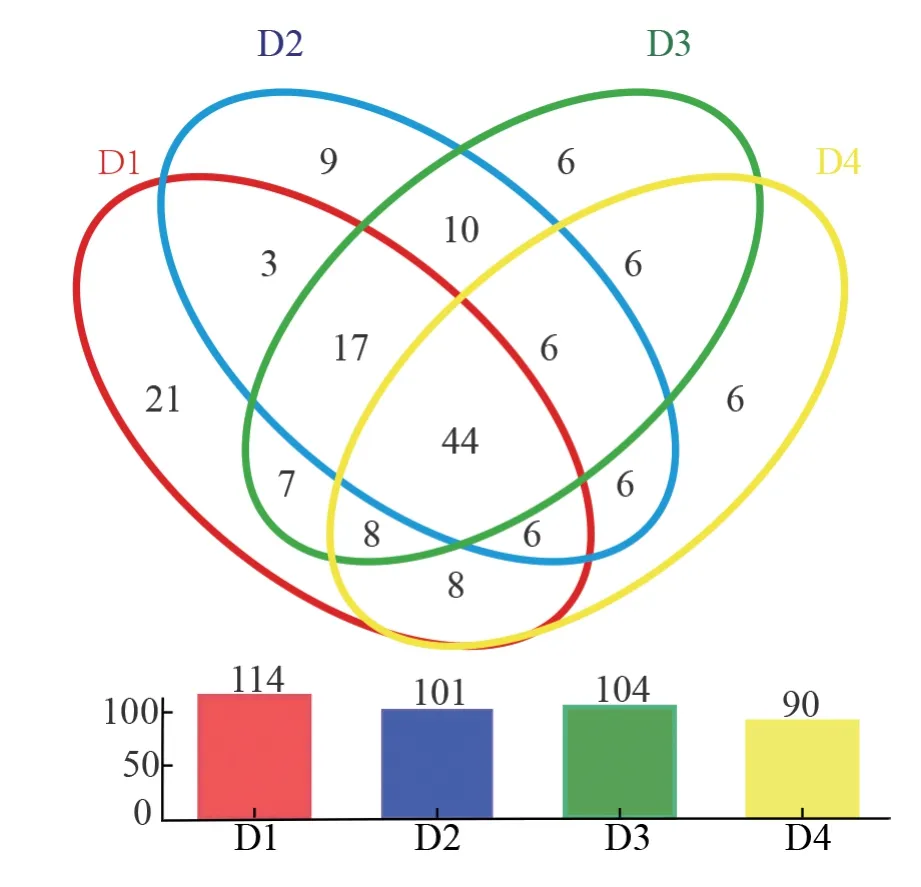
图2 基于OTU 水平的不同密度杉木根际土壤AMF 群落韦恩图Fig. 2 Venn diagram of AMF OTUs in rhizosphere soil under different density of C. lanceolata plantation
2.2 不同密度杉木人工林根际土壤AMF 群落结构及多样性
通过Shannon 指数评估AMF 物种多样性(表2),D3 和D4 密度杉木根际土壤的AMF 群落多样性最高,其次是D1 和D2 林地。这些结果表明密度调控在土壤AMF 物种多样性方面起到了重要作用。而各处理样本在测序覆盖度(coverage)上没有显著差异,所有样本的测序覆盖度高于0.98,说明测序深度足以覆盖包括物种在内的大部分微生物。Chao1 丰富度和Shannon 多样性相一致,进一步说明高密度杉木林地具有更低的微生物多样性。群落均匀性Simpsoneven、Shannoneven 均匀度指数和Heip 群落均匀度指数也随着密度的减小有增加的趋势。

表2 不同密度杉木根际土壤AMF 群落α 多样性指数†Table 2 Alpha diversity index of AMF community in rhizosphere soil under different C. lanceolata plantation
利用ANONIS、ADONIS 和PERMANOVA 3 种不同的方法,分析了不同密度杉木根际土壤AMF群落结构的差异(表3),3 种多因素方差分析结果均表明,4 种不同密度杉木林下土壤AMF 的群落结构存在显著差异(P<0.05)。

表3 不同密度杉木根际土壤AMF 群落结构ANONIS、ADONIS 和PERMANOVA 分析Table 3 ANONIS, ADONIS and PERMANOVA pairwise differences in AMF communities in rhizosphere soils under C. lanceolata plantations of different density
通过Kruskal-Wallis H test 克氏秩和检验对不同密度杉木根际土壤AMF 真菌群落丰度显著性差异检验分析表明(表4),分子种unclassified_g_Glomus_f_Glomeraceae、Glomus-YAMFato2005-DVTX00084 和Glomus-PSAMFG2-VTX00080 的丰度受林分密度的影响差异明显(P<0.05),其他物种丰度受林分密度的影响差异不显著。
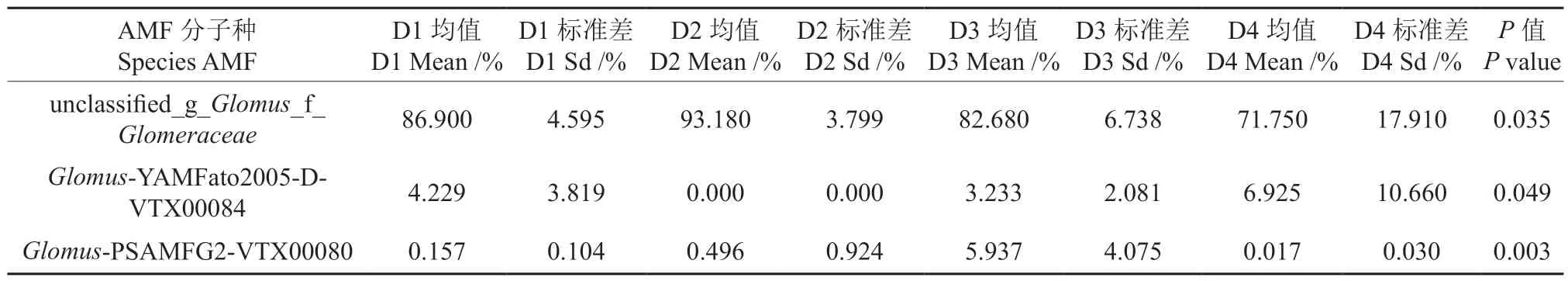
表4 基于种水平的不同密度杉木林土壤AMF 相对丰度组间差异检验Table 4 Significant difference test of AMF community abundance in soil under different density of C. lanceolata plantation
为明确不同密度杉木林下土壤根际AMF 群落的差异,使用热图分析相对丰度前50 的OTU。从群落热图(图3)可以看出,这50 个主要OTU的丰度在4 个不同密度杉木林有所不同。各密度杉木林根际土壤AMF 的优势OTUs 也有所不同。其中,各密度的优势OTU 也不同,D1 密度杉木林根际AMF 微生物占比优势为OTU423、OTU231,D2 密度杉木OTU231 和OTU423 为主,D3 密度杉木OTU296 和OTU497 占为主,D3 密度杉木OTU298、OTU289 占优势。4 种杉木林分根际土壤AMF 群落优势分子种不同。D1 中的丰度较高分子种unclassified-f-Acaulospora,D2 中Glomus-ORVIN-G10313 和Glomus-VTX00223,D3优势分子种分别是Glomus-PSAMG2-VTX00080、Glomus-Frank-A-VTX00082、Glomus-GLAb4.2-VTX00290,D4 中Gigaspora-decipiens-VTX00039、Glomus-Glo32-VTX00124、Glomus-Yamato2005-D-VTX00084。
2.3 植被和土壤环境对AMF 群落结构多样性的影响
在调查的60 个灌木和草本小样方中共统计16种灌木和2 种草本植物(表5),密度相对较低的D3 样地林下植物物种相对较多,有16 种,不同密度杉木林地上部分植被多样性方差分析表明,杉木林分密度对草本植被多样性影响差异不显著。其主要原因是杉木林下草本物种数量仅有2 种。灌木层中,随着林分密度的降低,Shannon 指数呈增加趋势。
丛植菌根真菌只有与寄主形成共生体才能生活。不同寄主植物的根系,影响AMF 群落组成和多样性[19]。林下植被辛普森指数与根际土壤AMF群落多样性辛普森指数呈显著正相关(r=0.494)。地表植被种类少的杉木林根际土壤中AMF 群落多样性也较低,说明AMF 群落多样性受寄主植物多样性的影响,地上植被丰富,根际土壤AMF 群落多样性也较高(表6)。

表6 不同密度杉木林下植被多样性与根际土壤AMF 群落多样性指数相关性分析†Table 6 Correlation analysis of diversity index of understory vegetation and AMF Community in rhizosphere soil under different C. lanceolata plantation
冗余分析(Redundancy analysis,RDA)被用来提取各解释变量在土壤微生物群落多样性中的变化。RDA 分析揭示了AMF 群落与土壤养分之间的关系。以土壤微生物群落组成作为原始变量,RDA 结果显示(图4),不同密度杉木林根际土壤AMF 真菌群落组成信息中的61.99%能够被所列的7 个环境因子所解释。其中,第1、2、3、4 轴的特征值分别是0.254 5、0.114 3、0.044 3、0.018 9,第一轴PC1 解释了大部分的AMF 真菌群落数据的变异,RDA1 解释了46.98%的变异信息,RDA2 解释了3.49%的变异信息。4 种杉木密度类型大致分成4 堆,不同密度杉木林由于局地环境因素影响,林下植被类型存在差异。
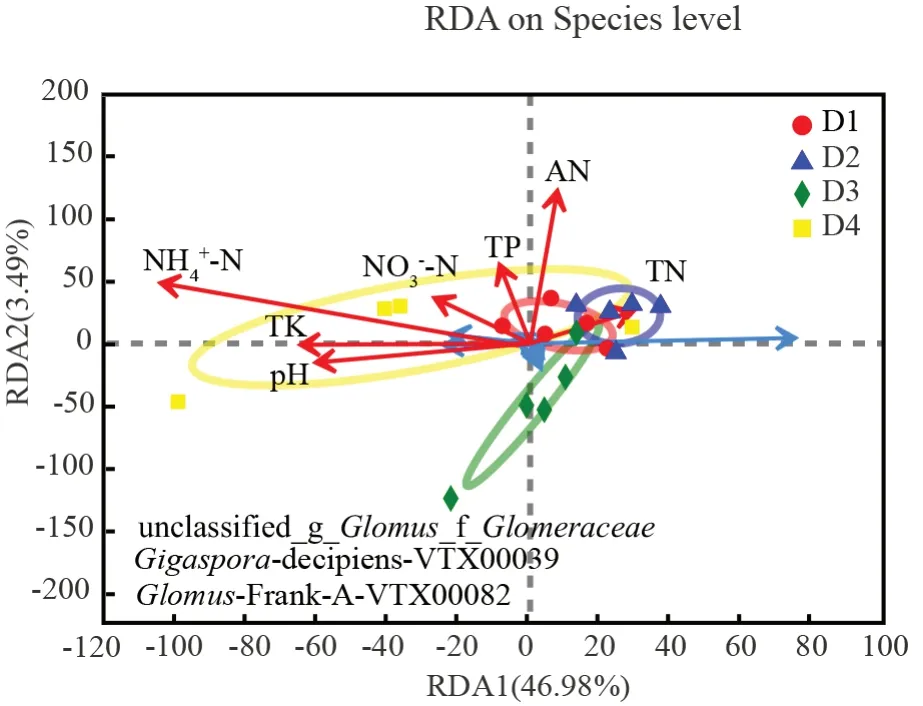
图4 种水平AMF 群落组成与土壤理化性质的RDA 分析Fig. 4 Redundancy analysis to show correlation between the AMF communities and soil physicochemical properties
已有研究发现,土壤微生物群落结构受土壤环境与地上植被的影响。植被类型不同土壤微生物群落组成和分布存在差异[6]。AMF 真菌群落组成显著受到NH4+-N、NO3--N、pH 值、TK 的影响,这与以往研究中,土壤微生物群落组成受地上植被、土壤N 与pH 值等因素的影响的结构类似[20]。碱解氮AN(R2=0.371 1,P=0.014),铵态氮NH4+-N(R2=0.639 1,P=0.001) 与AMF 群落结构具有显著正关性(表7)。综上所述,特定林分环境因素调控AMF 群落组成。
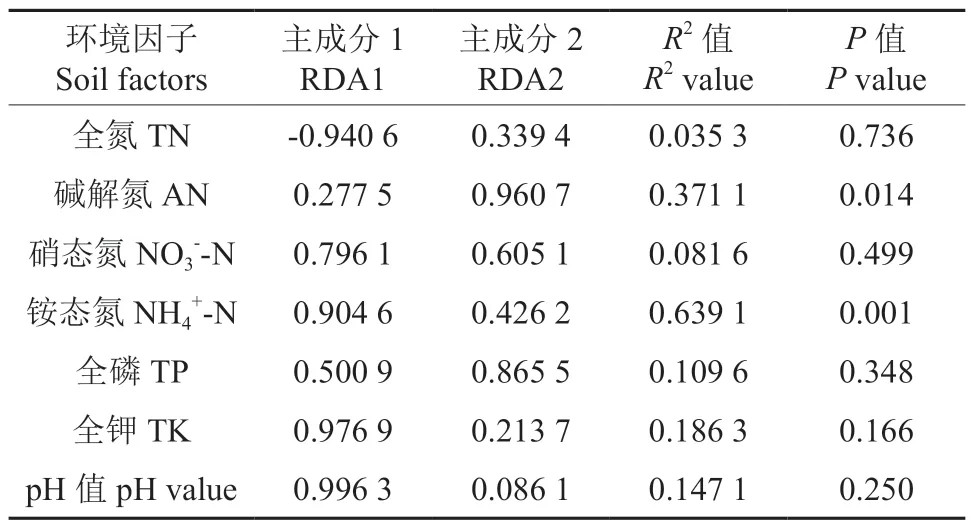
表7 物种与土壤理化性质RDA 相关数据Table 7 RDA data related to species and soil physicochemical properties
2.4 不同密度杉木人工林根际土壤AMF 群落共现性网络分析
共线性网络图可视化展示物种在不同样本中的共现关系。不同密度杉木土壤AMF 共线性网络分析表明(图5),共有分子种4 种,分别是Glomus-Glo32-VTX00124、Glomus-Yamato2005-D-VTX00224、unclassified_g_Glomus_f_Glomeraceae、Glomus-Frank-A-VTX00082。 随着间伐强度的增大,D4 密度杉木林根际土壤AMF群落独有分子物种分别是Glomus-Frank-A1-VTX00269、Glomus-Franke-A1-VTX00076、Gigaspora-decipiens-VTX00039、unclassified_c_Glomeromycetes。
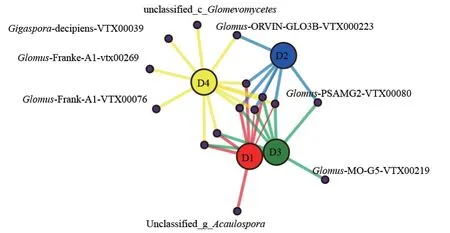
图5 基于种水平的不同密度杉木根际土壤AMF 群落共线性网络Fig. 5 Co-occurring network of AMF communities in rhizosphere soil under different density of C. lanceolata plantation on species level
基于这些OTU 中(图6),46%的OTU 与一个系统有关,证实4 个系统中群落组成的显著的重要OTUs 与所有的密度相关。约14%重要的OTUs 与D1 密度显著相关;约16%的OTU 与D2密度系统相关;22%的OTU 与D3 密度系统相关。16%的重要OTUs 与所有的密度相关。
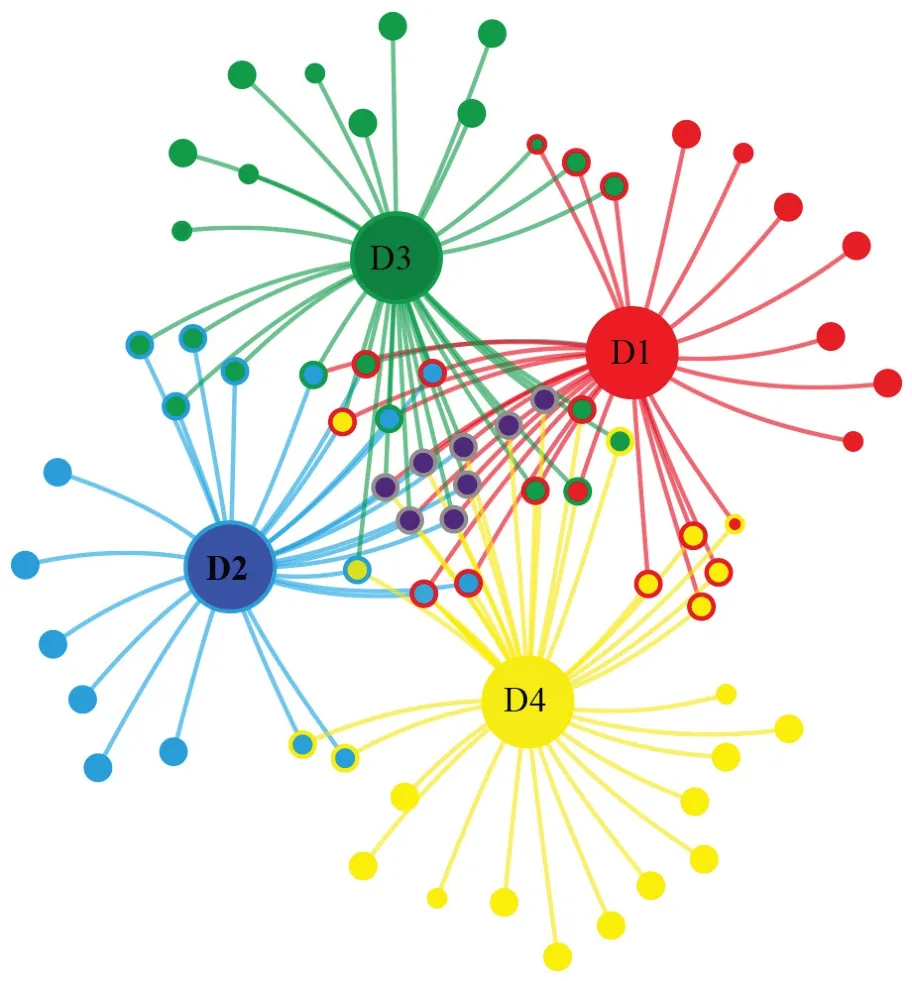
图6 基于OTU 水平的不同密度杉木根际土壤AMF 群落共线性网络Fig. 6 Co-occurring network of AMF communities in rhizosphere soil under different density of C. lanceolata plantation on OTU level
相关性Network 分析发现(图7),在4 种密度杉木林的20 个样本中,10 个种存在正相关关系(Spearman,R2≥0.6,P<0.05);在所有节点中,Glomus球囊霉属占比最多,占了所有节点的66.67%;将节点分布模块化,所有的节点可以分为2 个主要的模块(≥10 个节点);基于介数中心性,该值最高的5 个种分别是Glomus-MOG23-VTX00222、Glomus-viscosum-VTX00063、Glomus-Glo7-VTX00214、Glomus-Yamato08-A1-VTX00100、Glomus-sp.-VTX00304 表明这些AMF在共存在网络中属于核心物种。
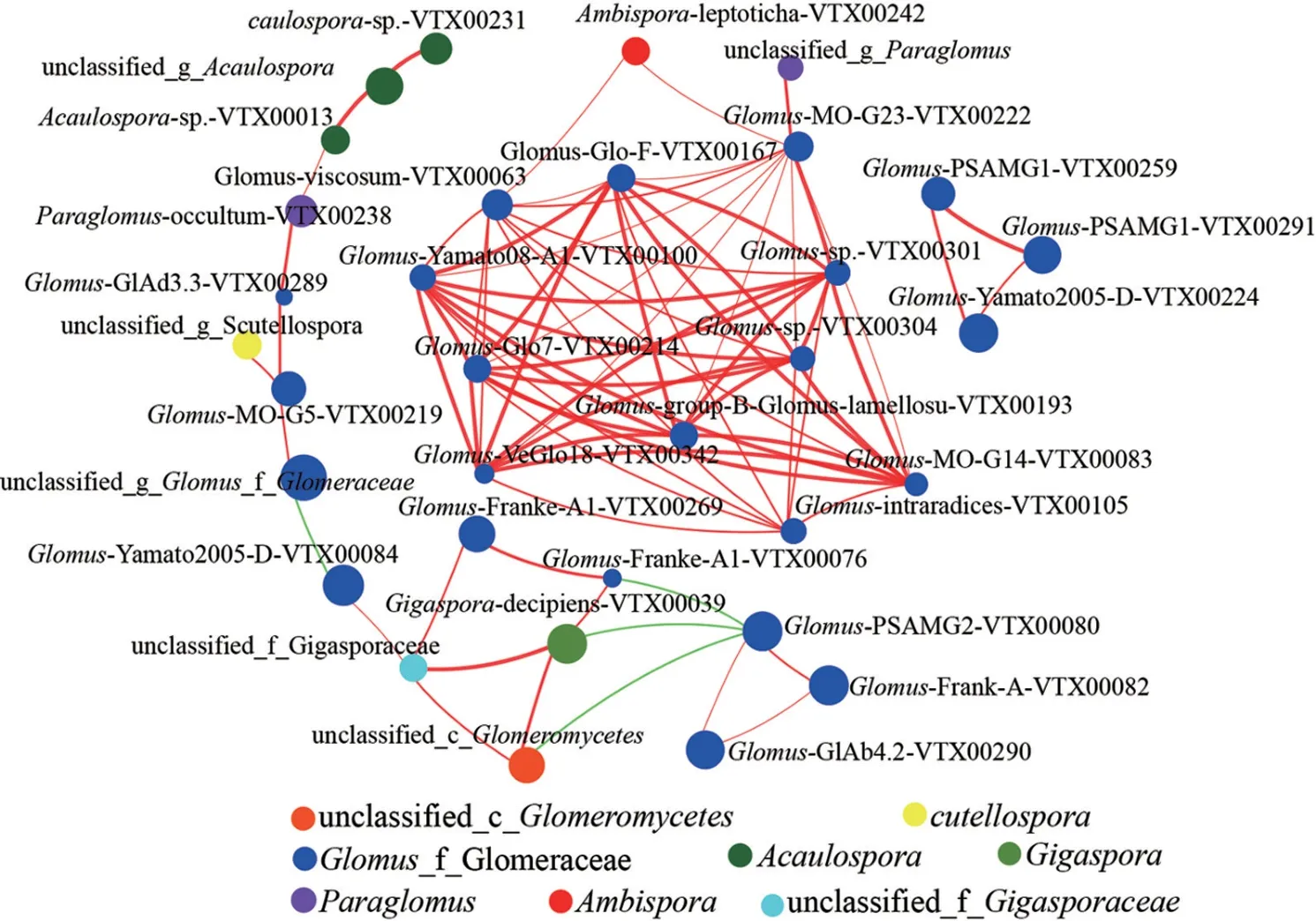
图7 不同密度杉木根际土壤AMF 群落的单因素相关性网络分析Fig. 7 Univariate correlation network analysis of AMF communities in rhizosphere soil under different density of C. lanceolata plantation
环境因子与物种双因素共线性网络分析表明(图8),模块的环境关联不同,只有一个模块与环境因素密切相关。这表明来自同一模块的分类群在生态上相似。在共线性网络中铵态氮NH4+-N 和碱解氮AN 网络中心系数为0.943 4,表明这个模块主要由喜N(unclassified_f_Gigasporaceae、Glomus-Franke-A1-VTX00076、Gigaspora-decipiens-VTX00039、Acaulospora-sp.-VTX00013)和寡营养(Glomus-PSAMG2-VTX00080、Glomus-GlAb4.2-VTX00290、Glomus-Frank-A-VTX00082、Glomusviscosum-VTX00063)的分类群组成。

图8 不同密度杉木根际土壤AMF 群落的双因素网络分析Fig. 8 Two factors correlation network analysis of AMF communities in rhizosphere soil under different density of C. lanceolata plantation
3 讨 论
3.1 杉木人工林根际土壤AMF 群落结构对林分密度的响应
本研究对不同密度杉木林下根际土壤AMF 群落多样性研究结果表明,不同密度下的根际土壤AMF 群落ACE 指数、Chao1 指数和Shannon 指数整体表现为D3、D4 中低杉木林分密度AMF 群落丰富度和多样性明显提高。各密度杉木林根际土壤AMF 的优势OTUs 也有所不同。其原因可能是不同林分密度改变了林下小气候、土壤水气热和理化性质以及林下植被,同时林下植被影响凋落物和根系分泌物组成。这些改变都会影响土壤微生物群落。Guo 等[7]对不同密度杉木林对林下植被和土壤微生物群落结构的影响发现杉木林分密度降低,促进林下植被增多,有利于良好菌群结构保持。这与本研究低密度杉木林分根际土壤AMF 群落多样性相一致,说明合理的杉木林分密度促进微生物群落多样性提高,有利于林地土壤肥力保持。
通过对不同密度下AMF 群落结构之间的相似性和差异性的分析,发现不同密度杉木根际土壤AMF 群落结构存在显著差异;随着林分密度变小,根际土壤球囊霉属的分子种Glomous-Yato2005-D-VTX00084、Glomus-Glo32-VTX00124种和巨孢囊霉属Gigaspora-decipiens-vtx00039 种相对丰度增大;分子种unclassified_g_Glomus_f_Glomeraceae、Glomus-YAMFato2005-D-VTX00084和Glomus-PSAMFG2-VTX00080 的丰度受林分密度的影响差异明显。马克平团队对亚热带森林长期定位监测研究发现[21],土壤真菌对树木密度存在依赖性,丛枝菌根更容易受到同种邻居密度的限制。合理调整林分密度,可改变林下微环境,增加生物多样性。总体来说,AMF 群落多样性的差异性响应林分密度变化。
3.2 不同密度杉木林根际土壤AMF 群落的共生模式
球囊菌属是球囊菌门中最常见和最大的属,与植物根形成共生关系[22]。在共生网络中,研究最丰富的属是球囊霉属,这表明这些多面手适应多种环境。在中心性测量(例如度、介数中心性和紧密中心性)的基础上,在一个共现网络中本质上比其他群体更紧密相连的微生物组[23]。不同密度杉木林根际AMF 群落共生网络的网络中心系数CC 值为0.63,表明该生态网络的相关性强。高于其他生态系统的CC 値。丛枝菌根真菌AMF 可以通过从土壤中吸收养分来提高植物生产力[24]。AMF 群落促进地上植物维持极端生态系统的生物多样性和生产力的重要性[25]。Glomus-MOG23-VTX00222、Glomus-viscosum-VTX00063、Glomus-Glo7-VTX00214 具有前3 个介数中心值,这表明这些节点在共生网络中的重要性。Glomus-MO-G23-VTX00222 在以前的研究中也被确定为关键物种,需要进一步的工作来更好解释这种真菌在共生网络中的作用[26]。因此,所有2 个关键分类群可能在生态过程中发挥关键作用。
微生物间相互作用对宿主-微生物稳态至关重要[27-28]。近年来,基于相关性的网络分析已成功用于探索微生物群落的共生模式[29-30],微生物网络分析已被用作探索一系列环境中相互作用的工具,提供有关微生物合作和竞争的重要细节[31-32]。此外,微生物网络已被强调为了解微生物群落组装动态和成员相互作用对变化环境的反应至关重要[33]。微生物生态网络可以表征群落之间的相互关系。生态网络的特性能够响应微生物群落对环境的变化[34]。已有研究证明,网络中模块化增强网络的稳定性,负相关性网络抗干扰能力强,弱相关性构成的网络更稳定[35]。本研究中,网络分析显示AMF 群落中存在非随机共现模式,10 个最强的正相关都在不同的属之间,这表明代谢合作可能在形成物种共生中发挥重要作用[36]。优势类群驱动网络结构(连通性和介数以及丰度之间呈正相关),这与前人的研究结果一致[21],此外,模块间种丰度和土壤特征之间的不同相关性表明这些组件具有特定的生态特征。这些AMF 真菌群落的非随机组合模式表明,物种间的相互作用和环境筛选在形成群落结构方面占主导地位。
3.3 不同密度杉木林根际土壤AMF 群落结构和多样性的影响因素
植物、土壤和微生物三方复杂的相互作用操纵植物向有利的方向发展,促进植物实现可持续的收益[37]。目前尚不清楚根际/叶际和内生植物区室(即寄主内)中的相互作用在多大程度上影响了微生物组合,以及微生物对植物生境的适应是否驱动了影响植物适应性的生境特定微生物-微生物相互作用策略(M. Amine Hassani)。已有研究表明,影响根际微生物组成的主要因素是土壤类型、土壤pH 值、有效磷和有机碳等对AMF 群落结构有重要影响[38]。本研究表明,不同密度杉木林根际土壤AMF 群落组成与土壤N、pH 值存在正相关关系。pH 值能够影响AMF 的产孢率、菌丝生长和形成,进而改变群落组成。
植物—土壤之间的相互作用是植物群落动态和养分循环的驱动力[39]。植物向地下输入碳源的第一级消费者是真菌[40]。已有研究表明,地上部植被群落变化改变了土壤含水量从而影响土壤微生物群落的重组[21]。张贾宇等[41]研究杨树人工林幼树阶段林下植被管理对土壤微生物量研究表明,林下植物物种数量的增加能提高土壤微生物生物量,同时物种数量增加提高了微生物对碳源的利用。密度调控改善了林分结构,林下植被多样化,提高了生物多样性,从而促进森林养分的利用效率[26]。林分林内小气候、有机质分解、微生物活性和碳流出等方面响应林分结构的改变发生实质性的变化。不同密度杉木的研究发现,适度的密度有利于林下植被生长、林地肥力保持和良好的微生物群落结构[42]。本研究表明,林下植被多样性Shannon 指数与根际土壤AMF 群落Shannon 指数间呈现显著的正相关关系。根际微生物群落的结构是复杂的根-土壤-微生物相互作用的结果。因此,在营林过程中,合理的密度促进养分利用效率,提高林分生产力。本研究杉木根际AMF群落影响因素不够全面,缺乏土壤酶活性、土壤呼吸、微生物生物量等相关指标的综合评价。今后确定土壤微生物的多样性及其影响指标,从不同时间、空间尺度探索AMF 时空演变的驱动机制,研究AMF 生态功能,特别是促进土壤N、P 养分循环与高效利用,并寻求AMF 功能基因。这对于杉木人工林生态系统抚育经营具有重要意义。
4 结 论
杉木林分密度显著影响根际土壤AMF 群落结构。影响AMF 特性的主要土壤环境因子是碱解氮和铵态氮。在林分密度变化过程中,不同土壤理化性质和分类群之间潜在的相互作用可能共同影响杉木林地AMF 群落结构。林分密度影响土壤微生物群落,变化后的土壤微生物群落又会影响地上植被,最终土壤群落与地上植被协同响应密度变化。这一结果为地上地下协同作用构建生态网络的研究提供新的见解。

