大麻二酚灌胃对博来霉素诱导的小鼠肺纤维化改善作用及其机制
张飞宇,孙梦迪,杨慧聪,卢芳,于栋华,刘树民
1 黑龙江中医药大学研究生院,哈尔滨 150040;2 黑龙江中医药大学中医药研究院
肺纤维化(pulmonary fibrosis, PF)是一种由反复炎症反应引起的以成纤维细胞增生、大量细胞外基质(Extracellular matrix, ECM)沉积、肺组织结构破坏为特征的间质性肺疾病[1],表现为肺顺应性下降、气体交换障碍、呼吸困难、活动耐量下降,严重时可引起呼吸衰竭甚至死亡。细胞焦亡又称细胞炎性坏死,是近年来发现的一种新的程序性细胞死亡方式,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物大量释放进而激活强烈的炎症反应。研究[2]显示,细胞焦亡能诱发肺部炎症反应和肺纤维化的进展。肺纤维化可发生于任何年龄段,多见于45~70 岁中老年人,给个人、家庭和社会带来了沉重的负担[3]。近年来上市的吡非尼酮[4]和尼达尼布[5],不良反应较多[6]且价格昂贵,迫切需要寻找预防和治疗肺纤维化的有效药物。大麻二酚(Cannabidiol,CBD)是提取自植物汉麻叶和花的一种非精神活性成分[7],分子式为C21H30O2,具有保护神经[8]、抗焦虑[9]、抗炎[10]、抗氧化[11]、抗肿瘤[12]、改善失眠[13]、提高皮肤自我修复力[14]等多方面的作用。全球多个国家已经把CBD 批准为药用或食品添加剂,我国云南、黑龙江已对汉麻的种植和销售合法化[15]。2018年7月,美国食品和药物管理局批准了第一种含有CBD 的处方药Epidiolex,用于儿童难治性癫痫的治疗[16]。近年来研究发现CBD 具有抗器官纤维化的作用,2022年3—7月,我们观察了大麻二酚灌胃对博来霉素诱导的小鼠肺纤维化改善作用,并探讨其作用机制。
1 材料与方法
1.1 CBD、小鼠、试剂与仪器 CBD 购自西安绿如泉生物科技有限公司。SPF 级Balb/c 小鼠60 只,购自辽宁长生生物技术股份有限公司,体质量18~20 g,8 周龄,许可证号:SCXK(辽)2020-0001。实验动物饲养于黑龙江中医药大学中药研究院动物室,自由进食饮水,温度22℃~26℃,相对湿度在55%~65%之间,昼夜循环,保持12 h光照。本实验经过黑龙江中医药大学实验动物伦理委员会批准,编号2022032901。博来霉素购自索莱宝生物科技有限公司,醋酸泼尼松片购自浙江仙琚制药股份有限公司。羟脯氨酸(Hydroxyproline, HYP)试剂盒、涎液化糖链抗原-6(Krebs Von den Lungen-6, KL-6)试剂盒、基质金属蛋白酶-7(Matrix metalloproteinase-7,MMP-7)试剂盒、IL-1β 试剂盒、IL-18 试剂盒均购自上海研抗生物科技有限公司。Tecan 酶标仪购自瑞士Tecan 公司;高速冷冻离心机购自安徽科大创新股份有限公司中佳分公司;Haier-80℃冰箱购自Haier 公司;Nikon Eclipse Ci-L 型正置白光拍照显微购自日本Nikon 公司;超声振荡器购自昆山市超声仪器有限公司;电热鼓风干燥箱购自杭州艾普仪器设备有限公司;病理组织漂烘仪购自常州中威电子仪器厂;莱卡转轮式切片机购自德国莱卡公司;包埋机购自常州中威电子仪器厂;全自动封闭式组织脱水机购自常州中威电子仪器厂;Myi QTM Optics Module 单色Real-time PCR 检测系统购自美国Bio-Rad公司。
1.2 肺纤维化小鼠模型制备、分组、CBD 给予方法 实验第1 天,60 只Balb/c 小鼠,适应性饲养7 天后,用随机数字表法随机分为对照组、模型组、泼尼松组、CBD 低剂量组、CBD 中剂量组、CBD 高剂量组,每组10 只。模型组、泼尼松组、CBD 低剂量组、CBD 中剂量组、CBD 高剂量组小鼠腹腔注射博来霉素(2 mg/mL)35 mg/kg,每周2 次,连续4 周,制作肺纤维化小鼠模型;对照组腹腔注射等体积生理盐水,每周2次,连续4周。将醋酸泼尼松片用生理盐水溶解成混悬液备用(1 mg/mL),CBD 用玉米油溶解备用(1 mg/mL、3 mg/mL、9 mg/mL)。实验第29天,泼尼松组、CBD 低剂量组、CBD 中剂量组、CBD 高剂量组分别以泼尼松(12 mg/kg)、CBD(12 mg/kg、36 mg/kg、108 mg/kg)进行灌胃,每天1 次,连续28天。模型组、对照组灌入同体积生理盐水。
1.3 各组小鼠肺组织病理学观察 实验第56 天,麻醉处死小鼠后取肺组织,左肺组织用4%多聚甲醛浸泡24 h以上,梯度乙醇脱水,二甲苯透明处理后以石蜡包埋。将石蜡切片切成4 μm厚的切片,脱蜡后置于梯度乙醇中浸泡处理,用苏木精伊红(HE)试剂盒、马松(Masson)试剂盒染色后,生理盐水漂洗1次,再次经脱水、透明后封片,显微镜下观察肺组织病理学变化。
1.4 各组小鼠肺泡炎、肺纤维化严重程度评分 ①根据SZAPIEL 等的方法对各组小鼠肺泡炎严重程度进行评分。0 分:无肺泡炎,肺组织正常;1 分:轻度肺泡炎,单核细胞浸润、肺泡间隔增厚,病变局限于胸膜下,病变范围<20%;2 分:中度肺泡炎,炎症病变主要位于胸膜下,病变范围为20%~50%;3 分:重度肺泡炎,炎症病变弥漫,病变范围>50%。②根据HUBNER 等的方法对各组小鼠肺纤维化严重程度进行评分。0 分:肺泡结构正常、无胶原沉积;1 分:散在少量胶原沉积灶,肺泡间隔厚度≤3 倍正常值,部分肺泡腔扩大,肺泡壁变薄,但无成团肺纤维化;2 分:肺泡间隔厚度>3 倍正常值,明显的胶原沉积,并伴有绳结样改变,但病变未融合,部分肺泡腔扩大,肺泡壁变薄,但无成团肺纤维化;3 分:连续肺纤维化,肺泡间隔厚度>3 倍正常值,部分肺泡腔扩大,肺泡壁变薄;4 分:单个成团胶原沉积灶,病灶范围<10%视野;5 分:融合成团肺纤维化灶,病灶范围10%~50%视野,肺形态结构严重受损但还能依稀可见;6 分:大片融合成团肺纤维化灶,病灶范围>50%视野,大部分肺泡间隔消失,大部分肺结构毁损;7 分:肺泡内几乎充满成片的纤维组织,肺泡间隔消失,但仍可见至少5个气泡样改变;8 分:满视野成团的纤维组织。
1.5 各组小鼠肺组织HYP 及肺纤维化诊断生物标志物检测 ①称取200 mg 的Balb/c 小鼠肺组织,加入2 mL 的组织提取液,置于110 ℃电热鼓风干燥箱,水解6~12 h,用提取液定容至2 mL,4 ℃条件下12000 g 离心20 min,取上清,根据试剂盒说明书检测HYP。②末次给药后3 h,麻醉小鼠,经腹部心脏采血,室温下自然放置30 min 凝固,4 ℃条件下3000 r/min 离心20 min,仔细吸取上清,严格按照ELISA 试剂盒说明书操作检测肺纤维化诊断生物标志物KL-6、MMP-7。
1.6 各组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 及血清IL-1β、IL-18检测 ①小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 检测采用Real-time PCR 法。取肺组织,按照试剂盒说明书TRIzol 法提取总RNA 后,逆转录成cDNA,采用Real-time PCR试剂盒进行扩增,以GAPDH 为内参基因,每个目的基因的待测样本设3个复孔。扩增反应条件为95 ℃预变性30 s,95 ℃变性5 s、60 ℃退火31 s,40 个循环,95 ℃扩增15 s。以2-ΔΔCt表示目的基因的相对表达量。②小鼠血清IL-1β、IL-18 检测采用ELISA 法,检测步骤参照“1.5”。
1.7 统计学方法 采用SPSS20.0 统计软件。计量资料呈正态分布时以±s表示,多组间比较用单因素方差分析,两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理形态比较 HE染色结果显示,对照组小鼠肺组织及肺泡结构完整、清晰,肺泡壁与肺泡间隔形态完整,无渗出物,未变厚,无炎性细胞浸润和充血水肿;模型组小鼠肺组织病理变化主要为肺泡炎,肺泡壁和肺间质大量单核细胞、中性粒细胞、浆细胞、淋巴细胞等炎性细胞浸润,严重的有脓肿灶出现,肺泡间隔变厚,血管炎病变和局灶肺水肿,少量肺泡腔内巨噬细胞渗出等;泼尼松组、CBD 低剂量组、CBD 中剂量组、CBD 高剂量组肺泡结构基本正常,炎性细胞浸润情况不同程度减轻。Masson 染色结果显示,对照组小鼠肺泡结构完整,肺泡壁及血管壁胶原纤维排列规整;模型组肺泡结构不完整,肺泡壁增厚,其中胶原纤维明显增多,结构排列紊乱,肺泡毛细血管扩张,部分肺泡腔内有渗出;泼尼松组、CBD 低剂量组、CBD 中剂量组、CBD高剂量组肺泡结构基本正常,肺泡壁增厚、肺泡腔内渗出、胶原纤维含量及排列情况呈不同程度减轻。
2.2 各组小鼠肺泡炎、肺纤维化严重程度评分比较 ①对照组鼠肺泡炎、肺纤维化严重程度评分为(0.73± 0.49)分、(0.94± 0.66)分,模型组小鼠肺泡炎、肺纤维化严重程度评分为(2.32± 0.58)分、(2.92± 1.02)分,两组相比,P均<0.05。②各组小鼠肺泡炎、肺纤维化严重程度评分见表1。由表1可知,与模型组相比,CBD 低剂量组、CBD 中剂量组、CBD 高剂量组、泼尼松组小鼠肺泡炎、肺纤维化严重程度评分均降低(P均<0.05),且CBD各剂量组之间有剂量依赖性(P均<0.05),CBD 高剂量组与泼尼松组之间差异无统计学意义(P均>0.05)。
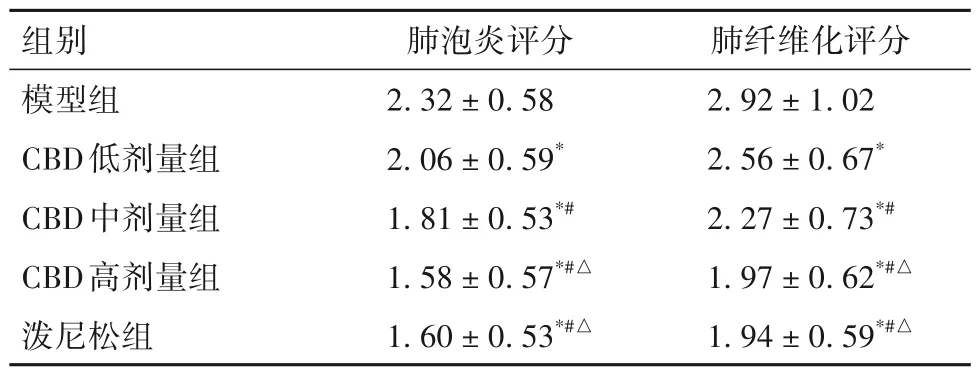
表1 各组小鼠肺泡炎、肺纤维化严重程度评分比较(分,-x± s)
2.3 各组小鼠肺组织HYP 及血清KL-6、MMP-7 水平比较 ①对照组小鼠肺组织HYP 及血清KL-6、MMP-7 水平分别为(11.82± 2.21)μg/mg、(287.19± 121.36)pg/mL、(19.21± 2.07)pg/mL,模型组小鼠肺组织HYP及血清KL-6、MMP-7水平分别为(27.17± 1.50)μg/mg、(354.43± 185.19)pg/mL、(38.84± 2.04)pg/mL,两组相比,P均<0.05。②各组小鼠肺组织HYP 及血清KL-6、MMP-7水平比较见表2。由表2 可知,与模型组相比,CBD低剂量组、CBD 中剂量组、CBD 高剂量组、泼尼松组小鼠肺组织HYP 及血清KL-6、MMP-7 水平均降低(P均<0.05),且CBD 各剂量组之间有剂量依赖性(P均<0.05),CBD 高剂量组与泼尼松组之间差异无统计学意义(P均>0.05)。
表2 各组小鼠肺组织HYP、血清KL-6、MMP-7水平比较(±s)
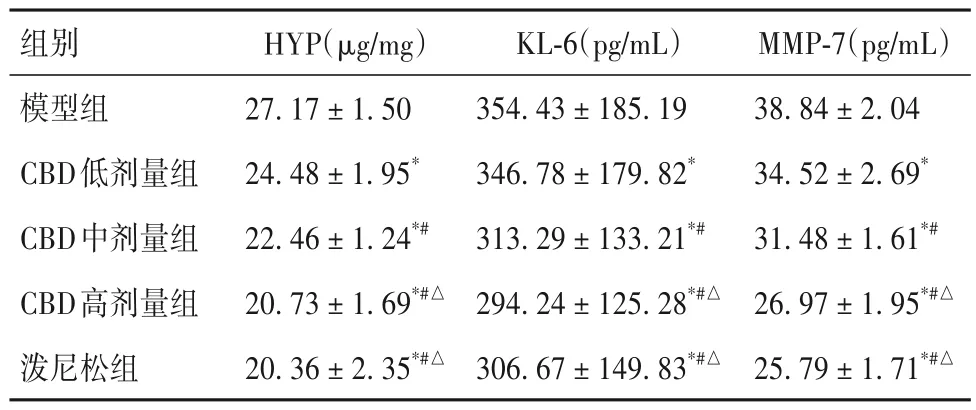
表2 各组小鼠肺组织HYP、血清KL-6、MMP-7水平比较(±s)
注:与模型组相比,*P<0.05;与CBD 低剂量组相比,#P<0.05;与CBD中剂量组相比,△P<0.05。
MMP-7(pg/mL)38.84± 2.0434.52± 2.69*31.48± 1.61*#26.97± 1.95*#△25.79± 1.71*#△组别模型组CBD低剂量组CBD中剂量组CBD高剂量组泼尼松组HYP(μg/mg)27.17± 1.5024.48± 1.95*22.46± 1.24*#20.73± 1.69*#△20.36± 2.35*#△KL-6(pg/mL)354.43± 185.19346.78± 179.82*313.29± 133.21*#294.24± 125.28*#△306.67± 149.83*#△
2.4 各组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量及血清IL-1β、IL-18水平比较检测
2.4.1 各组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量比较 ①对照组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量分别为0.83± 0.11、0.82± 0.11、0.88± 0.25、0.72±0.14、0.77± 0.13,模型组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量分别为2.10± 0.11、2.16± 0.14、2.42±0.26、2.15± 0.15、2.20± 0.16,两组相比,P均<0.05。②各组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA相对表达量比较见表3。由表3可知,与模型组相比,CBD 低剂量组、CBD中剂量组、CBD高剂量组、泼尼松组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量均降低(P均<0.05),且CBD 各剂量组之间有剂量依赖性(P均<0.05),CBD 高剂量组与泼尼松组之间差异无统计学意义(P均>0.05)。
表3 各组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量比较(±s)
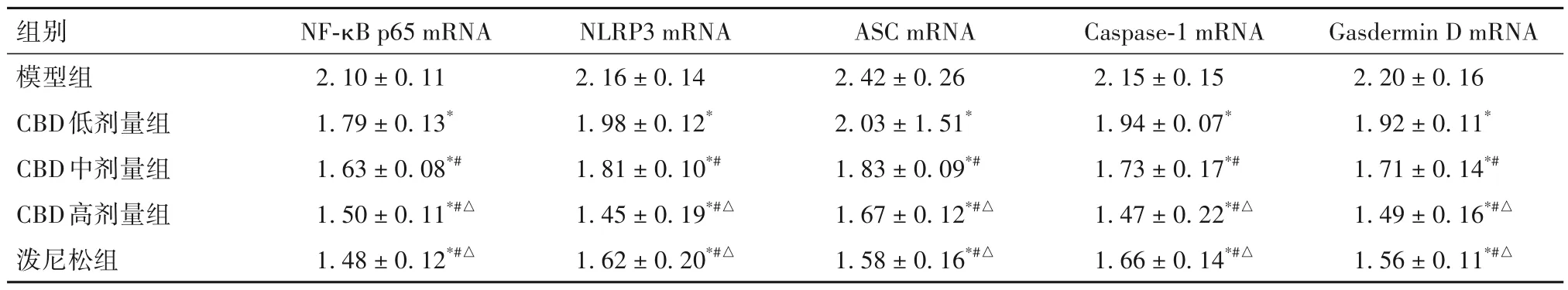
表3 各组小鼠肺组织中NF-κB p65、NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量比较(±s)
注:与模型组相比,*P<0.05;与CBD低剂量组相比,#P<0.05;与CBD中剂量组相比,△P<0.05。
组别模型组CBD低剂量组CBD中剂量组CBD高剂量组泼尼松组Gasdermin D mRNA 2.20± 0.161.92± 0.11*1.71± 0.14*#1.49± 0.16*#△1.56± 0.11*#△NF-κB p65 mRNA 2.10± 0.111.79± 0.13*1.63± 0.08*#1.50± 0.11*#△1.48± 0.12*#△NLRP3 mRNA 2.16± 0.141.98± 0.12*1.81± 0.10*#1.45± 0.19*#△1.62± 0.20*#△ASC mRNA 2.42± 0.262.03± 1.51*1.83± 0.09*#1.67± 0.12*#△1.58± 0.16*#△Caspase-1 mRNA 2.15± 0.151.94± 0.07*1.73± 0.17*#1.47± 0.22*#△1.66± 0.14*#△
2.4.2 各组小鼠血清IL-1β、IL-18 水平比较 ①对照组小鼠血清IL-1β、IL-18 水平分别为(11.13±1.79)pg/mL、(19.58± 1.44)pg/mL,模型组小鼠血清IL-1β、IL-18 水平分别为(24.49± 1.78)pg/mL、(28.31± 2.08)pg/mL,两组相比,P均<0.05。②各组小鼠血清IL-1β、IL-18 水平比较见表4。由表4 可知,与模型组相比, CBD 低剂量组、CBD 中剂量组、CBD 高剂量组、泼尼松组小鼠血清IL-1β、IL-18水平水平均降低(P均<0.05),且CBD各剂量组之间有剂量依赖性(P均<0.05),CBD 高剂量组与泼尼松组之间差异无统计学意义(P均>0.05)。
表4 各组小鼠血清IL-1β、IL-18水平比较(pg/mL,±s)

表4 各组小鼠血清IL-1β、IL-18水平比较(pg/mL,±s)
注:与模型组相比,*P<0.05;与CBD 低剂量组相比,#P<0.05;与CBD中剂量组相比,△P<0.05。
IL-1828.31± 2.0825.35± 0.88*23.49± 1.58*#20.97± 1.24*#△21.64± 1.35*#△组别模型组CBD低剂量组CBD中剂量组CBD高剂量组泼尼松组IL-1β 24.49± 1.7821.77± 1.56*19.87± 1.38*#15.48± 1.97*#△17.90± 1.87*#△
3 讨论
博来霉素是一种化疗药物,因肺组织中酰胺酶活性低,博来霉素代谢较慢,具有明显的肺毒性,其与铁离子形成的复合物嵌入DNA 后引起DNA 链的断裂[17]。因博来霉素引起的症状、肺功能变化和影像学改变与肺纤维化较为相似,是肺纤维化实验中最常用的造模药物。本实验通过多次腹腔注射博来霉素发现,小鼠肺组织HE 染色、Masson 染色结果相对于对照组出现了明显的肺泡炎和肺纤维化病变,表明多次腹腔注射博来霉素法可以制作小鼠肺纤维化模型,这与苏敏红等[18]研究结果一致。依据SZAPIEL肺泡炎评分法和HUBNER 肺纤维化评分法,评分结果发现相对于模型组,各给药组肺泡炎程度如肺泡壁和肺间质炎性细胞浸润、局灶肺水肿、肺泡腔内巨噬细胞渗出等情况和肺纤维化程度如胶原纤维明显增多、结构排列紊乱、肺泡毛细血管扩张等情况均不同程度缓解,且CBD 的缓解作用呈剂量依赖性。
肺纤维化是由多种致病因素引起的反复创伤愈合反应,造成肺间质成纤维细胞增殖及大量ECM 异常增生,最终导致肺泡空间结构破坏、肺血管重塑、肺硬度的增加[19]。Ⅱ型肺泡上皮细胞具有干细胞特性,在各种刺激因素作用下可通过上皮间充质转化逐渐转化为成纤维细胞和肌成纤维细胞,大量分泌胶原蛋白,导致肺间质胶原蛋白含量增多、肺组织收缩、变硬。胶原蛋白是ECM 的主要成分,胶原蛋白含量增加引起ECM 重构是纤维化的最重要表现形式。HYP 是胶原蛋白中特有的一种亚氨基酸,来源固定的胶原蛋白其含量稳定,是衡量胶原蛋白的标尺,HYP 含量的变化可以间接反应组织胶原蛋白的含量[20],是衡量纤维化程度的重要指标。我们研究发现,模型组小鼠肺组织HYP 含量相对于对照组明显升高,表明博来霉素引起了肺组织纤维蛋白含量增加,是肺纤维化发生的直接证据。各给药组肺组织HYP含量均有所下降,且CBD 的缓解作用呈剂量依赖性,这与Masson染色结果相互印证。
KL-6 在退变的Ⅱ型肺泡上皮细胞表达增强,是判断Ⅱ型肺泡上皮细胞功能的特异性指标。KL-6在肺部基底膜受损,血管通透性增加时可导致KL-6入血,血清中KL-6能敏感地反应肺泡上皮和间质的损伤程度,其含量与损伤程度正相关,已被多国确定为肺纤维化诊断与判断预后的生物标志物[21]。MMP-7在肺组织损伤阶段,可降解基底膜和ECM 成分;在修复阶段,引起异常的组织重构,从而引起肺泡结构的重建形成肺纤维化,血清中MMP-7 水平升高与肺纤维化程度正相关。KL-6 和MMP-7 是肺纤维化的独立预测因子,二者同时升高,可提高肺纤维化诊断的特异性。模型组小鼠血清KL-6 和MMP-7含量对于对照组明显增加,符合鲁未等[22]确诊肺纤维化的标准。CBD 低、中、高给药组血清KL-6 和MMP-7 含量相对于模型组均明显下降且成剂量依赖性,多角度证明了CBD对肺纤维化的缓解作用。
肺纤维化的发生与炎症关系密切,炎症损伤后发生的异常修复最终导致形成局部瘢痕性变化,影响肺换气功能。因此,抑制炎症反应是缓解肺纤维化发生的重要途径。细胞焦亡是机体一种重要的天然免疫反应,在感染性疾病发生发展中发挥重要作用。经典的细胞焦亡途径也称为依赖Caspase-1 的细胞焦亡途径,在刺激因素的作用下NLRP3 蛋白、ASC 蛋白、半胱天冬酶-1 前体(Pro-Caspase-1)蛋白表达量增加,三者组装成NLRP3 焦亡小体,进一步产生成熟的Caspase-1,Caspase-1 切割Gasdermin D蛋白,生成Gasdermin D 氮端游离的活性域多肽(GSDMD-N)在细胞膜上形成众多的小孔,使细胞膜完整性受损,导致细胞失去调控物质进出的能力,最终膨胀破裂,释放出细胞内容物;同时促进白细胞介素-1β 前体(pro-IL-1β)和白细胞介素-18 前体(pro-IL-18)成熟,生成大量IL-1β 和IL-18,扩大炎症反应。我们通过Real-time PCR 检测发现模型组小鼠肺组织NLRP3、ASC、Caspase-1、Gasdermin D mRNA 相对表达量相对于对照组均显著升高,ELISA 检测模型组小鼠血清中IL-1β、IL-18 含量相对于对照组均显著升高,提示博来霉素诱导的肺纤维化模型发生了经典细胞焦亡。NF-κB p65 蛋白是NF-κB 信号通路中的重要产物,做为转录因子与DNA 相应序列结合后,可上调相应基因的转录。实验结果表明,各给药组肺组织NF-κB p65、NLRP3、ASC、Caspase-1、GSDMD mRNA 相对表达量和血清中IL-1β、IL-18含量均不同程度降低,CBD 高剂量组的降低作用较低剂量更明显,呈剂量依赖性,其原因可能是通过NF-κB信号通路抑制了细胞焦亡发生的强度,但具体是通过NF-κB信号通路的哪个环节发挥作用还有待进一步研究。
综上所述,CBD 对博来霉素诱导的肺纤维化动物模型的改善作用呈剂量依赖性,其作用机制可能是通过抑制NF-κB 信号通路,减少NLRP3 炎症小体相关蛋白的表达,抑制细胞焦亡发生的程度,从而减轻了肺纤维化。

