不同抗性柑橘对野生型和柑橘链格孢毒素合成受阻褐斑病菌侵染的转录响应差异
马慧,马海杰,焦晨,李红叶*
(1.农业农村部作物病虫分子生物学重点实验室/浙江省作物病虫生物学重点实验室/浙江大学农业与生物技术学院,浙江 杭州 310058;2.农业农村部亚热带果品蔬菜质量安全控制重点实验室/浙江农林大学园艺科学学院,浙江 杭州 311300)
柑橘褐斑病(Alternaria brown spot, ABS)是由链格孢菌橘致病型(Alternaria alternatapathotypetangerine)引起的真菌性病害,主要为害一些橘类和由这些橘类杂交而来的柑橘。该病菌主要为害幼嫩新梢和果实,引起大量的落叶、落果和枯梢,严重时可造成春梢几乎全部枯死,果实落光,颗粒无收,使果农损失严重[1],是红橘、贡柑、瓯柑、椪柑、甜橘柚、爱媛等柑橘品种的重要病害之一。
作为死体营养型病原真菌,柑橘褐斑病菌产生的寄主选择性毒素——柑橘链格孢毒素[Alternaria citritoxin(ACT),一类环氧癸三烯酸类化合物]是重要的致病因子,在该病菌孢子萌发过程中即可产生,通过破坏寄主细胞质膜结构,引起细胞电解质快速渗漏,导致细胞死亡,进而死亡的细胞为病原菌定植生长提供能量[2]。此外,研究还发现该病菌分泌的细胞壁降解酶(cell wall-degrading enzymes,CWDEs)和活性氧解毒酶等也是致病因子,可帮助其成功定植和参与致病[3-5]。已有研究表明:合成ACT的基因都是多拷贝基因,除编码烯酰辅酶A水合酶的基因ACTT6外,其余毒素基因构成簇分布在条件非必要染色体(conditionally dispensable chromosome,CDC)上;ACTT6有2 个拷贝,对其进行敲除或者沉默可导致褐斑病菌无法合成ACT,同时丧失对感病叶片的致病力[6-7]。
前人关于柑橘对褐斑病菌的侵染或毒素响应机制也有一些研究。SHISHIDO 等[8]应用抑制消减杂交手段比较了对ACT 不敏感的粗柠檬(Citrus jambhiriLush.)对褐斑病菌产毒菌株和不产毒菌株的转录响应,发现粗柠檬对产毒菌株产生的防御反应比对不产毒菌株的更强烈;YAMASAKI 等[9]从粗柠檬中鉴定到一个定位于叶绿体的萜类合酶(terpene synthase, TPS)基因RlemTPS3,证实其可参与抗菌化合物单萜香叶醇的合成。针对不同褐斑病抗性的柑橘,接种褐斑病菌6 h 和12 h 的蛋白质组学研究表明,相比感病品种,抗病品种有更多的差异表达蛋白显著富集在解毒和免疫等生物过程中[10]。唐科志等[11]通过RNA 测序(RNA sequencing, RNA-Seq)解析了感病品种红橘接种柑橘褐斑病菌28 h 后基因转录水平的变化和功能通路的富集,共鉴定出11 728 个差异表达基因(differentially expressed genes, DEGs),发现受病原菌诱导的基因多富集在植物防御反应、转录因子(transcription factor, TF)调控、激素信号转导、活性氧清除等通路上,为柑橘响应褐斑病的免疫反应、功能基因表达及代谢通路等研究提供了一定的理论依据。但是,不同抗性品种对关键致病因子ACT 转录响应机制是否相同及其与寄主对褐斑病抗性的关系,仍有待研究。为解决上述问题,本研究将产毒的野生型菌株和ACT合成受阻菌株(ΔΔACTT6双敲除突变体)分别接种于抗褐斑病柑橘克里曼丁和感病柑橘丹西红橘上,通过转录组手段分析比较ACT对抗病、感病柑橘基因转录调控的影响,从而探讨抗病、感病柑橘的防御响应网络,以期挖掘受ACT激活或抑制的防御关键基因和代谢通路,在分子水平上为改良柑橘对褐斑病的抗性提供理论依据。
1 材料与方法
1.1 实验材料及处理
柑橘褐斑病菌野生型菌株Z7 由本实验室于2012 年自浙江省温州市发病瓯柑叶片上分离得到,保存于-80 ℃甘油中,其基因组已测序发表[12]。褐斑病菌毒素合成基因簇上ACTT6的2 个同源基因的双敲除突变体菌株ΔΔACTT6由本实验室保存,通过高效液相色谱法(high performance liquid chromatography, HPLC)检测确认该突变体已丧失ACT合成能力[13]。抗病品种为克里曼丁(Citrus clementinaHort.ex Tan.cv.Clementine),感病品种为丹西红橘(Citrus reticulataBlanco cv.Dancy),均盆栽于浙江大学紫金港校区设施温室内。
将野生型菌株Z7 和双敲除突变体菌株ΔΔACTT6在马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基平板上进行活化,26 ℃培养4~5 d 后,拆开封口膜并倒置培养3~4 d,待其产生足够孢子后在每个平板中加入适量无菌水,用灭菌过的三角棒轻轻刮擦菌落,过滤得到孢子悬浮液,然后使用血球计数板将孢子浓度稀释为1×105mL-1。正常产毒菌株接种处理:将野生型菌株Z7 的孢子悬浮液均匀喷洒在大小和成熟度基本一致的克里曼丁和丹西红橘离体叶片上,于保鲜盒内保湿,置于26 ℃培养箱中诱导孢子萌发侵染。不产毒菌株接种处理:按照上述实验步骤,将双敲除突变体菌株ΔΔACTT6的孢子悬浮液进行同样的接种和培养。各处理组3 个生物学重复,分别在接种24 h 和48 h后取样。
1.2 RNA 提取和转录组测序
采用植物总RNA提取试剂盒(浙江易思得生物科技有限公司)提取柑橘样品叶片RNA,并交由北京诺禾致源科技股份有限公司建库测序,测序平台为Illumina NovaSeq,读长模式为双端150 bp。转录组原始数据已上传至NCBI 数据库(https://www.ncbi.nlm.nih.gov/),项目编号为PRJNA922240。
1.3 数据分析
1.3.1 原始序列质控
为保证后续分析的可靠性,对RNA-Seq 的原始下机数据进行质量控制。使用Trimmomatic[14](v0.38)去除低质量和带有接头的序列,使用Bowtie v1.3.0 比对rRNA 数据库以去除核糖体rRNA 序列,得到高质量读长(clean reads)[15],并用FastQC v0.11.9(https://www.bioinformatics.babraham.ac.uk/projects/fastqc)对过滤后的测序样本进行质量检测。
1.3.2 基因序列比对
将质控后的数据用HISAT[16](v2.1.0)比对至目前拼接质量最高的柑橘基因组——甜橙参考基因组[17]上,并用HTSeq[18](v0.11.3)对基因的表达进行定量,通过Perl脚本计算基因的FPKM值。
1.3.3 差异表达基因计算
为鉴定柑橘对毒素的差异响应基因,使用DESeq2[19](v1.32.0)对不产毒的双敲除突变体菌株处理样品和产毒的野生型菌株处理样品的基因表达水平进行比较,将表达差异在2 倍以上且校正后p值≤0.05的基因定义为显著差异基因。其中,在野生型菌株处理样品中表达显著升高的基因为产毒菌株诱导基因,在不产毒菌株处理样品中表达显著升高的基因为不产毒菌株诱导基因。
1.3.4 基因功能注释和富集分析
对甜橙基因组进行功能注释,使用DIAMOND[20](v2.0.11.149)将参考基因序列在Swiss-Prot、TrEMBL和Araport11数据库中进行比对,预测基因功能和保守结构域。用iTAK[21](v1.7)预测全基因组转录因子、转录调节因子和蛋白激酶。
使用Blast2GO[22](Omicsbox v2.0.36)和Blast-KOALA[23]将甜橙参考基因组比对到基因本体(gene ontology, GO)及京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)中进行注释,并分别采用GOATOOLS[24](v1.1.6)和Cluster-Profiler 4.0[25]进行基因数据集的GO 功能和KEGG通路的富集分析[错误发现率(false discovery rate)≤0.05]。
1.4 实时荧光定量聚合酶链反应验证
根据转录组分析结果,随机选取6 个差异表达基因(表1)进行实时荧光定量聚合酶链反应(realtime fluorescent quantitative polymerase chain reaction,qRT-PCR)扩增,验证转录组测序数据的可靠性。
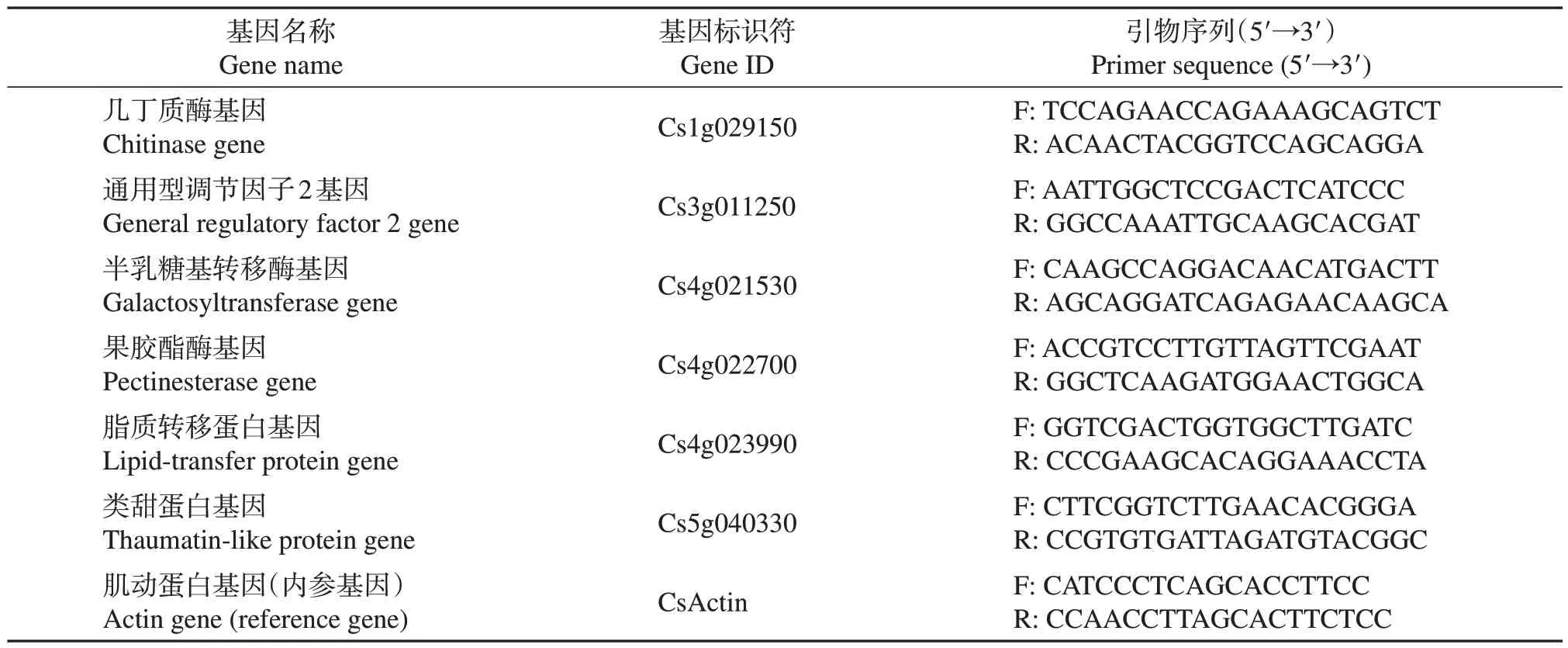
表1 用于qRT-PCR验证的基因及引物序列Table 1 Genes and primer sequences for qRT-PCR
使用Primer3Plus设计基因特异性引物(相关信息如表1所示),并利用琼脂糖凝胶电泳和qRT-PCR熔解曲线验证引物特异性。qRT-PCR 反应体系:SYBR Green Ⅰ qPCR Master Mix(南京诺唯赞生物科技股份有限公司)10 μL,上、下游引物各0.4 μL(10 μmol/L),模板cDNA 1 μL,使用ddH2O 补足至20 μL。qRT-PCR反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。每个样品重复3 次,使用肌动蛋白(actin)基因作为内参基因。采用2-ΔΔCT法计算基因的相对表达量和表达变化倍数(经log2转换)。
2 结果与分析
2.1 接种观察
使用野生型菌株Z7 的孢子悬浮液(浓度为1×105mL-1)或相同浓度的双敲除突变体菌株ΔΔACTT6的孢子悬浮液喷雾接种抗病品种克里曼丁和感病品种丹西红橘的离体叶片,保湿,分别在接种24 h 和48 h 后取样观察。结果(图1)发现:抗病品种克里曼丁在接种菌株Z7和ΔΔACTT6实验中均未表现出症状;感病品种丹西红橘在接种野生型菌株24 h后出现了零星的褐色病斑,在接种48 h后出现了明显的黑褐色点状病斑;而接种ΔΔACTT6的丹西红橘叶片在24 h和48 h均没有症状出现,证实该突变体已丧失致病力。

图1 抗病柑橘克里曼丁和感病柑橘丹西红橘叶片接种后的症状表现Fig.1 Symptoms on Clementine (resistant) and Dancy (susceptible) leaves after inoculation
2.2 测序数据结果
测序的原始数据经过滤质控后,各转录组文库的高质量读长都占原有测序产生的原始读长(raw reads)的90%以上(附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.12.221)。将高质量读长与甜橙参考基因组进行比对发现,平均有97.32%的RNA-Seq 序列被成功比对上,说明测序结果较好,可用于后续分析。此外,总计有23 581 个基因在样品中被检测到转录,占参考基因组总数的78.93%。根据主成分分析结果(附图1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.12.221),不同品种在第一主成分(principal component 1, PC1)轴上可以区分开,在第二主成分(PC2)轴上可以区分2 组菌株接种情况,表明实验接种成功且生物学重复性高。
2.3 差异表达基因
通过比较柑橘叶片在接种产毒和不产毒菌株后的基因表达情况,分别计算抗病和感病品种中的差异表达基因(DEGs)。将不同实验组所包含的DEGs 数目和不同实验组间产生交集的DEGs 数目绘制成UpsetR 图。结果(图2)表明:接种24 h 后,在克里曼丁中检测到190 个产毒菌株诱导的DEGs,132 个不产毒菌株诱导的DEGs;在丹西红橘中检测到1 298 个产毒菌株诱导的DEGs,683 个不产毒菌株诱导的DEGs。接种48 h 后,在克里曼丁中检测到595 个产毒菌株诱导的DEGs,1 263 个不产毒菌株诱导的DEGs;在丹西红橘中检测到3 555个产毒菌株诱导的DEGs,4 343个不产毒菌株诱导的DEGs。随着侵染时间的延长,柑橘对2种菌株的响应差异增大,大量基因被产毒菌株诱导表达,且在感病品种中更明显。在所有DEGs 数据集中,有1 636 个DEGs 在克里曼丁和丹西红橘中都能被检测到,有307 个DEGs 仅在克里曼丁中被检测到,有6 637个DEGs仅在丹西红橘中被检测到。
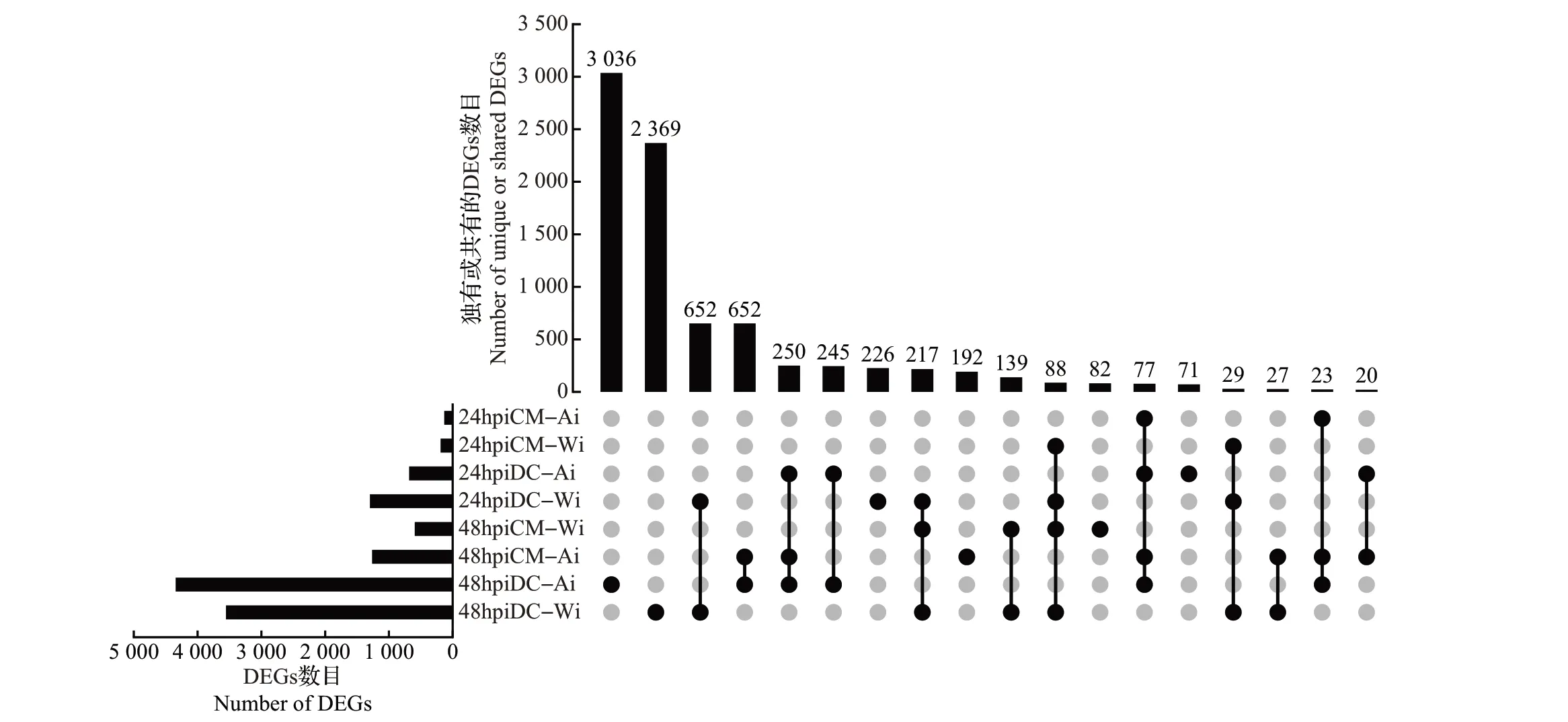
图2 不同处理组间差异表达基因(DEGs)比较Fig.2 Comparisons of DEGs among different treatment groups
2.4 GO 功能富集分析
使用GO 富集分析比较2 个柑橘品种对产毒和不产毒菌株的整体转录响应模式,结果如图3所示。
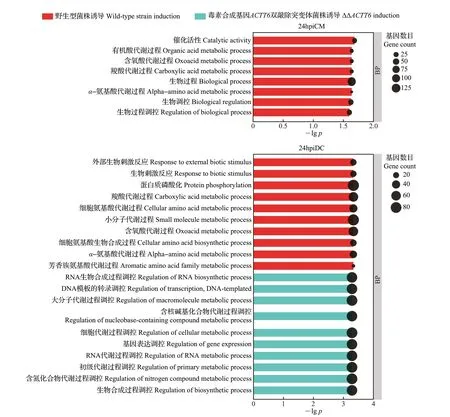
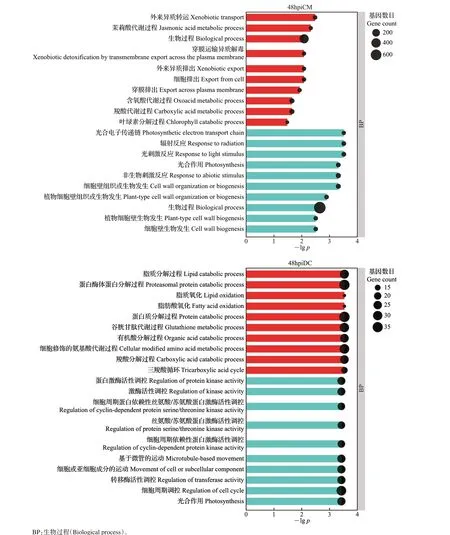
图3 差异表达基因的GO富集Fig.3 GO enrichment of DEGs
在接种早期(24 h),抗病品种克里曼丁显著富集到的GO 较少,且都是受产毒菌株诱导表达的基因,主要富集了α-氨基酸代谢、羧酸代谢等GO;在接种后期(48 h),克里曼丁受产毒菌株诱导表达的基因显著富集在与植物防御反应相关的GO 中,包含外来异质转运、茉莉酸代谢过程、穿膜运输异质解毒等,受不产毒菌株诱导表达的基因显著富集在光合电子传递链、光刺激反应等GO中。
在接种早期(24 h),感病品种丹西红橘富集的GO 主要涉及代谢调控的生物过程,其中受产毒菌株诱导表达的基因显著富集在芳香族氨基酸代谢、α-氨基酸代谢、含氧酸代谢等GO中,受不产毒菌株诱导表达的基因主要富集在含氮化合物代谢过程调控、初级代谢过程调控等GO 中;在接种后期(48 h),与病原物互作过程中,丹西红橘受产毒菌株诱导表达的基因显著富集在三羧酸循环等生物过程中,受不产毒菌株诱导表达的基因显著富集在光合作用、转移酶活性调控等生物过程中。
GO富集结果显示,在病原真菌互作后期,相较于不产毒菌株处理,与光合作用相关的基因在产毒菌株处理组中表达受到抑制,这一结果与之前的研究相符,即植物在遭受生物胁迫时参与光合作用的相关基因下调表达[26]。在毒素存在时,克里曼丁主要显著富集了与细胞解毒生物过程相关的GO,丹西红橘则显著富集了很多与脂质和蛋白质等大分子降解生物过程相关的GO;同时,茉莉酸代谢过程在克里曼丁受产毒菌株诱导表达基因中也检测到了显著富集,推测茉莉酸激素信号通路是侵染后期主要的抗病信号途径。另外,有5个GO在接种产毒菌株48 h后的克里曼丁中均显著富集,涉及穿膜运输异质的生物过程,且相关基因受到诱导表达的趋势不同,说明转运蛋白可能在柑橘防御褐斑病菌毒素反应中起着重要作用。
2.5 KEGG 通路富集分析
接种早期(24 h),克里曼丁仅在产毒菌株诱导表达的基因中出现了显著富集的代谢通路,与胁迫相关的通路为植物激素信号转导和丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路;接种后期(48 h),克里曼丁受产毒菌株诱导正调控表达的基因只富集了1 个KEGG 通路,即氨基糖和核苷酸糖代谢,受不产毒菌株诱导表达的基因显著富集了光合作用、光合作用-天线蛋白等通路(表2)。
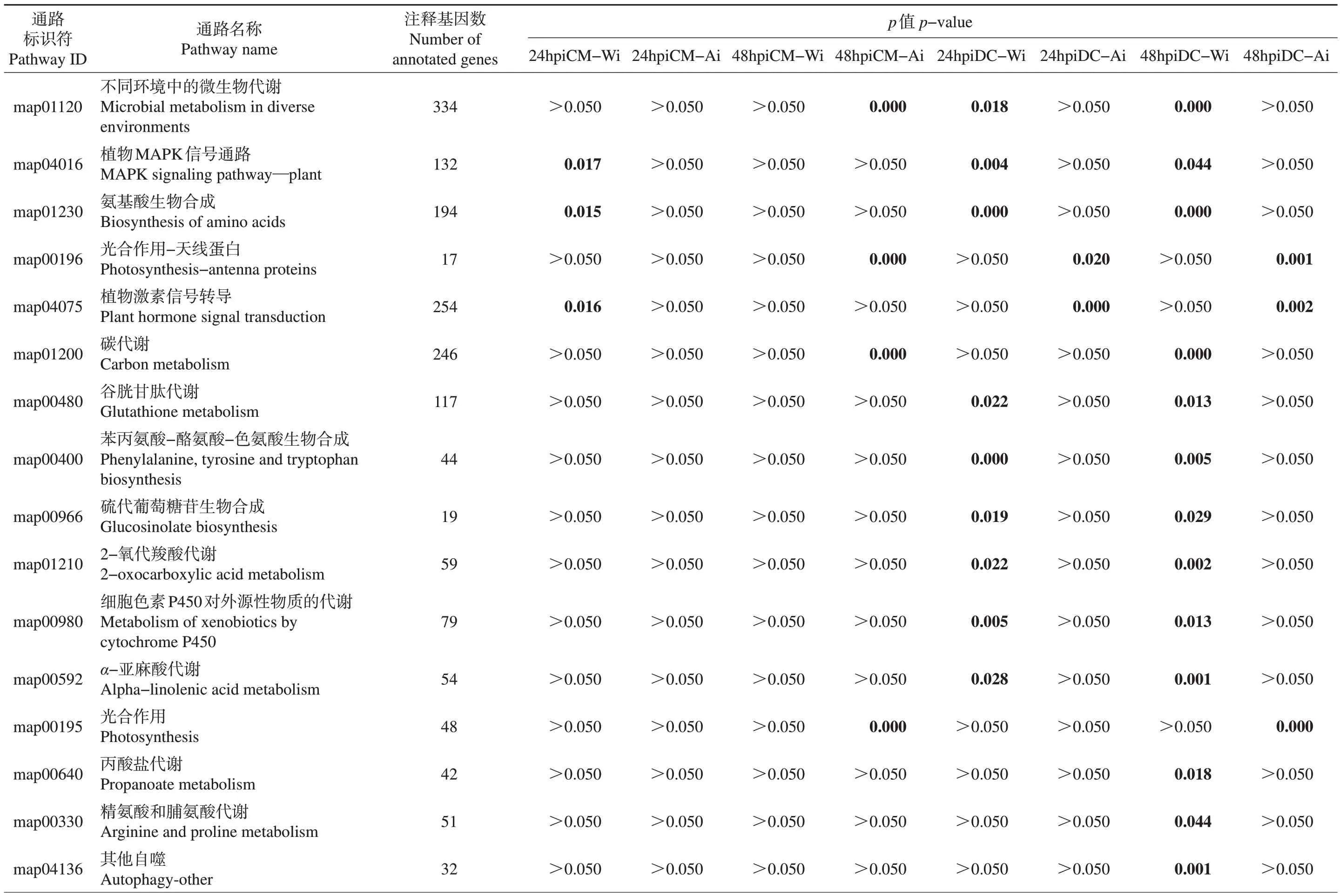
表2 差异表达基因的KEGG通路富集Table 2 KEGG pathway enrichment of DEGs
丹西红橘在与病原真菌互作中,接种早期和后期均受产毒菌株诱导表达的基因共显著富集了9个KEGG通路,主要有硫代葡萄糖苷生物合成、谷胱甘肽代谢、苯丙氨酸-酪氨酸-色氨酸生物合成、植物MAPK 信号通路等;有13 个通路仅在丹西红橘接种后期受产毒菌株诱导表达基因富集,最显著的通路是三羧酸循环。丹西红橘接种不产毒菌株后诱导表达的基因在早期和后期有2 个通路均被检测到显著富集,其中:植物激素信号转导这一代谢通路相关基因的表达趋势与克里曼丁在接种早期相反,丹西红橘包含一些激素代谢相关基因,如乙烯响应因子、茉莉酸锌指花序分生组织结构域蛋白[jasmonate zinc-finger-inflorescence meristem (ZIM)domain, JAZ]等基因的差异表达;另一个显著富集的代谢通路为光合作用-天线蛋白,与在克里曼丁中的表达趋势一致。
2.6 柑橘对褐斑病产毒菌株和不产毒菌株响应的差异
2.6.1 先天免疫反应
当植物感知到病原菌入侵时,会启动一系列的防御反应。植物通过细胞质膜上的模式识别受体(pattern recognition receptors, PRRs)识别病原物/微生物相关分子模式(pathogen/microbe-associated molecular patterns, PAMPs/MAMPs)激活一系列的基础免疫反应,如PAMPs触发的免疫反应(PAMPstriggered immunity, PTI)[27],即初级防御反应。图4显示了初级防御反应中的差异表达基因。在数据集中,有6 个被注释为受体样蛋白激酶的DEGs,包括几丁质激发子受体激酶1(chitin elicitor receptor kinase 1, CERK1)和细胞壁相关的类受体激酶(wall-associated kinase, WAK),均表现为产毒菌株诱导表达,其中2个DEGs在克里曼丁接种野生型菌株48 h 后显著上调表达,而全部DEGs 在丹西红橘接种野生型菌株48 h后均显著正调控表达。
植物还会通过核苷酸结合域和富含亮氨酸重复序列蛋白(nucleotide-binding domain and leucinerich repeat proteins, NLRs)与病原物效应子互作激活特异性次级免疫反应——效应子触发的免疫反应(effector-triggered immunity, ETI),即次级防御反应。在数据集(图4)中,检测到51 个属于NLRs 家族的DEGs,其中克里曼丁接种菌株24 h 后均无差异表达,接种48 h后检测到6个DEGs;有9个DEGs在丹西红橘接种菌株24 h 后差异表达,而大多数NLRs家族基因在丹西红橘接种48 h后出现差异表达(43 个DEGs),其中22 个基因受不产毒菌株诱导表达,21 个基因受产毒菌株显著诱导表达,这43 个DEGs 中受产毒菌株诱导表达变化最大的是Cs5g020260基因(5.5倍),编码腺苷二磷酸-核糖基环化酶。转录组数据表明,与植物防御反应相关的受体蛋白被病原菌激活,触发了PTI与ETI。
2.6.2 转录调控
转录因子参与基因转录表达的调控和各类上下游信号通路中信号分子的转导,在植物的生长发育、免疫防御等方面起着重要的作用。本研究选择在参与植物应答死体营养型真菌免疫反应中最有代表性的高等植物特有转录因子WRKY 家族进行分析。在数据集(图4)中,共鉴定到16个属于WRKY转录因子家族的DEGs。丹西红橘接种产毒菌株48 h后,这些DEGs均被显著诱导上调表达;WRKY75转录因子基因(Cs2g024430)作为表达倍数变化最显著的基因,相比不产毒菌株处理组,在丹西红橘接种产毒菌株24 h 后表达上调了9.7 倍,在48 h 后表达上调了7.6倍。克里曼丁接种菌株24 h后大多数WRKY转录因子基因无差异表达,唯一响应产毒菌株显著正调控表达的是WRKY72 转录因子基因(Cs7g025980);相比不产毒菌株处理组,克里曼丁接种产毒菌株48 h 后有7 个WRKY 转录因子基因被显著诱导表达。
2.6.3 病程相关蛋白
当植物处于胁迫环境中时,有一类蛋白会被诱导表达并在植物体内积累,参与植物的诱导系统抗性以抵御病原物侵染,被称为病程相关蛋白(pathogensis-related proteins, PRs)[28]。在数据集(图4)中,共检测到10个属于PRs家族的DEGs。丹西红橘在接种24 h后检测到5个由产毒菌株显著诱导表达的DEGs,在接种48 h后全部DEGs被产毒菌株强烈诱导表达,在2 个时间点产毒菌株诱导表达最显著的基因被预测为PR-4基因(Cs8g010240),相比不产毒菌株处理组其表达量均上调了5 倍以上。PR-4是一种抗真菌活性蛋白,说明丹西红橘接种褐斑病菌野生型产毒菌株后显著激活了PRs的表达,而在接种不产毒双敲除突变体菌株后其表达下调。克里曼丁接种产毒菌株24 h后,相比不产毒菌株处理组,只检测到1个PR-4基因(Cs8g010220)显著上调表达;接种48 h后,检测到4个受产毒菌株诱导表达的PRs基因,同样,表达倍数变化最大的仍是PR-4基因。
2.6.4 植物激素
植物响应死体营养型病原真菌的防御主要依赖茉莉酸(jasmonic acid, JA)和乙烯介导的信号通路[29]。在数据集(图4)中,与植物激素代谢途径相关的GO富集包含了茉莉酸代谢通路和赤霉素代谢通路。丹西红橘差异表达基因显著富集了α-亚麻酸代谢,而α-亚麻酸是一种多元不饱和脂肪酸,可作为茉莉酸合成的前体物质。在接种菌株48 h后,在克里曼丁和丹西红橘中有8 个DEGs 均富集到了茉莉酸代谢通路上,并响应产毒菌株正调控表达,它们都编码甲基酯酶(methyl esterase, MES),具有催化茉莉酸甲酯(methyl jasmonate, MeJA)生成JA 的功能。相比不产毒菌株处理组,2个DEGs在克里曼丁接种产毒菌株24 h后显著上调表达,5个DEGs在接种产毒菌株48 h后显著上调表达;3个DEGs在丹西红橘接种产毒菌株24 h后显著上调表达,8个DEGs在接种产毒菌株48 h 后显著上调表达,其中FPKM值变化最显著的由Cs1g025560 基因编码的MES1同源蛋白参与了茉莉酸、水杨酸代谢等生物过程。
2.6.5 次生代谢
在植物响应病原物防御的过程中,次生代谢也起到了重要的作用。次生代谢产物可分为酚类、萜类和含氮化合物类。丹西红橘在接种24 h 和48 h后均检测到被产毒菌株强烈诱导表达的DEGs,分别参与硫代葡萄糖苷生物合成、苯丙素类化合物生物合成,以及与莽草酸途径相关的芳香族氨基酸苯丙氨酸-酪氨酸-色氨酸生物合成。木质素生物合成途径中的首个关键酶为苯丙氨酸氨裂合酶(phenylalanine ammonia-lyase, PAL),有4 个编码该酶蛋白的DEGs在克里曼丁和丹西红橘中均表现为被产毒菌株显著诱导表达;4-香豆酸-辅酶A 连接酶(4-coumarate-CoA ligase, 4CL)为苯丙素代谢途径中最后一个关键酶,有10个DEGs编码4CL,主要在丹西红橘接种病原菌48 h 后表现出不同程度的差异表达(图4)。木质素作为植物细胞骨架的主要成分之一,可以增强细胞壁机械强度,抵御各种生物胁迫和非生物胁迫。转录组结果表明,受到病原菌侵染后,植物的木质素合成相关基因表达量上升,有利于积累木质素来增强植物的抗病性。
与萜类合成途径相关的大部分基因如萜类合酶(TPS)基因在不同处理组中也呈现差异表达。在克里曼丁接种后期检测到5个编码TPS的DEGs,其中1个受产毒菌株显著诱导表达(4倍以上);在丹西红橘接种早期检测到6 个DEGs 受产毒菌株显著诱导表达,在接种后期有5个DEGs受产毒菌株诱导表达,6 个DEGs 受不产毒菌株诱导表达。这些DEGs可能参与了柑橘和褐斑病菌的互作。
2.6.6 植物解毒蛋白
在GO 富集结果中,克里曼丁接种48 h 后显著富集了外来异质转运等5个共有GO,涉及多药及毒素化合物外排蛋白(multidrug and toxic compound extrusion protein, MATE)基因的显著差异表达。MATE作为一种转运蛋白,具有运输次生代谢产物、阳离子化合物、毒素化合物的功能,能够维持植物的生理生化稳态[30]。
基于以上GO 富集结果和MATE 的功能,本研究扫描了甜橙基因组中的MATE 家族基因,发现共35个被预测为MATE家族基因的DEGs转录表达有显著变化,受产毒菌株诱导表达的趋势大于受不产毒菌株诱导表达的趋势(图4)。丹西红橘接种48 h后的基因表达模式仍然是变化最显著的,有29 个MATE基因差异表达,而克里曼丁接种24 h 后只有4 个MATE基因差异表达。其中,Cs5g040590 基因编码解毒蛋白,相较于不产毒菌株处理组,在抗、感品种的2个时间点处理组中受产毒菌株诱导后其表达倍数变化值均最大,在丹西红橘接种48 h后更是响应产毒菌株上调表达了8倍以上。这表明柑橘对褐斑病菌毒素的响应显著激活了MATE 转运蛋白的表达。
在这些DEGs 中,Cs7g016240 基因在抗病品种克里曼丁接种48 h后被产毒菌株诱导表达;而在感病品种丹西红橘接种48 h 后受不产毒菌株诱导表达,即产毒菌株处理抑制了该基因的表达。推测该基因参与了柑橘对褐斑病的抗病调控。
2.7 qRT-PCR 验证
在转录响应更强烈的感病品种中进行qRT-PCR验证。随机挑选6 个基因(包含了编码病程相关蛋白、几丁质酶和果胶酯酶抑制剂等基因),通过qRTPCR 验证数据的可靠性和真实性。结果(图5)显示,供试基因的相对表达倍数变化与转录组测序表达趋势基本一致。
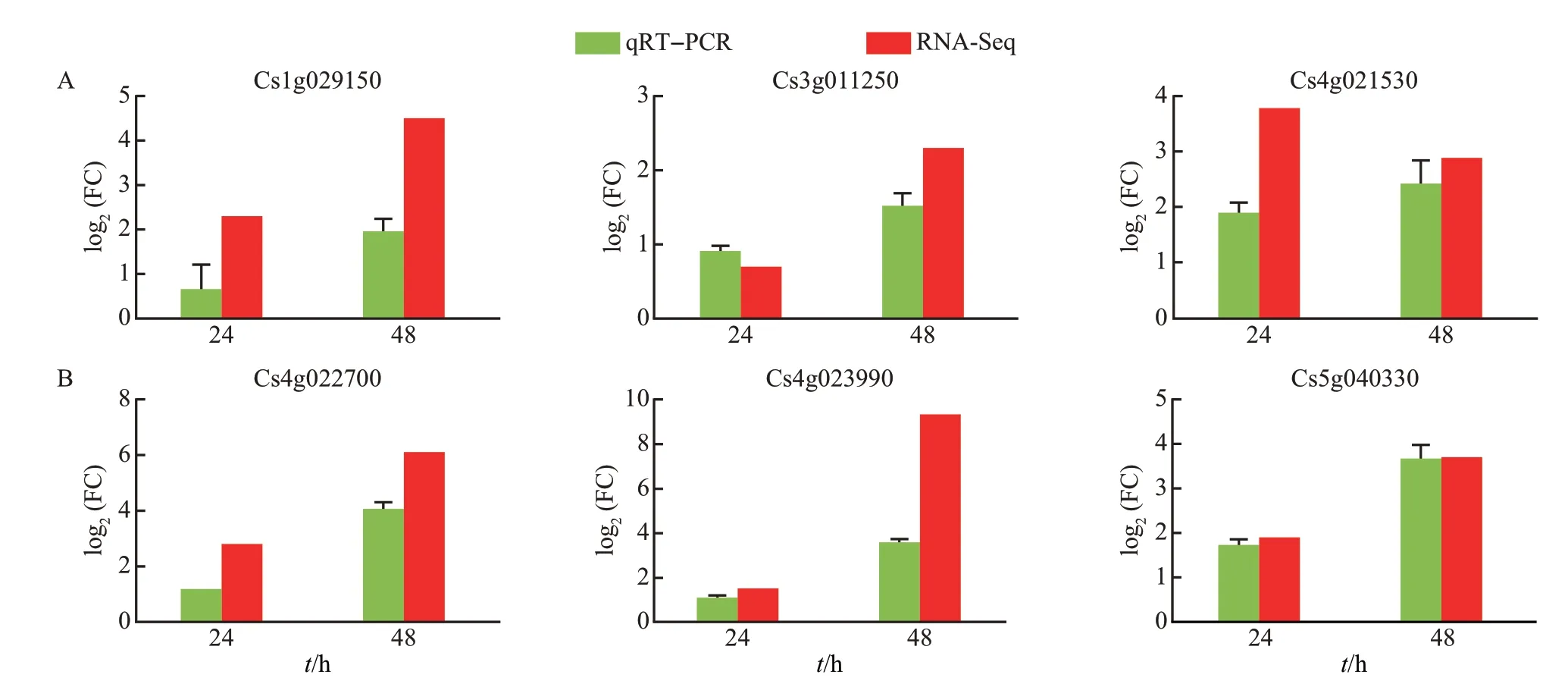
图5 差异表达基因的qRT-PCR验证Fig.5 Verification of DEGs by qRT-PCR
3 讨论
柑橘链格孢毒素(ACT)作为柑橘褐斑病菌重要的致病因子,破坏感病植物细胞质膜,造成胞内钾离子外流,从而导致细胞死亡。对ACTT6进行双拷贝敲除可使其不产毒且不致病,相比于可以正常产毒和致病的野生型菌株,本实验所用ΔΔACTT6突变体菌株未被检测到ACT产生[13],并且无伤接种感病品种丹西红橘叶片后也没有病斑产生。
褐斑病菌作为典型的死体营养型病原真菌,通过分泌寄主专化性毒素杀死细胞和组织,并从死亡的细胞中获得养分来实现侵染和定植。相应地,植物激活免疫反应来抑制病原菌的发展,这涉及复杂的生理生化反应和分子水平的转录调控。死体营养型病原真菌入侵后激活了植物的免疫反应[31],无论是抗病品种克里曼丁还是感病品种丹西红橘,都通过模式识别受体(PRRs)识别柑橘褐斑病菌分泌的几丁质等保守物质来激活PTI,在接种后期,有大量的抗病基因在植物与病原菌互作过程中被诱导表达。克里曼丁在接种后期显著富集了茉莉酸代谢通路,多个参与该通路的基因显著响应产毒菌株表达,表明植物受到链格孢菌橘致病型侵染后,茉莉酸激素信号通路被激活,进而激活了下游的防御基因表达。杨树接种链格孢菌后,与茉莉酸(JA)生物合成和信号转导相关的DEGs 被持续激活,通过过表达脂氧合酶基因PdbLOX2增强了杨树对链格孢菌的抗性[32]。同时,WRKY 转录因子作为正调控或者负调控因子,在不同水平参与调节植物防御基因的表达,在本研究中多个WRKY转录因子被证实参与调节JA介导的反应。在菊花中,构建过表达WRKY33基因植株增强了对链格孢菌的敏感性[33]。在拟南芥中,WRKY75可以与ORA59启动子区域结合来直接调节其表达,还可以与JAZ 8 蛋白互作来抑制其表达,过表达WKY75可增强JA 介导的响应和下游防御基因PDF1.2的表达,进而增强拟南芥对灰霉菌和芸薹生链格孢(Alternaria brassicicola)的抗性[34]。在本研究中,受野生型褐斑病菌胁迫,克里曼丁和丹西红橘激活了WRKY转录因子的表达,某些在丹西红橘中受产毒菌株显著诱导上调表达而在克里曼丁产毒菌株处理组中稳定表达的WRKY 转录因子可以作为候选的柑橘褐斑病抗性负调控因子。
多个基因编码的PRs受褐斑病菌诱导后被激活表达,包括PR-4 等具有几丁质结合域的抗真菌活性蛋白。菊花叶片被链格孢菌侵染后激活了PR-3类蛋白的表达[33],苹果被链格孢菌苹果致病型侵染后的转录组分析也表明多个PRs 转录调控被激活[35]。以上研究表明,PRs 在应对病菌胁迫方面起着重要的作用。
植物次生代谢类物质也积极参与对链格孢菌的防御响应。烟草接种链格孢菌烟草致病型后会在侵染点积累大量的香豆素类植保素和倍半萜类植保素[36-37]。本研究的转录组数据表明,柑橘接种链格孢菌橘致病型后在苯丙素类化合物生物合成和硫代葡萄糖苷生物合成途径中出现了大量的差异表达基因,这些次生代谢产物受野生型病原菌诱导合成,参与了寄主的免疫调控。
MATE 转运蛋白广泛分布于所有生物体中,植物中的MATE 家族基因有着多种生物学功能,比如次生代谢产物转运、异质解毒、激素转运等,参与调控植物对生物和非生物胁迫的响应[38]。拟南芥中AtDTX1 蛋白可作为植物源性生物碱、抗生素和其他有毒化合物的外排载体[39]。在菊花接种链格孢菌后期(24 h或36 h),鉴定到2个MATE基因显著上调表达,推测在侵染后期,菊花通过表达MATE基因抵御链格孢菌,减少寄主特异性毒素的产生[33]。在本研究中检测到多个编码MATE 蛋白的差异表达基因,接种后期,克里曼丁受产毒菌株显著诱导表达的MATE基因有11个,丹西红橘显著响应产毒菌株表达的MATE基因有15 个。基于以上结果,推测MATE基因在柑橘中参与了褐斑病菌的毒素外排过程,且在克里曼丁中存在与褐斑病抗性相关的特异性毒素诱导的MATE基因。
4 结论
本研究选择克里曼丁和丹西红橘2种抗、感褐斑病柑橘,以离体叶片接种柑橘褐斑病菌毒素合成受阻双敲除突变体菌株ΔΔACTT6和野生型产毒菌株Z7,通过RNA-Seq解析了抗、感柑橘叶片在接种早期和后期对褐斑病菌产毒和不产毒菌株侵染的转录响应差异。结果表明,接种后期比前期拥有更多的差异表达基因,且丹西红橘对病原菌的响应更强烈。产毒菌株在抗、感柑橘品种中均能抑制植物的部分生长发育及代谢活动,同时,也可激活2种柑橘中的防御相关基因,包含了次生代谢、免疫反应、激素信号转导、转录调控等,涉及WRKY转录因子和萜类合酶等基因的表达。在产毒菌株接种后期,丹西红橘富集了脂质和蛋白质等大分子降解过程,说明感病植株不能抵御毒素,从而导致细胞完整性遭到破坏;而克里曼丁则主要富集了异质解毒和茉莉酸代谢等生物过程,其中抗性柑橘特异激活表达的MATE基因可能与其抵御褐斑病菌毒素的能力相关。
致谢感谢浙江省柑橘研究所柯甫志副研究员提供克里曼丁和丹西红橘材料!

