基于广泛靶向代谢组学结合高效液相色谱法分析‘紫娟’和‘迎霜’茶树花代谢物差异
朱婉,吴颖,黎晓湘,张龙杰,梁月荣,陆建良,郑新强*
(1.浙江大学农业与生物技术学院茶叶研究所,浙江 杭州 310058;2.宁波市海曙区农业技术管理服务站,浙江 宁波 315012;3.宁波黄金韵茶业科技有限公司,浙江 宁波 315412)
茶树品种是茶叶生产和生物学研究的宝贵材料[1],不同品种鲜叶加工而成的茶产品品质和功效差异明显,产生的所谓“品种香”“岩韵”“音韵”等特殊风味,显著影响着茶产品消费人群的选择[2]。随着茶叶市场逐步细分,茶树品种选育也呈现出明显的多元化趋势[3],适于品饮和观赏等的新梢色泽特异品种选育尤受关注[4],而叶色特异品种多具有多花特性[5]。花是茶树重要的生殖器官之一,茶树花的花期长且产量大,仅次于新梢,作为茶饮原料开发潜力巨大[6]。2013 年,我国卫生部将茶树花列为新资源食品,以茶树花为原料的相关健康食品和功用饮品已在市场上崭露头角[7]。其中,制成花茶是茶树花最直接的利用方式,影响花茶品质的主要因素有茶树品种、采收时间、加工工艺等[8-9],而花茶品质取决于产品中的化学成分。
大量研究表明,茶树花不仅含有多种和茶叶相同的活性成分,其儿茶素(catechin, C)、黄酮醇、咖啡碱(caffeine, Caf)质量分数(分别为2.45~39.12、1.67~10.56、3.48~10.7 mg/g)低于茶叶(分别为105.85~112.72、30.00、34.86 mg/g)中的[10],而且茶树花中的一些优势功能分子,如游离氨基酸[11]、茶皂苷和多糖[7]质量分数(分别为8 089 μg/g、0.47%~4.23%、20%~30%)高于茶叶(分别为1 191~6 985 μg/g、0.04%~0.07%、20%~25%)中的,部分亚精胺类物质在茶树花中已被鉴定和分离,而在茶叶中未检出[12]。茶树花内含成分的组成和比例又常因部位、品种和花期而异,如皂苷类在茶树花中的含量为花瓣>雌蕊、雄蕊和子房>花托和花萼[13]。‘福建水仙’茶树花的杨梅素-3-O-葡萄糖苷质量分数(0.436 mg/g)高出‘梅占’‘水古’‘政和大白茶’‘黄叶早’茶树花的近4倍[14]。茶多酚含量随着茶树花的生长而下降,在露白期最高;游离氨基酸含量随花期变化先升高后降低,在初开期最高;可溶性糖含量随花期变化而上升,并且在全开期最高[15]。目前,关于茶树花的部分内含成分的含量、分布以及在发育阶段的变化规律已有较多研究,但对新梢紫色与常绿品种茶树花的代谢物整体对比研究鲜见报道。
广泛靶向代谢组学技术同时集中了非靶向和靶向代谢组学的优点,除可准确定性和精确定量数百种已知代谢物外,还可定量大量未知代谢物[16],在茶树代谢特征和品质研究中已有较多应用。ROTHENBERG 等[17]利用靶向代谢组学鉴定出12种使紫化品种‘柏塘群体种’花瓣呈现粉色的花青素类物质。ZHOU等[18]利用广泛靶向代谢组学进一步研究发现,‘柏塘群体种’的粉色花瓣中特异性积累了3种花青素类物质,即花青素-O-丁香酸、矮牵牛素-3-O-葡萄糖苷和天竺葵-3-O-葡萄糖苷,而这些成分在‘紫娟’茶树花的白色花瓣中没有积累。虽然茶树品种不同色泽花瓣中物质的积累差异已有研究报道,但仍缺少不同茶树品种茶树花的整体成分比较及其与茶树花感官品质联系的研究。‘紫娟’是由‘云南大叶种’茶树选育而成的新梢紫色突变种,其紫色嫩梢富含花青素,具有抗癌、抗肿瘤等功能,在保健品、饮料等领域受到较多重视[19]。‘迎霜’是‘福鼎大白茶’与‘云南大叶种’茶树自然杂交后代经单株选育而成的国家级品种,其嫩梢呈黄绿色,适制红茶和绿茶,在全国大部分产茶区已有引种[20]。本研究利用广泛靶向代谢组学技术及高效液相色谱法(high performance liquid chromatography,HPLC)检测‘紫娟’茶树花(ZJF)和‘迎霜’茶树花(YSF)代谢物的含量,分析2 个品种茶树花之间非挥发性代谢物的差异及其与滋味品质的关系,以期理解茶树花感官品质的物质基础,为茶树花茶的品质评定和利用提供一定的参考依据。
1 材料与方法
1.1 茶树花样品
在宁波黄金韵茶业科技有限公司茶叶基地(30°22´51″ N、121°03´22″ E,海拔50~100 m),于2020年11月1日采摘‘紫娟’和‘迎霜’2个茶树品种的完全盛开鲜花。采收的‘紫娟’鲜花花瓣呈白色、萼片和花梗呈浅紫色,‘迎霜’鲜花花瓣呈白色、萼片和花梗呈绿色。采用室内自然萎凋工艺制备茶树花轻发酵样品(茶树花为雌雄同花,样品是由花瓣、萼片、花梗、花托和花蕊等组成的完整鲜花制成的混合物),将鲜花置于竹筛上,均匀摊开,萎凋室内环境温度为25~26 ℃,相对湿度为50%~60%,萎凋4~6 h 后于50 ℃下初烘至九成干,再于80 ℃下烘至足干。
1.2 主要试剂与仪器
甲醇、乙腈、乙酸(均为色谱纯)购自德国Merck公司;儿茶素、表儿茶素(epicatechin, EC)、没食子儿茶素(gallocatechin, GC)、表没食子儿茶素(epigallocatechin, EGC)、儿茶素没食子酸酯(catechin gallate, CG)、表儿茶素没食子酸酯(epicatechin gallate, ECG)、没食子儿茶素没食子酸酯(gallocatechin gallate, GCG)、表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)8 种儿茶素类单体标准品,咖啡碱、茶碱(theophylline, TP)、可可碱(theobromine, TB)3 种生物碱标准品购自美国Sigma-Aldrich公司;芦丁(纯度98.8%)购自上海百灵威化学技术有限公司;蒽酮购自杭州辰通生化科技有限公司。
Nexera X2 超高效液相色谱仪购自日本岛津公司;Applied Biosystems 4500 QTRAP 三 重 四极杆(triple quadrupole, QQQ)质谱仪购自美国Thermo Scientific Fisher 公司;LC-20AD 高效液相色谱仪购自日本岛津公司;3-18K 高速冷冻离心机购自德国Sigma 公司;AB265-S 分析天平购自瑞士Mettler Toledo 公司;超纯水仪购自美国Thermo Scientific Fisher公司;Epoch酶标仪购自美国BioTek公司。
1.3 实验方法
1.3.1 茶树花感官审评和生化成分测定
参照GB/T 23776—2018《茶叶感官审评方法》中名优绿茶的审评方法,称取ZJF 和YSF 各3 g,用150 mL 沸水冲泡4 min,由6 名高级评茶员(3 名男性、3名女性)对ZJF和YSF的外形、汤色、香气和滋味等各项审评因子进行评价。
参考LIANG 等[21]的方法制备茶树花样品提取液,利用高效液相色谱仪对儿茶素类和生物碱含量进行测定,采用外标法定量。色谱条件:进样量10 µL,柱温33 ℃,色谱柱为Agilent TC-C18(4.6 mm×250 mm,5 µm),流速1 mL/min,波长280 nm。流动相A相为V(水)∶V(乙酸)∶V(乙腈)=965∶5∶30,B相为V(水)∶V(乙酸)∶V(乙腈)=695∶5∶300。洗脱梯度为35.00 min 内B 相比例从20% 线性增加至80%,35.01 min B 相比例从80%降至20%并持续5.00 min。每个样品设置3个生物学重复。
采用芦丁比色法测定黄酮类总量[14];采用蒽酮-硫酸比色法测定可溶性糖含量;采用分光光度计法测定花青素总量[18];采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法测定茶树花样品的水分含量。每个样品设置3个生物学重复。
1.3.2 茶树花广泛靶向代谢组学测定
茶树花样品用研磨仪研磨(30 Hz、1.5 min)至粉末状,称取100 mg粉末置于1.2 mL 70%甲醇提取液中,每30 min涡旋一次,每次持续30 s,共涡旋6次。将混合物于4 ℃、12 000 r/min条件下离心10 min,吸取上清液,用微孔滤膜(0.22 μm孔径)过滤并转存于进样瓶中,后续用于超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)分析。
UPLC条件。色谱柱为Agilent SB-C18(2.1 mm×100 mm,1.8 µm);流动相A相为含0.1%甲酸的超纯水,B相为含0.1%甲酸的乙腈;流速0.35 mL/min,柱温40 ℃,进样量4 μL。洗脱梯度:0 min B相比例为5%;9.00 min 内B 相比例由5%线性增加到95%,并在95%内维持1.00 min;10.00~11.10 min,B相比例降为5%,并以5%平衡至14.00 min。
MS/MS 条件。以三重四极杆线性离子阱(linear ion trap, LIT)质谱仪(QTRAP)进行扫描检测,采用正、负2种离子模式分别扫描。电喷雾离子源(electrospray ionization, ESI)参数如下:离子源温度550 ℃;涡轮喷雾电压(IS)5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体Ⅰ(GSⅠ)、离子源气体Ⅱ(GSⅡ)和帘气(CUR)分别设置为345、414、172 kPa,碰撞诱导电离参数设置为高。在QQQ 和LIT模式下分别用10、100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。使用多反应监测(multiple reaction monitoring, MRM)模式进行QQQ扫描,扫描范围为50~1 250m/z,并将碰撞气体(氮气)设置为中等,并进一步优化各个MRM离子对的去簇电压(declustering potential, DP)和碰撞能(collision energy, CE)。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
1.4 数据处理与分析
基于武汉迈特维尔生物科技有限公司自建代谢物数据库和二级质谱信息对代谢物进行定性分析,利用QQQ 的MRM 完成物质定量分析。利用Analyst 1.6.3软件处理质谱数据,采用R软件包对鉴定的代谢物进行主成分分析(principal component analysis, PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。从OPLS-DA模型获得变量投影重要性(variable importance in project, VIP)评分,并将VIP≥1、差异倍数(fold change, FC)≥2或FC≤0.5作为筛选显著差异代谢物的标准。利用京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)对上述差异代谢物进行注释。使用SPSS 22.0 软件对数据进行差异显著性检验(单因素方差分析),采用TBtools软件制作热图。
2 结果与讨论
2.1 ‘紫娟’茶树花(ZJF)和‘迎霜’茶树花(YSF)感官审评结果
ZJF 干样花朵完整,花瓣浅黄带浅绿,花托微黄,花萼翠绿,冲泡后花萼边缘略有红边,汤色黄明亮,香气蜜香稍闷,滋味鲜锐略苦;YSF干样花朵完整,花瓣象牙白,花托稍带嫩绿,花萼深绿,冲泡后成朵透亮,汤色杏黄明亮,香气略带花香,滋味略涩醇厚(表1)。2 个品种的茶树干花冲泡后虽然汤色差异不明显,滋味均有轻微苦涩感,但ZJF较YSF香气更浓郁,滋味更鲜。整体而言ZJF品质更佳。

表1 ZJF和YSF感官审评结果Table 1 Sensory evaluation results of ZJF and YSF
2.2 ZJF 和YSF 代谢 组 学 分析
分别在ESI正、负离子模式下对2个品种茶树花的代谢物进行UPLC-MS/MS分析。首先,针对质控样本的总离子流色谱图(total ion chromatogram,TIC)进行图谱叠加比较。如图1所示,ESI正、负离子模式的色谱图重叠性较好。针对2个品种的离子变异系数(coefficient of variation,CV)评价结果如下:ZJF中相对标准偏差小于20%的离子分别占ESI正、负离子总强度的85.58%和85.23%,YSF 中相对标准偏差小于20%的离子分别占ESI 正、负离子总强度的87.47%和83.54%(附表1~2,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.10.091)。上述结果表明,针对茶树花样品的代谢组学方法信号稳定、数据可靠、重复性好。
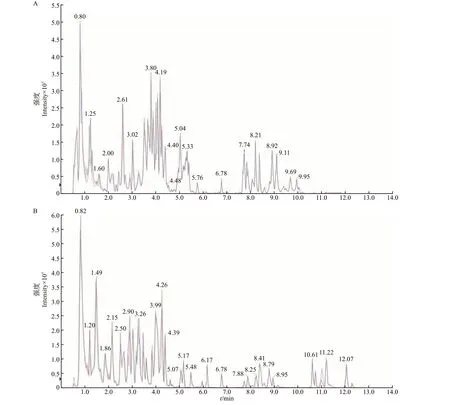
图1 质控样本的TIC重叠图Fig.1 TIC overlap map of quality control samples
基于广泛靶向代谢组学方法,在ZJF 和YSF 中共鉴定出11 类共897 种代谢物(图2),其中酚酸类(异绿原酸、苯甲酸、咖啡酸等)和脂质(甘油酯和游离脂肪酸)代谢物较多,分别有152 种和150 种;其次是黄酮类(黄烷醇、黄酮醇、黄酮碳糖苷、二氢黄酮等),有141种;其余类别都少于100种,种类最少的一类代谢物是萜类,只检测到22 种,仅分别为酚酸类和脂质的14.47%和14.67%。
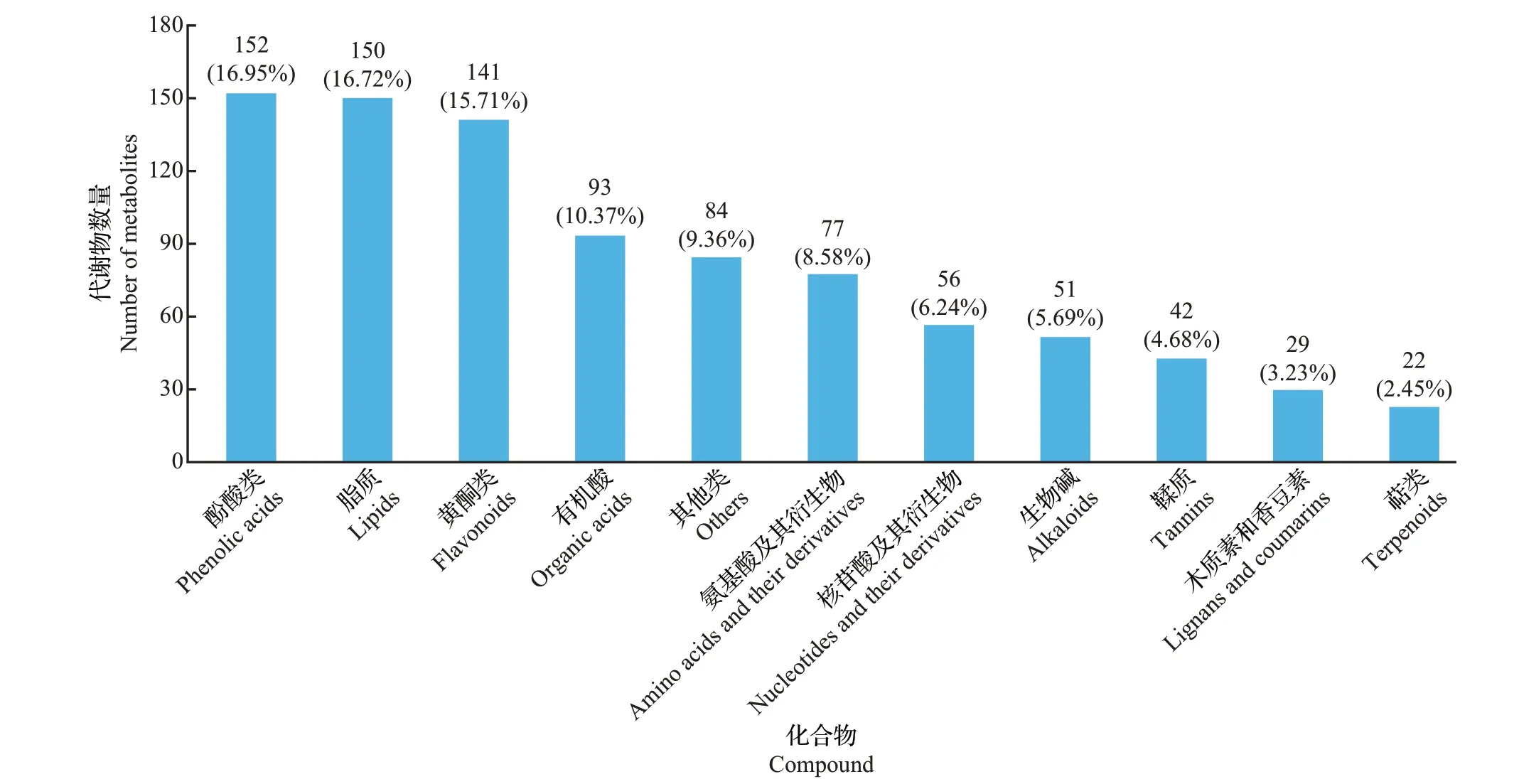
图2 ZJF和YSF中鉴定到的代谢物类别Fig.2 Categories of metabolites identified from ZJF and YSF
2.3 ZJF 和YSF 中的差异代谢物分析
2.3.1 差异代谢物鉴定与分析
对ZJF和YSF的代谢物进行PCA和OPLS-DA分析,结果如图3 和表2 所示。主成分1(principal component 1, PC1)的贡献率为68.35%,主成分2(PC2)的贡献率为9.99%(图3A、表2),且PC2 累积贡献率大于75%。在OPLS-DA 分析中,评价模型的参数有R2X、R2Y、Q2,其中R2X和R2Y分别表示所建模型对X和Y矩阵的解释率,Q2表示模型的预测能力。p1 表示3 个预测参数值,o1 表示3 个预测参数值对应的p值,一般p<0.05表示模型最佳。由图3B可知,模型评价参数R2X=0.685、R2Y=1.000、Q2=0.984,3 个参数均大于0.5,说明模型稳定可靠,且Q2大于0.9,表明该模型预测性较好,评估有效,根据VIP分析筛选的差异代谢物代表性较好。
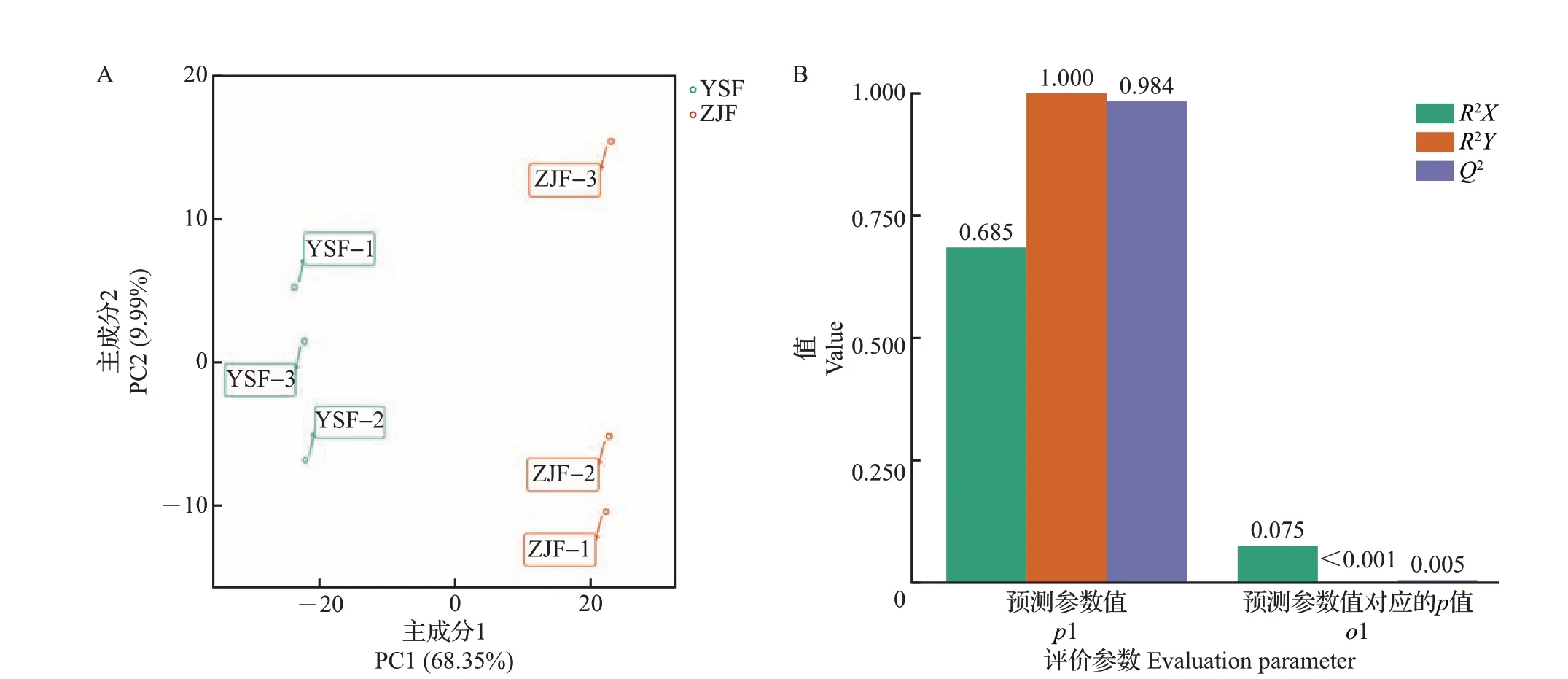
图3 ZJF和YSF代谢物的多元统计分析结果Fig.3 Multivariate statistical analysis results of metabolites in ZJF and YSF
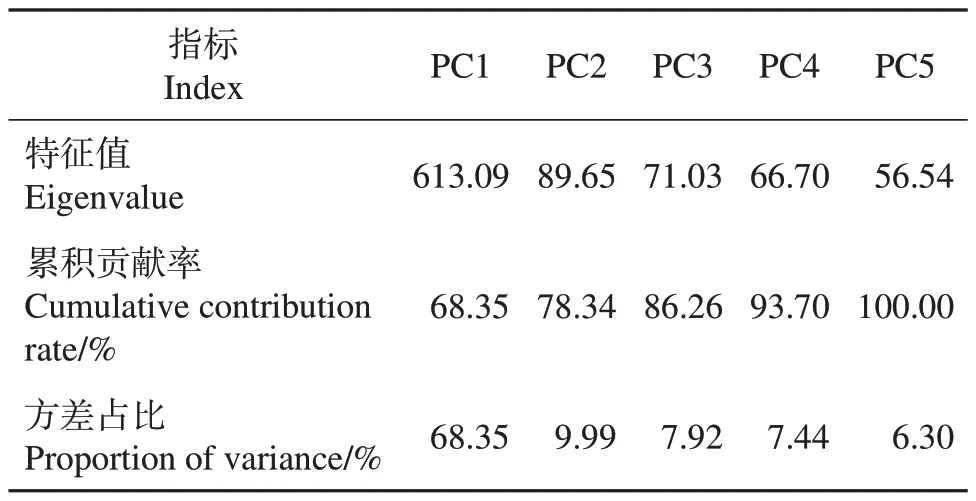
表2 ZJF和YSF代谢物的PCA结果Table 2 PCA results for metabolites in ZJF and YSF
基于OPLS-DA 模型,按照VIP≥1、FC≥2 或FC≤0.5的标准筛选ZJF和YSF的显著差异代谢物,图4A左侧为显著差异代谢物聚类树,2种颜色为对应显著差异代谢物的相对含量经标准化处理后所得的值(红色代表相对含量上调,绿色代表相对含量下调)。在2 个品种茶树花中共鉴定出219 种显著差异代谢物,占所测出代谢物总量的24.41%。如图4B 所示,火山图中的每个点表示一种代谢物,且绿色点表示相对含量下调差异表达代谢物,红色点表示相对含量上调差异表达代谢物,灰色点表示检测到的相对含量差异不显著的代谢物。由此可得,ZJF 中相对含量显著高于YSF 的上调代谢物有145种,而下调代谢物只有74 种。ZJF 中有43 种酚酸类、26 种黄酮类、16 种氨基酸及其衍生物、12 种脂质、11 种鞣质、11 种核苷酸及其衍生物、8 种生物碱和9种有机酸等的相对含量更高;YSF中则有20种黄酮类、14种脂质、13种酚酸类、8种鞣质、6种有机酸、1 种萜类、1 种氨基酸及其衍生物等的相对含量更高。ZJF和YSF在代谢物相对含量上的差异导致其形成了不同的滋味特征。差异代谢物数量分布较多的类别是酚酸类和黄酮类,其次是脂质和鞣质(图5)。
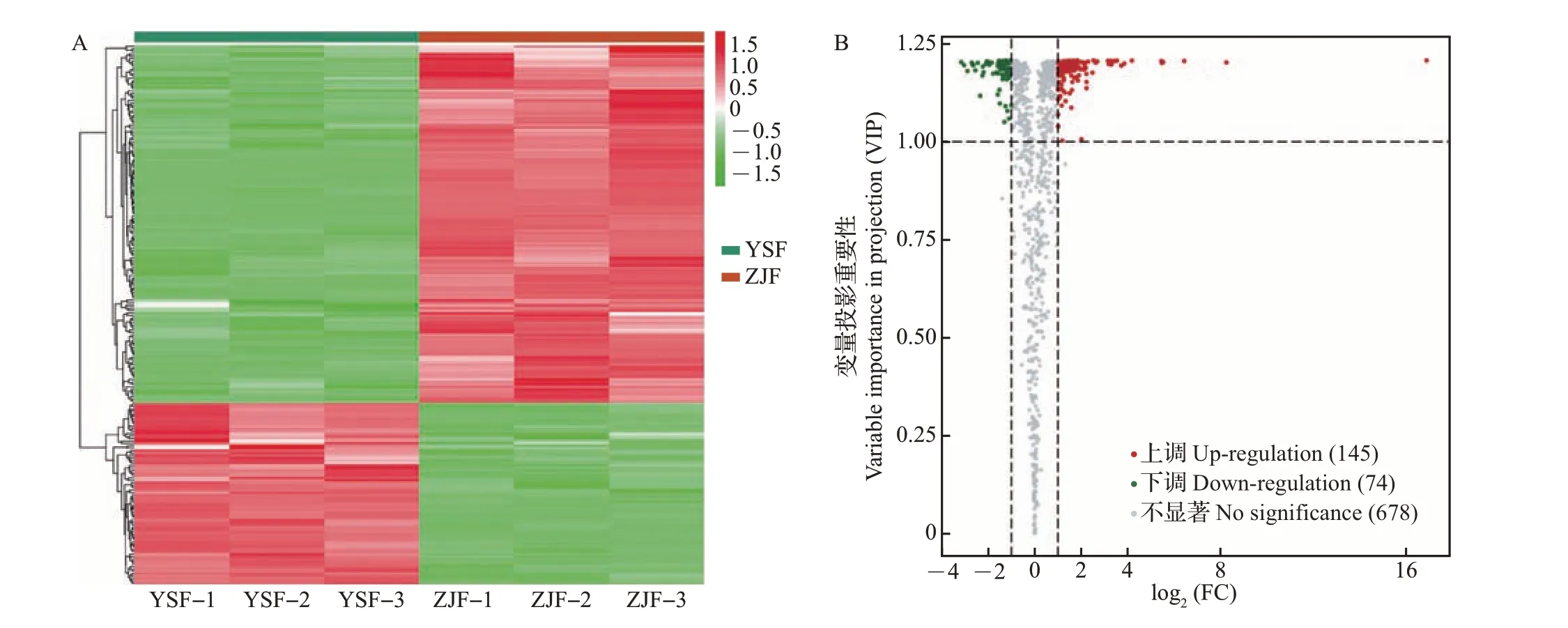
图4 ZJF和YSF的显著差异代谢物图谱Fig.4 Maps of significantly differential metabolites between ZJF and YSF
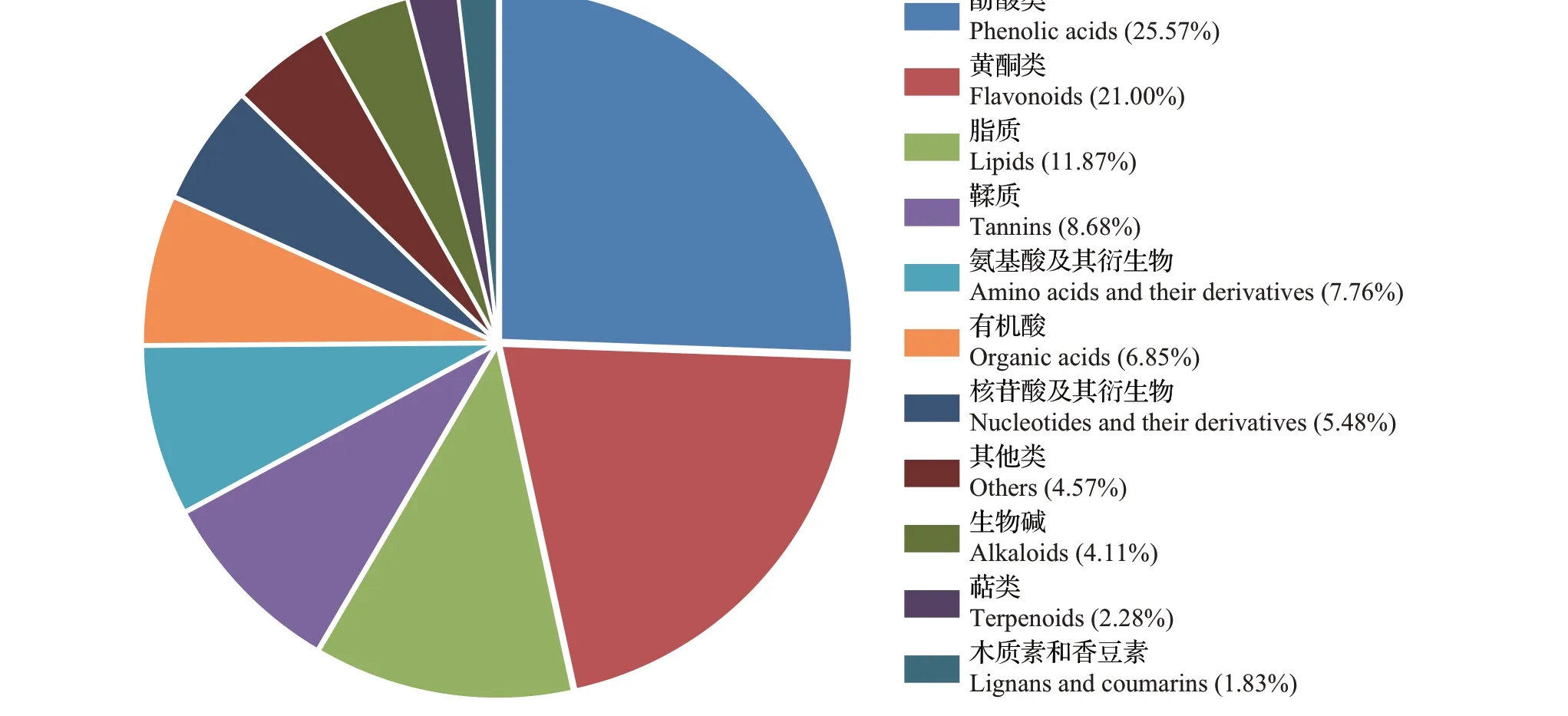
图5 ZJF和YSF中219种显著差异代谢物饼图Fig.5 Pie chart of 219 significantly differential metabolites between ZJF and YSF
2.3.2 差异代谢物通路富集分析
通过KEGG数据库对219种显著差异代谢物进行通路富集分析。其中,75种显著差异代谢物(ZJF相比YSF有上调代谢物54种、下调代谢物21种)被成功注释到75条代谢通路中(图6)。富集程度最高的前10 条通路分别为:色氨酸代谢、精氨酸生物合成、鞘脂代谢、苯丙氨酸代谢、酪氨酸代谢、黄酮和黄酮醇生物合成、抗坏血酸和醛酸代谢、单环β内酰胺生物合成、糖酵解/糖异生以及氰基氨基酸代谢途径。KEGG 通路注释分析发现,氨基酸类物质相关代谢途径以及黄酮和黄酮醇代谢途径是ZJF和YSF的主要差异代谢途径,其也对2 个品种茶树花滋味品质具有重要的影响。
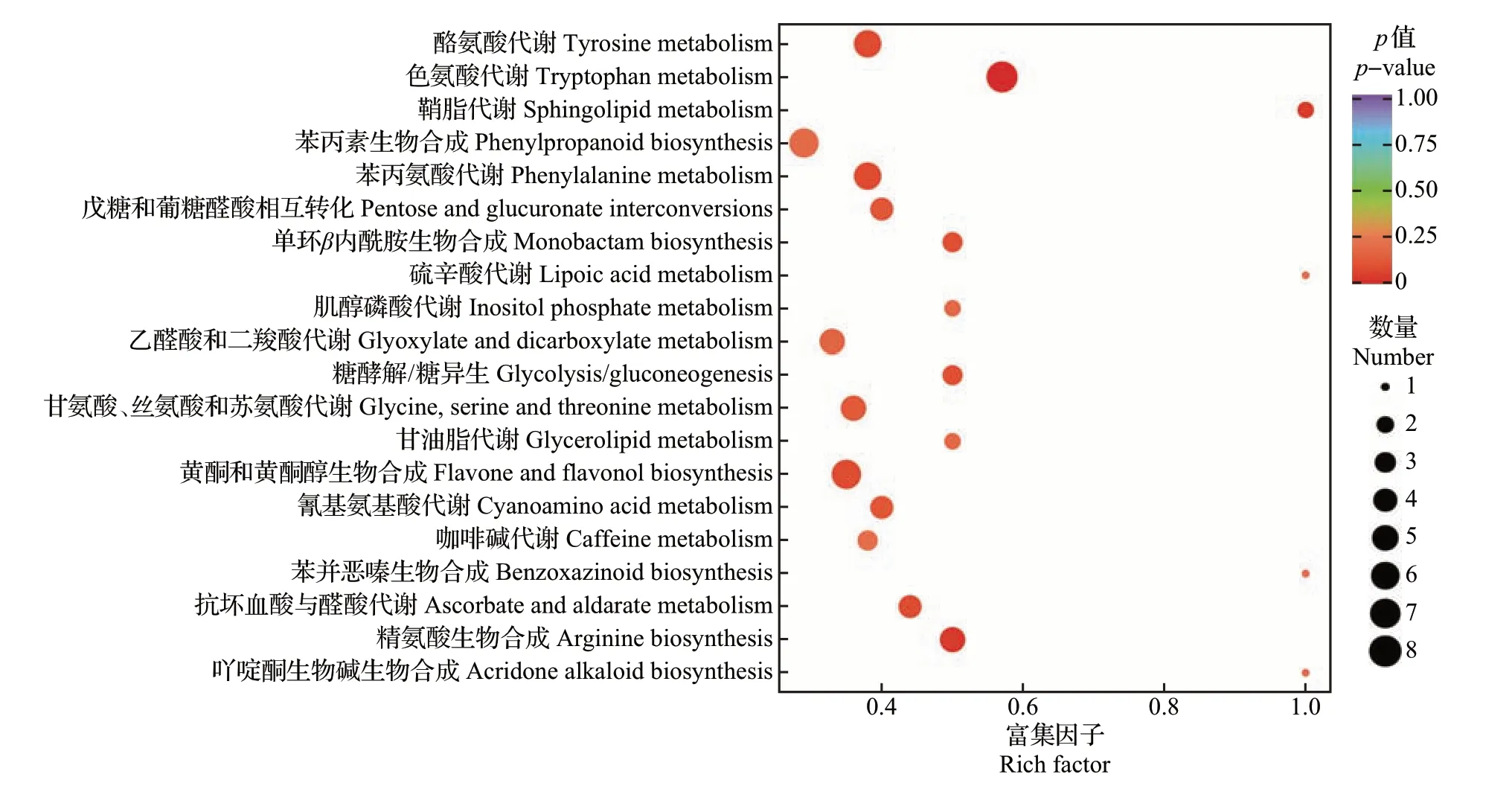
图6 ZJF和YSF中显著差异代谢物的KEGG通路富集图Fig.6 KEGG pathway enrichment diagram of significantly differential metabolites between ZJF and YSF
2.3.3 主要差异代谢物成分分析
为更清楚地了解2 个样品滋味品质的差异,本研究对ZJF 和YSF 的主要滋味差异代谢物酚酸类、黄酮类、氨基酸及其衍生物和鞣质等进行了分析,结果如图7所示。
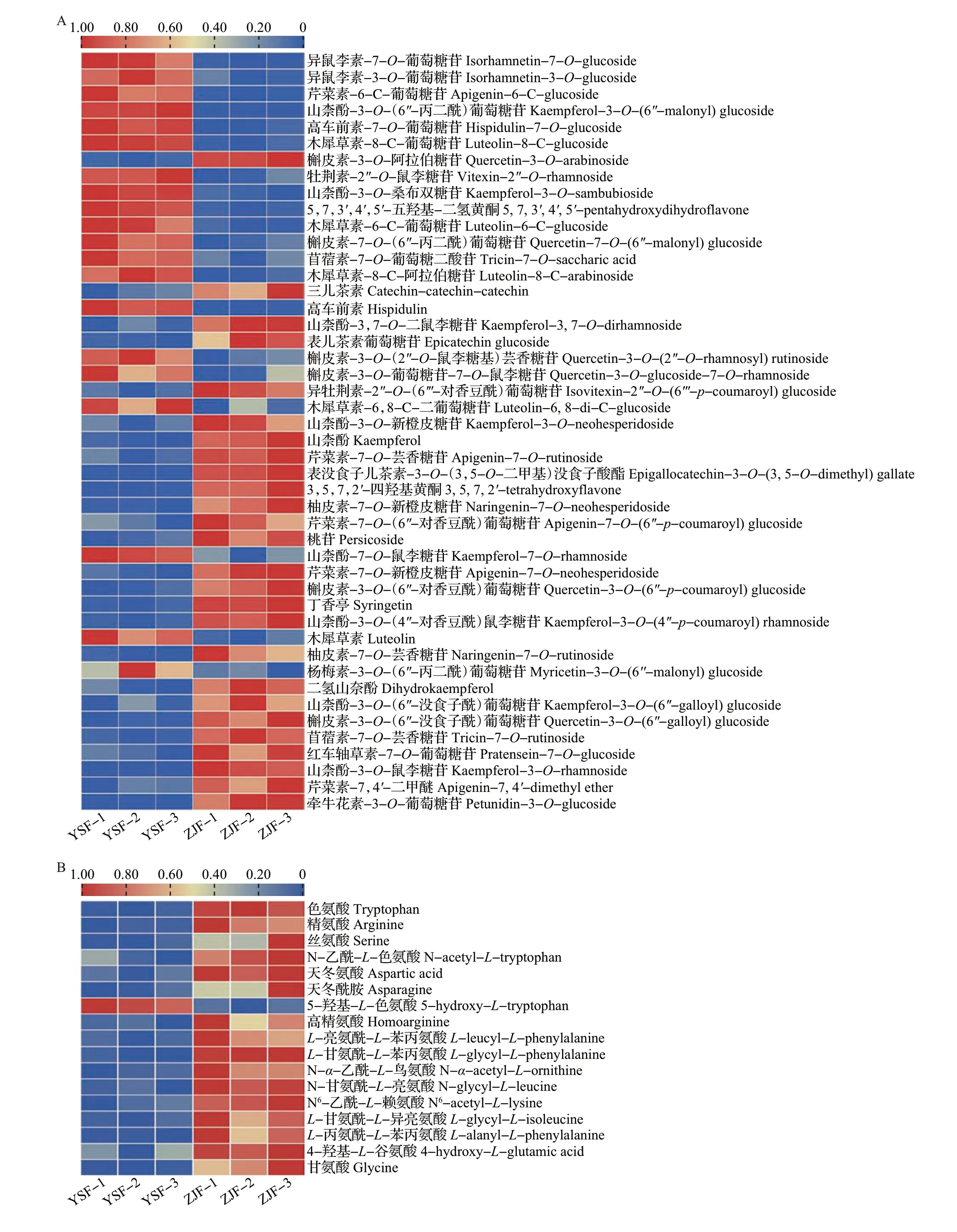
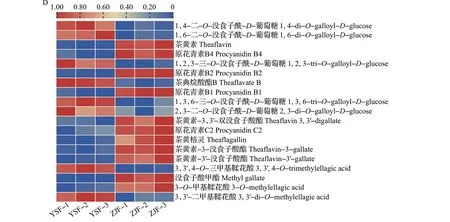
图7 YSF和ZJF中的主要滋味差异代谢物Fig.7 Main taste differential metabolites between YSF and ZJF
黄酮类作为茶树花的重要成分,其含量受采摘部位(如花瓣、花梗和花托等)[14]、花期、加工工艺以及品种的影响,总量一般为1.67~10.56 mg/g,低于茶叶中的黄酮总量[10]。ZJF和YSF中共有46种黄酮类差异代谢物(图7A),其中ZJF中有26种相对含量上调,主要为黄酮醇及其苷类、黄烷醇类和二氢黄酮,YSF 中有20 种相对含量上调,主要为黄酮醇及其苷类。2个样品中黄酮类差异代谢物种类最多的为黄酮醇,相较于YSF,ZJF 中山柰酚-3-O-鼠李糖苷、山柰酚-3-O-(4″-对香豆酰)鼠李糖苷、山柰酚-3-O-新橙皮糖苷、山柰酚-3,7-O-二鼠李糖苷和山柰酚相对含量显著上调,而YSF 中仅山柰酚-3-O-(6″-丙二酰)葡萄糖苷和山柰酚-7-O-鼠李糖苷相对含量显著上调;ZJF 中槲皮素-3-O-(6″-没食子酰)葡萄糖苷、槲皮素-3-O-(6″-对香豆酰)葡萄糖苷以及槲皮素-3-O-阿拉伯糖苷相对含量上调,而YSF中3种槲皮素苷[槲皮素-3-O-(2″-O-鼠李糖基)芸香糖苷、槲皮素-7-O-(6″-丙二酰)葡萄糖苷和槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷]、2 种异鼠李素苷(异鼠李素-7-O-葡萄糖苷和异鼠李素-3-O-葡萄糖苷)和1 种杨梅素苷[杨梅素-3-O-(6″-丙二酰)葡萄糖苷]相对含量显著上调。KEGG 分析结果也显示,黄酮和黄酮醇生物合成途径是2种茶树花的主要差异代谢途径之一。在黄酮和黄酮醇生物合成途径中,芹菜素-7-O-新橙皮糖苷、山柰酚、丁香亭、山柰酚-3-O-鼠李糖苷相对含量在ZJF 中显著上调,而木犀草素、芹菜素-6-C-葡萄糖苷和牡荆素-2″-O-鼠李糖苷相对含量则在YSF 中显著上调。与常绿品种‘云抗十号’茶叶相比,新梢紫化品种‘紫娟’茶叶特征性差异代谢物主要富集在黄酮和黄酮醇生物合成途径,且倾向于花色苷物质的积累[22]。与茶叶不同,本研究结果显示,相较于常绿品种YSF,ZJF更倾向于积累黄酮醇及其糖苷(山柰酚及其糖苷)、原花青素等物质,而花色苷富集的优势不明显。
黄酮醇及其苷类因阈值低而对茶汤涩味贡献较大,其对涩味的贡献受苷元、糖基类型和糖基排列顺序的影响[23],同时槲皮素-芸香糖苷还可协同增强咖啡碱的苦味[24]。本研究结果显示:ZJF中相对含量显著上调的黄酮醇及其苷类以山柰酚和槲皮素糖苷为主,其中山柰酚-3-O-鼠李糖苷、槲皮素-3-O-(6″-没食子酰)葡萄糖苷和山柰酚-3-O-(4″-对香豆酰)鼠李糖苷相对含量均显著上调,分别较YSF 提高305.4、14.5、9.2倍,可能与该品种略苦微涩的滋味属性有一定关系;而YSF中牡荆素-2″-O-鼠李糖苷相对含量显著上调,较ZJF提高2.2倍,与茶汤的苦味、涩味强度均具有较好的相关性[25]。2 个样品间不同苷元的相对含量差异可能是其具有不同苦涩度的原因之一,黄酮醇及其苷类组分可能是区分ZJF 和YSF 的主要差异代谢物。未来可增加茶树花品种样本量,进一步明确使茶树花呈现涩味的关键黄酮醇及其苷类,以及黄酮和黄酮醇生物合成途径是否与茶树新梢叶色具有相关性,并分析黄酮醇及其苷类在茶树花中的积累模式。
游离氨基酸含量不仅影响茶叶的品质,还对茶汤的鲜爽度和醇厚度有重要贡献[26],一般而言,茶树花中游离氨基酸总量高于茶叶中游离氨基酸总量[11]。本研究发现,ZJF 和YSF 中共有17 种差异氨基酸及其衍生物(图7B),其中ZJF中有16种相对含量上调。这17 种差异氨基酸及其衍生物被注释到KEGG 的9 条通路中,其中ZJF 中有8 种氨基酸(如甘氨酸、丝氨酸、天冬酰胺、天冬氨酸、N-α-乙酰-L-鸟氨酸、精氨酸、N6-乙酰-L-赖氨酸和色氨酸,主要参与精氨酸生物合成、酪氨酸代谢、鞘脂类代谢和苯丙氨酸代谢途径)相对含量显著上调,1种氨基酸(5-羟基-L-色氨酸,参与色氨酸代谢途径)相对含量显著下调。2个样品中的游离氨基酸对茶汤滋味的醇厚度可能有一定的贡献。ZJF中相对含量上调的氨基酸及其衍生物主要为蛋白类氨基酸,可能由萎凋过程中蛋白质水解而形成[27],其中天冬氨酸、天冬酰胺的含量与白茶的鲜味呈正相关[28],且这2 种氨基酸的相对含量在ZJF 中显著上调,分别较YSF提高2.3、2.5倍,可能在一定程度上增强了茶汤的鲜味。丝氨酸、甘氨酸等为甜味氨基酸[29],其相对含量在ZJF中显著上调,分别较YSF提高2.0、2.4倍,可能对茶汤味甘的属性有部分影响。
有研究显示,茶树花中酚酸及其衍生物质量分数为8 696.92 µg/g[30]。如图7C 所示,ZJF 和YSF 中有56 种酚酸类物质存在显著差异,其中ZJF 中有43种相对含量显著上调,YSF中有13种相对含量显著上调。此外,2 个品种中的18 种差异酚酸类物质被注释到KEGG通路中,在ZJF中有15种相对含量显著上调、3种相对含量显著下调,主要参与酪氨酸代谢、苯丙氨酸代谢等途径。酚酸类物质是茶叶中多酚类化合物的重要组分,包括绿原酸、咖啡酸和没食子酸等,主要呈涩味[31]。与YSF相比,ZJF中异绿原酸A、B、C 以及绿原酸的相对含量虽然均显著上调,但由于茶树花中酚酸类物质含量较少,对茶树花茶汤滋味贡献程度不大,导致该类物质并未对ZJF和YSF茶汤滋味产生明显影响。如图7D所示,ZJF 中有11 种鞣质的相对含量显著上调,其中包括8 种原花青素,而YSF 中有8 种鞣质的相对含量显著上调。
2.4 茶树花滋味化学组分分析
儿茶素类、生物碱也对茶汤涩味和苦味具有重要贡献,故采用HPLC和比色法测定儿茶素类、生物碱、花青素、黄酮类和可溶性糖等理化成分含量,为进一步解释ZJF和YSF呈现甘和和一定苦涩度的滋味属性提供依据。
儿茶素类物质主要包括酯型儿茶素(EGCG、ECG、GCG、CG)和非酯型儿茶素(GC、EC、EGC、C),其中EGCG 在茶树花中含量最高[10]。本研究中,ZJF 和YSF 的EGCG 分别占儿茶素类总量的32.65%和49.75%。代谢组学分析中,YSF 的GCG、EGCG含量高于ZJF,由表3可知HPLC检测结果与代谢组学儿茶素类分布趋势相符。酯型儿茶素与非酯型儿茶素含量的比值是衡量茶汤苦涩味和回甘程度的重要指标之一,其比值越大则苦涩味增加,比值越小则滋味越醇和[32-33]。本研究中YSF 和ZJF 的酯型儿茶素/非酯型儿茶素比值分别为3.16 和1.16(表3),故YSF滋味略涩。
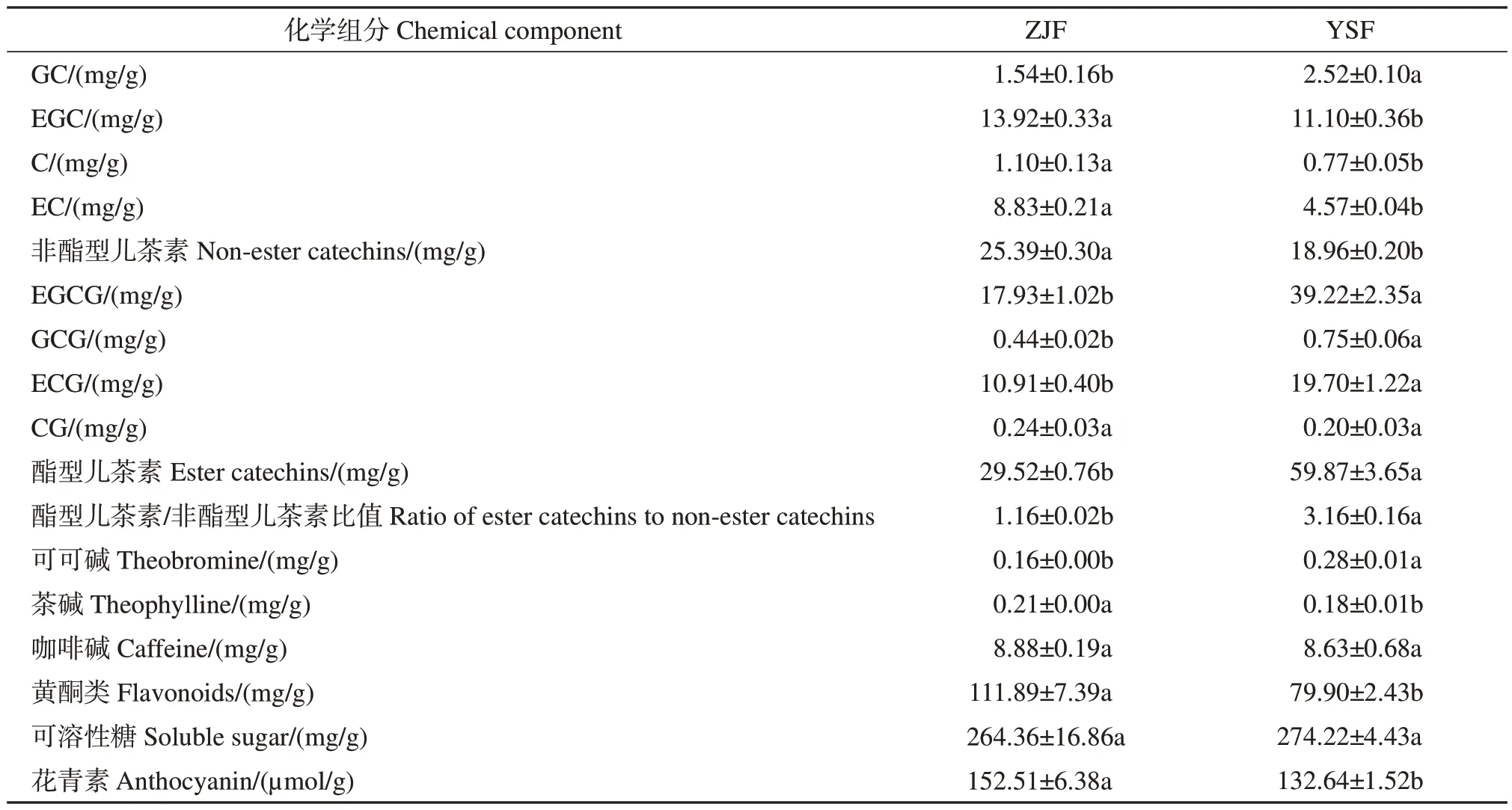
表3 ZJF和YSF中的滋味化学组分含量Table 3 Contents of taste chemical components in ZJF and YSF
ZJF中的黄酮类总量、花青素总量、咖啡碱和茶碱含量均高于YSF,其中黄酮类总量、花青素总量、茶碱含量差异达到显著水平(P<0.05);YSF中可溶性糖含量和可可碱含量均高于ZJF,其中可可碱含量差异达到显著水平(P<0.05)。花青素使茶汤中苦味增加,汤色变深[34-35],‘紫娟’茶叶中花青素总量是‘云抗十号’茶叶的16.2 倍[22]。本研究中,ZJF 花青素总量是YSF的1.15倍,说明ZJF中花青素富集优势不明显,与代谢组学分析中花色苷并未在ZJF中特异性积累的结果一致。此外,有研究显示茶树花中咖啡碱质量分数在3~11 mg/g之间,远低于茶叶中咖啡碱的含量[36],ZJF和YSF中的咖啡碱含量低,表明茶树花可作为一种低咖啡碱潜在饮品进行开发。此外,茶树花中糖总量占其干质量的20%~30%[7],且可溶性糖主要呈甜味,可降低茶汤的苦涩味[37],YSF中可溶性糖质量分数(274.22 µg/g)略高于ZJF(264.36 µg/g),这与代谢组学分析结果(YSF中水苏糖和蔗果四糖2种可溶性糖的相对含量分别比ZJF上调2.7、2.8倍)基本一致,推测2个样品中较高的可溶性糖含量有助于降低茶树花茶汤滋味的苦涩度,提高醇和感。
3 结论
本研究采用广泛靶向代谢组学技术全面测定了ZJF和YSF中的897种代谢物,成功筛选、鉴定出219种显著差异代谢物,其中酚酸类、黄酮类和脂质是2个样品的主要差异代谢物。关键非挥发性差异代谢物相对含量的差异造成了ZJF和YSF的滋味感官差异,ZJF 中山柰酚苷、槲皮素苷等8种黄酮醇苷以及16 种氨基酸及其衍生物相对含量上调可能导致该茶树花茶汤略苦微涩、鲜味明显,而YSF中牡荆素-2″-O-鼠李糖苷、槲皮素-芸香糖苷等12种黄酮醇苷相对含量上调则可能导致YSF 微苦略涩。采用HPLC 和比色法测定2 个样品中的理化成分含量,结果显示:ZJF中非酯型儿茶素总量、茶碱含量、黄酮类和花青素总量均显著高于YSF,酯型儿茶素总量、可可碱含量均显著低于YSF,可溶性糖含量在2个样品间差异不显著。代谢组学与比色法分析结果均说明ZJF中花青素富集优势不明显。KEGG通路注释分析进一步发现,氨基酸类物质相关代谢、黄酮和黄酮醇代谢途径是ZJF 和YSF 的主要差异代谢途径。在今后的研究中,可进一步对其他品种的茶树花差异代谢物进行验证并研究其生物学功能,深入探究其代谢机制,为不同品种茶树花的品质评定提供参考。

