餐饮中沙门氏菌实时荧光定量PCR 快速检测方法的建立
陈玉珍 朱良兵 胡翮 何硕 郭沛 赵子冰
(湘潭市食品药品检验所 湖南湘潭 411100)
0 引言
快速有效地检测沙门氏菌对于餐饮安全至关重要[1-3]。 沙门氏菌(Salmonella)是一种无芽胞、无荚膜的革兰阴性杆菌,包括肠道沙门氏菌和邦戈尔沙门氏菌2 种,目前已发现存在2 579 个血清型[4-5]。因其营养要求低,在粪便、土壤、水、食品(肉、蛋、奶、面包等) 中存活时间可长达5 个月至2 年之久,且污染食品后并无明显的感官变化,极易被动物及人类食用造成感染性疾病,是引起食物中毒的常见致病菌之一[6-8],感染后可引发伤寒、副伤寒、败血症、胃肠炎、食物中毒等,因此沙门氏菌始终是医疗卫生、食品卫生和商检部门的重点检验对象之一[9-11]。沙门氏菌病对全球特别是发展中国家的公共卫生安全构成严重威胁, 占我国食源性疾病的40%~60%。
沙门氏菌传统的检验方法存在特异性差、 步骤繁多、耗时耗力(需3~5 d)等缺点,无法满足当今社会环境下的检测需求。 因此,建立快速、准确的沙门氏菌检测方法对预防沙门氏菌病是非常必要的[12-14]。 本研究根据沙门氏菌ompC 保守序列设计特异性引物和TaqMan 探针, 建立一种可快速检测沙门氏菌的实时荧光定量PCR 法。
1 材料与方法
1.1 材料
1.1.1 试验菌株
亚利桑那沙门氏菌(Salmonella arizonae)、鼠伤寒沙门氏菌(Salmonella typhimurium)、乙型副伤寒沙门氏菌(Salmonella para-typhi B)、大肠埃希氏菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、单核细胞增生李斯特氏菌(Listeria monocytogenes)、福氏志贺氏菌(shigella flexneri)、副溶血性弧菌(Vibrio parahaemolyticus)均为本科室经试验分离鉴定保存菌株。
1.1.2 仪器和试剂
StepOnePlus 实时荧光定量PCR 仪 (美国ABI公司); 离心机(德国SIGMA 公司);VITEK2 compact 全自动微生物鉴定及药敏分析仪(法国梅里埃公司);麦氏比浊仪(法国梅里埃公司);HFsafe-1200生物安全柜(上海力申科学仪器有限公司);生化培养箱(上海一恒科学仪器有限公司);霉菌培养箱(天津泰斯特仪器有限公司);恒温水浴锅(北京市永光明医疗仪器厂);立式压力蒸汽灭菌器(上海博讯实业有限公司); 沙门氏菌核酸荧光PCR 法测定试剂盒(生科源);细菌培养基均由北京陆桥公司提供。
1.1.3 沙门氏菌核酸荧光试剂盒主要组成成份核酸提取液,沙门氏菌核酸荧光PCR 检测混合液、酶、H2O、阴性对照品、阳性对照品。
1.1.4 试验样品
随机抽样餐具、筷子、盒饭、米面制品、沙拉、鲜榨果蔬汁、中式凉拌菜、烧烤类、热菜及寿司类,采样地点覆盖饭店、酒店、集体食堂、街头摊点、快餐店、小吃店、饮品店等。
1.2 引物与引物和TaqMan 探针的设计与合成
根据GenBank 登录的沙门氏菌ompC 保守序列,运用Primer Express 5.0 软件设计引物和探针。
上游引物P1:5’-CTCACCAGGAGATTACAACATGG-3’;
下游引物P2:5’-AGCTCAGACCAAAAGTGACCATC-3’。
探针序列为:FAM-CACCGACGGCGAGACCGACTTT-TAMARA。由擎科生物股份有限公司合成。
1.3 方法
1.3.1 菌种复苏
将存于-80℃低温冰箱中的阳性菌液接种至胰酪大豆胨液体培养基中复苏,36°C 培养24 h。
1.3.2 模板制备
取培养液中的菌液,置于含1mL 生理盐水的离心管中,利用麦氏浊度仪配置成0.5 麦氏单位菌悬液(相当于含细菌数1.5×108/个)振荡混匀[15-16],12 000r/min离心5 min;去上清,直接在沉淀中加入50 μL DNA提取液,金属浴100℃5 min;12 000 r/min 离心2 min,取上清液即为DNA 提取液 (如不立即进行试验,于-20℃冻存)。
1.3.3 荧光定量PCR 检测体系的评价
先对阳性沙门氏菌对照菌种进行实时荧光定量PCR 检测,以考察体系的符合性;以无菌操作将沙门氏菌提取的核酸DNA (以0.5 麦氏单位菌悬液为原液提取),按10 倍稀释至10-1~10-7浓度,用本研究考察荧光定量PCR 的灵敏度和可行性;选取经过传统方法鉴定的47 份沙门氏菌阳性样品和另外3种实验室保存阳性沙门氏菌株进行DNA 的提取并进行PCR 检测,以验证该体系的特异性;同时对4个浓度的样本进行6 次的重复试验。 通过试验的结果CT 值的平均值来评价方法的可重复和稳定性。
1.3.4 VITEK2 compact 与荧光定量PCR 灵敏度
将0.5 麦氏单位菌悬液制成100~10-4浓度的菌液, 将5 个浓度菌液进行VITEK2 compact 上机生化鉴定, 同时对5 个浓度的菌悬液进行DNA 提取,并进行荧光定量PCR 检测。 通过试验结果来比较2种检测方法的灵敏度差异。
1.3.5 荧光定量PCR 检测体系建立
荧光定量PCR 体系为25 μL,包括19.5 μL PCR混合反应体系(包括引物和探针)、0.5 μL 混合酶液、5 μL 模板DNA,进行PCR 扩增。 扩增程序为:UNG处理50℃2 min; 预变性95℃3 min;100℃5 s、55℃60 s(采集荧光信号)循环40 次。荧光通道选择FAM通道。
2 结果
2.1 方法符合性
47 株分别是餐饮具和食品中分离鉴定的沙门氏菌, 通过PCR 扩增出现良好的S 型扩增曲线,CT值均<30,有明显指数增长,检测结果均能判定为阳性。表明本研究建立的荧光PCR 检测体系的正常性及对沙门氏菌检测具有较高的符合性,见图1。

图1 沙门氏菌实时荧光定量PCR 检测体系的符合性Fig.1 Conformity of Salmonella real-time fluorescence quantitative PCR detection system
2.2 方法的特异性
采用荧光定量PCR 方法扩增阳性对照DNA、沙门氏菌及5 种相关肠道细菌DNA 进行检测,结果见图2。 阳性菌和沙门氏菌DNA 扩增后,呈S 型扩增曲线, 其他肠道细菌DNA 及阴性对照均未扩增,表明本研究建立的荧光定量PCR 检测方法具有极高的特异性。
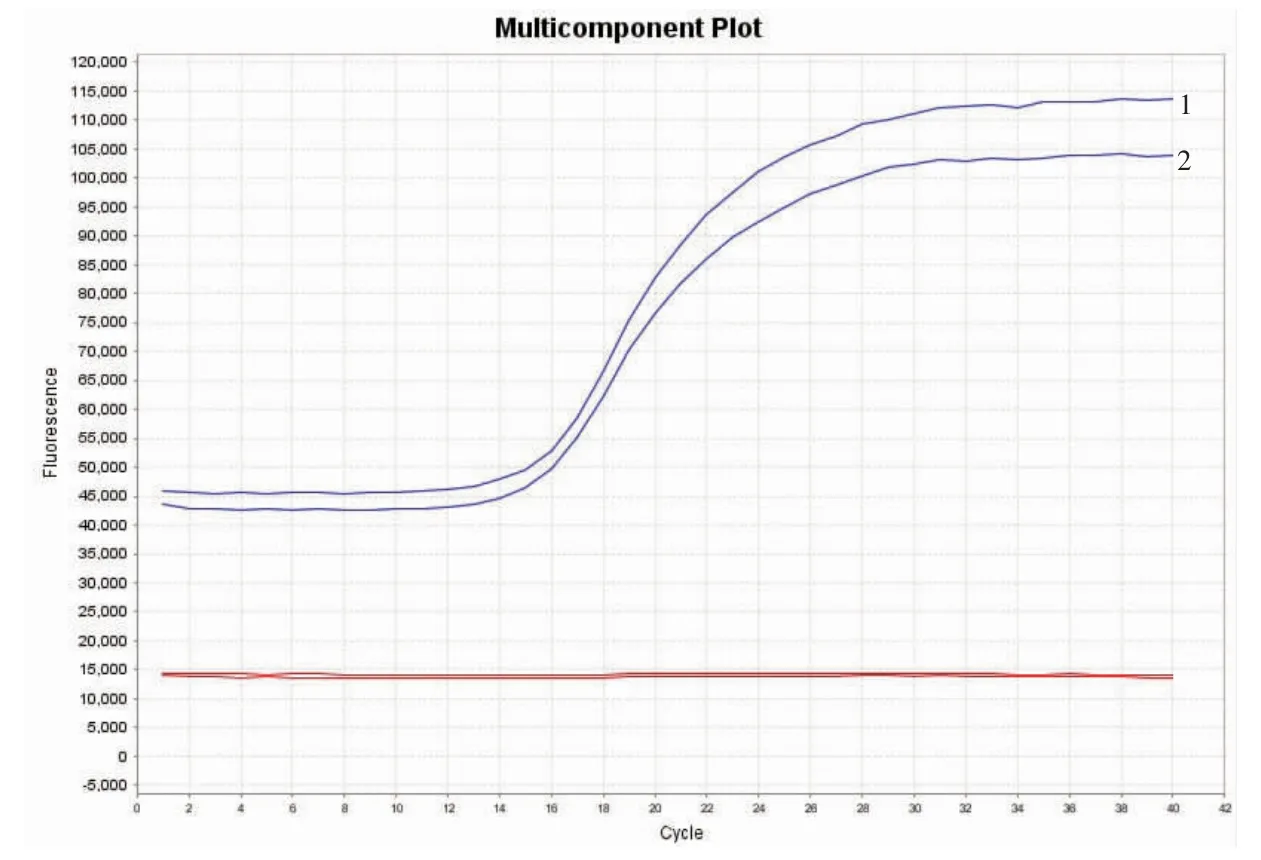
图2 沙门氏菌实时荧光定量PCR 检测特异性扩增结果Fig.2 Specific amplification results of real-time fluorescent quantitative PCR detection of Salmonella
2.3 方法的灵敏性
将阳性沙门氏菌DNA 稀释至浓度依次为1.5×107CFU/mL~1.5×101CFU/mL; 用稀释后的DNA 作为模板进行荧光定量PCR 扩增,结果见图3。 当DNA浓度为1.5×107CFU/mL~1.5×101CFU/mL,CT 值随着浓度的降低而增大,最低检出限量值为15 CFU/mL。

图3 沙门氏菌实时荧光定量PCR 检测灵敏性扩增结果Fig.3 Sensitivity amplification results of real time fluorescence quantitative PCR for Salmonella detection
2.4 方法的重复性
选取1.5×107、1.5×106、1.5×105、1.5×104CFU/mL共4 个浓度沙门氏阳性菌DNA, 用建立的PCR 反应体系分别进行6 次的重复检测,记录各组的Ct值,并计算变异系数,结果见表1。Ct 值变异系数均在合理范围内,均小于0.2%,表明本研究建立的检验方法重复性极高。
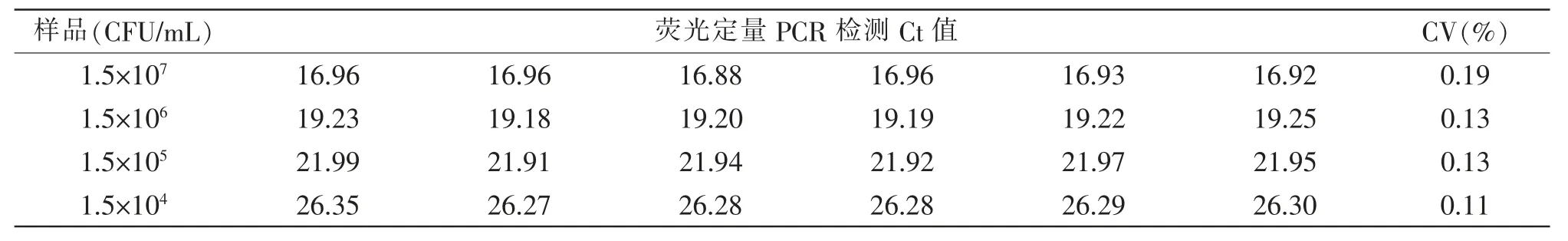
表1 阳性菌株样本重复性检测结果Table 1 Repeatability test results of positive strain samples
2.5 VITEK2 compact 与荧光定量PCR 灵敏度比较
将阳性沙门氏菌复苏菌液配置成0.5 麦氏单位菌悬液并稀释成100~10-4浓度的菌液, 将这5 个浓度的菌液分别进行VITEK2 compact 上机生化鉴定和荧光定量PCR 检测。 结果显示,VITEK2 compact和荧光定量PCR 检测时间相近,与传统沙门氏菌鉴定方法相比,时间大大缩短,但是二者在灵敏度上存在明显差异,详见表2。

表2 VITEK2 compact 和荧光定量PCR 检测方法灵敏度比较Table 2 Comparison of sensitivity between VITEK2 compact and fluorescent quantitative PCR detection methods
2.6 实际样品的检测
2020 年9 月—2021 年9 月,本实验室收集餐饮具和食品样品共计300 份:餐具、筷子、盒饭、米面制品、沙拉、鲜榨果蔬汁、中式凉拌菜、烧烤类、热菜及寿司类。对样品进行前增菌培养后,检测过程分别采用传统培养法、VITEK2 compact 全自动微生物鉴定及实时荧光定量PCR 进行平行试验,对比3 种方法的优劣。 结果显示,3 种方法检测阳性结果相近,其中传统培养法和实时荧光定量PCR 都检出47 批阳性,VITEK2 compact 检出42 批阳性。之后分别采用全式金DNA 提取试剂盒提取DNA,采用其配套PCR体系和生科源检测试剂盒进行实时荧光定量PCR检测,对上述47 批阳性样本进行第二轮验证,发现二者检测阳性结果一致,符合率为100%。从以上分析结果可以看出, 应用荧光定量PCR 方法检测餐饮具和食品实际样品中的沙门氏菌更快捷、准确。
3 结论与讨论
沙门氏菌是一种革兰氏阴性肠道杆菌, 能够进入多种宿主细胞的侵袭细菌[17]。 沙门氏菌作为一种人类致病菌每年都会导致很多严重病例和死亡病例,受到全世界的广泛关注[17]。餐饮具、餐饮食品、动物或动物制品、 新鲜的农产品等间接受到沙门氏菌污染都会导致感染[18]。 传统的沙门氏菌检测主要依靠细菌分离、生化鉴定等方法,过程繁琐,费时费力,生化反应容易交叉[19]。因此,快速、准确地检测沙门氏菌对保障食品安全、防止疾病传播具有重要意义[20]。
实时荧光定量PCR 方法是一种建立在普通PCR基础上的新技术, 该技术可以检测分析各技术扩增同时进行,具有特异性强,灵敏度高、检测快速等特点[21]。 根据沙门氏菌ompC 保守序列登录GenBank,运用Primer Express 5.0 软件设计引物和探针,确定PCR 体系及反应条件后,同时对阳性沙门氏对照菌种、3 种实验室保存阳性沙门氏菌株以及5 种相关肠道细菌的DNA 进行扩增检测。 结果显示,所有沙门氏菌及其阳性对照菌株呈S 型扩增曲线, 其他细菌没有扩增, 充分证明了沙门氏菌的实时荧光定量PCR 方法具有高度特异性和覆盖性。同时,对阳性沙门氏菌DNA 稀释至浓度依次为1.5×107CFU/mL~1.5×101CFU/mL 进行灵敏性检测; 对浓度依次为1.5×107、1.5×106、1.5×105、1.5×104CFU/mL 进行重复性检测,灵敏度为15 CFU/mL,重复试验的CT 值变异系数小于0.2%。利用本研究建立的荧光定量PCR方法与生科源沙门氏菌检测试剂盒分别对采集的300 份样本中的沙门氏菌进行检测,2 种方法的阳性检出率都为15.7%。 比较VITEK2 compact 和荧光定量PCR 2 种检测方法, 检测时间分别为6 h和3 h,可见2 种检测方法时间比较相近, 但是VITEK2 compact 检测存在试剂成本较高、购买时间周期长、所有配套检测卡片均需从国外进口的缺点, 且在样品复苏菌液含量低于1.5×107CFU/mL 时便不能检出;而荧光定量PCR 的检验灵敏度可达到15 CFU/mL, 且检测成本低, 所有试剂均可在国内购买。 在实际检测300 份样本时,VITEK2 compact 存在漏检阳性的情况,漏检率达到11%。 这些检测方法的对比结果说明本研究建立的荧光定量PCR 方法方便、 快捷,可以有效用于餐饮具、 餐饮食品安全监测以及临床检测等领域[22]。
普通PCR 检测从核酸DNA 提取至PCR 扩增级电泳的全过程大约需要5~7 h, 而采用本研究建立的方法从核酸DNA 提取到检测完成最快仅需3 h,且该方法实行完全闭管式操作, 可从根本上杜绝污染[23-24]。 综上所述,本研究建立的沙门氏菌实时荧光定量PCR 检测方法,具有灵敏度高、特异性强、稳定性好、方便快捷等优点,可运用于实验室日常保障检测任务中,具有良好的实用价值,对沙门氏菌的防治具有重要意义。

