恒温荧光PCR 法与国标法在单增李斯特氏菌检验能力验证中的应用与分析
高土玲 符天晓
(海南省食品药品检验所三亚分所 海南三亚 572000)
0 引言
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)简称单增李斯特氏菌,是一种食物传播病原菌,特别是对免疫缺陷的人群具有潜在的致命性[1]。2002 年,WHO 已将单核细胞增生李斯特氏菌列为重要的食源性致病菌之一[2]。 由该菌感染引起的人畜患胃肠炎、脑膜炎、败血症以及孕妇流产等疾病致死率高达30%~70%[3-4]。 随着人们生活节奏的加快,速冻食品、即食食品的消费量也迅速增加,但该类食品极易被单增李斯特氏菌污染[5]。 近年来,我国食品安全风险监测人员调查发现, 我国即食食品中的熟肉制品和凉拌菜污染该致病菌的概率较高[6-7],因此,建立快速、准确的检测方法是保障人民食品卫生安全的重要手段。
目前, 我国食品药品检验检测机构主要采用国标法GB 4789.30—2016《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验检》[8]检测食品中单增生李斯特氏菌。 国标法检测的程序比较繁琐,首先是对待测样品进行选择性增菌培养,然后转接至显色培养基平板上,根据显色平板上的菌落特征进行分离单增李斯特氏菌, 再经过一系列生化试验进行确证。 国标法检测周期长,大约需要5~7 d,不能满足快速检测的要求,且容易受到同属其他李斯特菌的影响,对检验人员的操作能力和工作经验要求较高[9]。 环介导等温扩增技术(loop-mediated isothermal amplification,LAMP) 是Notomi 等建立的一种新的核酸扩增方法[10],原理是利用4 条特殊设计的引物及具有链置换活性的Bst DNA 聚合酶,在恒温条件下高效扩增核酸,在1 h 内即可完成。 易敏英等[11]建立了恒温实时荧光法检测副溶血性弧菌, 该方法具有特异性强、灵敏高等特点,符天晓等[12]在副溶血性弧菌检验能力验证中,利用恒温荧光PCR 法与国标法进行比较,发现两种方法检测结果一致,利用恒温荧光PCR 法可有效提高检测效率。 黄小真[13]建立同时快速检测6 种致病菌的恒温荧光PCR 方法,发现恒温荧光PCR 法和国标培养法检测的结果一致性为100%。
有文献报道, 少数单增李斯特氏菌存在不溶血现象(ATCC15313)、少数英诺克李斯特氏菌能够发酵木糖等[8],因此,检验人员不能单纯通过溶血实验或某个生化实验结果来确认或排除某一种李斯特氏菌,有必要利用核酸扩增(PCR)的手段,在分子水平上对单增李斯特氏菌进行检测, 这样能够避免漏检或判断错误的发生。 本研究以中国检验检疫科学研究院组织的单核细胞增生李斯特氏菌检测能力验证为契机, 通过比较分析恒温实时荧光核酸检测技术与国标GB 4789.30—2016《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》 的结果, 以期丰富实验室人员对单增李斯特氏菌的检测经验,提高实验室检验检测能力。 同时,利用恒温荧光PCR 法快速检测单增生李斯特氏菌的方法进行确认,为食品中致病菌的快速检测提供依据。
1 材料与方法
1.1 材料
1.1.1 样品来源
中国检验检疫科学研究院发放的编号为20-E323、20-P712 的肉类冻干粉。
1.1.2 耗材和仪器
对照用菌株:单核细胞增生李斯特氏菌(中国工业菌种保藏中心,编号:CICC23929)、英诺克李斯特氏菌(中国工业菌种保藏中心,编号:CICC10417)。
试剂:李氏增菌肉汤LB(LB1,LB2)、单增李斯特氏菌显色培养基、PALCAM 琼脂、 含0.6%酵母浸膏的胰酪大豆肉汤(TSB-YE)、血平板、单核细胞增生李斯特氏菌生化鉴定试剂盒(广州环凯微生物科技有限公司);VITEK 2 COMPACT 全自动微生物鉴定系统、GP 卡(生物梅里埃公司);DNA 快速提取试剂盒、 单核细胞增生李斯特氏菌核酸检测试剂盒包括LM 反应液、Bst DNA 聚合酶、阴性对照、LM 阳性对照、密封液(广州迪澳生物科技有限公司)。所有试剂经过验证并在有效期内。
仪器:MLS-3781L-PC 高压蒸汽灭菌锅(日本松下公司);KB240 生化培养箱(德国BINDER 公司);BHC-1300ⅡA2 生物安全柜(苏州安泰空气计数有限公司);Deaou-308C 恒温荧光检测仪(广州迪澳生物科技有限公司)。
1.2 实验方法
1.2.1 国标检验方法
参照GB 4789.30—2016 《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验第一法单核细胞增生李斯特氏菌定性检验》进行检测。
增菌和分离:分别将20-E323、20-P712 的肉类冻干粉样品,无菌操作打开冻干细菌混合物西林瓶,立即加入18 mL 生理盐水复原,充分混匀,复原后样品相当于25 g 的新鲜肉糜样品。 以无菌操作方式,将上述待测样品放入盛有225 mL LB1增菌液的无菌均质杯中,均质,同时,接种本实验室保藏的单增李斯特氏菌和英诺克李斯特氏菌作为对照, 置于30℃生化培养箱进行培养24 h。 用移液枪分别吸取0.1 mL,转种于10 mL LB2增菌液内,于30℃生化培养箱培养24 h。 将LB2增菌液分别转接至具有选择性的平板上, 即接种于李斯特氏菌显色平板和PALCAM 琼脂平板, 并于36℃生化培养箱培养24~48 h。
生化鉴定:从选择性平板上挑选5 个可疑菌落,分别接种木糖、鼠李糖发酵管,于36℃培养24 h。 同时,在TSA-YE 平板上进行纯化,置于36℃生化培养箱培养24 h,用于生化试验。根据单增生李斯特氏菌生化鉴定试剂盒说明书进行生化鉴定。同时,制备浊度为0.5 的菌悬液进行VITEK 2 COMPACT 生化鉴定。
1.2.2 恒温荧光PCR 检验方法
参照广州迪澳生物科技有限公司提供的DNA提取试剂盒的使用方法进行模板制备; 参照试剂配制、添加模板、扩增反应。
(1)模板制备
吸取1 mL LB1培养液于1.5 mL EP 管内,离心,去掉上清液,加入1 mL 无菌水混匀作为待测液,取待测菌液100 μL 至900 μL DNA 提取液,涡旋振荡混匀,在金属浴100℃条件下加热10 min,1 000 r/min离心30 s, 所得上清液为待测样品基因组DNA,作为PCR 扩增模板。
(2)试剂配制
将试剂解冻、混匀,1 000 r/min 离心30 s,将LM反应液(22 μL×N)和Bst 聚合酶(1.0 μL×N)置于1.5 mL EP 管中,涡旋混匀、离心30 s,分装到N 个0.2 mL PCR 管中,每管加入23 μL 混合反应液,最后分别向每管加入20 μL 密封液。
(3)添加模板
在步骤(2)中已含反应液的PCR 管中加入2 μL模板, 顺序为阴性对照、 待测样品模板、 阳性对照(LM),1 000 r/min 离心30 s,立即进行扩增反应。
(4)扩增反应
使用Deaou-308C 恒温荧光检测仪进行检测,反应程序为63℃反应45 min, 仪器自动判定结果,如若有“S”型扩增曲线,则判断为阳性,即检出单增李斯特氏菌;如无“S”型扩增曲线,则判为阴性,即未检出单增李斯特氏菌。
2 结果与分析
2.1 国标检验结果
2.1.1 菌落形态
单增李斯特氏菌、英诺克李斯特氏菌、20-E323和20-P712 的菌落在显色平板上的菌落特征如图1、图2 所示。其中图1 为菌落在PALCMA 平板上的培养结果, 结果显示, 阳性对照菌株单增李斯特氏菌、 阴性对照菌株英诺克李斯特氏菌以及20-E323和20-P712 在PALCMA 平板上均有小的圆型灰绿色菌落、周围有棕黑色水解圈的菌落生长。在单增李斯特氏菌显色培养基上, 因单增李斯特氏菌生长代谢产生葡萄糖甘酶能够与显色培养基中的底物发生酶特异性反应,产生特有的菌落形态:蓝绿色光滑规则小菌落, 而英诺克李斯特氏菌菌落为无色光滑规则小菌落。 由图2 可知, 阳性对照菌单增李斯特氏菌、20-E323 和20-P712 在单增李斯特氏菌显色平板上均有规则蓝绿色光滑小菌落, 完全符合单增李斯特氏菌在李斯特氏菌显色平板上的形态特征。

图1 单增李斯特氏菌、英诺克李斯特氏菌、20-E323 和20-P712 在PALCMA 平板上的可疑菌落Fig.1 Suspected colonies of Listeria monocytogenes,Listeria inoculata,20-E323 and 20-P712 on PALCMA plates

图2 单增李斯特氏菌、英诺克李斯特氏菌、20-E323 和20-P712 在李斯特菌显色培养基平板上的可疑菌落Fig.2 Suspected colonies of Listeria monocytogenes,Listeria inoculata,20-E323 and 20-P712 on Listeria chromogenic medium plates
2.1.2 生化鉴定结果
为了确证显色平板所生长的菌落是否属于单增李斯特氏菌,将平板上的可疑菌落进行纯化,采用广州环凯单核细胞增生李斯特氏菌生化鉴定试剂盒以及梅里埃VITEK 2 COMPACT 全自动微生物鉴定系统进行生化鉴定实验。 可疑菌落革兰氏染色均为阳性短杆菌。 动力试验结果显示:在SIM 培养基上方呈伞状生长。 生化试剂盒鉴定结果如表1 所示,20-E323 和20-P712 的可疑菌落糖发酵结果如下:七叶苷(+)阳性、木糖(-)阴性、鼠李糖(+)阳性、葡萄糖(+)阳性、麦芽糖(+)阳性、甘露醇(-)阴性,生化结果与阳性对照菌单增李斯特氏菌的结果一致,符合国家标准GB 4789.30—2016 描述单增李斯特氏菌的生化特性。
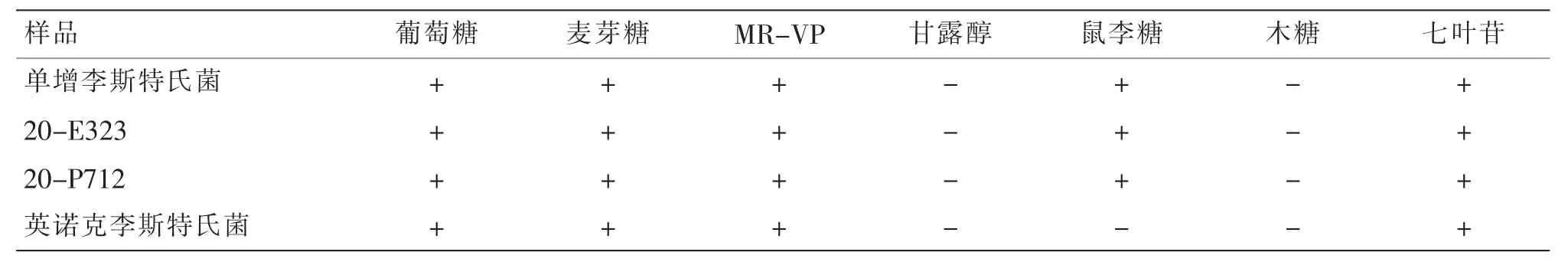
表1 单增李斯特氏菌、英诺克李斯特氏菌、20-E323 和20-P712 的可疑菌落生化反应的结果Table1 Results of suspected colony biochemical reactions for Listeria monocytogenes,Listeria innock,20-E323,and 20-P712
VITEK 2 COMPACT 自动微生物鉴定系统常用于微生物的鉴定, 且符合我国食品微生物学检验相关标准的要求。使用VITEK 2 COMPACT 全自动微生物鉴定系统进行生化鉴定,20-E323 和20-P712的可疑菌落鉴定结果见表2。 由表2 可知,2 组能力验证样品的可疑菌落确定为单增李斯特氏菌。

表2 VITEK 2 COMPACT 全自动微生物鉴定的结果Table 2 The results of VITEK 2 COMPACT automatic microbial identification
2.2 恒温荧光PCR 检测结果
恒温荧光PCR 检测结果显示,待检样品20-E323和20-P712 均检出,如图3 所示,20-E323、20-P712 与阳性对照单增李斯特氏菌的出峰时间在13~15 min之间,荧光吸收值峰值为23 000 左右,2 组样品与阳性对照的结果基本一致。
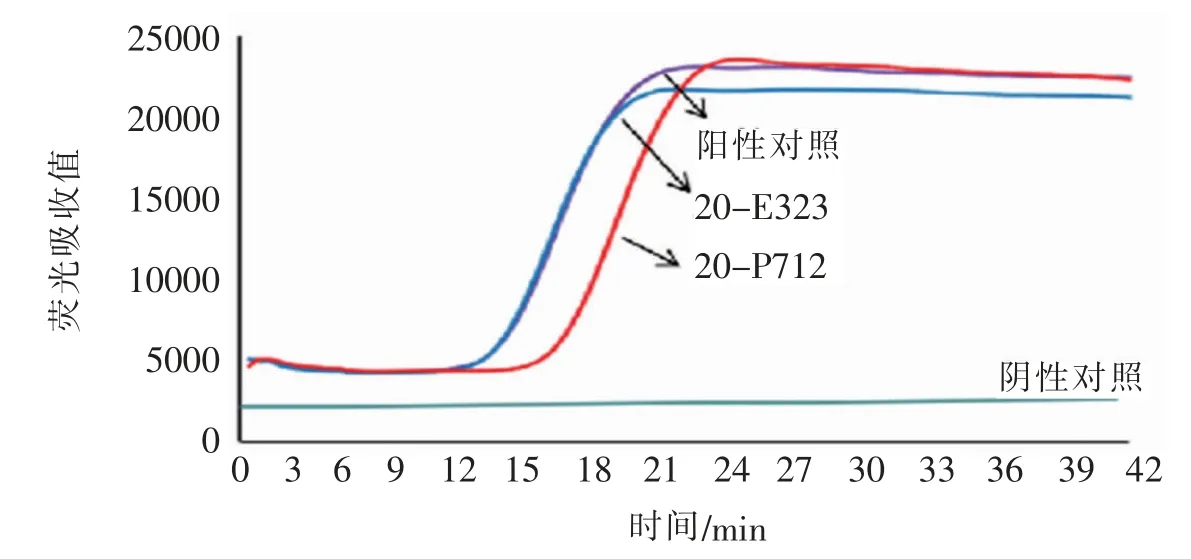
图3 20-E323 和20-P712 恒温荧光PCR 检测结果Fig.3 The results of two groups of samples were determined by isothermal fluorescence PCR
2.3 恒温荧光PCR 法与国标法对2 组样品验证结果的比较
能力验证样品的恒温荧光PCR 法与国标方法检测结果一致。如表3 所示,2 组样品均检出单增李斯特氏菌。 为了能够更加直观的分析恒温荧光PCR法的准确率,以国家标准方法为参考方法,计算其灵敏度和准确度,发现其灵敏度和准确度均为100%。计算公式如下:

表3 恒温荧光法与国标方法检测结果的比较Table 3 Comparison of detection results by isothermal fluorescence PCR and national standard method
式中:A——待确认方法和参考方法均确认为阳性的数量;B——参考方法为阳性,待确认方法为阴性的数量;C——待确认方法和参考方法均确认为阴性的数量。 N=A+B+C。
3 结论与讨论
本次能力验证采用恒温荧光PCR 法和国家标准GB 4789.30-2016 对2 组能力验证样品的可疑菌落进行单增李斯特氏菌鉴定,2 种方法的检测结果为:20-E323 和20-P712 均检出单增李斯特氏菌,此次能力验证获得满意评价, 表明本实验室完全具备检测单增李斯特氏菌的能力, 采用2 种不同的检验手段也验证了实验室人员具有基本素质和职业素养。同时也进一步证实了,当待测样品经过增菌富集后,采用恒温荧光PCR 法检测与国家标准法检测具有同等的检出率。
食品中单增李斯特氏菌的含量有可能较低,且经过加工后会造成细胞损伤, 若利用常规的国标准进行检测,有可能会出现漏检现象。本文通过对恒温荧光PCR 法检测结果与国标方法检测结果进行比较分析,发现两者的检测结果一致,且与国家标准方法相比,恒温荧光PCR 法操作步骤简单、耗时短、准确率高,可以快速检出阳性样品,可为后续的国家标准方法检验作为重要提示, 可以更好地排除人员操作对试验结果的影响,防止漏检现象的发生。在今后的工作中,可将恒温荧光PCR 筛选技术运用到其他的食品中致病菌的初筛。同时,在重大活动餐饮保障任务、 重点节假餐饮食品安全保障等需要快速出具检测结果或者需要现场进行检测的工作中, 可以利用恒温荧光PCR 法进行检测,能够快速阻断问题食品流向餐桌,确保广大人民群众的饮食安全。 并且,恒温荧光PCR 检测技术可操作性强,即使基础条件相对薄弱的实验室也可以开展检测工作。

