预测胶质瘤复发和术后生存期的MRI影像组学初步研究
翟晓阳,任进发,程思佳,毛珂,董亚宁,韩东明
作者单位:新乡医学院第一附属医院核磁共振科,新乡 453100
0 前言
胶质瘤是最常见的原发性脑部肿瘤,其主要累及成人,恶性率为80%[1-2]。恶性胶质瘤会直接影响患者的生活质量和认知功能障碍,其术后临床结局往往不佳[3]。目前胶质瘤患者标准的治疗方案为最大范围地进行切除,然后联合放疗和/或同时使用替莫唑胺化疗[4]。尽管进行了积极的治疗,患者的术后仍然很差,其中位总生存期(overall survival, OS)为29.6 个月,五年生存率为7.2%[5-6]。在常规的MRI 图像上胶质瘤复发或治疗等相关反应表现相似,很难通过常规的图像将两者区分开来。虽然随时间推移的连续成像可以尝试区分假性进展和真正的肿瘤复发,但这种明确区分通常需要数月的时间,通常会导致患者治疗不足或过度治疗的风险,因此发现患者术后是否复发对患者的预后治疗方案的制订和生存质量的提高非常重要。
影像组学是医学影像和计算机领域相结合的新兴交叉学科,通过更加全面地描述感兴趣区(region of interest, ROI)内的信息,可以捕捉远超肉眼观察到的图像信息,这些特征能够更好地反映肿瘤的异质性。在最近研究中显示,使用这些特征,特别是结合机器学习算法后在预测胶质瘤O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)启动子甲基化[7]、异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)突变状态[8-9]、肿瘤分级[10]的诊断性能和预测患者的预后效果[11]方面显示出了很有前景的可行性。这些研究聚焦于肿瘤的实体成分[12],而且忽略了周围环境对疾病本身的影响,同时模型的效能仍有提升空间[13],并且缺乏对术后较长生存期的探讨。在这项研究中,我们计划提取来自瘤周水肿区域(edema region, ED)和术前瘤内增强区域(preoperative enhancement region, POE)的影像组学特征,建立预测胶质瘤术后复发的机器学习模型,并研究其与术后生存期之间的关系。
1 材料与方法
1.1 研究对象
2018年1月至2022年4月,回顾性分析新乡医学院第一附属医院120例经病理证实的原发性胶质瘤患者病例。此外,所有数据在处理前都进行了脱敏处理,所有患者个人信息都经过去识别化和匿名化处理。本研究遵守《赫尔辛基宣言》,经新乡医学院第一附属医院伦理委员会批准,免除受试者知情同意,批准文号:EC-023-073。入组标准:(1)术后病理证实为胶质瘤的患者;(2)术前一周内行常规MRI 检查,包括T2WI、对比增强(contrast-enhanced, CE)T1WI和T2液体衰减反转恢复(T2 fluid attenuated inversion recovery, T2-FLAIR)序列扫描,扫描参数见表1;(3)术后替莫唑胺和同步放化疗。排除标准:(1)术后缺乏规范的治疗方案;(2)图像运动伪影较大或图像质量差;(3)缺乏术后完整的临床影像学检查;(4)无术后影像学随访或随访丢失。根据这些标准最终120名患者纳入原始队列中,并且收集了这些患者的临床资料和病理结果。
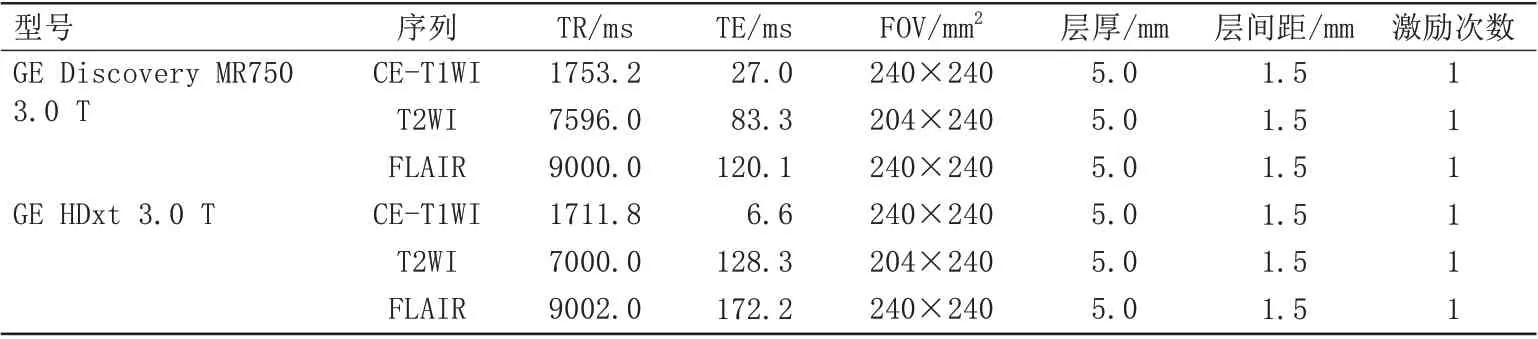
表1 机器扫描参数Tab.1 The parameters of machine scanning
根据二次手术病理结果或者神经肿瘤反应评价(Response Assessment in Neuro-Oncology, RANO)标准[14],真性进展或者复发定义:(1)至少两次间隔≥4 周的连续影像学检查,两次扫描的结果均显示病灶直径乘积之和增加≥25%;(2)随访MR 图像内有新的或增大的强化。
63名患者被定义为复发/进展,57名患者被定义为治疗相关反应。所有患者的随访主要为复诊和电话方式,末次随访时间为2023 年5 月13 日。生存时间的起点是患者首次入院MRI确诊为胶质瘤的日期,终止日期是死亡时间或末次随访时间。患者的临床资料纳入到研究中,包括性别、年龄、WHO分级、IDH状态、Ki-67 表达水平、1p/19q 和MGMT 甲基化状态。为了评价Ki-67的表达程度,我们将截断指数设为20%,<20%表示低表达,≥20%表示高表达,详见表2。
1.2 处理过程
研究流程包括ROI勾画、图像预处理、特征提取、特征选择和影像组学模型构建。两名影像科医师(3 年诊断经验的住院医师)独立勾画所有的图像,并在勾画完成后时隔一个月再次勾画,同时由第三位有30 年临床诊断经验的医师重新审查图像,与两名医师结果不一致时,三人商议重新确定图像ROI。为保证ROI 的可重复性,随机抽取30 例患者,由不同的放射科医生进行两次ROI分割,然后计算两医师各自提取特征之间的组内相关系数。所有的ROI包含POE和ED,均使用ITK-SNAP 软件手动勾画。患者的T2WI和CE-T1WI 图像纳入研究,并转化为NIFTI 格式。使用刚性和仿射变换将T2WI配准到相应的CE-T1WI,并且通过N4偏置场校验。接着将体素重采样为1 mm×1 mm×1 mm,然后用最近邻插值将灰度数据离散化25 个bin 值宽度。所有特征提取在Python 3.9 版本使用Pyradiomics包上完成。为了获取高通量特征,本研究采取了非线性强度在图像体素(平方、平方根、对数和指数)上进行变换;高斯拉普拉斯滤波器sigma值为1、2、3、4、5;对一阶统计和纹理特征进行了8种小波变换算法(分别为LLL、LLH、LHL、LHH、HLL、HLH、HHL和HHH)。
1.3 特征选择和模型构建
在对数据进行标准化处理后,为了减少冗余特征和不相干特征对结果的影响,同时提高模型的精准度,我们对特征进行了筛选。首先通过组内相关系数法分析了特征之间的相关性,阈值设置为0.75,其中大于0.75的特征纳入下一步分析。然后使用方差分析检验复发组与非复发组之间的差异性,P<0.05 认为差异具有统计学意义,其特征纳入后续分析。接着采用Spearman相关分析计算特征之间的相关系数,评价特征间的多重共线性。如果一对特征的系数值≥0.9 或≤-0.9,则只保留诊断性能较好的特征。最后通过最小绝对收缩和选择算子(least absolute shrinkage and selection operator regression, LASSO)回归并选择最小lamda 值剔除回归系数为零的冗余特征,见图1、2。
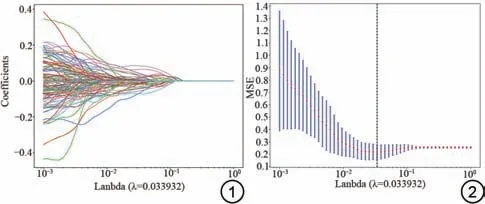
图1 最小绝对收缩和选择算子(LASSO)特征选择图。图2 选择最小lambda作为阈值的特征选择图。MSE:均方误差。Fig.1 The least absolute shrinkage and selection operator (LASSO)feature selection plot.Fig.2 Feature selection plot for selecting the minimum lambda as the threshold.MSE: mean squared error.
影像组学特征分别从POE和ED得到了5264个特征,为了确保特征的可重复性,采用Mann-WhitneyU检验选择了615 个与复发结果显著相关的特征。然后使用Spearman相关性分析检测了特征之间的相关性,最终留下了191 个特征。最后通过LASSO 回归选择最小lambda 值得到了15 个特征。这些特征类包括firstorder 特 征(n=3, 20.00%)、GLSZM(n=6,40.00%)、GLRLM(n=1, 6.67%)、GLDM(n=1, 6.67%)和GLCM(n=4, 26.67%)组成,见图3。
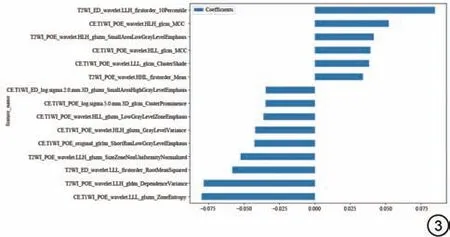
图3 特征的权重。ED:水肿区域;CE-T1WI:T1 对比增强加权图像;POE:术前瘤内增强区域。Fig.3 Weightings of features.ED: edema region; CE-T1WI: contrast-enhanced T1-weighted image; POE: preoperative enhancement region.
我们使用Python 3.70 中的scikit-learn 包进行了模型构建和评估。根据7∶3 的比例随机把患者划分为训练集和测试集,其中训练集纳入84人、测试集36 人。采用逻辑回归(logistic regression,LR)模型,最终筛选的特征纳入模型当中,采用网格搜索和5折交叉验证的方法筛选出最优的拟合模型,并在测试集中检验模型的效能。建立三种不同的LR模型,包括只含有POE、POE+ED和含有临床指标加POE、ED的融合模型。为了评估患者的生存情况,我们建立了包含IDH、影像组学评分(Rad-score)和复发状态的COX比例风险回归诺模图。根据Rad-score评分的均值把患者分为低危组(<均值)和高危组(≥均值),根据IDH 状态分为IDH 野生型组和IDH 突变型组,根据复发情况分为复发组和未复发组,分别在训练集和测试集中对患者的生存率进行Kaplan-Meier(KM)分析。采用受试者工作特征(receiver operating characteristic, ROC)曲线、校准曲线和决策曲线分析(decision curve analysis, DCA)展示模型的预测能力。计算POE、ED加POE和融合模型的诊断指标,包括曲线下面积(area under the curve, AUC)、95%置信区间(confidence interval,CI)、特异度、敏感度和准确度。Rad-score计算公式如下:
1.4 统计学分析
使用R 软件(R version 4.3.0)和Python(3.7.12)平台进行统计学分析。用Kolmogorov-Smirnov检验确定连续变量的正态或非正态分布。连续变量用均数±标准差表示,使用Mann-WhitneyU检验或Student'st检验比较组间差异。使用卡方检验或Fisher's精确检验来比较分类变量之间差异性。采用Spearman 相关分析计算最终选定特征之间的相关系数,见图4。利用ROC曲线评估模型的诊断性能,并计算AUC来估计预测模型的判别性能。统计学显著性水平均为双尾,P<0.05表示差异具有统计学意义。
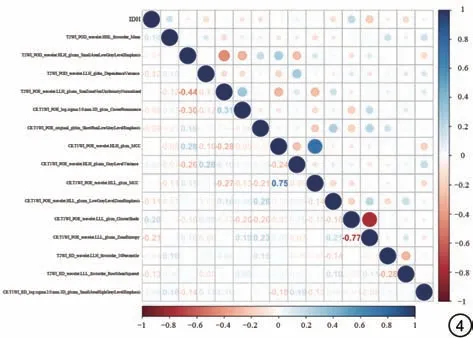
图4 最终选择特征之间的相关性热图。Fig.4 Correlation heatmap in the final selcetion of features.
2 结果
2.1 基线资料分析结果
该研究包括120名患者,其中男57例(47.5%),女63 例(52.5%),平均年龄为53.81 岁,平均生存时间为20.04个月,中位生存时间为15.50个月。根据RANO诊断标准或病理结果,术后复发患者63例(52.5%),未复发患者57例(47.5%)。复发组和未复发组性别和年龄差异无统计学意义。纳入的临床指标中WHO 分级、1p/19q、TP53、ATRX、Ki-67和CD34等差异均无统计学意义,其中IDH状态在复发组与未复发组之间差异具有统计学意义(P=0.040)。所有患者的临床资料见表2。
2.2 模型分析结果
把最终得到影像组学特征纳入到LR 模型当中后,测试集中三种模型(POE、POE+ED 和融合模型)的AUC 分别为0.859、0.866 和0.897,见图5。训练集中三种模型的AUC 分别为0.905、0.925 和0.923,其他指标详情见表3。通过对三种模型的结果对比发现,融合模型对胶质瘤术后的预测效果最好,在训练集和测试集中AUC 分别为0.923 和0.897。测试集的校准曲线显示,所有的模型拟合程度都比较好,见图6。DCA 表明,当阈值概率超过0.24 时,3 个模型都有利于诊断胶质瘤复发,表明基于影像组学的模型可以用于临床,并使患者受益,见图7。

图5 测试集中不同模型之间的受试者工作特征曲线。AUC:曲线下面积。Fig.5 Receiver operating characteristic curves of different models in test sets.AUC: area under the curve.
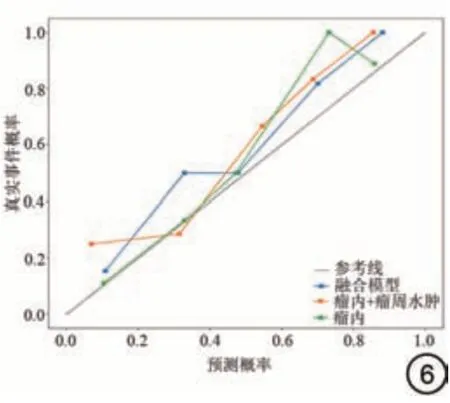
图6 测试集不同模型的校准曲线。Fig.6 Calibration curve of different models in test sets.
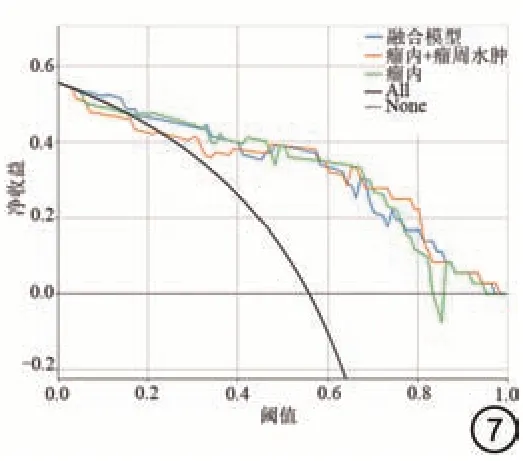
图7 测试集不同模型的临床决策曲线。Fig.7 Clinical decision curve of different models in test sets.

表3 不同模型之间的效能Tab.3 The performance in different models
2.3 生存资料分析结果
COX回归分析显示IDH野生型是影响生存的危险因素[风险比(hazard ratio, HR)=0.79,95%CI:0.50~1.30];高Rad-score 是影响生存的危险因素(HR=1.40,95%CI:0.66~2.80);术后复发是影响生存的危险因素(HR=0.82,95%CI:0.46~1.50),见表4。通过COX 回归分析诺模图显示,在全部胶质瘤患者中,三年生存率为17.5%,五年生存率为2.5%,见图8。KM 生存曲线分析显示在测试集中IDH 突变型比IDH 野生型的生存情况较好;复发组的生存情况要低于未复发组;根据Rad-score进行分组显示高危组的生存情况要差于低危组的生存情况,但3个分组之间生存情况并未显示出差异,见图9。

图8 生存时间诺模图。IDH:异柠檬酸脱氢酶,1代表突变型,0代表野生型;label:复发状态,1代表复发,0代表未复发;Rad_score:影像组学评分。Fig.8 Nomogram for predicting survival time.IDH: isocitrate dehydrogenase, 1 for mutant type, 0 for wild type; label: relapse status, 1 for recurrence, 0 for no recurrence; Rad _ score: Radiomics score.
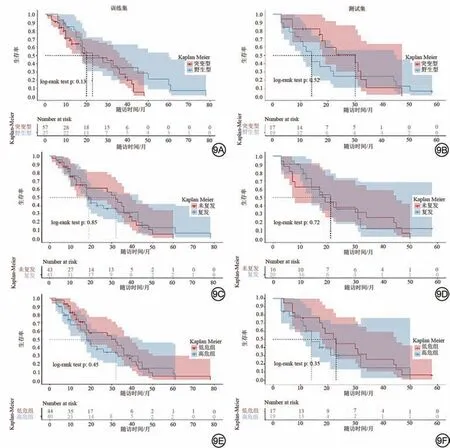
图9 训练集和测试集不同分组的Kaplan-Meier分析。Fig.9 Kaplan-Meier analysis of different group in train and test sets.

表4 多因素COX回归分析Tab.4 Multifactorial COX regression analysis
3 讨论
影像组学的概念由Lambin 在2012 年提出[15],通过自动化算法从选定的ROI提取大量图像信息,进而捕获肿瘤组织中的有效生物学信息。在这项研究中我们采用了来自于POE 和ED 的多参数影像组学特征对胶质瘤术后复发进行预测,经过特征降维得到了15个影像组学特征,同时结合临床变量,纳入LR模型中的综合模型取得最佳效能,其测试集AUC为0.897。DCA显示当阈值大于0.24时,所有的模型均能展示出良好的临床实用性。本研究使用KM分析对患者生存期进行初了步的探讨,在复发与未复发组、IDH 突变与野生型组和Rad-score 高危和低危组之间展示出了一定程度的差异。
先前学者的结果显示[16],通过捕捉瘤内的特征验证了影像组学可以作为预测患者无病生存期的重要工具。之前的研究通过对肿瘤内部定量参数的测量,验证了瘤内特征可以对胶质瘤术后复发状态进行鉴别[17]。最近有研究使用了ED 作为ROI 对胶质瘤患者的生存情况进行了研究,结果显示ED 的特征对生存期的预测有较好的性能[18]。在我们的研究中综合纳入POE 和ED 的影像组特征对术后复发进行预测,并且显示出了较好的诊断效果,其测试集AUC 为0.866。
3.1 瘤内区域分析
先前研究显示胶质瘤内部呈现不同程度的细胞异质性,其中肿瘤内的小胶质细胞可以促进肿瘤细胞的生长,此外对治疗具有高抵抗性的胶质瘤干细胞很难被彻底清除,进而会产生新的肿瘤细胞[19]。同样的,瘤内异质性还会影响肿瘤的进展和对治疗的相关反应[20-21]。在之前的研究中这种肿瘤内的异质性已经初步被定量参数表示,例如扩散峰度成像[17]、酰胺质子转移成像[22]等,但空间上的丰富信息通常被丢弃。在本研究中通过影像组学的方法捕捉瘤内的生物信息,其中包含了空间信息,并且展现出了较好的效果,在瘤内模型的AUC为0.859。
3.2 ED分析
ED 是胶质瘤常见的影像表现,在图像上表现为高信号区域。肿瘤细胞表达过多的血管内皮生长因子会促进新生的毛细血管,使血管内皮细胞之间的紧密连接遭到破坏,细胞间隙增大导致血浆、肿瘤细胞等从异常肿瘤毛细血管渗出,因此ED 可能含有浸润性肿瘤细胞[23-24]。此外,胶质瘤术后ED是术后一个高发的部位,大约90%的复发出现在这里[25]。之前文献表明ED 中不同细胞间的相互作用会导致组织缺氧、血管生成和肿瘤浸润,而这些都使得术后患者的生存率低下[26]。另外,当手术切除范围大于增强范围时,肿瘤的额外切除均能提高OS[27],这表明ED可能含有对诊断有意义的生物学信息。因此我们将ED纳入ROI,并且在结合瘤内区域特征后模型效能得到明显提升。
3.3 临床特征和影像组学特征分析
在本研究最终选定的特征中,基于形状特征统计了ROI 的几何特征。之前的研究显示一些基于图像的典型形状特征对鉴别胶质瘤复发和放射性坏死有一定的帮助[28-29],这与本研究采取的特征相似,都从图像上对肿瘤进行描述,表明了纹理特征对于疾病诊断的可行性。本研究临床资料分析显示,年龄、性别等临床指标在复发与相关性反应之间均无显著差异。而IDH 状态显示出与胶质瘤复发有显著的相关性。之前的研究显示不同IDH 状态的肿瘤生物学行为不同,IDH 野生型的弥漫性星形细胞瘤有着更高的向高级别胶质瘤恶性转化的潜力[30],并且两者预后及对术后化疗的敏感度不同,IDH 突变型弥漫性星形细胞瘤预后更好并对化疗药物替莫唑胺的敏感度更高[31],因此纳入IDH 的状态可以增加对复发的预测能力,在我们的分析中IDH突变型的患者生存时间普遍长于IDH 野生型的患者,这与IDH 突变型对化疗敏感的研究结果相一致。
3.4 局限性
本研究仍然存在一些局限性:(1)本研究不同分组之间KM分析的统计学检验并没有显示出明显的差异,这可能跟我们的样本本身存在选择性差异有关,因此我们仍需要大样本和多中心的数据去验证本研究的结果。(2)MGMT 的甲基化状态没有显示出组间差异性,但不同状态MGMT对放化疗的敏感度不同,因此以后需要对此扩大MGMT 患者的样本量,进一步分析不同的状态MGMT 是否会影响患者的复发和术后状态。(3)机器学预测的最终结果仍有提升的空间,因此更改算法,例如采用深度学习技术,和纳入更多的临床变量对模型效能可能会有一定的提升。
4 结论
综上所述,本文使用来自于ED 和POE 的多参数影像组学特征,结合临床特征建立的LR 模型展现了术前预测胶质瘤患者术后状态的可能性,并且使用根据影像组学特征计算的Rad-score 对患者的生存状态进行了初步评估,基于MRI的影像组学预测胶质瘤患者术后复发有较好的效果,并且可以初步评估术后生存期。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:韩东明设计本研究的方案,对稿件重要内容进行了修改;翟晓阳设计本研究的方案,起草和撰写稿件,获取、分析或解释本研究的数据;任进发设计本研究的方案,获取、分析或解释本研究的数据,对稿件重要内容进行了修改;程思佳、毛珂、董亚宁获取和分析本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

