基于T1 mapping 序列的定量参数鉴别肺癌病理类型的应用研究
张玮,赵鹏,郭文秀,林祥涛*,张琪,何雨,马文静,杨咏青,汪玉,刁瑞园
作者单位:1.山东大学山东省立医院医学影像科,济南 250021;2.乐陵市人民医院核磁共振室,德州 253600;3.山东第一医科大学附属省立医院医学影像科,济南 250021
0 前言
肺癌是全球最常见的原发性肺肿瘤,也是癌症死亡的主要原因,占所有癌症死亡的18%[1],是中国发病率和死亡率最高的恶性肿瘤[2]。原发性肺癌主要分为腺癌、鳞状细胞癌和小细胞肺癌(small cell lung cancer, SCLC)[3]。不同病理类型和分化程度的肿瘤预后和复发率差异显著,肺腺癌常伴有局部浸润,易发生血行转移,并多表现为周围型;鳞癌细胞体积较大,有角化倾向,易发生坏死和空洞,肿瘤生长相对缓慢,转移发生也相对较晚;SCLC 增殖快,易早期转移,手术切除疗效差,但对放疗和化疗较为敏感。由于肺癌的生物学习性、治疗方案及预后与其病理类型紧密相关,因此临床诊疗过程中确定其病理类型便尤为重要。
目前肺癌筛查最常用的无创性方法是CT[4-5],早期肺癌通常表现为肺结节,肿瘤的CT 诊断和评估主要依靠形态特征和密度,对于亚实性结节的诊断较其他影像技术具有明显优势,但对于实性结节的定性与鉴别诊断相对困难,实性结节往往形态规则、密度均匀,强化扫描不具有特征性,因此CT难以完成对实性结节的早期、精准诊断。而术前确定病理类型最常用的方法是支气管镜检查或影像引导下穿刺活检,但这也容易引起气胸、出血、感染等并发症,当肿瘤体积较大且成分混杂时,还可能因穿刺不到肿瘤组织细胞而限制肿瘤的综合评估。另外还有一些患者由于身体状况、肿瘤位置及其他特殊原因无法进行活检。无创性肺癌的影像学定性评估是对肿瘤性质及病理分型的重要补充。近年来,随着MRI硬件和后处理技术的发展,功能MRI 已成为研究热点,并已逐步应用于胸部疾病的检查[6]。纵向弛豫时间定量(T1 mapping)技术是一种定量MRI技术,用于测量组织T1值[7],因操作简单,扫描时间较短,具有较高的稳定性和可重复性,近年来在心肌疾病、肝脏疾病、肾肿瘤及脑肿瘤等领域中得到广泛的研究,有文献表明T1 mapping技术可用于慢性阻塞性肺疾病患者肺功能评估[8]。通过公式计算采集范围内每个体素的T1 值,形成定量T1 伪彩图,直观地显示组织T1 值的差异。肿瘤的发生、发展往往同时伴随着细胞外微环境的改变,增强前后T1 值的变化可以在一定程度上反映病变的病理生理过程,但应用T1 mapping 成像定量评估肺肿瘤的研究国内外的文献报道比较有限,此前,有学者发现,T1 mapping 伪彩图上可以准确测量肺部肿瘤的范围,根据T1 值可以区分恶性肿瘤、肺结核和良性非结核病变[9]。另有学者认为增强后的T1 值在腺癌、鳞癌、SCLC 三组之间存在差异[10]。目前关于T1 mapping在鉴别肺癌病理类型的研究多为小样本、单中心研究,临床应用价值有待进一步研究与扩展。
本文旨在探讨基于B1 场校正的3D 可变翻转角VIBE 序列联合T1 mapping 序列获取的增强前后T1值、△T1及△T1%对肺癌常见病理类型鉴别诊断的可行性,探索反映肿瘤病理定量特征的影像标志物,提高影像学对肺实性肿瘤鉴别诊断的敏感度、特异度及准确率,达到肺癌早期准确诊断的目的。
1 材料与方法
1.1 临床资料
本研究前瞻性收集2021 年9 月至2022 年8 月在山东省立医院住院初诊为“肺癌”的患者。纳入标准:(1)胸部CT检查初诊为“肺癌”并在山东省立医院住院行肺结节MRI增强扫描的患者;(2)肺MR增强扫描前未行穿刺活检或手术、未接受新辅助治疗及放化疗;(3)CT检查显示病灶长径在10~50 mm之间的孤立性实性病灶;(4)病例资料及实验室检查资料齐全;(5)患者一般状况良好,无药物及食物过敏史,可以配合完成MRI检查。排除标准:(1)无法手术或者穿刺活检取得病理者;(2)MRI图像不佳,影响病变诊断及后处理。本研究遵守《赫尔辛基宣言》,经山东大学附属省立医院伦理委员会批准(批准文号:SZRJJ:NO.2021-587),所有受检者均签署知情同意书。
1.2 检查方法
采用德国西门子3.0 T Prisma MRI 扫描仪(MAGNETOM Prisma, Siemens healthcare, Erlangen,Germany)及18 通道体部相控矩阵线圈进行MRI 检查。检查前告知患者MRI 检查注意事项,排除禁忌证,签署知情同意书。仰卧位,头先进。增强扫描前后均扫描T1 mapping 序列,T1 mapping 采用B1 场校正的3D 可变翻转角VIBE 序列采集:采用两个翻转角,分别为5°、15°,以病灶为中心行横断面屏气扫描,扫描完成后系统自动生成T1 mapping 伪彩图。对比剂为钆喷酸葡胺注射液(北京北陆药业股份有限公司,中国北京),以高压注射器经肘静脉注入对比剂0.2 mL/kg,速率2.5 mL/s。MRI 采用的序列及参数设置见表1。

表1 扫描序列的参数设置Tab.1 Parameter settings of scan sequence
1.3 T1 mapping图像处理
将MRI 图像导入syngo.via(Client4.2 版本)工作站,由一名具有10 年以上工作经验的主治医师和一名具有5 年以上临床经验的住院医师选择MM 基础阅片模块进行独立分析。在T2WI、T1WI、弥散加权成像及强化图像中观察病灶,在强化后T1 mapping 生成的伪彩图中选取病灶的最大截面,避开肉眼可见的钙化、血管、伪影区,勾画ROI,并将ROI复制到平扫T1 mapping 图像的病灶相同层面及相同位置;在强化后T1 mapping生成的伪彩图中选取血池中信号均匀区域勾画ROI,并将ROI 复制到血池平扫T1 mapping图像的相同层面及相同位置,见图1~3。分别记录病灶及血池强化前、后的T1 值。通过公式(1)~(2)计算肿瘤增强前后T1值变化(△T1)及增强前后T1值变化率(△T1%)。

图1 女,51岁,鳞状细胞癌,右肺下叶结节,截面大小约1.5 cm×1.0 cm。1A:CT图像;1B:MRI强化前T1WI图像;1C~1D:强化前后T1 mapping伪彩图,测量T1pre=1188.93 ms,T1post=573.17 ms,ΔT1%=0.51;1E:病理图片(HE ×200),示右肺下叶高分化鳞状细胞癌,具有丰富的嗜酸性细胞质和角化珠。Fig.1 A 51-year-old woman with right lower lobe squamous cell carcinoma, 1.5 cm×1.0 cm.1A: CT image; 1B: MRI pre- enhanced T1WI images; 1C-1D: T1 mapping pre-and post-contrast enhancement, T1pre=1188.93 ms, T1post=573.17 ms, ΔT1%=0.51; 1E: Pathological picture (HE ×200), pathology shows a well differentiated squamous cell carcinoma in the lower lobe of the right lung, with abundant eosinophilic cytoplasm and keratinized beads.
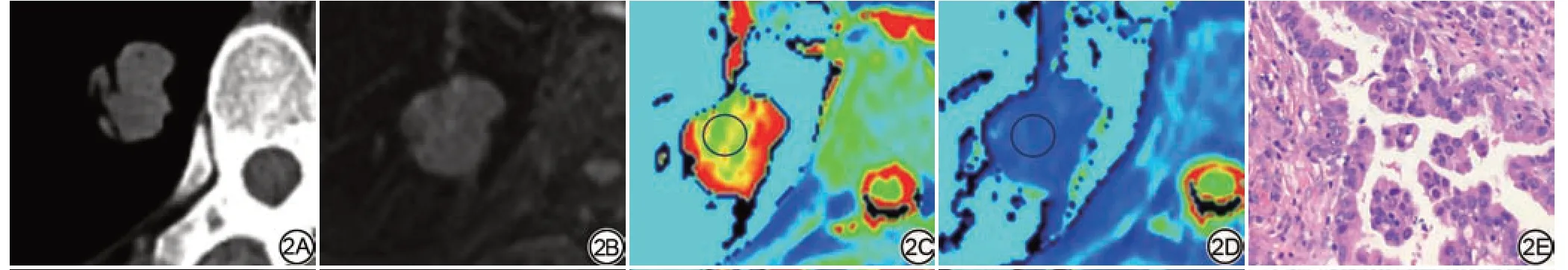
图2 男,64 岁,腺癌,右肺下叶结节,截面大小约2.2 cm×1.4 cm。2A:CT 图像;2B:MRI 强化前T1WI 图像;2C~2D:强化前后T1 mapping 伪彩图,测量T1pre=1316.24 ms,T1post=418.08 ms,ΔT1%=0.68;2E:病理图片(HE ×200),示右肺下叶浸润性腺癌,靠近胸膜,细胞呈管状生长。Fig.2 A 64-year-old manwith right lobe poorly-differentiated adenocarcinoma, 2.2 cm×1.4 cm.2A: CT image; 2B: MRI pre- enhanced T1WI images; 2C-2D: T1 mapping pre-and post-contrast enhancement, T1pre=1316.24 ms, T1post=418.08 ms, ΔT1%=0.68; 2E: Pathological picture (HE ×200), pathology shows that there is invasive adenocarcinoma in the lower lobe of the right lung, which is close to the pleura with tubular growth of cells.
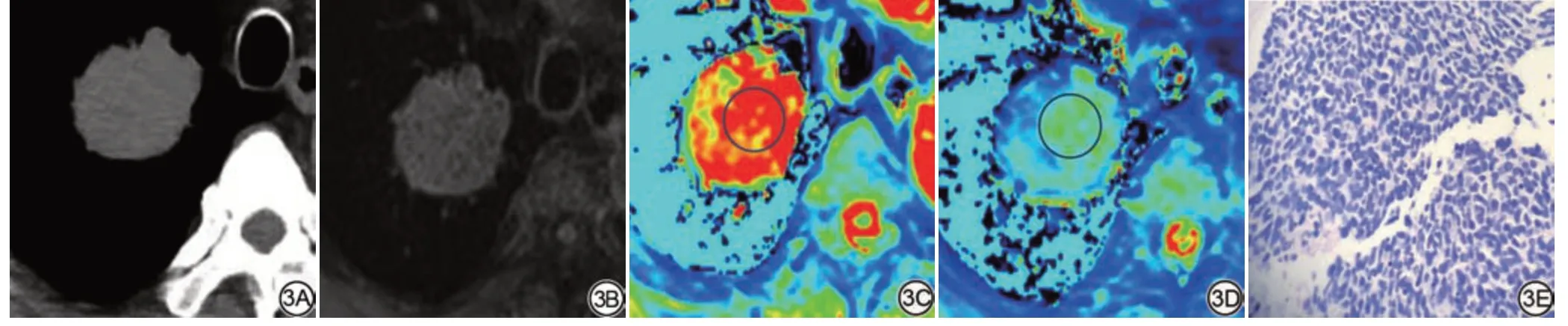
图3 男,64岁,小细胞肺癌,右肺上叶结节,截面大小约4.4 cm×3.5 cm。3A:CT图像;3B:MRI强化前T1WI图像;3C~3D:强化前后T1 mapping伪彩图,测量T1pre=1251.05 ms,T1post=654.07 ms,ΔT1%=0.47;3E:(HE ×200),示右肺上叶的小细胞癌。细胞大小和形状均匀,体积小,排列紧密。T1pre:增强前T1 值;T1post:增强后T1 值;△T1%=(T1pre- T1post)/T1pre。Fig.3 A 64-year-old man with right upper lobe smallcell lung cancer, 4.4 cm×3.5 cm.3A: CT image; 3B: MRI pre- enhanced T1WI images; 3C-3D: T1 mapping pre-and post-contrast enhancement, T1pre=1251.05 ms,T1post=654.07 ms, ΔT1%=0.47; 3E: Pathological picture (HE ×200), pathology shows small cell carcinoma in the upper lobe of the right lung.T1pre: T1 value before enhancement; T1post: T1 value after enhancement; △T1%=(T1pre-T1post)/T1pre.
1.4 统计学分析
应 用IBM SPSS 软 件(Version 25; Armonk,NY, USA)及 MedCalc Statistical Software version 19.0.4 (MedCalc Software bvba, Ostend,Belgium;https://www.medcalc.org;2019)对数据进行统计学分析。采用ICC评价两位观察者测量结果的一致性,以ICC≥0.70认为测量一致性较好,0.40≤ICC<0.70认为测量一致性一般,ICC<0.40认为测量一致性较差。运用Kolmogorov-Smirnov test 检验计量资料是否符合正态分布,符合正态分布的数据采用均数±标准差的方式描述,组间差异比较采用独立样本t检验;不符合正态分布的数据采用中位数M(P25,P75)的方式描述,组间差异比较采用Mann-WhitneyU检验。采用独立样本t检验或Mann-WhitneyU检 验 分 析T1pre、T1post、△T1、△T1%值在各组间的差异是否具有统计学意义,差异有统计学意义的组别绘制ROC 曲线,计算AUC,根据最大约登指数,确定最佳临界值、敏感度及特异度等参数。以P<0.05 为差异有统计学意义。运用logistic 回归联合ROC 曲线评价多参数联合对肺癌病理类型的诊断价值。
2 结果
2.1 临床资料结果
共纳入117例患者(男84例,女33例),均行手术或穿刺(手术:61例;穿刺:56例)获得病理结果,其中腺癌62例,鳞癌26例,SCLC 29例。有吸烟史67例,有咳嗽、咳痰、胸痛、喘憋、咳血或痰中带血等临床症状者69例,患者一般信息见表2。一般资料中性别、吸烟史的差异性利用χ2检验进行分析,差异均无统计学意义。两名诊断医师所测得117例患者T1Pre、T1post的ICC分别为0.87、0.94,具有良好的一致性。
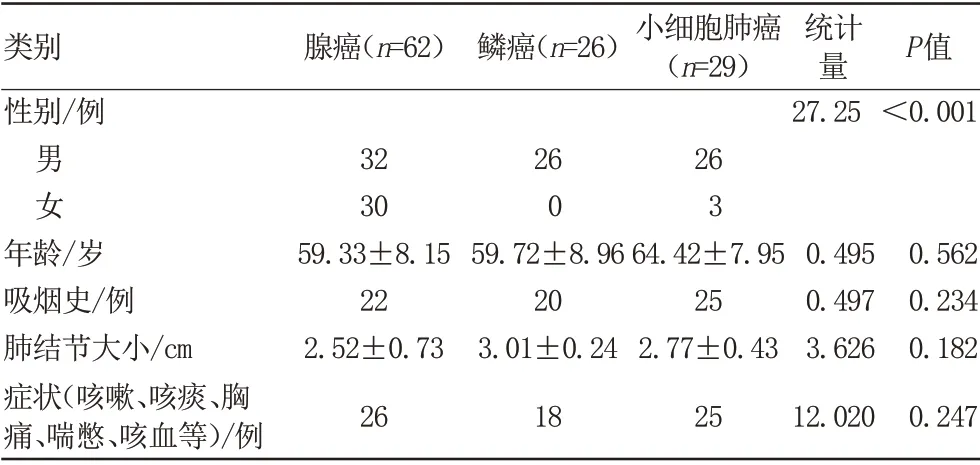
表2 肺癌患者一般资料Tab.2 General information of lung cancer patients
2.2 各组别之间T1Pre、T1post、△T1、△T1%值比较
基于T1 mapping 值计算的117 例患者的T1Pre、T1post 结果不符合正态分布。采用非参数秩和H检验分析分析T1Pre、T1post、△T1、△T1%在各组间的差异。SCLC、腺癌、鳞癌三者之间的T1post、△T1、△T1%值的差异有统计学意义(P<0.001),T1pre 差异无统计学意义(P=0.506);进一步组内两两比较发现,SCLC的T1post大于鳞癌和腺癌,差异存在统计学意义(P<0.001)。鳞癌的T1post具有大于腺癌的趋势,但其差异无统计学意义(P=0.062)。腺癌的△T1、△T1%大于鳞癌、SCLC,差异存在统计学意义(P<0.001)。鳞癌的△T1%、△T1 大于SCLC,△T1%差异存在统计学意义(P<0.001),△T1 差异无统计学意义(P=0.181)。T1Pre 在SCLC 与非小细胞肺癌(non-small cell lung cancer, NSCLC)之间差异无统计学意义(P=0.892),T1post、△T1、△T1%差异存在 统 计 学 意 义(P<0.001);T1Pre、T1pos、△T1、△T1%在中心型肺癌与周围型肺癌之间差异无统计学意义(P=0.540、P=0.075、P=0.950、P=0.159),在纵膈淋巴结转移及纵隔淋巴结无转移肺癌之间的差异无统计学意义(P=0.346、P=0.336、P=0.114、P=0.082)。具体结果见表3。
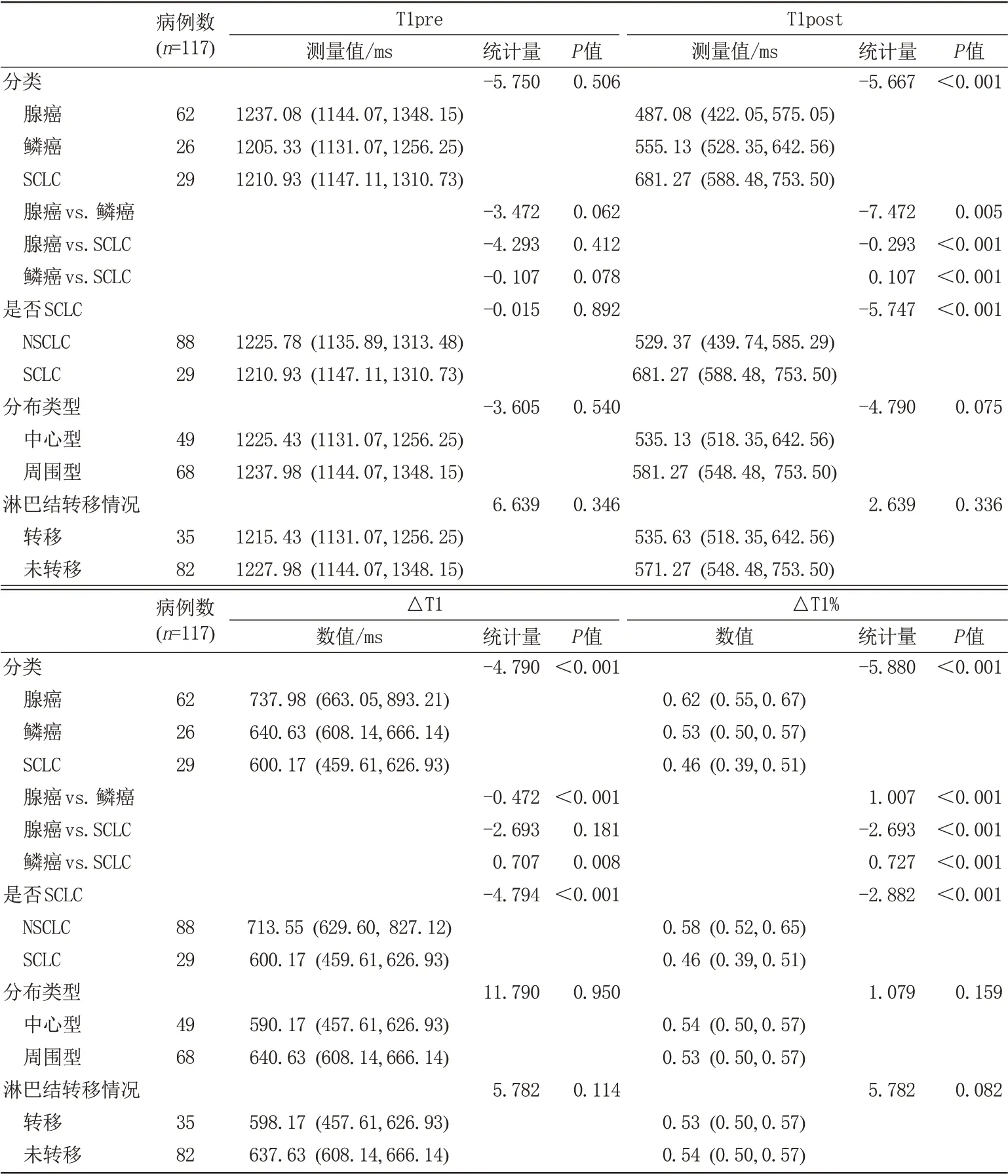
表3 各组别之间T1pre值、T1post值、△T1值、△T1%比较Tab.3 T1pre, T1post, △T1, △T1% parameters in different pathological types
由图4 可见,T1pre 在三种类型肺癌中分布未表现出明显差异。T1post、△T1、△T1%在不同类型肺癌中存在差异。T1post在SCLC中明显高于鳞癌和腺癌,但在腺癌与鳞癌间未见明显差异;△T1、△T1%在腺癌与鳞癌中差异存在统计学意义,但在△T1 鳞癌与SCLC间差异无统计学意义。相同病理类型之间的T1post、△T1、△T1%值分布相对较为集中,不同病理类型之间的各参数分布存在明显差异。
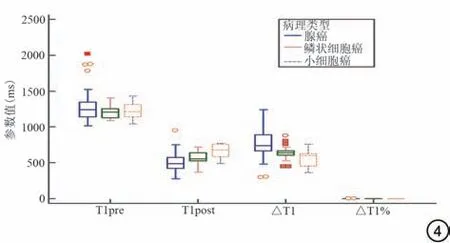
图4 不同病理类型T1 mapping 各参数值箱式图。AUC:ROC 曲线下面积;T1pre:增强前T1 值;T1post:增强后T1 值;△T1 =T1pre- T1post;△T1%=(T1pre- T1post)/T1pre。Fig.4 Box plots of T1 mapping parameter values for different pathological type.AUC: area under the curve; T1pre: T1 value before enhancement; T1post: T1 value after enhancement; △T1=T1pre-T1post;△T1%=(T1pre- T1post)/T1pre.
2.3 T1 mapping在不同肺癌病理类型中的诊断价值
2.3.1 T1post、△T1、△T1%及三者联合鉴别NSCLC与SCLC的诊断效能
绘制T1post、△T1、△T1%及三者联合鉴别SCLC与NSCLC 的ROC 曲 线(图5A),AUC 分 别 为0.856、0.805、0.864、0.870(表4),计算约登指数,确定最佳阈值,当T1post、△T1、△T1%值分别设为564.5 ms、639.09 ms、0.51 时,其诊断敏感度和特异度分别为93.10%和70.45%、86.21%和71.59%、82.76%和80.68%。由此可见,三者联合可提高诊断准确度,差异有统计学意义(P<0.05)。

图5 鉴别不同病理类型的ROC 曲线。5A:T1post、△T1、△T1%鉴别SCLC 与NSCLC 的ROC 曲线;5B:△T1、△T1%值鉴别鳞癌与腺癌的ROC 曲线;5C:△T1%、T1post鉴别鳞癌与SCLC 的ROC曲线;5D:T1post、△T1%鉴别腺癌与SCLC 的ROC曲线。T1post:增强后T1值;△T1:增强前后T1值变化;△T1%:增强前后T1值变化率;SCLC:小细胞肺癌;NSCLC:非小细胞肺癌。Fig.5 ROC curve is used to identify different pathological types.5A: ROC curve of T1post, △T1, △T1% to differentiate SCLC from NSCLC; 5B: ROC curve of△T1, △T1% value differential squamous carcinoma and adenocarcinoma; 5C: ROC curve of △T1%, T1post identification squamous carcinoma and SCLC; 5D:ROC curve of T1post and △T1% for differentiating adenocarcinoma from SCLC.T1post: T1 value after enhancement; T1pre: T1 value before enhancement; △T1=T1pre-T1post; △T1%=(T1pre-T1post)/T1pre; SCLC: small cell lung cancer; NSCLC: non-small cell lung cancer.
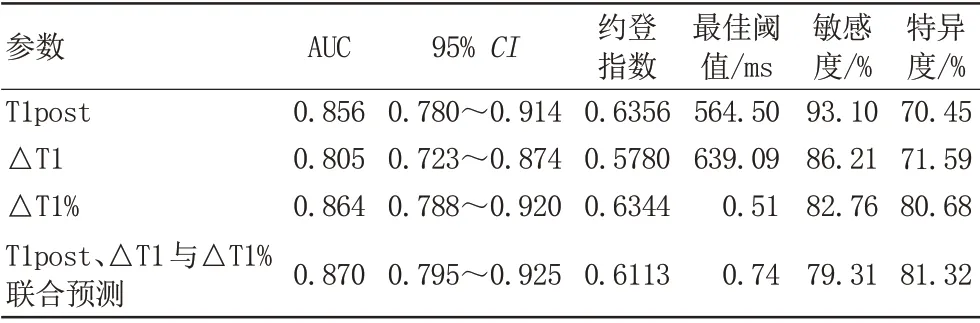
表4 T1post、△T1、△T1%值及三者联合鉴别NSCLC与SCLC的诊断效能Tab.4 Diagnostic efficacy of T1post,△T1,△T1%,and their combination in distinguishing SCLC and NSCLC
2.3.2 △T1、△T1%及二者联合鉴别鳞癌与腺癌的诊断效能
绘制△T1、△T1%及二者联合鉴别鳞癌与腺癌的ROC 曲线(图5B),AUC 分别为0.755、0.767、0.771,计算约登指数,确定最佳阈值,△T1、△T1%值分别设为666.14、0.57 ms时,敏感度、特异度分别为76.92%和74.19%、80.77%和64.52%。二者联合略能提高诊断准确率(AUC=0.771),但差异无统计学意义(P>0.05)(表5)。
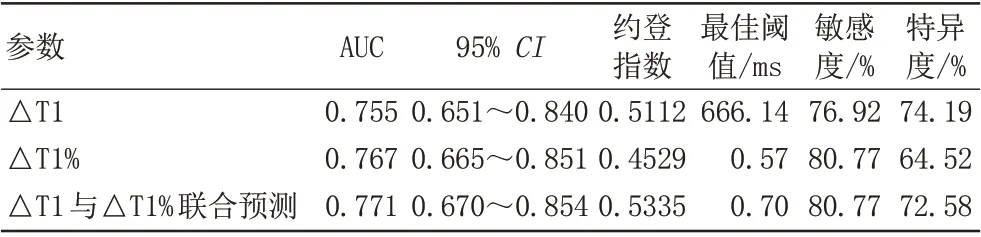
表5 △T1、△T1%及二者联合鉴别鳞癌与腺癌的诊断效能Tab.5 Diagnostic efficacy of △T1, △T1% and their combination in distinguishing adenocarcinoma and squamous cell carcinoma
2.3.3 T1post、△T1%及二者联合鉴别鳞癌与SCLC的诊断效能
绘制△T1%、T1post及二者联合鉴别鳞癌与SCLC的ROC 曲线(图5C),计算约登指数,确定最佳阈值,AUC分别为0.788、0.818、0.831。△T1%、T1post值分别设为0.48、573.17 ms 时,敏感度、特异度分别为84.62%和65.52%、65.38%和89.66%。△T1%敏感度高,特异度略低,T1post 特异度高、敏感度略低。二者AUC 差距不大;二者联合可提高诊断准确度,但差异无统计学意义(P>0.05)(表6)。

表6 T1post、△T1%及二者联合鉴别鳞癌与SCLC的诊断效能Tab.6 Diagnostic efficacy of T1post, △T1% and their combination in distinguishing squamous cell carcinoma and SCLC
2.3.4 T1post、△T1%及二者联合鉴别腺癌与SCLC的诊断效能
绘制T1post、△T1%及二者联合鉴别腺癌与SCLC的ROC 曲线(图5D),计算约登指数,确定最佳阈值,AUC分别为0.895、0.873、0.898。△T1%、T1post值分别设为0.52、554.03 ms 时,敏感度、特异度分别为83.87%和86.21%、73.58%和96.55%。△T1%敏感度高,特异度略低,T1post 特异度高、敏感度略低。二者AUC 差距不大;二者联合可提高诊断准确度,但差异无统计学意义(P>0.05)(表7)。
3 讨论
本研究基于3.0 T MRI肺结节扫描,B1场校正的3D 可变翻转角VIBE 序列联合T1 mapping 成像技术对肺结节进行定性及定量评估,结果表明B1 场校正的3D 可变翻转角VIBE 序列可清晰显示肺结节的形态特征,T1 mapping 成像技术可获得反映肺结节病理生理变化的参数,其中T1post、△T1、△T1%在区分SCLC 与NSCLC 以及鳞状细胞癌和腺癌方面具有较高的敏感度、特异度及准确率,可达到肺癌早期准确诊断的目的。相较于以往通过穿刺、支气管镜活检等手段获得病理类型,B1 场校正的3D 可变翻转角VIBE序列联合T1 mapping 成像技术具有无创性,可以获取CT、MRI 常规扫描无法获得的定量参数,使得传统影像学从视觉评价、主观评价,转变为定量、客观评价,为临床提供诊疗方案具有一定价值。
3.1 T1 mapping技术及其在肺部病变检查中的优势
T1 mapping 成像可反映肺结节的病理生理变化[11-12],是测量组织固有T1 值的定量技术[13-14],它简单无创,经过一系列的数据计算和后处理后可以得到反应组织固有特性的参数,即T1 弛豫时间,简称T1 值[15]。T1 值与多种生物学因素有关,如大分子浓度、水结合状态和组织含水量,是组织内源性标志之一[16],目前在心脏[13,17-18]和肝脏[19-20]上应用得比较多,主要用于诊断心肌病、定量评价心肌纤维化及水肿程度、鉴别轻重度肝纤维化及预测肝癌分化程度评估肝细胞癌微血管侵犯。在宫颈癌、肾癌、前列腺癌及脑胶质瘤[21-23]也有部分报道。T1 mapping 能定量测定感兴趣区域的T1 值[24],肿瘤异质性导致T1 值发生变化,不同肿瘤类型T1值不同,T1值对肿瘤的鉴别诊断具有一定价值[10]。关于其在肺部病变中的相关应用研究报道较少。近年来的一些研究表明T1 mapping 在肺部良恶性肿瘤中具有一定的应用价值,有学者证实T1 mapping 可用以区分肺部良恶病变,特别是那些需长期随访的不确定结节可明显获益[25]。也有学者证实,T1post 可用于区分肺部良性肿瘤和非结核性良性病变[8],以及肺结核和非结核性良性病变,但不能区分良性肿瘤和结核病灶[26]。在一项有关儿童早期囊性纤维化的研究中,T1 mapping 可检测早期病变,并有助于评估急性恶化[27]。目前,常用获取T1 值的T1 mapping 技术有变量翻转角(variable flip angle, VFA)和B1-corrected VFA[28],前者可受B1 磁场不均匀性影响明显,信噪比较低,对运动敏感。本研究使用B1 场校正的3D 可变翻转角VIBE 序列,采用小角度(5°,15°)翻转角,执行多次序列扫描,然后计算组织的T1 值,这样TR 会非常短,节约扫描时间,图像采集时间短,患者耐受性高,并有效减小了成像时间在对比剂代谢研究中的影响,提高了获取组织T1 值的时间精确度;且本研究在T1 mapping扫描之前还进行了B1场匀场校正,可以提高信号的均匀度[29-30],也进一步提高了获得的组织T1值的精确性,为获得肺内病变的T1值奠定了基础。
3.2 腺癌、鳞癌及SCLC T1 mapping参数差异性分析
目前,利用T1 mapping对肺部肿瘤进行定量评估的报道较少。有研究表明细胞恶性程度越高,细胞密度大、增殖快、水分子运动受到限制,而细胞外空间越小,细胞外对比剂较少,高级别肿瘤的ΔT1及△T1%小于低级别者[19],本研究结果与其一致。LI等[31]的研究证实,T1值在SCLC和腺癌之间、鳞状细胞癌和腺癌之间存在显著差异,但在鳞状细胞癌和SCLC之间没有显著差异,这与本研究结果一致,考虑这与肿瘤细胞的密集程度不同,导致了细胞外空间大小差异。腺癌血供丰富不易坏死,间质胶原纤维增生使得血管外间隙回流受阻,导致对比剂滞留时间相对较长,故腺癌T1post低于鳞癌、SCLC;而SCLC的细胞小、排列紧密,细胞外空间小,故对比剂在其细胞外空间的分布量较少。鳞癌的T1post具有大于腺癌的趋势,但其差异无统计学意义,考虑二者差异性可能与细胞生长方式不同有关,鳞癌细胞多为团块状生长方式,易因中心供血不足出现坏死,细胞间隙扩大。肿瘤细胞大小、血供、生长方式及坏死程度等方面的不同导致三种类型的肺癌的差异,通过T1post、△T1 可以体现出这种差异。T1post受对比剂在细胞外空间的分布影响,与组织血液灌注有关。常规MRI评估肺癌主要依据信号改变做出定性诊断,而 T1 mapping成像则依据T1的改变,微观定量的反映更丰富的肿瘤信息。
关于乳腺癌T1 mapping 的定量研究[32]证实乳腺良性肿瘤的T1 值明显大于恶性肿瘤,鉴别肿瘤的△T1%的AUC 大于△T1,与本研究结果相似。对宫颈癌T1 mapping 的定量研究发现,T1post 可用于反映宫颈癌类型及分化程度[33-34]。T1post 受对比剂在细胞外空间的分布影响,与组织血液灌注有关。有学者认为T1pre 能够反映肿瘤的病理亚型[34],这与本研究结果并不一致,本研究认为在对肺癌诊断、分型及分化程度的评估中,常规MRI评估肺癌主要依据信号改变做出定性诊断,而T1 mapping 成像则依据T1的改变,微观定量的反映更丰富的肿瘤信息,是常规序列的有效补充,二者结合分析对肺癌的早期研究有重要指导意义。另外RAVOORI 等[35]、MCSHEEHY 等[36]已在多种哺乳动物模型研究中证实,T1 值可作为某些抗肿瘤药物(贝伐单抗、5-Fu、紫杉醇等)治疗反应的早期指标。本研究认为,或许T1 mapping 可作为不可手术肺癌治疗反应的标志物。
3.3 本研究的局限性
本研究也存在以下局限性:(1)本研究为前瞻性、单中心的初步研究,纳入鳞癌、SCLC 样本量偏少,各组的样本量占比不一致,可能会对参数分析造成偏倚,后期会逐步收集更多样本弥补分析偏差,继续总结、研究;(2)虽然在本研究中使用了两位医师独立描绘ROI,选择3 个ROI,并尽可能避免了可见的血管和伪影区,但不排除它们可能含有微小的坏死,这可能会影响 T1 值的测量;(3)本研究采用B1场校正的3D可变翻转角VIBE序列,未与其他T1 mapping序列(如MOLLI)进行比较。在接下来的研究中,我们将纳入更多符合研究要求的患者,同时控制各个分组纳入病例的比例,使实验研究更加完整、更具有说服力;进一步探索其在鉴别良恶性肺部肿块、预测无法手术肺癌患者的预后及评价肺癌疗效等方面的应用价值。
4 结论
综上所述,常规MRI评估肺肿块主要依据信号改变作出宏观定性诊断,而T1 mapping可在无创且无辐射损伤的情况下定量地获得腺癌、鳞状细胞癌和SCLC的T1值,从而微观定量地反映更丰富的肿瘤信息,基于T1 mapping技术获取的定量参数与其病理类型进行对照分析,发现相同病理类型之间的T1post、△T1、△T1%值分布相对较为集中,不同病理类型之间的各参数分布存在明显差异。T1post、△T1、△T1%可用于区分SCLC与NSCLC以及鳞状细胞癌和腺癌,具有较高的敏感度、特异度及准确率,联合可提高诊断准确度,对于在术前对肺癌进行影像学定性诊断、病理分型预告等方面具有重要的临床价值及意义。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:林祥涛设计本研究的方案,对稿件重要内容进行了修改;张玮起草和撰写稿件,获取、分析或解释本研究的数据;赵鹏、郭文秀、何雨、张琪、马文静、杨咏青、汪玉、刁瑞园获取、分析或解释本研究的数据,对稿件重要内容进行了修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

