Bp-MRI影像组学对前列腺癌根治性切除术后切缘阳性的预测价值
郭盛,周川,王超,张云峰,王东,周逢海
作者单位:1.甘肃中医药大学第一临床医学院,兰州 730000;2.兰州大学第一临床医学院,兰州 730000;3.甘肃省人民医院泌尿外科,兰州 730050
0 前言
前列腺癌(prostate cancer, PCa)为泌尿系常见肿瘤且位居男性常见癌症第2位,也是男性死亡第5 大原因[1-2]。在临床实践中,PCa 根治术是治疗PCa有效的方式之一[3]。然而,尽管手术技术在不断进步,但PCa根治术后仍有部分病例出现手术切缘阳性(positive surgical margin, PSM)。手术PSM 是指术后切缘残存癌细胞,癌组织未完全切除,相比较于术后切缘阴性复发风险较高、预后较差[4]。准确预测PSM 对于优化手术效果和术后指导管理至关重要。传统的组织病理学检查是评估PSM的金标准,其局限性较多,包括取样偏差和观察者之间的差异等。目前,人们更多关注于开发基于非侵入性成像技术来预测PSM 并改善决策过程。双参数磁共振成像(bi-parameter magnetic resonance imaging, Bp-MRI)结合了T2WI 和扩散加权成像(diffusion-weighted imaging, DWI),可提供有关前列腺及疑似癌症病灶的详细解剖功能信息[5]。近年来,随着影像组学兴起,MRI 影像组学可从影像图片中提取并分析相关定量成像特征及肉眼无法发现的特征信息[6-7],已在无创癌症特征描述和预测方面显示出优势前景。目前国内外研究[8]大多是MRI 上的肿瘤分期预测术后PSM,鲜有关于MRI影像组学预测PCa根治术后PSM的研究报道,基于此,本研究旨在开发一种基于Bp-MRI影像组学构建的预测模型,可最大限度帮助术前风险分层并指导手术规划,对PCa 根治术后PSM 的预测评估具有一定参考价值。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经甘肃省人民医院医学伦理委员会批准,免除受试者知情同意,批准文号:2021-260。回顾性分析2020 年4 月至2023 年5 月甘肃省人民医院行PCa 根治术的105 例患者临床及MRI 资料。纳入标准:(1)经直肠超声穿刺活检及根治术后病理诊断为PCa;(2)临床分期处于局限期,且未发现远处转移;(3)临床信息及影像资料完整。排除标准:(1)MRI图像质量不佳影响图像分割;(2)术前曾行新辅助内分泌治疗。
1.2 临床资料
收集所有患者年龄、身体质量指数(body mass index, BMI),采用标准方法记录,并收集患者总前列腺特异性抗原(total prostate specific antigen,tPSA)、术前及术后Gleason 评分、前列腺体积(prostate volume, PV)。计算前列腺特异性抗原密度(prostate specific antigen density, PSAD),PSAD=tPSA/PV。超声检查在横断面测量前列腺最大左右径,在矢状面测量最大前后径和上下径。PV=前列腺前后径×左右径×上下径×0.52。病理标本评分采用2014版国际泌尿病理协会分级改良系统,评分≤6分、7分或≥8分。PSM定义:由病理科2位以上医师对术后病理进行评估,镜下可见肿瘤切缘有肿瘤细胞(图1)。
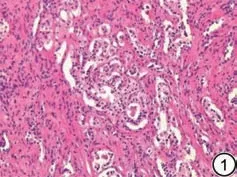
图1 男,64 岁,训练集PCa 患者病理(HE 20×10)图。Gleason 评分4+4=8 分,切缘查见癌组织。Fig.1 Pathological results (HE 20×10) of a 64-year-old male with prostate cancer from the training dataset, Gleason score of 4+4=8, with cancer tissue observed at the surgical margin.
1.3 MRI图像采集
术前对所有患者采用Philips(Ingenia 3.0 T)MR 扫描仪进行图像采集。检查前嘱患者适度饮水充盈膀胱,使用18通道腹部线圈行盆腔扫描,患者取仰卧位。T2WI 轴位序列扫描参数:TR 3544 ms,TE 100 ms,FOV 240 mm×240 mm,矩阵180×159;DWI 轴位序列扫描参数:TR 5000 ms,TE 78 ms,FOV 300 mm×360 mm,矩阵 120×120,b值100、1000 s/mm2;两种序列成像的层厚均为3.0 mm、层间距均为0.6 mm。扫描结束后,使用本机后处理软件自动生成表观扩散系数(apparent diffusion coefficient, ADC)。所有MRI 结果由我院两名10 年资历影像科副主任医师进行盲法分析,并达成一致的诊断意见。
1.4 图像分割和特征提取
从我院影像科获取所有符合纳入标准患者的MRI图像资料,为了保证MRI图像质量的一致性,在勾画前对所有要标注的图像进行N4偏置场校验。然后将患者MRI 图像以DICOM 的格式导入ITK-SNAP 软件(4.0版),由两名有10年影像科工作经验的副主任医师分别在T2WI、DWI、ADC上沿肿瘤边缘手动逐层勾画感兴趣区(region of interest, ROI)。意见不一致时协商达成一致,将勾画好的图像(图2)以nii.gz格式保存。为了评估观察者间ROI分割的再现性和特征提取的鲁棒性,随机选择30个病例,由两位医师进行独立分割,从分割病灶中提取的特征进行观察者间一致性的检测[9];用Kappa 检验计算出组内相关系数(intra-class correlation coefficient, ICC)值表示观察者间的一致性,ICC值范围从0~1,数值接近1代表再现性更强,ICC值>0.8表明特征可再现[10]。
采用Pyradiomics 工具包从T2WI、DWI、ADC 序列图像中分别提取特征,共提取到312 种影像组学特征。特征种类包括:一阶直方图特征(first order statistics)、形态特征(shape-based)、灰度共生矩阵(gray level cooccurrence matrix, GLCM)、灰度游程矩阵(gray level run length matrix, GLRLM)、灰度大小区域矩阵(gray level size zone matrix,GLSZM)和相邻灰度差矩阵(neighbourhood gray-tone difference matrix, NGTDM)。
1.5 预测模型构建
通过Z-score 法对所有组学特征进行标准化处理,采用Spearman 相关系数评估特征提取的观察者间一致性,高于0.9 的特征被认为是可靠的,并建立一个特征集用于后续分析。使用基于LASSO 算法的逐步搜索来找到基于精度的特征最佳组合,并执行多次迭代来评估每个特征的重要性。按照7∶3 的比例随机将患者分为训练集(73 名)和测试集(32 例),基于逻辑回归(logistic regression, LR)分类器构建预测模型。
1.6 统计学方法
采 用R 软 件(version 4.3.1, http://www.r-project.org)及IBM SPSS Statistics 21.0 软件完成统计分析。符合正态分布的计量资料以()表示,不符合者以中位数(上下四分位数)表示,分别行t检验及曼-惠特尼U秩和检验;计数资料行χ2检验。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC)评估影像模型预测PCa 根治术后发生PSM的效能。绘制决策曲线分析(decision curve analysis, DCA)评估模型的临床净收益。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
105 例PCa 患者均于腹腔镜下行根治术,术后PSM 40 例,切 缘 阴 性65 例,PSM 发 生 率38.10%(40/105)。所有结果均经手术后病理学证实。训练集中 两 组 间tPSA、PSAD、术 前Gleason 评 分、术 后Gleason 评分、穿刺阳性针数(针)、穿刺阳性针数百分比(%)、术后病理分期差异有统计学意义(P<0.05)。测试集中两组间tPSA、PSAD、穿刺阳性针数百分比(%)、术后病理分期差异有统计学意义(P<0.05)(表1)。
2.2 MRI影像组学特征选择
从每个患者的T2WI、DWI 和ADC 序列中共提取到312 个影像组学特征。为了确定超参数,如模型的特征数量,对训练数据集进行了5倍的交叉验证。使用LASSO 回归模型进行特征选择(图3),筛选出10 个影像组学特征与复发密切相关(图4)。基于这些被选中的特征,用LR分类器建立了预测模型。
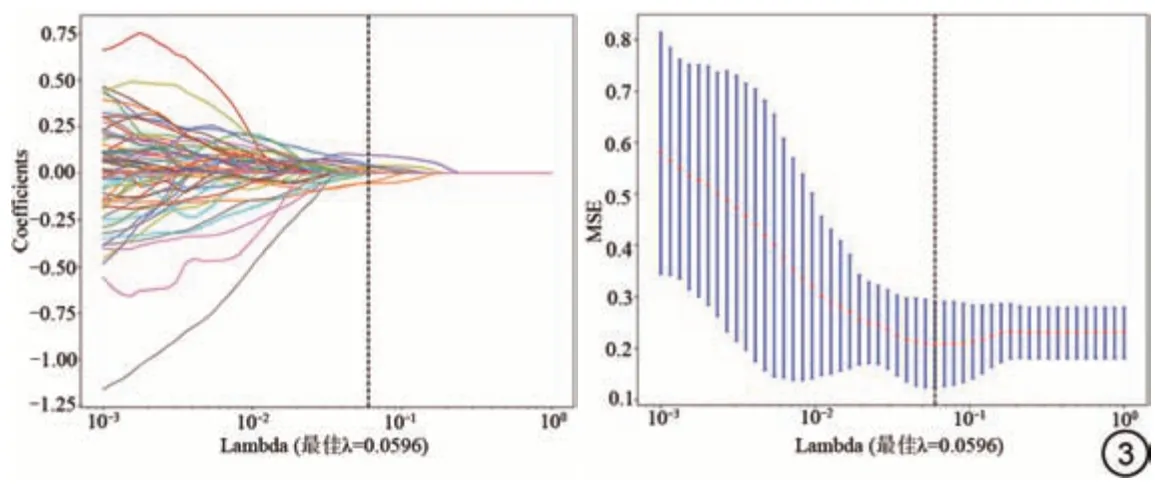
图3 LASSO 筛选回归建模因素。Fig.3 LASSO selection of regression modeling factors.

图4 LASSO 模型筛选出的影像组学特征及系数。LASSO:最小绝对收缩与选择算子;MSE:均方误差;ADC:表观扩散系数;DWI:扩散加权成像;glszm:灰度大小区域矩阵;gldm:灰度依赖矩阵;glcm:灰度共生矩阵。Fig.4 Radiomic features and coefficients selected by the LASSO model.LASSO: least absolute shrinkage and selection operator; MSE: mean-square error; ADC: apparent diffusion coefficient; DWI: diffusion-weighted imaging; glszm: gray level size zone matrix; gldm: gray level dependence matrix; glcm: gray level cooccurrence matrix.
2.3 基于影像组学特征建立的预测模型结果
基于T2WI+DWI+ADC 建立的组学模型在训练集和测试集AUC值分别为0.869(95%CI: 0.786~0.952)、0.858(95%CI: 0.726~0.991)(图6),对预测模型进行了临床DCA,以评估患者可以获得的净收益(图5)。表明基于b-MRI 的影像组学模型可有效预测PCa 患者根治术后PSM。
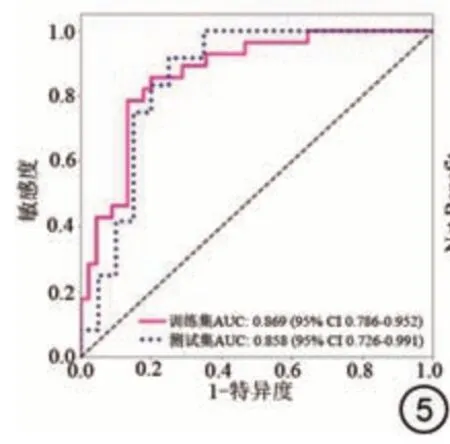
图5 基于LR分类器构建影像组学模型预测PCa根治术后发生PSM的受试者工作特征曲线。Fig.5 Receiver operating characteristic curves of subjects predicting the occurrence of PSM after radical PCa surgery based on classifiers for constructing imaging histomics models.

图6 影像组学模型预测PCa 根治术后发生PSM的DCA 曲线。纵轴为净收益率,横轴为概率阈值。AUC:曲线下面积;CI:置信区间;LR:逻辑回归;PCa:前列腺癌;PSM:术后切缘阳性;DCA:决策曲线分析。Fig.6 Imaging histology modeling to predict the DCA for the occurrence of PSM after radical prostatectomy for PCa.The vertical axis is the net benefit rate and the horizontal axis is the probability threshold.AUC: area under the curve; CI: confidence interval;LR: logistic regression; PCa: prostate cancer; PSM: positive surgical margin;DCA: decision curve analysis.
3 讨论
本研究从Bp-MRI(T2WI、DWI、ADC)图像中提取并筛选出10 个影像组学特征,建立基于LASSO 回归的影像组学模型预测PCa根治性切除术后PSM。结果显示,在训练集和测试集组中均有良好的预测效能,AUC 值分别为0.869、0.858,有助于PCa 术前风险分层并为术后PSM患者的临床诊疗提供参考依据。
3.1 临床特征与既往研究比较
根治性前列腺切除术作为PCa的主要治疗方式,术后PSM是术后生化复发的高风险指标,是影响预后的重要因素[11]。据统计[12],局限性PCa 患者接受根治性前列腺切除术后仍然有10%~35%的PSM 发生。靳通通等[13]进行一项PCa 根治术后PSM 危险因素的Meta 分析,结果表明影响PSM 的危险因素跟术前PSA、穿刺阳性针数百分比、穿刺Gleason 评分、术后Gleason 评分和术后病理T 分期有一定关系。张争等[11]通过对177 例病理确诊的PCa 患者进行研究发现,PSM 组57 例与阴性组120 例在穿刺阳性针数、穿刺阳性针数百分比(%)、术后病理分期差异均有统计学意义。本研究中105 例接受根治性前列腺切除术的患者术后有40 例出现PSM,总体PSM 率为38.10%,训练集和测试集均在术后病理分期差异有统计学意义(P<0.05),病理分期≤cT2b 的22 例中PSM 5 例(12.5%),cT2c 的52 例中PSM 10 例(25%),≥cT3a 的31例中PSM 25例(62.5%),与既往研究[14]相似。
3.2 LR-LASSO分类器构建模型的优势
目前,基于机器学习LR-LASSO 分类器建立的预测模型适合处理小样本数据,其分类精度高,特别适合解决二分类问题。这些模型相对简单,易于理解和实现,但可能需要细粒度的特征工程和参数调优。同时,数据要求相对宽松,在数据质量好的情况下,可以处理分类、回归、异常检测等问题[15]。最终,本研究通过LASSO 筛选和降维,确定了10 个影像组学特征。结果显示LR-LASSO 分类器构建的预测模型对PCa 术后PSM 有较强的预测效能,这表明基于影像组学强大的预测效能开发模型,可协助临床医生对该病的临床诊疗做出精准决策。
3.3 影像组学预测PSM的优势
MRI在PCa的诊断和预后评估中可以提供丰富的图像信息,包括T2WI、DWI、动态增强成像和磁共振波谱成像,有助于评估PCa的位置、体积和分级[15]。当前,基于影像组学构建模型在术前对疾病进行精准评估、术后疗效评估、疾病复发转移预测以及预测包膜外延伸和PSM方面已成为研究的热点[16-17],影像组学能够提供关于整个器官或病变区域的全局性信息,能够从多个角度、多个维度进行分析和诊断。通过分析影像数据中不同区域的形态、纹理、强度等特征,可以获取更加全面的疾病信息[18-19]。这使得影像组学较传统影像检查更能够捕捉到微小病变特征[20],有助于提高疾病检测和分析的准确性。影像组学可以提取肿瘤的形状和边缘特征,这对于判断肿瘤的生长模式和与周围组织的关系非常重要。不规则的形状和模糊的边缘可能提示肿瘤浸润到邻近的正常组织,增加PSM 的风险。影像组学通过及时监测术中影像,可以调整手术策略以最小化PSM的风险,帮助外科医生在手术过程中做出更准确的决策。MRI影像组学目前多应用于PCa初诊断[21-22]、活检穿刺[23-24]、病理分期[25-26]、骨转移[27]、生化复发[28-29]及预后[30-31]等。曲玉虹等[32]研究了基于MRI影像组学构建模型在预测保乳手术治疗乳腺癌的可行性,结果显示训练集和测试集在预测保乳手术后乳腺癌PSM 的AUC 分 别 为0.961(95%CI:0.905~1.00)、0.855(95%CI:0.707~1.000),表明MRI 影像组学在预测术后PSM的可行性。
3.4 相关研究比较
目前国内外的研究多为根据临床特征或MRI 上的肿瘤分期构建模型预测术后PSM,基于Bp-MRI影像组学的研究较少。丁振山等[33]基于临床数据提出了一种有效的腹腔镜前列腺根治术后PSM的预测模型,模型在训练数据集和验证数据集的AUC 分别为0.738 和0.691。WANG 等[8]进 行 了 一 项 关 于MRI 上肿瘤分期预测PCa 患者PSM 的荟萃分析,结果表明MRI 上的T 分期对预测PSM 具有中等诊断准确性。HE 等[34]的研究收集459 例患者基于MRI 影像组学模型评估PCa 囊外延伸和PSM,结果显示基于T2WI 序列影像组学模型预测术后PSM 的AUC 为0.680(95%CI:0.567~0.779),ADC 序列影像组学模型的AUC 为0.766(95%CI: 0.659~0.853),表明基于MRI 影像组学特征在PSM 预测中表现良好。本研究基于T2WI、DWI 及ADC 序 列 联 合 构 建 模 型 的AUC 为0.869(95%CI: 0.786~0.952),表明Bp-MRI 影像组学在预测术后PSM的可行性方面有一定潜在价值。
3.5 局限性与展望
本次研究仍存在一定不足:首先,本研究未构建临床模型与影像组学模型作出比较;其次,本研究为回顾性、单中心的小样本研究,患者病例数相对较少,且分布不均,未来需要进一步扩充样本量进行分析及用外部数据来验证结果的普遍性;最后,本研究仅使用LR-LASSO分类器而未使用其他分类器构建模型,该模型的效能是否最佳有待后续研究进一步验证。
4 结论
综上所述,本研究构建了Bp-MRI 影像组学对于PCa 根治性切除术后PSM 的预测模型并予以验证,这项研究的结果有助于改善个体化治疗计划和帮助外科医生在手术过程中做出更准确的决策,并最终改善PCa患者的治疗效果。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:周逢海设计本研究的方案,对稿件重要内容进行了修改,获得了甘肃省重点研发计划基金项目资助;郭盛起草和撰写稿件,获取、分析和解释本研究的数据;周川、王超、张云峰、王东获取、分析或解释本研究的数据,对稿件重要内容进行了修改,周川获得了甘肃省自然科学基金项目资助,王超获得了甘肃省人民医院院内科研基金项目资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

