人工智能辅助压缩感知技术对颅脑磁敏感加权成像图像质量及核团相位值的影响
钟美梦,曹家骏,安琪,杨超,宋清伟
作者单位:大连医科大学附属第一医院放射科,大连 116011
0 前言
磁敏感加权成像(susceptibility weighted imaging, SWI)是一种利用组织间磁敏感性差异进行成像的技术,在中枢神经系统中的应用非常广泛,包括脑血管相关疾病、创伤性脑损伤、脑肿瘤以及神经退行性疾病等[1-3]。通过图像重建及后处理得到的相位图含有大量局部不同组织间磁化率差异的信息,有利于脑出血和钙化的显示与鉴别[4]。对于右手系统(如联影磁共振),静脉在相位图上是低信号(因为脱氧血红蛋白相对于其周围组织是顺磁性的),钙化在相位图上是高信号(因为钙相对于脑组织是反磁性的)[5]。SWI 相位图上“燕尾征(swallow tail sign, STS)”的缺失被认为是帕金森(Parkinson's disease, PD)患者成像标志之一[6]。此外,张聪等[7]研究表明双侧海马和黑质的相位值在阿尔茨海默病(Alzheimer's disease, AD)组和对照组差异有统计学意义。由此可见,SWI 相位图不仅对于核团的显示比较清晰,还可以对核团的相位值进行定量测量。然而,SWI 为3D 梯度回波成像,采集时间比较长,且易受运动伪影干扰导致图像质量下降。K 空间欠采样是目前缩短MRI扫描时间的主要方法,包括半傅立叶(Half Fourier, HF)成像,并行成像(parallel imaging, PI)和 压 缩 感 知(compressed sensing,CS)等,但过高的加速因子(acceleration factor,AF),不可避免会带来图像质量的下降[8]。
PI是临床常用的加速技术,该技术是使用多通道相控阵线圈并行采集,并通过减少K空间相位编码线密集度的方法,实现磁共振图像的快速采集[9]。一些研究表明其缩短SWI扫描时间的同时会增加图像的噪声以及降低组织对比度[10-11]。人工智能辅助压缩感知(artificial intelligence assisted compressed sensing, ACS)技术集合了HF、CS 和PI 等技术,将深度学习神经网络作为人工智能(artificial intelligence, AI)模块引入到CS 框架的迭代重建过程中,AI 智能模块使用数百万个全采样数据进行训练,以抑制传统加速方法在高AF 下形成的各种重建伪影,在保证图像质量的同时能显著缩短扫描时间[12-13]。本研究将应用不同ACS AF 的SWI 图像与常规PI 技术进行对比,观察AF 对采集时间、图像质量及脑灰质核团相位值(phase value, PV)的影响,旨在满足临床诊断及PV 精确测量的前提下,筛选出最佳的ACS AF。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经大连医科大学附属第一医院伦理委员会批准(批准号:PJ-KS-KY-2022-274),受试者均签署知情同意书。于2023 年3 月至5 月在大连医科大学附属第一医院前瞻性招募24 名健康志愿者,男5 名,女19 名,年龄23~30(24.79±1.79)岁。纳入标准:(1)无脑部疾病史和手术史;(2)年龄大于18 周岁。排除标准:(1)有MRI检查禁忌证;(2)严重酒精依赖及精神活性物质滥用;(3)图像质量不佳,存在不可去除的伪影。
1.2 仪器和方法
采用联影UIH uMR Omega 3.0 T 磁共振扫描仪(上海联影医疗科技有限公司,中国),32通道头部线圈,结合PI 技术(AF 为2.2)及不同AF(3、4、5)的ACS技术行颅脑轴位SWI 扫描。PI 2.2、ACS 3、ACS 4、ACS 5对应扫描时间分别为208、101、80、70 s。扫描参数:视野230 mm×200 mm,体素大小0.72 mm×0.72 mm×2.2 mm,层数56,TR 21.8 ms,TE 14.8 ms,激励次数1。
1.3 图像质量分析
1.3.1 图像主观评价
由2 名具有五年以上头部影像学诊断经验的副主任医师采用双盲法对SWI 相位图质量进行主观评分,观察PUT 和GP 之间的分界线以及核团解剖结构是否清晰:1 分,各核团解剖结构显示不佳、边界模糊;2 分,各核团解剖结构显示较好、边界较为清晰;3分,各核团解剖结构显示清晰、边界清晰。
1.3.2 图像客观评价
采用医学影像处理软件(uWS-MR,上海联影医疗科技有限公司,中国)进行图像后处理。在SWI相位图上于双侧尾状核头(head of caudate nucleus, HCN)、壳核(putamen, PUT)、苍白球(globus pallidus, GP)、红核(red nucleus, RN)、黑质(substantia nigra,SN)、齿状核(dentate nucleus, DN)的边缘手动勾画感兴趣区(region of interest, ROI)(图1)。以各层面内核团PV 的平均值作为信号强度(signal intensity, SI),HCN、PUT 和GP 周围的额叶白质(层面一)、RN 和SN 周围的中脑(层面二)以及双侧DN 周围的小脑(层面三)标准差(standard deviation,SD)作为该层面的背景噪声。三个层面的背景ROI大 小 分 别 为30.5、9.8 和40.3 mm2。每 个ROI 连 续测量三次取平均值,并计算各层面信噪比(signal-to-noise ratio, SNR)和 对 比 噪 声 比(contrast-to-noise ratio, CNR),见公式(1)~(2)。
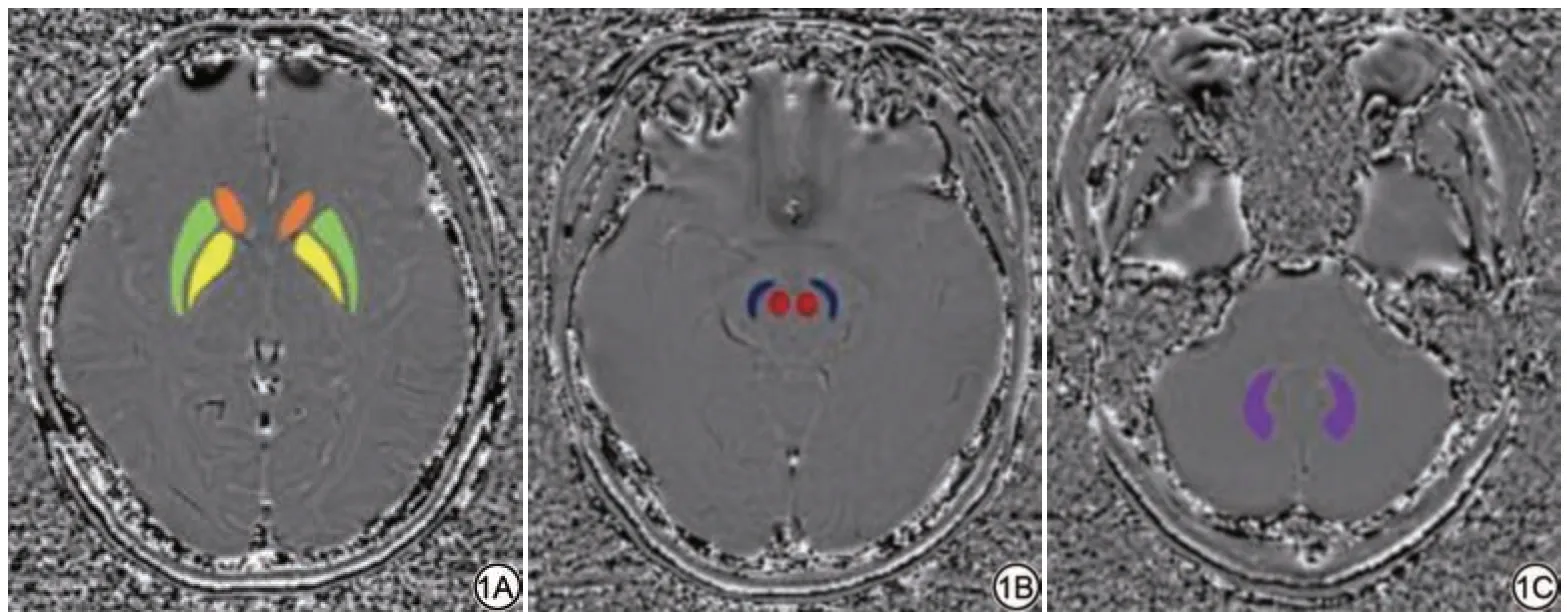
图1 女,25 岁,ROI 放 置 示 意 图。1A:于层面一勾画HCN(橙色)、PUT(绿色)和 GP(黄色);1B:于层面二勾画RN(红色)、SN(蓝色);1C:于层面三勾画DN(紫色)。NCN:尾状核头;PUT:壳核;GP:苍白球;RN:红核;SN:黑质;DN:齿状核。Fig.1 Female, 25 years old, the picture shows a schematic diagram of ROI placement.1A: Outlined HCN(orange), PUT (green) and GP (yellow)on layer 1; 1B: Outlined RN (red) and SN (blue) on layer 2; 1C: Outlined DN(purple) on layer 3.HCN: head of caudate nucleus; PUT: putamen; GP: globus pallidus; RN: red nucleus; SN: substantia nigra; DN: dentate nucleus.
1.4 统计学分析
使用SPSS 25.0 统计软件进行统计学分析。以均数±标准差表示符合正态分布的计量资料,以中位数(上下四分位数)表示不符合者。采用Cohen's Kappa检验评价观察者间对图像主观评价结果的一致性,Kappa 值≤0.4 为一致性差,0.4<Kappa 值≤0.6 为一致性一般,0.6<Kappa 值≤0.8 为一致性较好,Kappa 值>0.8 为一致性极好。采用Fisher 精确概率法分析PI 2.2 与其他条件下主观评分的差异。客观评价结果的组间比较采用单因素方差分析(两两比较采用LSD-t法),P<0.05为差异有统计学意义。
2 结果
2.1 主观评价
ACS 4和ACS 5的主观评分均低于PI 2.2(P均<0.001),ACS 3和PI 2.2的主观评分差异无统计学意义(P>0.05)(表1)。两位观察者对图像质量的主观评价一致性较好(Kappa值:0.704~0.864,P均<0.001),随AF增加,PUT和GP之间的界限(图2)及各核团解剖结构(图3)逐渐模糊。
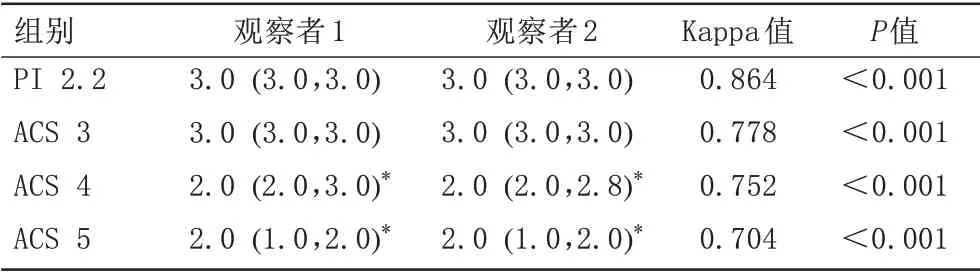
表1 主观评价结果比较和观察者间一致性分析结果Tab.1 Comparison of subjective evaluation results and inter-observer consistency analysis results
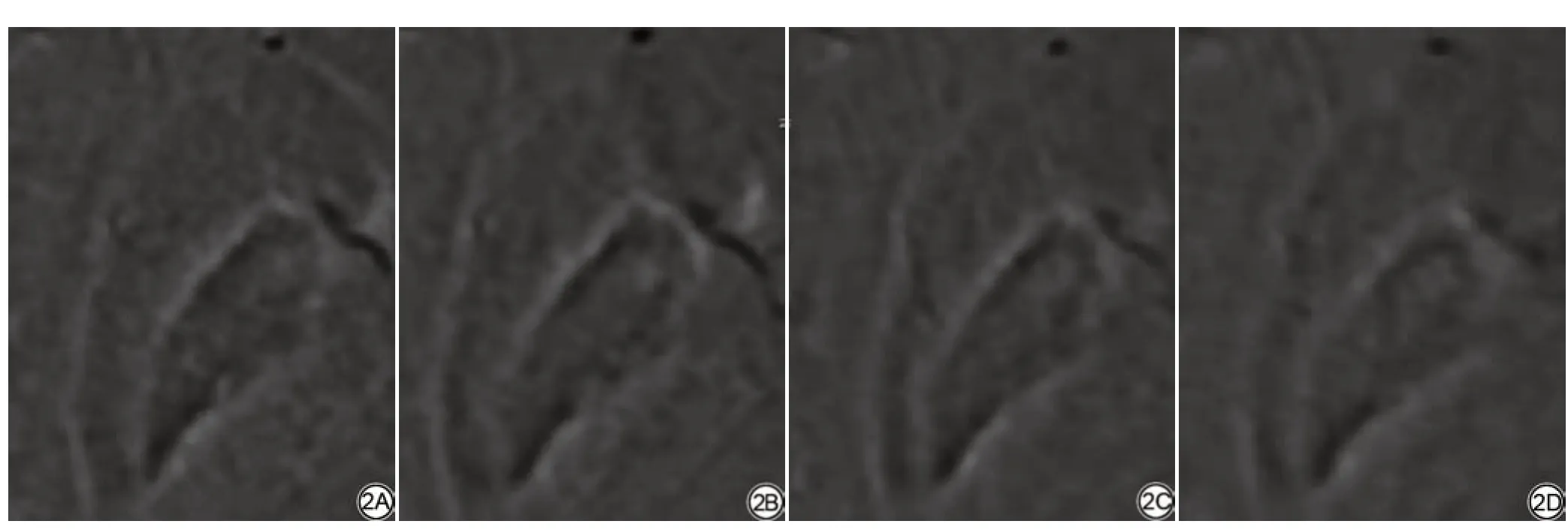
图2 女,25岁,主观评分标准对应图像。2A:PI 2.2的SWI相位图,主观评分为3分;2B:ACS 3的SWI相位图,主观评分为3分;2C:ACS 4的SWI相位图,主观评分为2分;2D:ACS 5的SWI相位图,主观评分为1分。SWI:磁敏感加权成像;PI:并行成像;ACS:人工智能辅助压缩感知。Fig.2 Female, 25 years old, the subjective scoring criteria correspond to the image.2A: The SWI phase image of PI 2.2 and the subjective scores is 3; 2B: The SWI phase image of ACS 3 and the subjective scores is 3; 2C: The SWI phase image of ACS 4 and the subjective scores is 2; 2D: The SWI phase image of ACS 5 and the subjectives scores is 1.SWI: susceptibility weighted imaging; PI: parallel imaging; ACS: artificial intelligence assisted compressed sensing.

图3 女,25 岁,主观评分标准对应图像。3A~3D:分别为PI 2.2、ACS 3、ACS 4、ACS 5 的SWI 相位图(层面一),主观评分分别为3、3、2、1 分;3E~3H:分别为PI 2.2、ACS 3、ACS 4、ACS 5的SWI相位图(层面二),主观评分分别为3、3、2、1分;3I~3L:分别为PI 2.2、ACS 3、ACS 4、ACS 5的SWI相位图(层面三),主观评分分别为3、3、2、1分。SWI:磁敏感加权成像;PI:并行成像;ACS:人工智能辅助压缩感知。层面一指双侧尾状核头、壳核和苍白球周围的额叶白质,层面二指红核和黑质周围的中脑,层面三指双侧齿状核周围的小脑。Fig.3 Female, 25 years old, the subjective scoring criteria correspond to the image.3A-3D: The SWI phase image of PI 2.2, ACS 3, ACS 4, ACS 5 ( layer 1), with the subjective scores is 3, 3, 2, 1, respectively; 3E-3H: The SWI phase image of PI 2.2, ACS 3, ACS 4, ACS 5 (layer 2), with the subjective scores is 3, 3, 2, 1,respectively; 3I-3L: The SWI phase image of PI 2.2, ACS 3, ACS 4, ACS 5 ( layer 3), with the subjective scores is 3, 3, 2, 1, respectively.SWI: susceptibility weighted imaging; PI: parallel imaging; ACS: artificial intelligence assisted compressed sensing.The layer 1 refers to the frontal white matter around the head of caudate nucleus, putamen, and globus pallidus; the layer 2 refers to the midbrain around the red nucleus and substantia nigra; the layer 3 refers to the cerebellum around the dentate nucleus.
2.2 客观评价
四组图像于不同层面的SNR 和CNR 差异均有统计学意义(P均<0.05)。两两比较结果:ACS 4 和ACS 5 的SNR 和CNR 均高于PI 2.2,差异有统计学意义(P<0.05);ACS 3与PI 2.2的SNR和CNR差异无统计意义(P>0.05)(表2、图4)。与PI 2.2 相比,左侧PUT、双侧RN和双侧SN的PV在ACS 4和ACS 5差异有统计学意义(P均<0.001),而右侧PUT 的PV 于ACS 5差异有统计学意义(P<0.001),其余核团于各AF下的PV测值差异无统计学意义(P均>0.05)(表3)。
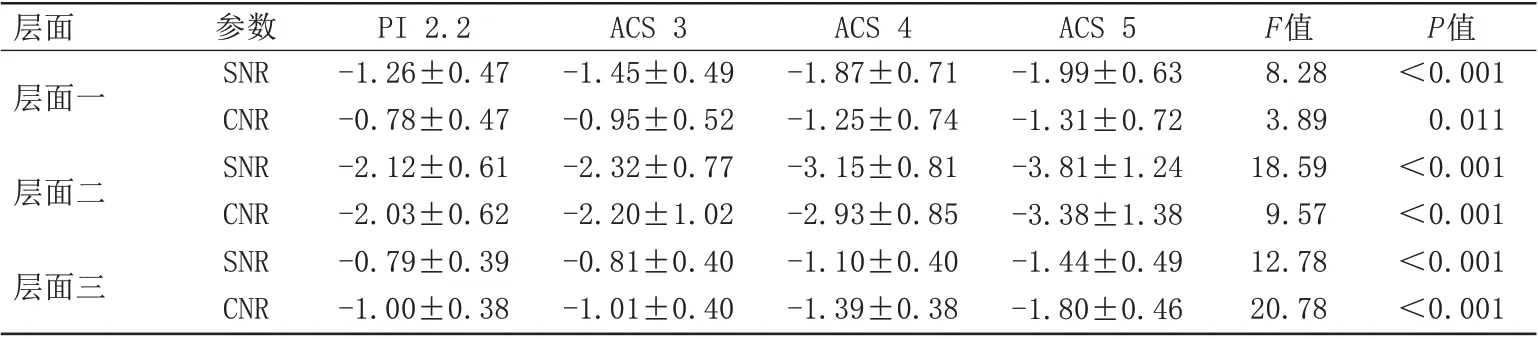
表2 不同AF间SNR和CNR差异性检验Tab.2 Test of variability of SNR and CNR among different AF

表3 不同AF间各核团PV差异Tab.3 Differences in the PV values of each nuclei among different AF conditions

图4 SWI 相位图不同AF 客观评价的两两比较。SWI:磁敏感加权成像;AF:加速因子;PI:并行成像;ACS:人工智能辅助压缩感知;SNR:信噪比;CNR:对比噪声比。Fig.4 The pairwise comparison of different AF objective evaluation of each SWI phase image.SWI: susceptibility weighted imaging; AF: acceleration factor; PI: parallel imaging; ACS: artificial intelligence assisted compressed sensing; SNR: signal-to-noise ratio; CNR: contrast-to-noise ratio.
3 讨论
本研究将不同AF的ACS应用于头部SWI序列,将其与传统PI 技术对比并进行了AF 的优化,结果表明当AF为3时,SWI相位图的SNR、CNR、主观评分及各核团PV 与传统基于PI 的SWI 相位图差异无统计学意义,扫描时间缩短了51%。此外,ACS 4 和ACS 5 的SNR 和CNR 均高于PI 2.2,但主观评分却低于PI 2.2。随着AF的增大,核团的解剖结构及边界逐渐模糊,并且双侧PUT、RN 和SN 的PV 与PI 2.2 相比出现差异。由于PD 和AD 患者的年龄普遍较大及疾病症状的特殊性,SWI 较长的扫描时间会使这类患者依从性降低,进而影响图像质量。目前未发现将ACS技术应用到SWI 的研究,故缩短SWI 扫描时间不仅可以提高检查成功率,还可提高设备的社会经济效益,具有较好的临床应用前景。
3.1 与既往头部SWI加速成像技术相关研究比较
PI 和CS 技术虽能有效加快头部SWI 扫描速度,但其原理均是通过K空间的欠采样来缩短扫描时间,因此不可避免地出现图像质量下降的现象。ACS 技术结合HF、PI和CS,创新性地将深度学习神经网络作为AI模块引入重建过程,在抑制噪声、减少伪影和检测病变等方面具有优势[12]。CONKLIN等[10]的研究表明PI 可以在缩短扫描时间的同时提供与标准SWI 相似的图像质量,但增加了图像噪声。LUPO 等[11]发现与完整重建数据集相比,PI 会导致小血管对比度下降。本研究的定量评估结果显示在相同分辨率下,使用ACS 的序列扫描时间明显短于PI,并且图像的SNR 和CNR值不但没有下降,甚至更高,这表明ACS即使在高AF 下也具有保持图像质量的能力。杨婧等[14]采用CS技术对SWI 进行了加速采集,发现在AF 为2时对图像质量无明显影响,但对幕下核团(如SN 和DN)的PV产生影响,而本研究发现在ACS 3仍对图像质量及PV无明显影响。分析其原因可能是ACS 超快速成像冻结了部分运动伪影,并且基于深度学习重建算法有助于去除噪声和截断伪影,从而确保高质量的图像质量[15-17]。
3.2 与现有ACS技术相关研究比较
LIU 等[18]将ACS 应用于脑部疾病导致不自主头动患者的T2WI 液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列,与传统的PI-FLAIR相比,图像采集时间更短且图像质量更高。WANG等[19]的研究证明,与传统的PI 相比,新颖的ACS 方案在膝关节成像中表现出更好的图像质量,并且可以实现对结构异常的等效检测,同时将采集时间缩短一半。既往ACS 相关MRI 研究主要针对PI 和ACS 的对比分析,而本研究对不同AF值进行了细致比较,发现ACS 3与PI 2.2的主客观评分及PV值均无明显差异。SUI等[20]发现ACS加速序列不仅可实现更快的腰椎成像,而且具有与常规2D 序列相似的成像质量。严祥虎等[21]将ACS 技术应用于心脏T2WI 黑血成像序列,相较于常规T2WI黑血序列,其可以在不明显增加扫描时间的情况下将空间分辨率提高了一倍,从而有利于心肌水肿的检出。此外,利用ACS技术还能显著缩短心力衰竭患者的单次屏气时间[22]以及肝脏T2WI单次屏气所需时间[23-25],从而有效避免呼吸伪影对图像质量的影响。一些研究还将ACS 技术应用于肾脏、子宫和直肠等部位的磁共振成像中,在缩短扫描时间的同时还可以保持甚至改善图像质量[26-28]。上述研究成果表明将ACS 技术应用于全身各部位的扫描具有良好的可行性。与既往研究不同,本研究发现虽然ACS 在一定程度上增加了SWI 相位图的SNR和CNR,但随着AF 的增加,核团解剖结构和边界逐渐模糊,并且部分核团的PV 会发生改变。这意味着即使ACS具有降噪以减少伪影的特征,但一些固有的伪影可能仍然没有被消除(如SWI 中的磁敏感伪影[29-30]和晕染效应[31])。与PI 方法不同,当使用来自深度学习方法的ACS时存在一些潜在风险,其高精度在很大程度上取决于训练数据集的大小和种类。虽然目前的深度学习算法已经显示出准确的重建结果,但结果仍然缺乏稳定性。不稳定性问题主要包括以下几个方面:(1)某些小噪声扰动的不稳定性;(2)组织变化的不稳定性;(3)样本量差异的不稳定性[32]。
3.3 局限性及展望
本研究的主要局限性:(1)样本量较少,且均为健康志愿者,稳定性和临床适用性有待验证,后续需要纳入中枢神经系统疾病患者进一步深入观察;(2)由于某些核团比较小(如RN、SN)或形状不规则(如DN),ROI 勾画比较困难,可能导致测量结果出现偏倚。为了进一步将SWI应用于身体的其他器官,例如肝脏和肾脏,主要挑战之一是处理运动伪影[33-34],特别是当需要相对较高的成像分辨率时,ACS 等快速成像技术是解决此问题的关键[35]。这些加速技术可能在SWI 的未来应用中发挥重要作用,并有望应用于SWI的腹部成像。
4 结论
综上所述,利用ACS技术可在保证成像质量且不影响PV 结果的前提下缩短SWI 扫描时间,ACS 3 为最佳AF,较常规PI 扫描缩短51%的扫描时间,为颅脑常规SWI 检查中ACS AF 的选择提供一定的参考,具有良好的临床应用前景。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:宋清伟设计本研究的方案,对稿件的重要内容进行了修改;钟美梦起草和撰写稿件,获取、分析或解释本研究的数据;曹家骏、安琪、杨超获取、分析或解释本研究的数据,对稿件的重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

