阻塞性睡眠呼吸暂停低通气综合征的脑ReHo和fALFF研究
王琴,熊妍希*,张自力,敖锋,李胜,李艳红,陈光斌
作者单位:1.十堰市人民医院(湖北医药学院附属人民医院)放射影像中心,十堰 442099;2.十堰市人民医院(湖北医药学院附属人民医院)放射影像研究所,十堰 442099;3.十堰市人民医院(湖北医药学院附属人民医院) 呼吸疾病中心,十堰 442099
0 前言
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome, OSAHS)存在着不同程度的脑功能异常[1],可进一步发展为认知功能障碍[2-3],严重影响患者的生存质量、威胁其生命安全[4]。因此,早期识别OSAHS 脑功能损害、探索其神经病理机制并针对病因进行早期预防及精准治疗均是亟待解决的难题。静息态功能磁共振成像(resting state functional magnetic resonance imaging,rs-fMRI)及其先进的数据处理方法为OSAHS 神经影像学的研究开辟了新道路[5]。目前仅有少数研究者运用rs-fMRI 来研究OSAHS 的脑功能状态。其中,局部一致性(regional homogeneity, ReHo)分析主要反映脑神经元的自发活动一致性的变化[6]。分数低频振幅(fractional amplitude of low-frequency fluctuation, fALFF)分析主要体现脑神经元的活动强度。而迄今为止,鲜少有学者将ReHo 和fALFF 两种分析方法联合运用于OSAHS的脑功能异常研究中。因此,本研究选择ReHo 、fALFF分析分别从活动一致性及活动幅度两个方面来探究OSAHS 患者的脑功能异常。研究方法兼具全面性及创新性。有研究表明[7],患者性别、左右利手均会影响其脑功能状态。因此,我们只纳入了男性、右利手的OSAHS 患者及志愿者以保证试验结果的准确性。
1 材料与方法
1.1 研究对象
前瞻性纳入2019 年9 月至2020 年12 月在十堰市人民医院呼吸内科经过多导睡眠监测(polysomnography, PSG)初次诊断为OSAHS 的男性患者30 例作为OSAHS 组。选取同时段经PSG 监测为睡眠正常、而其他基本情况与OSAHS组相似的志愿者30例为正常对照(normal control, NC)组。
OSAHS组纳入标准:(1)右利手;(2)男性;(3)30~60 岁;(4)符合OSAHS 诊断标准[8]。NC 组纳入标准:(1)右利手;(2)男性;(3)30~60 岁;(4)呼吸暂停低通气指数(apnea hypopnea index, AHI)<5次/h。
OSAHS组和NC组的排除标准:(1)其他睡眠疾病;(2)严重的心脑血管及呼吸系统疾病、糖尿病等病史;(3)神经或精神系统疾病;(4)酗酒;(5)MRI 扫描禁忌证者。
本研究遵守《赫尔辛基宣言》,经十堰市人民医院伦理委员会批准(批准文号:syrmyy2021-017),受试者均签署了知情同意书,系自愿参与。
1.2 PSG监测
受试者在进行PSG 监测前均需完成爱泼沃斯嗜睡量表(Epworth Sleepiness Scale, ESS)量表和蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评分,评估白天嗜睡及认知功能改变情况。采用Alice 5 LE 睡眠系统,PSG 监测时间≥7 h,记录AHI、微觉醒指数(arousal index, AI)、氧减指数(oxygen desaturation index, ODI)、最低血氧饱和度(arterial oxygen saturation, SaO2)、平均SaO2、SaO2<90%百分比等指标。
1.3 MRI数据采集
采用德国西门子3.0 T 磁共振仪(MAGNETOM Skyra 3.0 T, Siemens AG, Germany)进行数据的采集。首先,叮嘱受试者闭目保持清醒但尽量不思考,进行常规平扫,以排除有脑实质性病变的受试者。接着,采集静息态下全脑血氧水平依赖(blood oxygen level dependent, BOLD)数据。BOLD 序列扫描参数如下:TR 2000 ms,TE 122 ms,翻转角90°,层数30,层厚4.0 mm,间距1.2 mm,FOV 230 mm×230 mm,矩阵64×64。共得到240 个时间点,扫描时间为8 min 6 s。最后,采集3D-T1WI 序列用以空间定位,3D-T1WI 序列扫描参数如下:TR 1900 ms,TE 2.26 ms,翻 转 角9°,间 距0 mm,FOV 250 mm×250 mm, 矩阵256×256,总层数176,扫描时间为5 min 14 s。
1.4 BOLD数据预处理
首先,对平扫图像进行判读以排除大脑实质性病变对结果的影响,其次,采用MRIcro(www.MRIcro.com)和MRIcron(www.MRIcron.com)软件包对BOLD数据进行检查,去除不合格的数据。最后基于MATLAB 2014a(MathWorks, Natick, MA, USA)平 台,采 用RESTplus version 1.24(http://www.restfmri.net)软件包进行预处理,具体步骤如下。
(1)转换格式:将从PACS 上拷贝下来的DICOM 格式转换为NIfTI格式;
(2)去除时间点:去除前10 个时间点的BLOD数据;
(3)时间层校正:将一个重复时间内采集的图像校正到同一时间点上;
(4)头动校正:采用弗里斯顿头部运动参数来校正头部运动的影响,受试者三维最大位移(x、y、z)超过3 mm及三维旋转角度大于3°的图像被剔除;
(5)将BOLD 图像通过线性变换3D 解剖图像进行配准,并重新分割脑脊液及灰、白质;
(6)空间标准化:将功能性MRI 图像空间标准化到蒙特利尔神经研究所(Montreal Neurological Institute, MNI)标准空间;
(7)去除线性漂移及协变量:对每个时间序列进行线性趋化效应,去除其他因素对BOLD信号的干扰;
(8)低频滤波:为降低低频漂移和高频生理呼吸噪声,对每个体素进行去低频滤波。
1.5 基于体素水平的计算
利用RESTplus 软件对ReHo 值及fALFF 值进行计算。单个体素与其周围26体素时间序列的肯德尔和谐系数即为该体素的ReHo 值。使用DPARSF 软件包(http://www.restfmri.net)对滤波后的时间序列进行快速傅里叶变换,得到其功率谱,求得单个体素的fALFF 值。为减少个体差异,对全脑ReHo 值及fALFF 值进行标准化得到标准化的ReHo 图、fALFF 图用以统计学分析。
1.6 统计学分析
采用IBM SPSS 25.0 软件将两组的基本资料进行比较。根据数据分布类型选择两独立样本t检验或秩和检验,P<0.05 认为差异具有统计学意义。利用SPM 12 软件对两组标准化的ReHo 图、fALFF 图进行两独立样本t检验。经SPM 12 进行统计推断后,记录差异有统计学意义的脑区的大小及其MNI坐标,以体素水平P<0.001、团块≥40 体素经Alphasim 校正,被认为差异具有统计学意义,由RESTplus软件将结果进行呈现。
2 结果
2.1 临床基本资料的结果
本研究纳入OSAHS 组、NC 组受试各30 例,均为男性、右利手。其中,两组的年龄、受教育年限差异无统计学意义;两组的BMI、AHI、AI、ODI、最低SaO2、平均SaO2、SaO2<90%的百分比、ESS 评分、MoCA 评分差异均有统计学意义,详见表1。
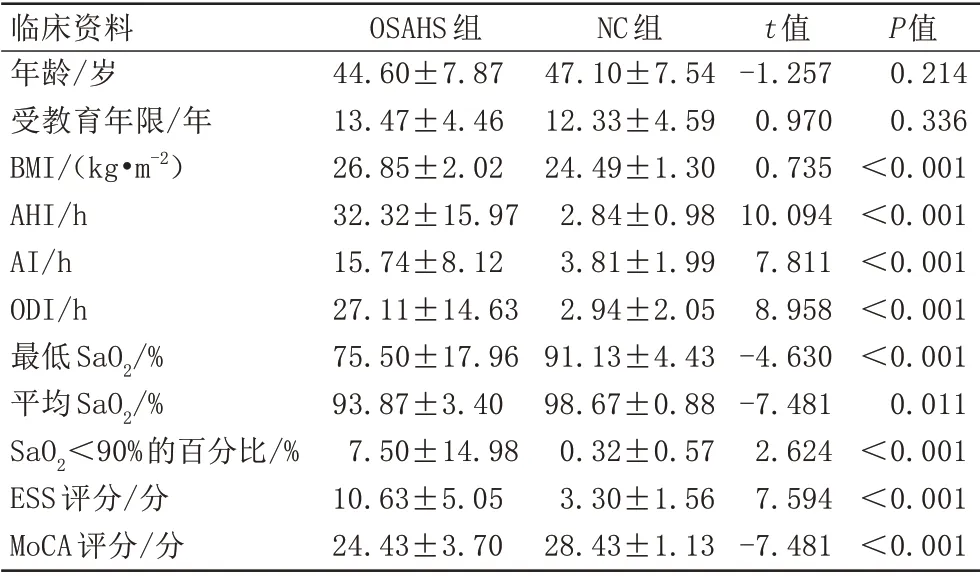
表1 OSAHS组及NC组临床基本资料比较
2.2 ReHo分析结果
与NC 组相比,OSAHS 组的ReHo 值、fALFF 值差异均有统计学意义(P<0.001,Alphasim 校正):ReHo值增加的脑区有左侧脑桥(t=3.94,P<0.001)、左侧小脑前叶(t=4.68,P<0.001)、右侧小脑前叶(t=4.94,P<0.001)。全脑无明显ReHo值减低的脑区,详见图1。
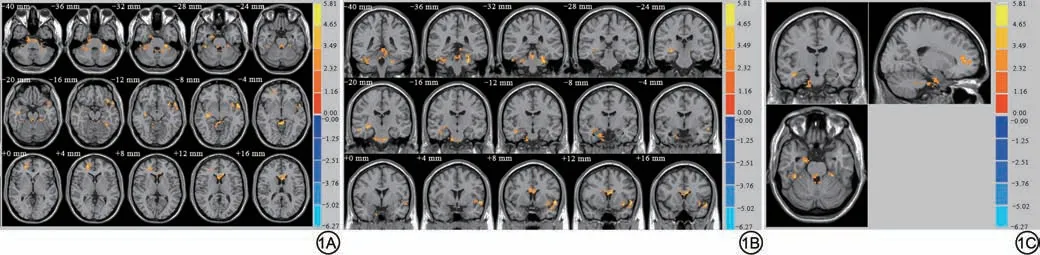
图1 OSAHS 组与NC 组ReHo 值发生变化的脑区。
2.3 fALFF分析结果
与NC组相比,fALFF值增高的脑区有左侧小脑后叶(t=6.20,P<0.001),左侧颞上回(t=5.49,P<0.001),左侧梭状回(t=4.39,P<0.001),fALFF 值减低的脑区有左侧中央旁小叶(t=-4.12,P<0.001),详见图2。

图2 OSAHS 组与NC 组fALFF 值发生变化的脑区。黄色为fALFF 值升高的脑区,蓝色为fALFF 值降低的脑区。OSAHS:阻塞性睡眠呼吸暂停低通气综合征;NC:正常对照;ReHo:局部一致性;fALFF:分数低频振幅。
3 讨论
本研究采用ReHo 分析和fALFF 分析两种方法来探索了OSAHS 患者与正常人之间的脑功能差异。目前国内外仅有少数研究者运用rs-fMRI来研究OSAHS的脑功能状态,且现有研究[9]多采用ReHo和低频振幅(amplitude of low-frequency fluctuation, ALFF)来研究,鲜少采用fALFF 来研究OSAHS 的脑功能状态。而fALFF 是一种在ALFF 基础上改良得到的新算法,它将低频段(0.01~0.08 Hz)信号的功率谱除以整个频段(0~0.25 Hz)上信号的功率谱,可有效消减ALFF 中生理性噪声,准确度相对更高[5]。fALFF 目前广泛应用于原发性失眠[10]、抑郁症[11-12],双相情感障碍[12]、精神分裂症[13]以及焦虑性帕金森病[14]的脑功能的研究中,仅有少数研究将fALFF 应用于评估OSAHS 的治疗效果[15-16]。本研究将ReHo 和fALFF 两种联合运用于OSAHS的脑功能研究中,不仅具有一定创新性,同时保证了该研究的相对准确性。本研究首次发现,OSAHS 患者存在多个ReHo 值增高的脑区且全脑未见明显ReHo 值减低的脑区,OSHAS 患者fALFF值发生变化的脑区均位于左侧大脑半球。为探索OSAHS 患者认知障碍的神经病理学机制提供了新方法、新视角及新线索。
3.1 ReHo分析
本研究发现,与NC 组相比,OSAHS 组ReHo 值增高的脑区有左侧脑桥、双侧小脑前叶,全脑未见明显ReHo值降低的脑区。我们的研究首次发现,OSAHS患者多个脑区神经元的活动一致性增高且全脑未见活动一致性减低的脑区。同时,本研究还将OSAHS患者与NC 组的两组的临床基本资料进行了比较,结果发现OSAHS组的BMI值明显高于NC组,表明肥胖的人更易患OSAHS,与既往的报道[17-19]相符。另外,OSAHS 组与NC 组的AHI、AI、ODI、最低SaO2、平均SaO2、SaO2<90%的百分比差异均有统计学意义。有学者认为,缺氧、睡眠不足或睡眠效率低下可能是OSAHS患者脑功能损害的基础[20-21]。我们亦发现OSAHS 组与NC 组的ESS 评分、MoCA 评分差异有统计学意义。由此推测,OSAHS 患者某些脑区ReHo 值的增高可能与其认知功能损害及白日嗜睡有关,但通过相关性分析,并未发现增高脑区的ReHo 值与ESS 评分、MoCA 评分之间存在显著相关性。因此,仍需进一步探究其内在联系。之前的研究表明[22-23],OSAHS 患者存在多个脑区的ReHo 值的减低,且某些特定脑区的减低的ReHo 值与患者的认知功能之间存在相关性。LI 等[24]指出,特定脑区减低的ReHo 值与OSAHS 患者MoCA 评分、ESS评分以及AHI存在相关性。SHU等[23]研究发现,OSAHS患者的MoCA评分与睡眠效率呈显著的正相关。这有助于理解OSAHS患者认知功能障碍的神经影像机制,并可作为鉴别OSAHS 是否伴发认知功能障碍的潜在生物标记物。另有学者指出[22-23,25],某些特定脑区异常的ReHo值可作为评估OSAHS 神经元损伤的潜在的生物标记物,并推测OSAHS患者长期睡眠不足以及睡眠效率低下可能是造成其认知损害的原因。而本研究结果与先前存在差异性,推测可能是我们没有对患者进行病情分度,从而干扰了研究结果。
3.2 fALFF分析
本研究发现,与NC 组相比,OSAHS 组fALFF 值增高的脑区有左侧小脑后叶、左侧颞上回、左侧梭状回,减低的脑区有左侧中央旁小叶。由前述可见,fALFF 值发生变化的脑区均位于左侧大脑半球,有学者[26]认为OSAHS 患者两侧大脑半球功能重排可能是其脑功能损伤的原因,本研究中fALFF值发生改变的脑区多数发生左侧大脑半球,很有可能是OSAHS患者左、右侧大脑半球功能重排的体现。
SANTARNECCHI 等[26]的研究表明,OSAHS 患者的中央前回和中央后回之间的内在联系增强,作者认为这种增强可能与睡眠相关肌肉组织的高活性有关。有学者认为[4,27],睡眠期间肌张力、觉醒阈值和回路增益等因素可驱动阻塞性呼吸暂停和呼吸减弱。此外,还有研究指出[28-29],中央自主神经网络的区域的fALFF值与OSAHS的认知障碍可能存在联系。本研究发现,OSAHS患者左侧中央旁小叶的fALFF值减低,说明该脑区神经元的活动幅度减低,脑功能可能受损,从而影响相关肌肉组织的活动,导致睡眠障碍,进一步支持了之前的研究结果,为探索OSAHS 认知障碍的神经病理学机制提供了新的线索。此外,本研究中,OSAHS组fALFF值增高的脑区有左侧小脑后叶、左侧颞上回、左侧梭状回,提示这些脑区出现了功能代偿,但关于具体作用机制,仍需进一步研究探索。
本研究采用ReHo 和fALFF 方法对男性OSAHS 患者的脑功能进行了研究。经探索发现,与正常人比,OSAHS 患者的多个脑区的活动一致性、活动幅度均有所改变。OSAHS 患者的部分脑区的ReHo 增高,fALFF发生变化的脑区多集中于左侧大脑半球。有研究表明[16,24,30],OSAHS 患 者 治 疗 后ReHo 值 及fALFF 值 均 会发生改变,说明OSAHS 脑功能损害存在可逆性的可能,强调了早识别、早治疗的重要性,并推测特定脑区异常的ReHo 值及fALFF 值可作为评估OSAHS 神经元损伤的潜在的生物标记物。因此,rs-fMRI 在OSAHS 的科学研究及指导临床治疗中都具有良好的应用前景。
3.3 局限性
本研究仅纳入了男性患者及志愿者,且只采用了ReHo、fALFF两种方法比较了两者脑功能之间的差异,未探究处于不同病程的OSAHS 患者的脑功能情况。将来应纳入女性患者及志愿者,并联合多种方法、以病情分度为亚组进行综合分析,以阐明其潜在的神经病理学机制。
4 结论
OSAHS 患者的多个脑区的脑神经元局部活动一致性、活动幅度均有所改变。OSAHS 患者的部分脑区的ReHo增高,fALFF发生变化的脑区多集中于左侧大脑半球。rs-fMRI 为探索OSAHS 患者认知障碍的神经病理学机制、寻找其脑神经元损伤的潜在生物标记提供了新方法、新视角及新线索。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王琴、陈光斌、张自力、敖锋、李胜、李艳红、熊妍希参与选题和设计,参与资料的分析与解释,撰写论文并对其学术内容的重要方面进行了关键修改,对最终要发表的论文版本进行了全面的审阅和把关,并最终同意该文发表,同意对研究工作各方面的诚信问题负责;其中熊妍希获得了十堰市科技局2019年度引导性科研项目的资助。

