HER2阳性乳腺癌接受曲妥珠单抗辅助治疗病人预后分析(附1 246例报告)
李岳峰,洪 进,李志安,阮国栋,陈伟国
(1.绍兴第二医院肿瘤外科,浙江 绍兴 312000;2.上海交通大学医学院附属瑞金医院普外科 乳腺疾病诊治中心,上海 200025)
乳腺癌发病率在全球范围逐年上升,在1990至2019 年间,女性乳腺癌病人的死亡率居女性常见癌症首位,占女性癌症相关死亡总数的15.9%[1]。在中国,乳腺癌新发病例已从2015 年的30 万增加到2020 年的42 万,且女性的乳腺癌发病率始终居于所有癌症之首[2-3]。乳腺癌具有多种分子亚型,其中人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)阳性的乳腺癌亚型被证明有高度恶性与耐药性[4-5]。近年来,对抗HER2 靶点的药物应用使HER2 阳性乳腺癌病人的治疗取得了相当大的进步[6]。1998 年,靶向药物曲妥珠单抗首获美国食品药品管理局(Food and Drug Administration, FDA)批准用于治疗HER2 阳性乳腺癌,现已明确推荐用于我国HER2 阳性乳腺癌病人辅助治疗策略中[7-8]。为评估近年来在我国接受曲妥珠单抗治疗的HER2 阳性乳腺癌病人的预后,本研究回顾性分析上海交通大学乳腺癌数据库自2009 年1 月至2019 年12 月1 246 例接受曲妥珠单抗辅助治疗的初诊病理为HER2 阳性浸润性乳腺癌病人数据,分析影响其预后的相关因素,为今后乳腺癌综合性个体化治疗提供新的依据。
1 材料与方法
1.1 临床资料
选取上海交通大学乳腺癌数据库中2009 年1月至2019年12月期间接受曲妥珠单抗辅助治疗的女性HER2 阳性乳腺癌病人1 246 例。纳入标准如下:①女性初诊浸润性乳腺癌;②接受标准乳腺癌根治术;③术后病理免疫组织化学结果为HER2(3+)或HER2(2+)且荧光原位杂交(fluorescencein situhybridization, FISH)(+);④辅助治疗均接受化疗联合曲妥珠单抗治疗。排除标准如下:①病历资料不完整;②未接受化疗或靶向治疗;③接受新辅助治疗;④接受双靶向治疗。
1.2 病理评估和治疗方法
1.2.1 手术选择
根据临床评估及病人保乳意愿分别选择全乳切除术或保乳手术。依据临床术前评估及前哨淋巴结活检(sentinal lymph node biopsy,SLNB)选择是否行腋窝淋巴结清扫。
1.2.2 病理评估
所有病人的组织标本皆由至少2 位病理专家独立审核,报告结果包括病理类型、组织学分级、肿瘤大小、淋巴结转移数、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2 和核增殖抗原Ki-67 的表达水平。HER2 阳性定义标准为免疫组织化学结果HER2(3+)或HER2(2+)且FISH(+)。
1.2.3 术后辅助治疗
所有病人均接受曲妥珠单抗辅助靶向治疗。激素受体阳性者选择单用芳香化酶抑制剂(aminoglutethimide, AI)、他莫昔芬(tamoxifen, TAM),或联合卵巢功能抑制剂(ovarian function suppression,OFS)。化疗根据病理结果个体化选择蒽环联合紫杉类化疗方案:表柔比星联合环磷酰胺序贯多西他赛(EC-T 方案),环磷酰胺联合表柔比星及氟尿嘧啶序贯多西他赛(CEF-T 方案),表柔比星联合环磷酰胺(EC 方案),环磷酰胺联合表柔比星及氟尿嘧啶(CEF 方案)等;紫杉类或其他化疗方案:多西他赛联合环磷酰胺(TC 方案),多西他赛联合卡铂(TCb 方案),环磷酰胺联合甲氨蝶呤及氟尿嘧啶(CMF方案)等。
1.3 统计方法
采用IBM SPSSstatistics 26软件行统计学分析,采用GraphPad Prism 8 制图。计数资料根据年龄、病理分期等条件项转化为分类变量后,清点各组观察单位的频数进行描述,比较采用卡方检验。应用Log-rank 单因素分析及多因素COX 回归分析研究接受曲妥珠单抗辅助治疗的HER2 阳性乳腺癌病人预后影响因素,以及不同因素的预后差异。将自手术到出现局部复发、远处转移或对侧乳腺癌等乳腺癌事件的时间间隔定义为无乳腺癌生存期(breast cancer free interval,BCFI),将自手术开始至随访过程中去除因任何原因死亡的病人后幸存病人数与总例数的比例定义为总体生存(overall survival,OS)率表示,用Kaplan-Meier 法作生存曲线。P<0.05为差异具有统计学意义。
2 结果
2.1 接受曲妥珠单抗辅助治疗的HER2 阳性乳腺癌病人临床病理特征及治疗
纳入研究统计分析共1 246 例,中位生存时间为63.0 个月,其临床病理特征见表1。其中,病理类型IDC、pT3~4期、组织学分级Ⅲ级、乳房切除术、蒽环联合紫杉类化疗方案、辅助放疗这些因素与淋巴结转移有相关性(P<0.05)(见表1)。
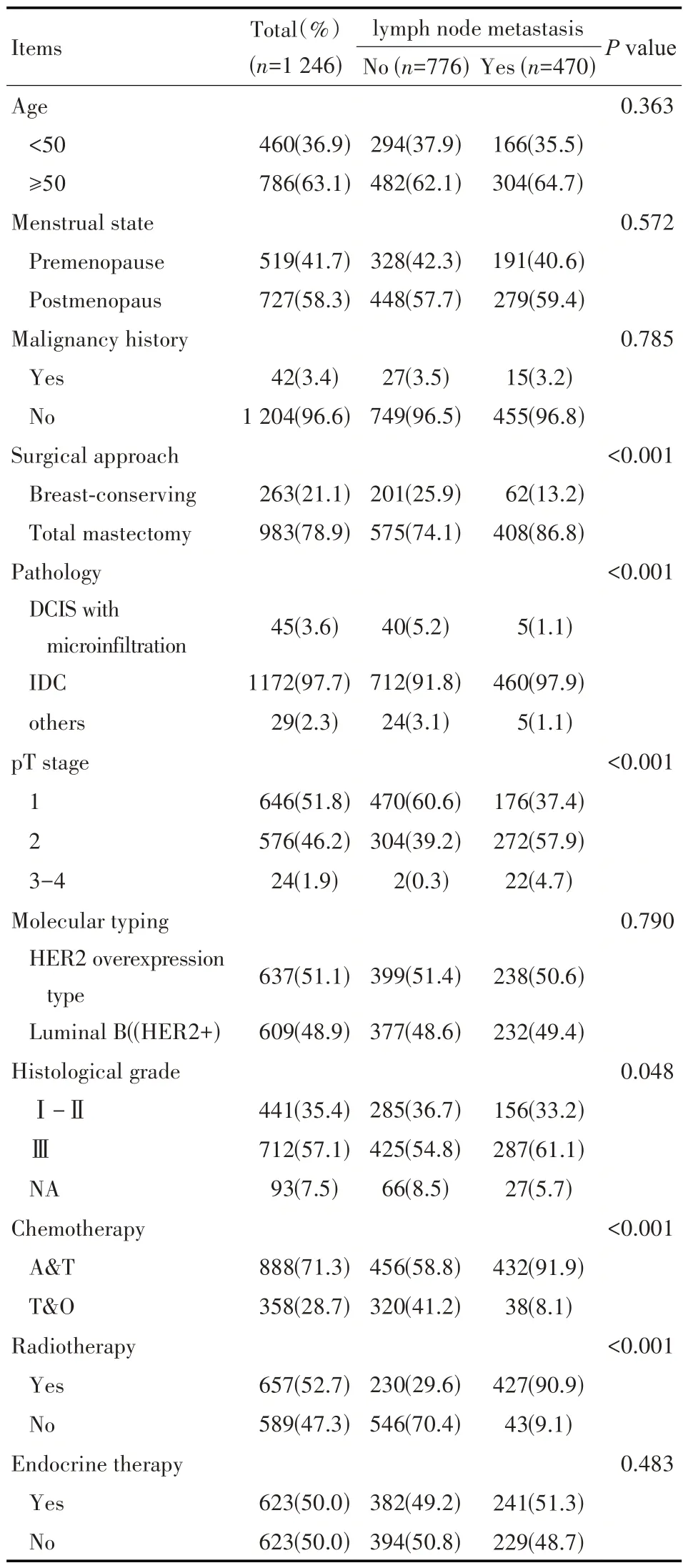
表1 病人临床病理特征及治疗[n(%)]Tab 1 Clinicopathological characteristics and treatment regimens[n(%)]
2.2 接受曲妥珠单抗治疗的HER2 阳性病人BCFI的影响因素分析
比较接受曲妥珠单抗治疗的HER2 阳性病人不同亚群的BCFI。pT1期组5 年BCFI 为96.3%,显著好于pT2~3期组的89.3%(P<0.000 1);pN0、pN1期组5 年BCFI 分别为95.5%和92.8%,显著优于pN2~3期组的83.4%(P<0.000 1);化疗行紫杉类或其他组的5 年BCFI 为97.9%,明显好于化疗行蒽环联合紫杉类组的91.0%(P<0.000 1);内分泌治疗组5 年BCFI 率为95.1%,明显优于未行内分泌治疗组的90.7%(P=0.000 3)(见图1)。对比不同pN 分期的接受曲妥珠单抗治疗、HER2阳性病人的OS,pN0期者5 年OS 为98.6%,pN1期为97.2%,pN2~3期为94.3%,pN2~3期组总体预后明显劣于pN0或pN1组(P=0.001 3)(见图2)。

图1 HER2阳性乳腺癌接受曲妥珠单抗病人的BCFIFig 1 The BCFI of HER2-positive breast cancer patients receiving trastuzumab monotherapy
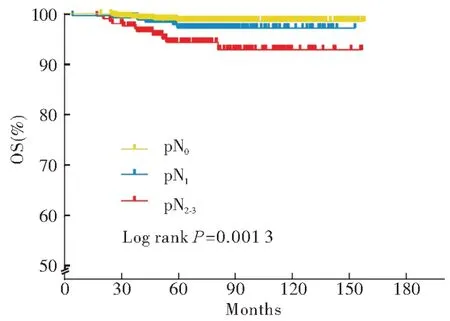
图2 接受曲妥珠单抗治疗的HER2 阳性乳腺癌病人不同临床肿瘤N分期的OSFig 2 OS of the HER2-positive breast cancer patients receiving trastuzumab monotherapy with different pN stages
单因素分析结果表明,pT 分期(P<0.001)、pN分期(P<0.001),乳腺癌分子分型(P=0.001),辅助化疗方案(P<0.001),是否内分泌治疗(P<0.001),是否放疗(P<0.001)是显著影响接受辅助曲妥珠单抗治疗HER2 阳性病人BCFI 的因素;pT 分期(P=0.036)、pN 分期(P=0.006)是显著影响其OS 的因素(见表2)。多因素分析结果表明,pT 分期、pN 分期、辅助化疗方案和是否内分泌治疗是其BCFI的独立影响因素。其中pT2~3期(HR=2.10,95%CI:1.29~3.40,P=0.003),pN2~3期(HR=2.81,95%CI:1.71~4.61,P<0.001),未行内分泌治疗(HR=2.50,95%CI:1.59~3.94,P<0.001)为影响病人BCFI 的危险因素。接受紫杉类或其他化疗方案化疗者则具有相对较好的预后(HR=0.40,95%CI:0.18~0.85,P=0.017)。pN分期为影响其OS的独立影响因素(HR=4.48,95%CI: 1.86~10.82,P=0.001)(见表3)。

表2 影响乳腺癌病人BCFI和OS的单因素分析Tab 2 Univariate analysis of factors influencing BCFI and OS in the breast cancer patients
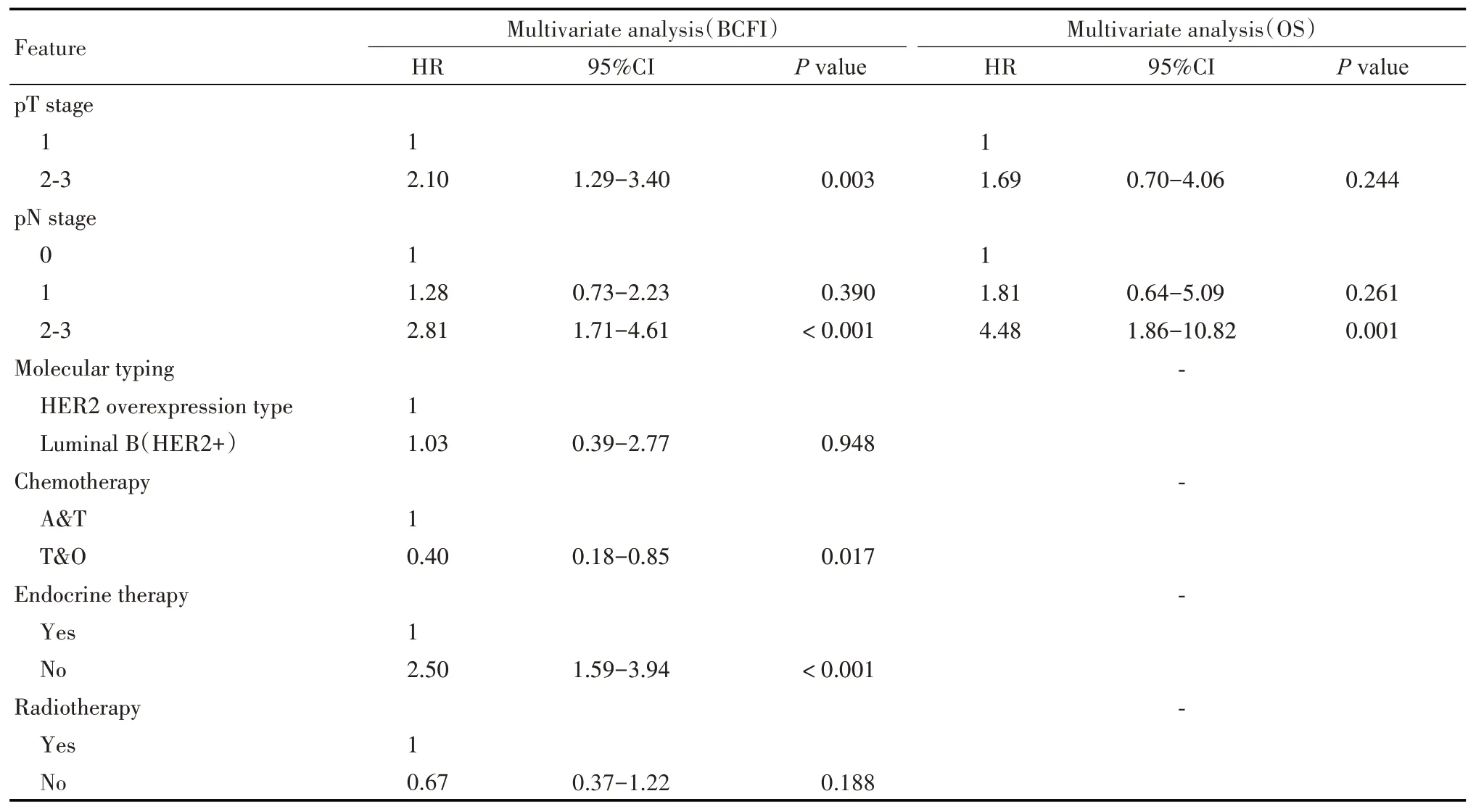
表3 影响乳腺癌病人BCFI和OS的多因素分析Tab 3 Multivariate analysis of factors influencing BCFI and OS in the breast cancer patients
2.3 不同淋巴结状态的亚组分析
比较接受曲妥珠单抗辅助治疗的淋巴结未转移、HER2阳性病人不同亚群BCFI的影响。结果表明,pT1期组5 年BCFI 率为97.3%,明显优于pT2~3期组的92.7%(P=0.000 7)(见图3A),化疗行紫杉类或其他组5 年BCFI 为98.3%,明显优于蒽环类联合紫杉类组的93.7%(P=0.003 7)(见图3E)。接受内分泌治疗组与内分泌治疗组差异无统计学意义(P=0.063 1)(见图3C)。

图3 接受曲妥珠单抗治疗的HER2阳性乳腺癌病人BCFI亚组分析Fig 3 Subgroup analysis of BCFI in the HER2-positive breast cancer patients receiving trastuzumab monotherapy
对淋巴结未转移、HER2 阳性病人行单因素分析发现,pT 分期(P=0.003),是否保乳手术(P=0.031),是否放疗(P=0.041),辅助化疗方案(P=0.004)为影响接受曲妥珠单抗治疗的HER2阳性病人BCFI 的因素。多因素分析发现pT 分期,是否接受内分泌治疗,辅助化疗方案,手术方式是其独立影响因素(均P<0.05)。其中,pT2~3期(HR=2.36,95%CI:1.15~4.88,P=0.020)和不接受内分泌治疗(HR=2.19,95%CI:1.06~4.52,P=0.034)为其危险因素,而乳房切除术式(HR=0.43,95%CI:0.22~0.87,P=0.019),接受紫杉类或其他化疗方案者(HR=0.35,95%CI=0.13~0.91,P=0.032)则具有相对较好的预后(见表4)。
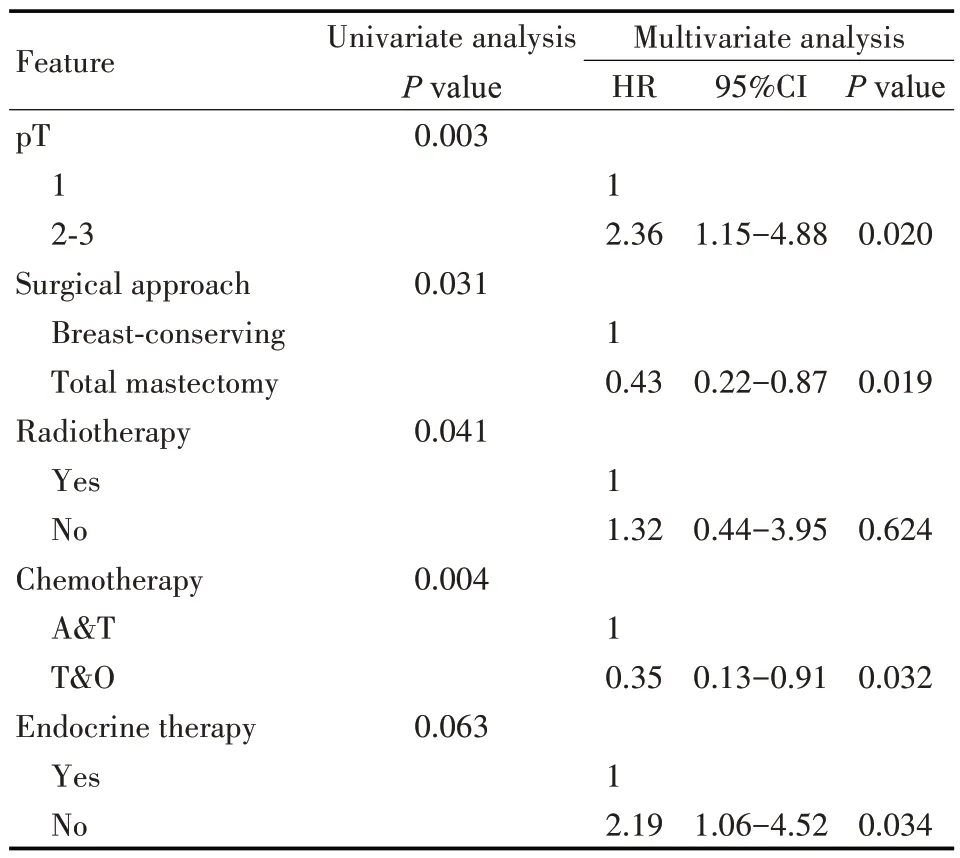
表4 影响淋巴结未转移病人BCFI的单因素和多因素分析Tab 4 Univariate and multivariate analysis of factors affecting BCFI in the lymph node-negative patients
比较接受曲妥珠单抗辅助治疗的淋巴结转移、HER2阳性病人不同亚群BCFI的影响。结果表明,pT1期组5年BCFI率为93.8%,显著优于pT2~3期组的85.6%(P=0.010 7)(见图3B),接受内分泌治疗组5年BCFI率为93.2%,明显优于未接受内分泌治疗组的84.0%(P=0.000 7)(见图3D)。对接受不同化疗方案的病人差异无统计学意义(P=0.455 1)(见图3F)。
对淋巴结转移、HER2 阳性病人行单因素分析发现,pT 分期(P=0.011),是否接受内分泌治疗(P=0.001),乳腺癌分子分型(P=0.002)为影响接受曲妥珠单抗治疗的HER2 阳性病人BCFI 的因素。多因素分析发现,pT 分期、是否接受内分泌治疗为其独立影响因素(均P<0.05)。其中,pT2~3期(HR=2.28,95%CI=1.20~4.32,P=0.012)和不接受内分泌治疗(HR=2.65,95%CI=1.48~4.74,P=0.001)是淋巴结转移病人中的危险因素(见表5)。
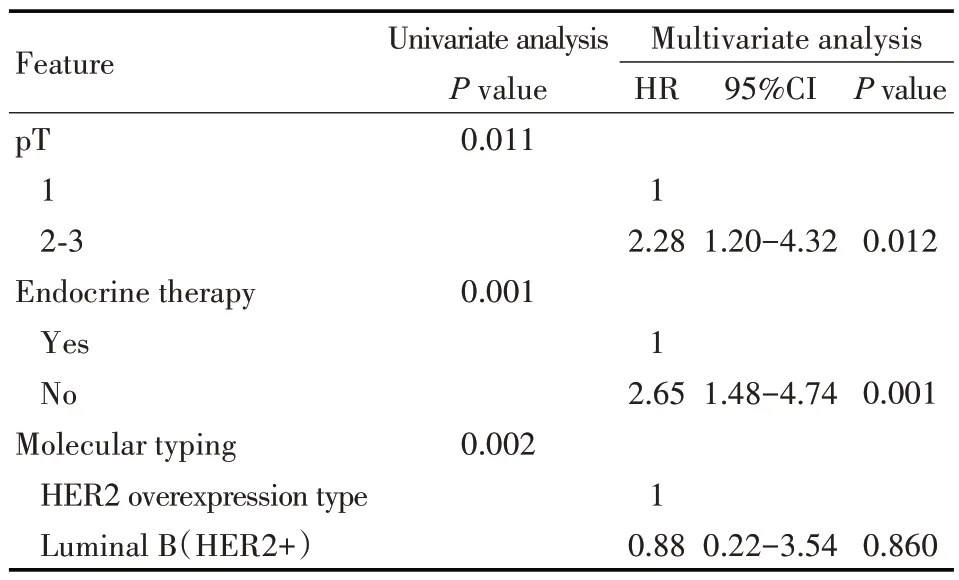
表5 影响淋巴结转移病人BCFI的单因素和多因素分析Tab 5 Univariate and multivariate analysis of factors affecting BCFI in lymph node-positive patient
3 讨论
HER2 阳性乳腺癌病人占所有乳腺癌的15%~20%,是乳腺癌中具侵袭性的亚型之一[9]。靶向HER2 的药物曲妥珠单抗是第一个获批治疗HER2阳性乳腺癌的药,且迄今为止仍是该亚型乳腺癌治疗的基石[10]。“BCIRG-006 临床试验”和“HERA 试验”等证实术后接受1 年的曲妥珠单抗辅助治疗显著提高HER2阳性早期乳腺癌病人的长期无病生存获益和OS率[11-12]。这些研究均奠定了曲妥珠单抗在HER2 阳性乳腺癌辅助治疗中的地位。然而,即便如此,仍有病人出现复发和转移,部分病人存在原发性和继发性耐药。其机制诸如表位掩蔽引起靶向药结合表位被隐藏,受体之间的串扰导致靶向药作用的信号通路被阻断等,这些皆不同程度地影响着曲妥珠单抗对HER2阳性乳腺癌的疗效[13-14]。由此,对曲妥珠单抗在临床实际应用的预后以及其中混杂影响预后因素的探究显得尤为重要。
本研究发现,在HER2 阳性乳腺癌病人中病理T 分期高者易发生淋巴结转移,而对有淋巴结转移的病人临床上多选择乳房切除术、蒽环联合紫杉类化疗以及辅助放疗等手段。基于这些特性,对研究群体进行预后相关因素的分析,发现病理T2~3分期、N2~3分期、未行内分泌治疗的亚群在接受曲妥珠单抗辅助治疗后存在较高的复发风险,而接受紫杉类或其他药物的化疗方案的亚群有较好的预后。尽管对于早期乳腺癌非蒽环类药物比蒽环类药物毒性低,但同样有效[15]。低风险病人采用不含蒽环类的含紫杉烷方案化疗甚至具有很好的预后[16]。但值得肯定的是,在HER2 阳性高危乳腺癌病人中蒽环类加紫杉烷类联合曲妥珠单抗可提高疗效[17]。因此,辅助化疗药物需根据乳腺癌风险评估来作出合理的选择。
本研究发现,T 分期(肿瘤体积)是影响曲妥珠单抗辅助治疗预后的一大危险因素,这与先前的研究[18]一致。结合以往的治疗探索,曲妥珠单抗在治疗原发灶较小的HER2 阳性乳腺癌方面积极作用仍然明显[19]。另外,本研究对淋巴结阳性、HER2阳性病人行单因素分析发现,分子分型及是否接受内分泌治疗均影响乳腺癌的预后,而多因素分析发现仅内分泌治疗影响其预后。指南推荐,激素受体阳性病人一般需采用内分泌治疗[20]。本研究存在激素受体阳性的乳腺癌病人,其分子分型根据指南采用内分泌治疗手段的选择偏倚或是造成此统计结果的原因。
笔者注意到,淋巴结状态对接受曲妥珠单抗治疗的HER2 阳性乳腺癌病人预后有着明显影响,因此将研究群体分为淋巴结未转移和淋巴结转移两个亚组进一步展开分析。发现不同的化疗方案对两个亚组病人的预后影响也完全不同,无淋巴结转移的HER2 阳性病人接受曲妥珠单抗联合紫杉类或其他化疗药疗效较好。一方面可能由于肿瘤较小或不伴有高Ki-67表达、ER 阴性等高危因素的淋巴结阴性HER2 阳性乳腺癌病人多采用不含蒽环类药物的化疗方案,这类病人本身预后就较好;另一方面也可能与蒽环类药物的不良反应影响治疗有关[8,21-22]。研究表明,对于HER2 阳性早期乳腺癌,不含蒽环类药物的化疗联合曲妥珠单抗化疗方案也是常用的辅助治疗方案[23-24]。且前瞻性研究Adjuvant Paclitaxel and Trastuzumab Trial(APT 试验)特别指出,淋巴结未转移、HER2 阳性的小乳腺癌病人豁免蒽环类药物的治疗方案复发风险更低[25]。含高危因素的淋巴结未转移HER2 阳性乳腺癌辅助治疗中,含蒽环类联合环磷酰胺序贯多西他赛加曲妥珠单抗的化疗方案与紫杉类加卡铂联合曲妥珠单抗的化疗方案,指南是相同的推荐等级[8]。因此对于该类病人,可选择豁免蒽环类的降阶梯化疗方案。
淋巴结转移的HER2 阳性乳腺癌病人在接受曲妥珠单抗治疗联合不同的化疗方案的预后差异无统计学意义。提示HER2 阳性乳腺癌病人淋巴结转移时联合曲妥珠单抗治疗的化疗药可有更多选择余地。研究表明,蒽环联合紫杉类治疗药物,紫杉醇会增强蒽环类药物的心脏不良反应[22]。蒽环类药物和曲妥珠单抗的组合心脏毒性事件发生率较高[26]。此外,Ⅲ期试验“TRAIN-2研究”比较Ⅱ~Ⅲ期乳腺癌病人接受曲妥珠单抗和帕妥珠单抗双靶治疗联合卡铂-紫杉烷方案与添加蒽环类药物新辅助治疗后的病理完全缓解率,提出双靶联合豁免蒽环类药物的新辅助治疗可能是早期HER2 阳性乳腺癌的首选方法[27]。另BCIRG-006 研究比较含蒽环类加多西他赛序贯紫杉类化疗药联合曲妥珠单抗方案与不含蒽环类的多西他赛加卡铂联合曲妥珠单抗方案,应用于HER2 阳性早期乳腺癌病人的辅助治疗,随访发现两个方案的疗效相似[11]。据此,在淋巴结转移的HER2 阳性乳腺癌病人可采取豁免蒽环类药物的辅助化疗方案以期避免心脏毒性而到达同样的疗效。
结果中值得一提的是,在曲妥珠单抗治疗HER2 阳性淋巴结未转移的乳腺癌病人前,选择乳房切除术相较于保乳术有更好的预后。或难以接受术后放疗者全乳房切除术是推荐的治疗选择[8,28]。另一方面,比较pT1~2期淋巴结未转移的乳腺癌手术疗效,发现保乳治疗病人的OS 优于乳房切除术[29]。因此,在实际临床应用中,保乳治疗更多为分期较早的病人选择,且预后可更好[30]。本研究还发现,内分泌治疗可以明显改善淋巴结转移亚组的预后,这可能与ER 和HER2 通过与不同配体结合激活磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路[phosphatidylinositol 3-kinase (PI3K)/protein kinase B (AKT)/mammalian target of rapamycin, mTOR]信号通路影响乳腺癌的转移、侵袭的机制有关[31]。因此,在激素受体阳性乳腺癌的辅助治疗方案中,内分泌治疗的地位仍然重要。
综上,本研究发现近年来曲妥珠单抗在HER2阳性乳腺癌病人中的疗效受多种因素的综合影响。基于这些因素,笔者认为分类管理治疗尤为重要。对于淋巴结未转移、肿瘤较小的T1期乳腺癌病人,可考虑降阶梯治疗,采用曲妥珠单抗联合豁免蒽环的化疗方案辅助治疗。对于淋巴结转移、肿瘤较大的T2~3期乳腺癌病人,在化疗方案中豁免蒽环类化疗药可获得同样的疗效并减少心脏的不良反应。

