微塑料PVC与磺胺甲恶唑联合暴露大型溞引发的急慢性毒理效应
修文洁 闫 淼 顾冀海, 柳峰松, 张玉明,
(1.河北大学生命科学学院, 保定 071002; 2.河北省动物系统学与应用重点实验室, 保定 071002)
塑料产品广泛应用于工业、农业、物流交通等诸多领域, 塑料污染已成为当代最重要的环境问题之一。环境中的废弃塑料在紫外线、机械剪切力等理化作用下不断破碎与降解, 最终形成微塑料[1]。常见微塑料类型有聚氯乙烯(Polyvinyl chloride,PVC)、聚乙烯(Polyethylene, PE)、聚苯乙烯(Polystyrene, PS)、聚丙烯(Polypropylene, PP)、聚酰胺(Polyamide, PA)和聚酯类(Polyester)等。塑料污染与人类活动密切相关, 湖泊、河流等水环境已成为微塑料的主要归宿与富集地。水生生物摄食多无选择性, 被误食的微塑料在肠道内累积会影响其正常进食并产生机械损伤, 进而导致机体能量缺乏、运动和繁殖能力损伤, 甚至发生个体死亡现象[2]。微塑料具有的体积小、表面积大、难降解的特点[3],极易吸附环境中其他污染物, 进而对生物体产生联合毒性。例如, 微塑料会促进铜在鲤(Cyprinus carpio)中积累, 造成严重的肝脏毒性[4]。类似的, 微塑料可通过吸附三氯生(Tricolsan), 提高其在斑马鱼(Danio rerio)肠道和肝脏中的积累量[5]。此外, 微塑料和菲(Phenanthrene)联合暴露尖齿胡鲶(Clarias gariepinus)后, 不仅会引起鱼体鳃和肝脏损伤, 而且会导致其生殖基因表达紊乱[6]。在水环境中, 微塑料与其他污染物长期共存互作, 会通过食物链“藻类-浮游动物-鱼类”在不同营养级生物上富集传递,甚至有危害人体健康的生态风险[7]。
PVC塑料广泛用于包装材料、防雨用品、农用育秧膜、电缆绝缘层和建筑业, 是环境中赋存量最大的微塑料种类之一。PVC微塑料不仅会对双齿围沙蚕(Perinereis aibuhitensis)[8]和蛋白核小球藻(Chlorella pyrenoidosa)[9]等水生生物产生直接毒害,而且能作为载体, 携带其他环境污染物进入生物体内, 产生更为复杂的毒性效应与生态风险。此外,随着我国社会经济的迅速发展, 抗生素的使用量日益增加。除了作为医疗处方药物, 抗生素还作为兽药在畜牧业和水产养殖业中广泛应用[10]。并且, 抗生素生物利用度不高, 大部分药物会随着人体或动物的尿液和粪便排出体外, 进一步随着雨水与市政废水进入水体环境[11]。磺胺甲恶唑(Sulfamethoxazole, SMZ)是典型的磺胺类抗生素, 可竞争性抑制细菌二氢叶酸合成酶, 发挥抗菌作用。SMZ具有生产成本低、抗菌谱广等特点, 除了用于治疗细菌性感染疾病之外, 还曾作为饲料添加剂大量用于畜牧和水产养殖[12]。SMZ化学结构稳定、环境赋存量大, 是水产养殖等淡水环境中检出率最高的抗生素之一[12]。已有多项研究证实SMZ可对水生生物产生毒性与器官损伤, 包括氧化应激[13]、胚胎毒性[14]、遗传毒性[15]和神经毒性[16], 以及破坏肠道菌群平衡[17]等。由于SMZ在水体环境中频繁检出, 且毒性效应涉及面广, 其相关毒理学研究与生态风险评估亟待开展。
目前, 微塑料与其他污染物联合毒性的研究多集中在重金属和农药等传统污染物上[18,19]。微塑料和抗生素在淡水环境中普遍存在, 但是二者的联合毒性效应研究十分有限, 微塑料对抗生素的毒性呈现“增强”或“减弱”效应亟待澄清。剂量效应关系是评价污染物毒性的核心。与高剂量、短期、单独暴露相比, 使用环境相关浓度污染物进行长期、联合暴露研究更具现实意义。虽然微塑料和抗生素实际环境浓度并不高, 但是可能会通过吸附互作, 在环境或生物体内积累、迁移和转化; 甚至会通过食物链传递, 引发环境与健康风险。因此,研究环境相关浓度两类污染物共暴露引发的毒理效应十分必要。浮游动物在水环境物质循环和能量传递过程中发挥重要作用, 同时也影响污染物在食物链中的迁移转化。大型溞(Daphnia magna)以浮游植物、藻类和细菌等生物为食, 同时又是鱼类和其他水生动物的食物。大型溞是我国质量监督检验检疫总局官方认定的污染物评估模式生物, 同时也是生态毒理学领域的重要模式生物[20]。此外,大型溞虫体透明、饲喂简单、繁殖能力强, 是开展微塑料研究的良好实验物种。鉴于此, 本研究选取PVC和SMZ为微塑料、抗生素的典型代表材料, 探讨二者相互作用与联合毒性效应, 关注其对大型溞生长生殖、氧化应激、肠道和运动能力的影响, 以期为SMZ和PVC共存下引发的环境和生态风险评估提供理论依据。
1 材料与方法
1.1 实验材料
PVC微塑料(下文简称PVC)购自东莞市华创塑化有限公司。为确定该微塑料粒径, 本研究借助扫描电镜(JSM-IT500, Jeol, Japan)观察, 并统计其粒径分布。进行毒理学暴露实验时, 用蒸馏水配制成1 g/L的PVC母液。
SMZ(分子式C10H11N3O3S, 纯度≥98.0%, CAS号723-46-6)购自上海麦克林生化科技有限公司。由于SMZ水溶性不佳, 本研究选用二甲基亚砜(Dimethyl sulfoxide, DMSO)作为助溶剂。参照文献[21]描述方法, 使用高效液相色谱仪(LC20, Shimadzu,Japan)检测溶液中SMZ浓度。
1.2 PVC与SMZ的吸附作用
为了研究PVC与SMZ的相互作用, 参照文献[22]描述方法, 考察水溶液中PVC对SMZ的吸附能力。在本吸附实验中, 温度均为(23.0±1.0)℃。首先, 考察PVC (20 mg/L)对SMZ (20 mg/L)的吸附动力学。然后, 配置不同浓度(4—30 mg/L)的SMZ溶液, 加入终浓度为20 mg/L的PVC, 在150 r/min振荡12h后, 检测溶液中SMZ浓度, 绘制吸附等温线。在吸附平衡后, 使用傅立叶红外光谱仪(FTS-40, Bio-Rad, USA)测定PVC表面官能团变化, 仪器的分辨率设定为2/cm, 扫描的波数范围为400—4000/cm。PVC与SMZ的吸附作用实验中, 助溶剂DMSO的终浓度为0.1% (w/v)。
1.3 大型溞饲喂与急/慢性毒理实验
大型溞饲喂大型溞的养殖与饲喂参考本实验室前期报道[12], 培养基为M4, 培养温度为(23.0±1.0)℃, 光周期为14L∶10D, 培养密度为50只/L, 食物为蛋白核小球藻(C.pyrenoidosa)。培养过程为半静态, 即每2d更换50%的培养基。毒理学实验所用大型溞为出生<24h的幼溞, 并且幼溞需要活动灵敏、体型均一。
急性毒理实验依据经济合作与发展组织(Organization for economic co-operation and development, OECD)推荐的方法[23], 首先对大型溞进行48h的急性毒性实验。本实验设置对照组、PVC单独暴露实验组(1 mg/L)、SMZ暴露实验组(浓度范围50—270 mg/L); 同时, 在SMZ暴露组中添加终浓度为1 mg/L的PVC, 即形成SMZ+PVC联合暴露实验组。在实验中, 将幼溞置于装有100 mL M4培养基的烧杯中, 每个烧杯养殖20只幼溞。在48h后, 轻微晃动烧杯, 不能游动的幼溞认为死亡。上述所有对照与实验组培养液中均含有0.1% (w/v)的DMSO,每个实验组均设置3个平行, 重复3次。参照文献[24],计算SMZ与PVC联合作用类型。同时, 在48h急性毒理实验后, 对大型溞体内PVC和SMZ含量进行检测。大型溞体内PVC微塑料含量参照报道方法[25]计数; 48h急性毒理暴露后的大型溞经洗涤、研磨、离心(10000×g, 10min)后, 取上清液进行SMZ浓度检测。大型溞体内PVC和SMZ浓度测定时, 每个实验组设置3个平行, 重复3次。为降低培养液中PVC沉降带来的实验误差, 每12h手动摇晃大型溞培养瓶1次。
21d慢性毒理实验依据OECD推荐的大型溞慢性毒理实验方法[23]开展21d慢性毒理试验, 考察PVC和SMZ对大型溞生长繁殖的影响。PVC的浓度固定为1 mg/L, SMZ暴露浓度为10、100和1000 μg/L, 实验组与对照组中含有0.01% (w/v)的DMSO。在21d慢性毒理试验中, 对照及实验组均设置10个平行, 每个平行1只幼溞。幼溞置于50 mL M4培养基, 其中添加设定浓度的PVC或/和SMZ。参照文献[26], 统计大型溞存活率、蜕皮数和生殖数, 每7d在体视镜(M205A, Leica, Germany)下测量其体长, 直至21d实验结束。为降低培养液中PVC沉降带来的实验误差, 每12h手动摇晃大型溞培养瓶1次。
1.4 氧化应激指标测定与肠道染色
检测经PVC或/和SMZ暴露21d后的大型溞体内3个氧化应激标志物水平: 丙二醛(Malondialdehyde, MDA)含量、超氧化物歧化酶(Superoxide dismutase, SOD)活性和谷胱甘肽S转移酶(Glutathione s-transferase, GST)。本研究均使用南京建成生物研究所试剂盒检测MDA、SOD和GST含量/活性,商品货号分别为A003-1-1、A001-1-1和A004-1-1,测定方法均严格依照试剂盒说明书操作, 检测原理如下: MDA为自由基攻击生物膜等脂类物质的终产物, MDA可与硫代巴比妥酸(Thibabituric acid)缩合形成红色产物, 可通过532 nm处检测其浓度来反馈MDA含量。超氧阴离子自由基会氧化羟胺形成亚硝酸盐; SOD能清除超氧阴离子自由基, 亚硝酸盐的浓度与SOD的活性呈反比, 可根据亚硝酸盐浓度(显色法测定532 nm吸光值)以反馈SOD酶活。GST具有催化还原型谷胱甘肽(Glutathione, GSH)与1-氯-2, 4-二硝基苯(1-chloro-2, 4-dinitrobenzene)结合的能力, 反应体系中GSH与GST酶活呈反比关系; 因此, 可通过显色法在412 nm处测定GSH浓度以反馈GST酶活性。检测MDA、SOD和GST时, 大型溞样品处理参照本实验室前期报道方法[27], 将暴露21d后的大型溞使用M4培养基短暂洗涤以去除其体表吸附的SMZ和PVC。每个样品取20只大型溞于1.5 mL的离心管中, 按试剂盒说明书要求加入匀浆缓冲液, 研磨充分后以2500 r/min的转速离心10min, 收集上清液。使用Bradford法[28]测定上清液中蛋白质含量, MDA、SOD和GST测定值用蛋白质浓度进行归一化处理。在上述生化指标测定实验中, 每个检测样品使用20只大型溞, 对照组和实验组均设置5个平行重复。
根据本实验室前期报道方法[12], 检测大型溞肠道的组织学变化。取5只暴露21d后的大型溞于EP管中, 固定过夜, 用乙醇梯度脱水, 之后进行透明处理, 再通过浸蜡仪进行渗透, 最后用纯石蜡将大型溞包埋。使用石蜡切片机在大型溞中肠部位切片, 干燥5h后进行苏木精-伊红染色, 并用中性树脂封片, 然后在显微镜下对切片观察并拍照。
1.5 运动行为测定
根据我们前期报道的方法[12]进行大型溞行为学检测。将对照组和经污染物暴露21d的大型溞置于6孔板中, 每孔放入1只大型溞, 内含2 mL M4培养液。使用数码摄像机(EOS450D, Canon, Japan)录制大型溞运动视频, 借助软件Kinovea (Ver.9.4,Joan Charmant & Kinovea, https://www.kinovea.org/,USA)分析视频, 计算其运动速度, 并使用软件Ctrax(Ver.0.518, Caltech, http://ctrax.sourceforge.net/, USA)生成运动轨迹。在运动行为测定实验中, 每个实验组设置5次平行。
1.6 数据分析
利 用Excel (Ver.2019, Microsoft, https://www.microsoft.com/zh-cn/, USA)和SPSS (Ver.20.0, IBM,http://www-01.ibm.com/software/analytics/spss/,USA)软件对实验数据进行数据分析, 数据结果采用平均值(mean)±标准差(Standard deviation, SD)表示。实验数据首先进行正态性检验, 如果通过检验,两个独立样本(SMZ组与SMZ+PVC组)之间显著性比较采用Student’st-text进行分析, 显著性用星号表示(*表示P<0.05, **表示P<0.01); 使用单因素方程分析(one-way ANOVA)比较SMZ组或SMZ+PVC组内的数据差异, 并进行Duncan多重比较检验, 不同大写字母(A、B和 C)表示SMZ组内的显著差异(P<0.05), 不同小写字母(a、b和c)表示SMZ+PVC组间的显著差异(P<0.05)。
2 结果
2.1 PVC与SMZ的相互作用
本研究所用PVC微塑料呈规则球形(图1a), 粒径分布于0.03—2.32 μm, 平均粒径为(0.65±0.32) μm,颗粒多集中在0.2—0.8 μm (图1b)。图1c是PVC与SMZ的吸附动力学曲线: 吸附开始时(0—2h), PVC对SMZ的吸附速率快, 吸附量增加也较快; 随着反应进行到6h, 吸附量增长缓慢; 反应至10h时, 吸附逐渐饱和并趋于平衡。
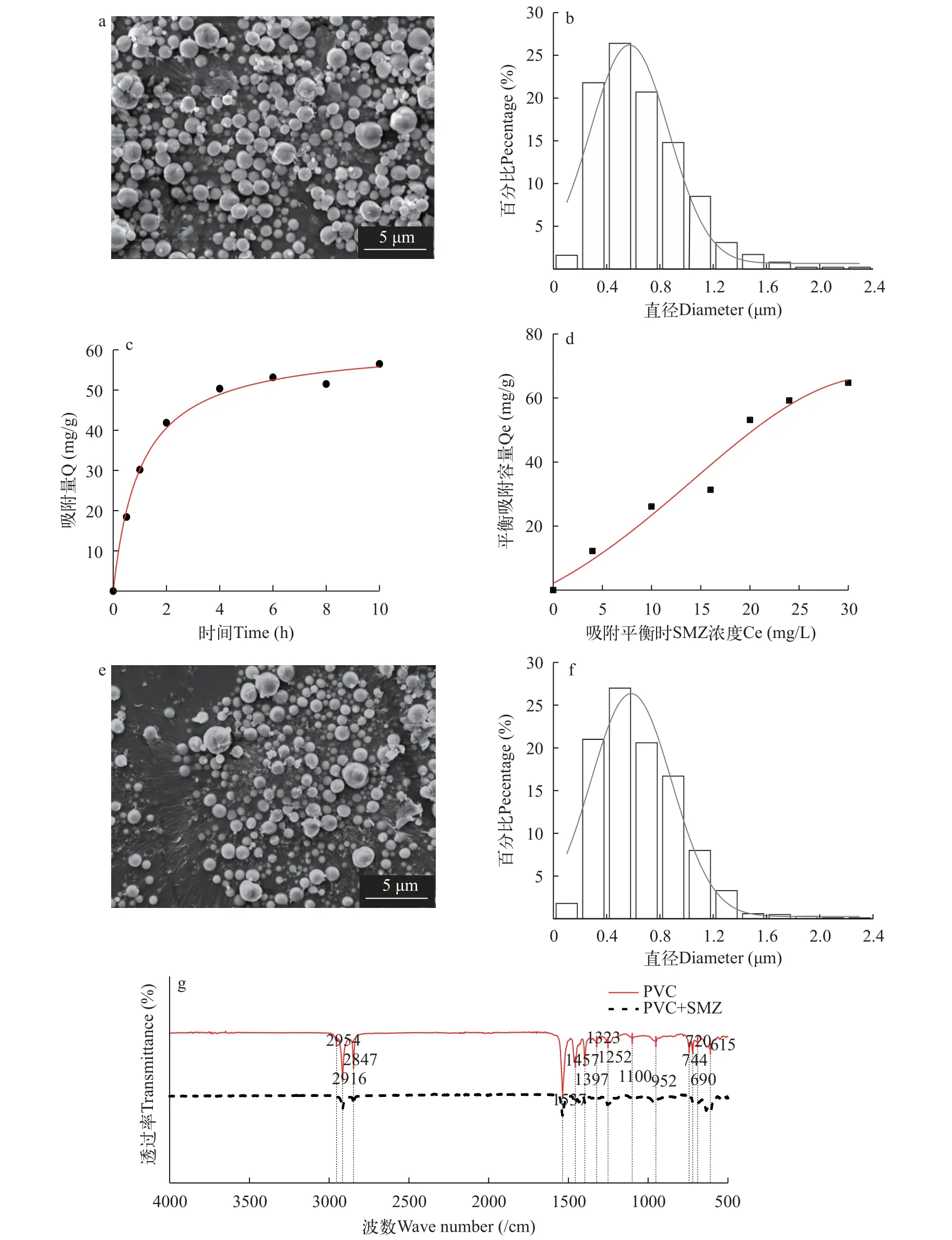
图1 PVC微塑料的表征及其与SMZ吸附作用Fig.1 Characterization of PVC particles and adsorption between PVC and SMZ
为了进一步明确PVC对SMZ的吸附特性, 本研究测定了PVC对SMZ的吸附等温线。如图1d所示,随着溶液中SMZ浓度升高, 平衡吸附量呈线性增长。在吸附平衡后, 我们将PVC从溶液中分离、干燥处理后, 使用扫描电子显微镜和红外光谱仪表征其形态与化学基团变化, 并统计其粒径分布。如图1e所示, 在PVC吸附SMZ处理后, 颗粒表面形貌无明显变化。粒径统计结果(图1f)显示, 充分吸附SMZ后的PVC粒径分布于0.07—2.22 μm, 平均粒径为(0.65 ± 0.31) μm, 颗粒多集中在0.2—0.8 μm。红外光谱结果(图1g)显示, PVC与SMZ充分吸附后未出现新官能团峰, 且615/cm处C—Cl伸缩振动特征峰未偏移, 表明二者未发生化学吸附。
2.2 PVC缓解了SMZ对大型溞的致死效应(48h急性毒理实验)
结果显示, SMZ对大型溞的48h急性毒性EC50(48h)为131.2 mg/L; 1 mg/L的PVC与不同浓度SMZ联合暴露时, 对大型溞的EC50(48h)为156.9 mg/L,这表明PVC减轻了SMZ的毒性。图2a显示, SMZ与1 mg/L的PVC共存时, 与单独SMZ暴露实验组相比,大型溞致死率下降, 且在120、150和270 mg/L实验组时存在统计学差异。
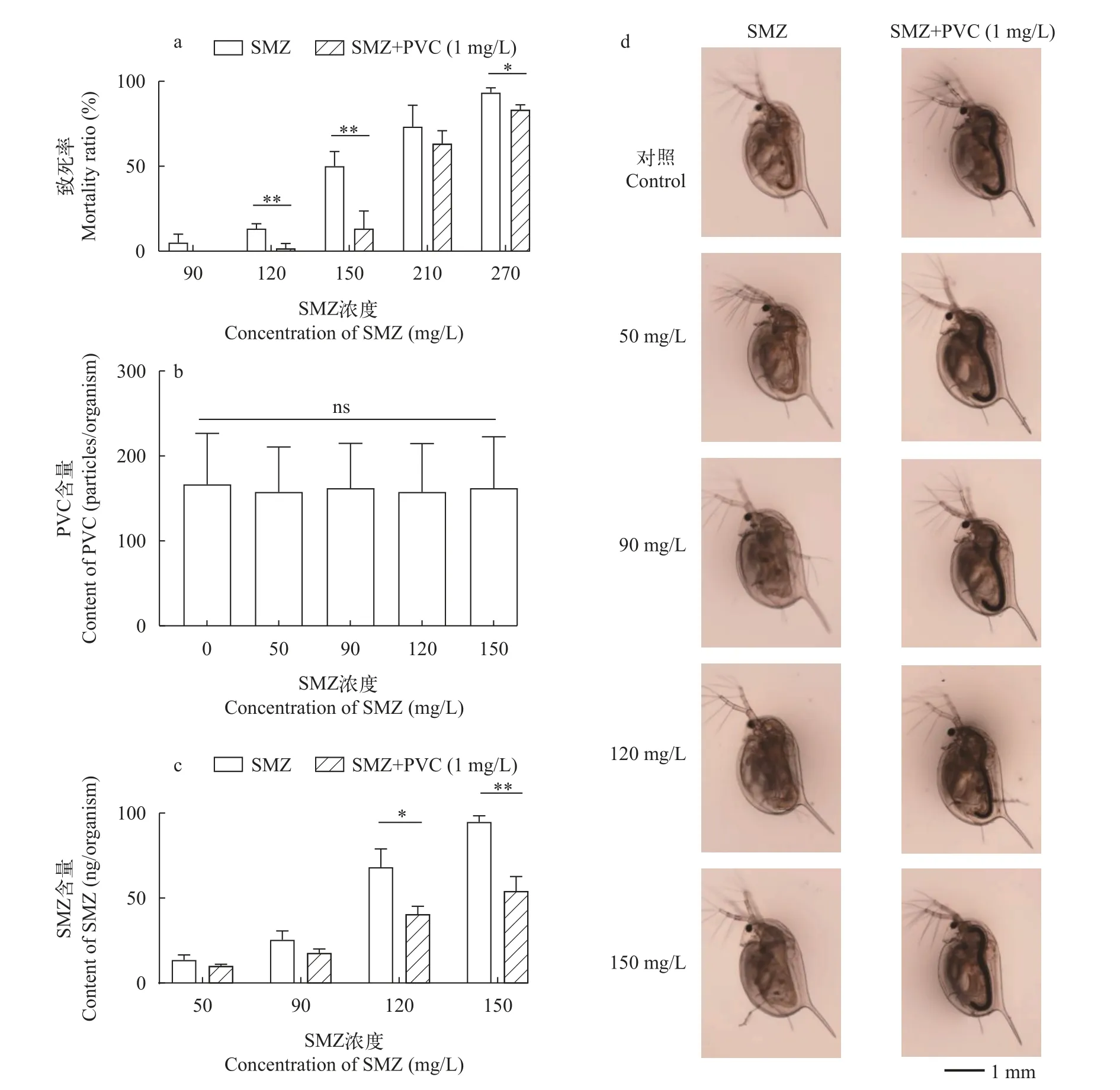
图2 SMZ单独或与PVC联合暴露大型溞的48h急性毒理实验Fig.2 48h acute toxicity test of SMZ or SMZ+PVC exposure to D.magna
图2b显示, SMZ的存在没有影响大型溞对PVC的摄入。图2c显示, 1 mg/L的PVC与SMZ共同暴露时, 降低了大型溞体内SMZ的含量, 且在120和150 mg/L实验组中存在显著差异(P<0.05)和极显著差异(P<0.01)。通过光学显微镜观测(图2d), 我们发现SMZ+PVC共同暴露实验组的大型溞肠道内均有PVC存在, 且与SMZ浓度无明显相关性, 该结果与大型溞体内PVC计数结果(图2b)一致。
2.3 SMZ+PVC对大型溞生长和生殖的毒性效应(21d慢性毒理实验)
图3显示了SMZ或SMZ+PVC暴露21d对大型溞的生长发育及生殖能力的影响。虽然SMZ与PVC单独或联合暴露对大型溞存活率(图3a)与蜕皮次数无显著影响(图3b), 但是PVC会减缓10 μg/L SMZ对大型溞体长的促进作用(P<0.01; 图3c)。总产卵量计数结果(图3d)显示, SMZ对大型溞产卵量影响存在非典型剂量效应关系。与对照组相比, PVC与SMZ联合暴露显著提升了100 μg/L (P<0.001)和1000 μg/L (P<0.05)浓度SMZ暴露组中大型溞的产卵量(图3d)。综上, 在21d毒理学实验中, PVC和SMZ的存在对大型溞存活率和蜕皮数没有影响; 值得注意的是, 对于大型溞的体长和产卵量而言, PVC具有减轻SMZ毒性的效果。
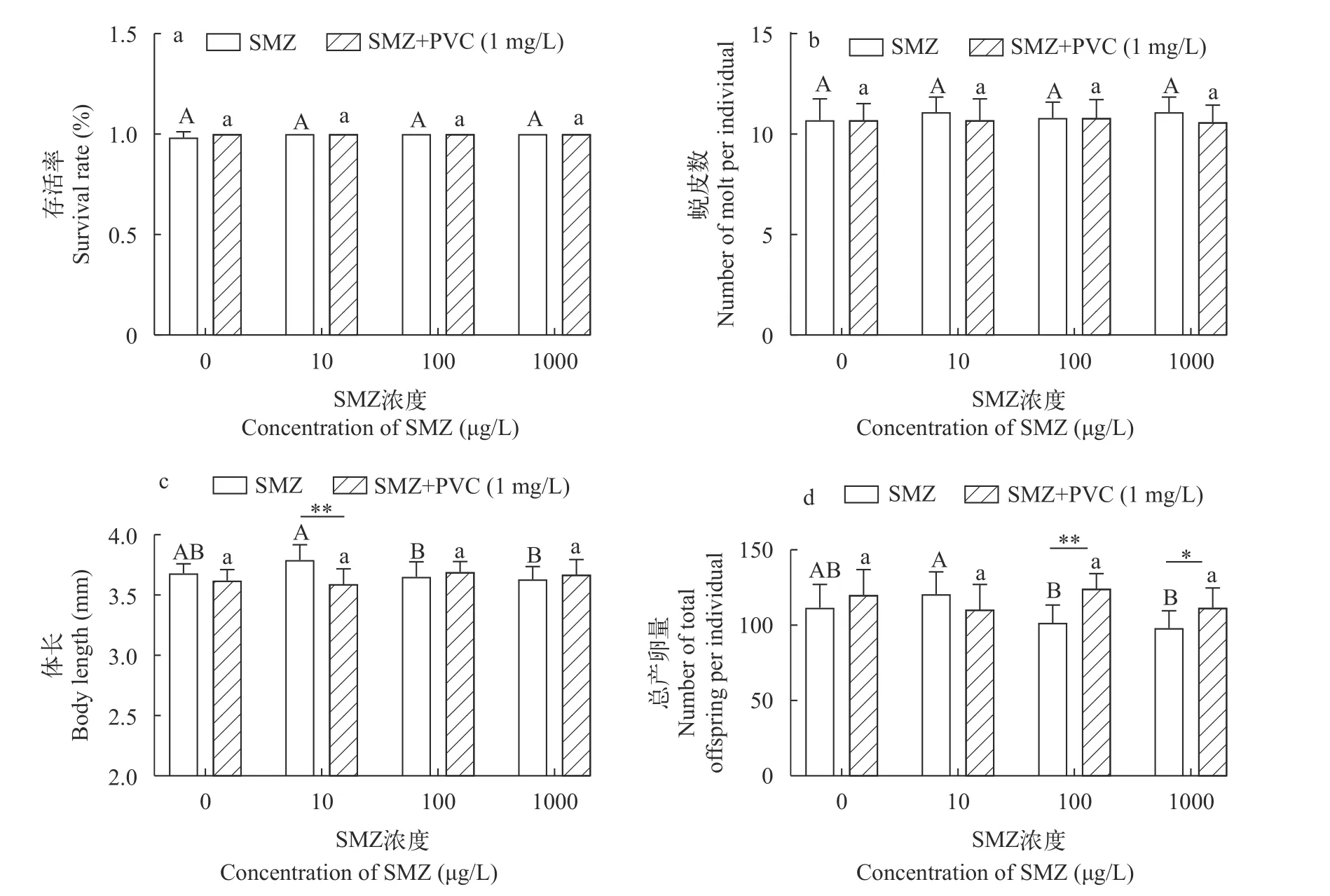
图3 SMZ单独或与PVC联合暴露(21d)对大型溞存活、蜕皮和生长繁殖能力的影响Fig.3 Effects of SMZ or SMZ+PVC exposure on mortality, molt, body length, and reproduction of D.magna
2.4 PVC与SMZ联合暴露诱发大型溞氧化应激和肠道损伤(21d急性毒理实验)
为了探究污染物单独或者联合暴露是否会引起大型溞氧化应激, 我们检测了MDA、SOD和GST三个生物标志物的水平变化。如图4a显示, SMZ单独暴露或者SMZ+PVC联合暴露会使MDA含量呈浓度依赖性升高, 在高浓度SMZ暴露剂量时, 呈现统计学差异(P<0.05); PVC的存在加剧了MDA的诱导产生(P<0.05)。图4b显示, 1000 μg/L高剂量的SMZ暴露显著降低了大型溞体内SOD酶活性(P<0.05); 在PVC与SMZ共同暴露时, 污染物对SOD活性的影响更为显著(PVC+100 μg/L SMZ; PVC+1000 μg/L SMZ;P<0.05)。图4c显示, 虽然SMZ单独暴露对GST活性无显著影响, 但是PVC与SMZ联合暴露会导致GST活性呈浓度依赖性降低(PVC+1000 μg/L SMZ,P<0.05), 即PVC的加入显著加重了SMZ对GS0T活性的抑制。
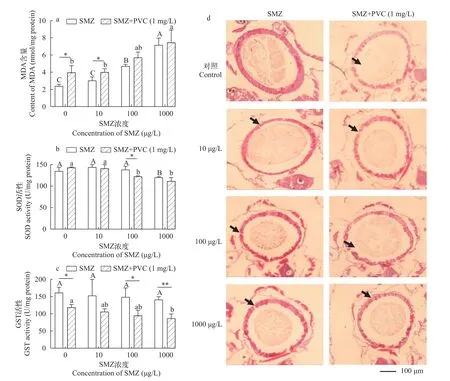
图4 SMZ单独或与PVC联合暴露(21d)大型溞导致氧化应激和肠道损伤Fig.4 SMZ or SMZ+PVC exposure induces oxidative stress and intestinal structure damage of D.magna
为了考察SMZ单独暴露或SMZ+PVC联合暴露对大型溞肠道健康影响, 我们对污染物暴露21d后的大型溞的中肠部位的切片进行观察。如图4d所示, 对照组中大型溞的肠道结构完整, 上皮细胞排列紧密有序, 肠道横切面呈光滑的圆形。随着SMZ暴露剂量的增加, 大型溞肠道组织出现明显的损伤, 上皮细胞间界限模糊且略显松散, 纹状缘模糊, 部分细胞间甚至发生断裂, 出现空泡化现象; 并且, 损伤程度与SMZ浓度呈现依赖效应。值得指出的是, 与单独SMZ暴露组相比, SMZ和PVC联合暴露后, 大型溞的肠道损伤更为明显, 即PVC的存在加重了SMZ对大型溞的肠道损伤效应。
2.5 PVC与SMZ联合暴露诱发大型溞运动损伤(21d慢性毒理实验)
如图5a显示, SMZ单独暴露导致大型溞运动速度呈浓度依赖性降低(100及1000 μg/L SMZ;P<0.05)。PVC与SMZ联合暴露大型溞也显示出类似的效果,且PVC的加入导致大型溞的运动速度均出现下降趋势, 其中2个联合暴露组(SMZ+PVC 10 μg/L及SMZ+PVC 100 μg/L)中出现显著性差异(P<0.05)。我们将SMZ单独暴露和SMZ+PVC联合暴露各实验组中大型溞的代表性运动轨迹进行分析。如图5b所示, 对照组中大型溞运动轨迹平滑且较为均匀的分布于孔板各个位置。在SMZ暴露后, 大型溞运动轨迹出现停滞和原地转动的现象, 且运动轨迹局限于孔板的某一范围, 并且上述现象随着SMZ暴露剂量的增加更为明显。值得指出的是, 1 mg/L的PVC存在会加重各个剂量SMZ引发的大型溞运动损伤。
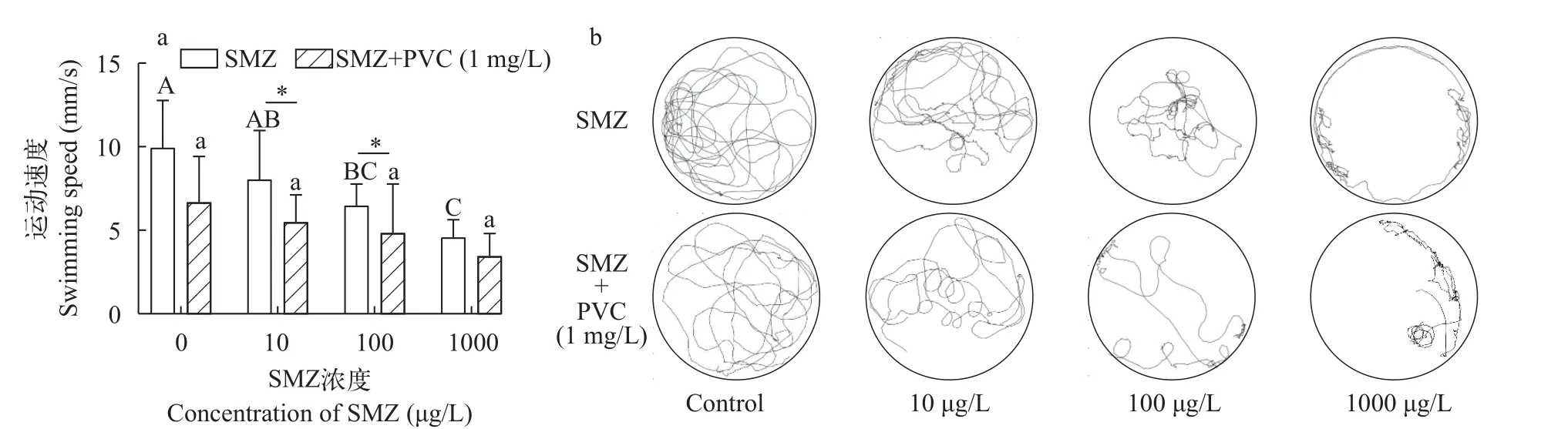
图5 SMZ单独或与PVC联合暴露(21d)对大型溞运动能力的影响Fig.5 Effects of SMZ or SMZ+PVC exposure on the swimming behavior of D.magna
3 讨论
3.1 污染物暴露浓度的选择
微塑料和抗生素在环境中长期共存, 研究二者的相互作用与联合毒性十分必要。抗生素SMZ使用剂量大、半衰期长, 在水体中检出率高。SMZ在一般淡水环境中的浓度为ng/L到μg/L范围, 在高污染水域中其浓度可达上百μg/L。例如, 越南河内附近的医药和养殖废水中SMZ浓度为252 μg/L[29]; 我国桂林会仙喀斯特湿地环境中, SMZ的环境浓度可达到51.14 μg/L[30]。微塑料的环境浓度一般在μg/L到mg/L范围内[7], 在人类活动密集的河流中微塑料的检出率高, 赋存量甚至高于10 mg/L[31]。因此, 很多学者选择mg/L级别的微塑料进行毒性效应研究, 研究物种涉及鲤[4]、大型溞[32]和珊瑚(Tubastrea aurea)[33]。基于SMZ和微塑料环境相关浓度, 以及我们的前期研究基础[13], 本研究选择1 mg/L和10—1000 μg/L作为PVC和SMZ的暴露浓度, 考察两种污染物对大型溞的联合毒性。
3.2 SMZ和PVC的体外吸附研究
为了研究PVC对SMZ的吸附作用, 我们首先开展了吸附动力学和吸附等温线实验。吸附动力学曲线显示(图1c), SMZ从水相向PVC表面扩散速度很快(10h可达到吸附平衡), 说明二者吸附能力强。这种现象与PVC吸附环丙沙星的过程类似[34]。PVC对SMZ的亲和力较大, 吸附等温线呈线性增长模式(图1d), 推测二者的互作机制为疏水分配作用和范德华力[35]。本研究吸附等温线结果与文献中PVC吸附四环素[36]和环丙沙星[37]的过程类似。此外, PVC吸附SMZ前后的表面形态、粒径大小和红外光谱结果无明显变化。因此, 我们判断二者的吸附类型为物理吸附。Xu等[38]的研究也发现SMZ与PE微塑料会发生物理吸附, 范德华力和疏水键是二者吸附的主要作用力。当然, 确定PVC对SMZ吸附官能团及吸附模型等机制问题还需要借助X射线光电子能谱仪、傅里叶变换红外光谱仪等技术手段进一步确定。值得指出的是, 文献显示PVC对左氧氟沙星[3]、阿莫西林[39]、四环素[36]和环丙沙星[37]等抗生素均存在吸附作用。基于文献和本研究结果, 我们认为PVC与SMZ会在水环境和生物体中吸附互作, 从而产生复杂的生物毒性。因此, 二者共存时的生物毒性研究亟待开展。
3.3 SMZ和PVC联合暴露对大型溞生长和生殖的影响
急性毒性实验是评价化学品安全性的首选方法。本研究显示, 1 mg/L的PVC会降低SMZ对大型溞的致死率(图2a)。通过显微镜观察和微塑料颗粒计数, 我们发现PVC积累于大型溞肠道内(图2b和2d)。并且, SMZ+PVC联合暴露组中大型溞体内的SMZ浓度显著低于SMZ单独暴露组(图2c)。经微塑料与SMZ联合暴露的罗非鱼[40]和小鼠[41]也存在类似结果, 即微塑料的存在会降低SMZ在生物体中的积累。日本虎斑猛水蚤(Tigriopus japonicus)相关研究[26]也显示, 96h急性毒理实验时, PS微塑料会通过吸附邻苯二甲酸二丁酯(Dibutyl phthalate, DBP)而降低其生物利用度, 展现出减弱DBP毒性的生物效应。本研究推测PVC对SMZ毒性的减弱是由于积累于大型溞肠道内的微塑料将SMZ吸附固定, 使得生物体内“有效”SMZ浓度下降, 进而减弱了抗生素毒性。本文认为, 该生物毒性效应与PVC能快速吸附SMZ的研究结果是可相互印证的。
剂量效应是研究污染物毒性的关键因素。实际上, 暴露剂量是污染物浓度和暴露时间的双重效应加和结果。虽然PVC在48h急性毒理实验中可以降低SMZ对大型溞的致死效应, 但是PVC与SMZ的长期暴露毒性效应还需要进一步证实。与急性毒理实验相比, 慢性毒理实验中污染物暴露浓度设置更接近于环境相关浓度, 研究结果更能反映真实生态风险。尤其是, 慢性毒理实验可以考察污染物的遗传毒性、免疫毒性和运动损伤等指标, 更适合微塑料、抗生素等低毒物质的生态风险评价。李勤等[42]研究发现, 虽然12.5 mg/L的PVC微塑料对大型溞心率、摄食和抗氧化酶活性无影响, 但是其子代会出现体长变短、发育畸形等现象。因此, 本研究选择了环境相关浓度PVC和SMZ开展21d慢性毒理实验, 从生长生殖、氧化应激、肠道生理和运动行为角度进一步探究二者的联合毒性。结果显示, 虽然SMZ单独或者与PVC联合暴露均没有影响大型溞致死率、蜕皮数、体长和产卵量; 但是, 对于大型溞的体长和产卵量而言, PVC具有减轻SMZ毒性的效果(图3)。这与PS微塑料和磺胺二甲基嘧啶(Sulfamethazine)联合暴露海洋青鳉(Oryzias melastigma)的研究结果相似, 即微塑料不仅对生物体发育与生殖无影响, 并且会减弱抗生素的生殖毒性[43]。
3.4 SMZ和PVC联合暴露引发大型溞氧化应激、肠道损伤和运动障碍
与生长、生殖等生物学指标相比, 大型溞的抗氧化系统对污染物的毒性反馈更为敏感[44]。MDA、SOD和GST均是公认的氧化应激生物标志物。当生物体遭受外界环境胁迫时, 通常会诱导活性氧自由基爆发, 导致细胞内的多聚不饱和脂肪酸受损产生MDA[45]。SOD的生物功能是清除活性氧自由基,其活力下降代表机体抗氧化能力降低[46]。GST可通过修复自由基引起的膜磷脂损伤、抑制微粒体过氧化反应等途径发挥抗氧化作用, 并参与生物体解毒功能[47]。方海燕等[48]研究发现PVC微塑料暴露可以显著上调大型溞SOD基因表达量。也有报道显示, SMZ暴露诱发斑马鱼等水生生物产生氧化应激[49]。本研究发现, SMZ单独或SMZ+PVC联合暴露21d后, 均会引发大型溞氧化应激; 并且, PVC会加剧SMZ诱发的氧化损伤(图4)。与48h急性毒理实验不同, PVC和SMZ的叠加毒性效应在21d实验中逐渐展现出来。结合PVC与SMZ的吸附效应分析, 长期积累于大型溞体内的PVC颗粒可能发挥了富集水体中SMZ的作用。由此推测, 大型溞的抗氧化系统难以及时清除体内的活性氧自由基, 污染物诱导产生的氧化损伤可能会进一步影响其营养吸收和生理代谢。
大型溞的中肠是分泌消化酶和吸收营养的重要器官, 肠道结构完整性是其发挥生理功能的基础[50]。作为滤食性生物, 大型溞的肠道是微塑料攻击的首要器官[7]。此外, 水环境中的抗生素也会不断进入大型溞肠道, 破坏肠道菌群平衡, 间接损伤肠道稳态。实际上, 除了大型溞, 微塑料对水生生物肠道功能破坏十分普遍, 涉及肠道结构受损[51]、肠道炎症[52]等。例如, 盛诚等[5]发现PVC微塑料会加重抗菌剂三氯生对斑马鱼肠道的损伤。本研究发现, SMZ单独暴露会引起大型溞肠道结构损伤,SMZ+PVC联合暴露会加剧大型溞肠道损伤, 甚至导致肠道上皮细胞间发生断裂和空泡化(图4d)。基于本研究PVC对SMZ物理吸附结果, 推测积累于大型溞消化道中的PVC会持续吸附培养液中的SMZ, 进而增多SMZ在肠道的摄入与积累量, 造成两种污染物在大型溞肠道局部“强化”暴露, 导致SMZ+PVC联合毒性效应叠加。虽然微塑料和抗生素单独暴露引发生物体肠道损伤的研究很多, 但是长期暴露下微塑料加剧抗生素肠道毒性的报道并不多见, 该联合毒性效应需引起关注。
生物体需要摄取能量以应对污染物胁迫。我们推测, 积累于肠道的PVC可能会导致大型溞虚假性饱腹感。并且, SMZ+PVC联合暴露引发的肠道损伤会直接降低大型溞营养吸收, 造成能量供应不足。实验动物的运动行为可直观地反馈生物体的能量代谢水平, 该指标已成为评估污染物的毒性效应的有效手段[53]。本研究发现, SMZ单独或SMZ+PVC联合暴露大型溞21d后, 都会引发大型溞游泳速度下降; 并且, SMZ+PVC联合暴露增强了该毒性效应(图5)。本研究认为, SMZ暴露引起大型溞运动能力速度下降, 与能量供给不足密切相关。在PVC与SMZ共存时, 严重的肠道损伤更为降低大型溞的能量摄取。此外, PVC吸附SMZ产生的氧化损伤会干扰大型溞免疫和代谢调控, 进而引起运动行为受损。有研究表明, PE微塑料-苯并芘(Benzopyrene)联合暴露会导致海洋青鳉幼鱼游泳速度降低[54]; 微塑料-汞联合暴露也会影响欧洲鲈(Dicentrarchus labrax)的运动行为, 甚至出现昏睡和倒立游泳等现象[55]。大型溞是淡水环境食物链中重要组成部分,积累于大型溞肠道中的微塑料和抗生素会随食物链传递与富集。在长期暴露时, 本研究所展示的PVC对SMZ肠道毒性、氧化应激和运动损伤的增敏效应不容忽视, 二者共存所产生的生态毒理风险需引起足够重视。
抗生素与微塑料在水环境中长期共存, 两类污染物的生态风险与毒性效应评估已引起学者关注。然而, 二者的联合毒性效应报道不一: 微塑料减弱或者增强抗生素毒性均有报道。例如, PS微塑料会加重四环素对草鱼(Ctenopharyngodon idella)肠道和鳃组织损伤[56]。Fonte等[57]也发现, PE微塑料会加重头孢氨苄对虾虎鱼(Pomatoschistusmicrops)的神经毒性和氧化损伤。相反,Y u等[14]将PS微塑料和土霉素联合暴露斑马鱼, 观察到微塑料会减轻土霉素引起的肠道损伤,且大粒径微塑料对抗生素的毒性缓解作用更大。类似的,Guo等[58]在底栖生物河蚬(Corbicula fluminea)的研究中也显示出PS微塑料可减轻环丙沙星的生物毒性。本文推测,微塑料会通过肠道损伤,增加生物体对污染物的摄入[59];相反, 微塑料也能通过吸附作用,改变生物体对污染物的可利用性[60]。结合本研究结果发现微塑料-抗生素对于生物体的毒害可能受污染物剂量效应、微塑料粒径效应和受试物种差异等多方面因素影响, 该科学问题需要从毒理学、环境化学、生物化学、分子生物学和肠道微生物学等多学科、多角度探究。尤其是, 使用环境相关浓度污染物对生物体进行长期、多世代暴露研究更具现实意义。总之, 微塑料和抗生素的联合毒性效应复杂而多变, 相关毒性机制还有待深入阐述。

