莱菔硫烷通过下调MAPK/NF-κB 信号通路逆转Aβ纤维介导的M1型小胶质细胞极化和神经炎症介导的神经干细胞程序性坏死
张嘉发,杨灿洪,张淑芬,曹婷婷,彭 瑞,郭蔚泓,严予苹,谢淑婷,彭晓佳,吕田明,黄添容
1南方医科大学第三附属医院神经内科,广东 广州 510630;2广州市南沙区第二人民医院,广东 广州511455
莱菔硫烷(SFN)具有抗氧化、抗癌、抗炎以及治疗退行性疾病的作用[1]。SFN是阿尔兹海默病(AD)早期治疗的候选药物之一[2]。β-淀粉样蛋白(Aβ)过度沉积和神经炎症反应是AD的重要发病机制[3]。小胶质细胞是中枢神经系统(CNS)炎症的关键细胞并影响体内神经干细胞(NSCs)死亡、迁移和分化[4,5]。NSCs在修复CNS过程中发挥重要作用,NSCs的丢失也会降低神经发生和认知发育[6],当体内NSC消耗殆尽时,可能导致AD等许多神经退行性疾病进入失代偿期。C17.2是较为常用的小鼠神经干细胞细胞系。既往研究发现SFN能有效抑制小胶质细胞MAPK/NF-κB信号通路介导的神经炎症进而降低小胶质细胞介导的神经元程序性坏死[7]。但是SFN通过小胶质细胞保护神经干细胞的作用目前还没有直接证据。
由此我们推测,SFN 可能通过在Aβ25-35 纤维(fAβ25-35)激活的BV-2细胞中下调MAPK/NF-κB信号通路逆转M1型小胶质细胞极化以降低小胶质细胞介导的C17.2神经干细胞程序性坏死,从而为SFN用于治疗AD提供新的理论依据。为了验证这一推测,我们将通过体外细胞实验,应用transwell 共培养的方法,对BV-2或C17.2进行细胞活性、流式细胞分析、Western blotting 等实验探讨其中可能的作用机制,旨在探讨SFN用于治疗神经退行性疾病的可行性。
1 材料和方法
1.1 材料
主要试剂:Aβ25-35(上海吉尔生化公司);DMEM 高糖培养基、胎牛血清(FBS)、青霉素-链霉素(10 000 U/mL)、StemPro™、胰蛋白酶/ETDA、p38抑制剂SB203580、bFGF、EGF、SFN、Cell Counting Kit-8(MedChemExpress);多聚赖氨酸(Poly-L-lysine,PLL)、4%多聚甲醛固定液、免疫染色封闭液、免疫染色洗涤液、蛋白酶抑制剂混合物(通用型,100X)、RIPA裂解液(强)、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5X)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天);RNA isolater Total RNA Extraction Reagent、HiScript Q RT SuperMix for qPCR、ChamQ SYBR qPCR Master Mix(南京诺唯赞);小鼠白细胞介素6(IL-6)ELISA科研试剂盒、小鼠肿瘤坏死因子α(TNF-α)ELISA 科研试剂盒(酶免);APC anti-mouse CD16/32 antibody、PE anti-mouse CD206(MMR)antibody(Biolegend);Nestin Rabbit mAb、Doublecortin Rabbit mAb、GFAP Rabbit mAb、Phospho-p38 MAPK XP®Rabbit mAb、Phospho-NF-κB p65 Rabbit mA(CellSignalingTechnology);Anti-Phospho-MLKL antibody、驴抗兔IgG H&L(Alexa Fluor®647)、驴抗鸡IgY H&L(FITC)、GFAP鸡源抗体(abcam)。主要耗材和仪器:Transwell小室(Corning);共聚焦皿(赛宁);超净工作台(苏州净化设备公司);倒置激光共聚焦显微镜LSM 880 with Airyscan(Carl Zeiss);多功能酶标仪(Thermo);实时荧光定量PCR仪(Roche);多维高清流式细胞分析仪(LSRFortessa X-20,BD)。
1.2 fAβ25-35制备
fAβ25-35:将Aβ25-35多肽5 mg溶解于双蒸水中,使其终浓度为1 mmol/L。0.22 μmol/L滤器过滤除去细菌,EP管分装后,于37 ℃细胞培养箱中孵育7 d,形成fAβ25-35,然后储存于-20 ℃冰箱备用。进行细胞药物干预前用相应的无血清培养基将fAβ25-35稀释至所需浓度。
1.3 细胞
BV-2细胞株由南方医科大学司法鉴定中心赠与,使用含有10%FBS的DMEM高糖培养基培养,2~3 d传代。C17.2细胞株从广州欣源生物科技有限公司购买,使用含有10%FBS的DMEM高糖培养基培养,2~3 d传代。
1.4 分组
以不同浓度fAβ25-35和SFN 对BV-2 细胞作用后,检测细胞活性以确定药物浓度。再进行实验分组:溶媒对照组(Con)、Aβ组、Aβ+SFN 组、Aβ+SFN 组、Aβ+SB203580组。SB203580参考既往研究条件使用20 μmol/L浓度作用24 h[7]。进行检测BV-2细胞相关实验时,把BV-2细胞种于孔板中。进行检测NSCs相关实验,BV-2细胞首先种于transwell上室,药物处理后,去除药物上清,再与种有NSCs的孔板组合。细胞比例为BV-2∶NSCs=1∶1,合并后使用无血清高糖培养基:NSC培养基=1∶1对共培养体系进行培养,24 h后提取NSCs蛋白进行检测(图3A)。
1.5 实验方法
1.5.1 CCK8细胞活性检测 药物作用BV-2细胞后,严格遵照Cell Counting Kit-8 说明书,对各组BV-2细胞进行细胞活性检测。
1.5.2 ELISA试验 遵照试剂盒说明书步骤,对BV-2上清进行ELISA 检测以检测上清培养基中的TNF-α和IL-6的含量。
1.5.3 实时荧光定量PCR 按RNA isolater Total RNA Extraction Reagent 试剂盒说明书提取总RNA,检测BV-2细胞RNA浓度,按照HiScript Q RT SuperMix for qPCR和ChamQ SYBR qPCR Master Mix试剂盒说明书步骤进行RT-qPCR。引物由深圳华大基因科技有限公司合成。将目的基因扩增结果经内参校正后,以空白组的目的基因扩增结果作为溶媒对照,2-△△Ct法比较不同样品间mRNA的表达量差异。引物信息见(表1)。
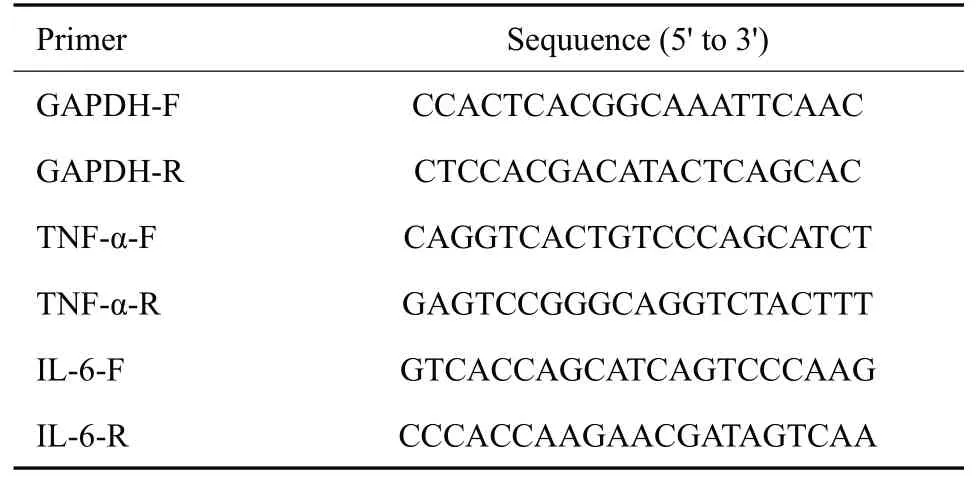
表1 qRT-PCR引物序列Tab.1 Sequences of qRT-PCR primers
1.5.5 流式细胞术 收集BV-2细胞。胰酶消化后,10%FBS DMEM高糖培养基终止消化,离心,加入适当的APC荧光标记的CD16/32(在100 μL体积下,每百万细胞取≤0.25 μg)、黑暗中冰上孵育20 min。PE荧光标记的CD206(在100 μL体积下,每百万细胞取≤0.5µg)。洗涤2 遍。固定、破膜,洗涤2 遍后,PE 荧光标记的CD206(在100 μL体积下,每百万细胞取≤0.5µg)室温孵育20 min。洗涤2遍后,转移至流式上样检测管中,随即在多维高清流式细胞分析仪上进行检测分析。
1.5.6 Western blotting 用4 ℃预冷的PBS缓冲液洗涤板中细胞3次,加入含有蛋白酶抑制剂的RIPA裂解液(强)于冰上裂解10 min。超声5 s,共3次,使细胞充分裂解。4 ℃、12 000 r/min离心10 min,取上清,BCA蛋白浓度测定试剂盒定量后,混合蛋白样品和蛋白上样缓冲液,100 ℃或沸水浴加热3~5 min,以充分变性蛋白。取各组蛋白进行SDS-PAGE电泳分离转膜至PVDF膜上,分别加一抗,用含5%脱脂奶粉封闭后4 ℃孵育缓慢摇动过夜,经TBST洗涤3次,5 min/次;室温用二抗(辣根过氧化物酶标记,稀释比例为1∶2000)孵育1~2 h,TBST清洗后,使用ECL 发光试剂盒曝光,拍照,并进行蛋白定量。
1.6 统计学分析
采用统计分析软件GraphPad Prism 9.0.0,各组数据以均数±标准差表示,多组间比较采用单因素方差分析,对于Western blotting条带半定量分析结果采取配对t检验,P<0.05时认为差异具有统计学意义。
2 结果
2.1 CCK8 法检测fAβ25-35与SFN 对BV-2 细胞活性的影响
不同浓度下fAβ25-35对BV-2细胞作用24 h后,检测细胞活性。与溶媒对照组相比,6.25 μmol/L浓度组细胞活力增加(P<0.01,图1A),≥50 μmol/L浓度组与溶媒对照组相比活力降低(P<0.0001,图1A)。SFN在0~10 μmol/L范围内,对BV-2细胞作用24 h后,无明显差异(P>0.05,图1B)。与溶媒对照组相比,Aβ组细胞活性下降(P<0.0001,图1C);与Aβ组相比,Aβ+SFN组细胞活性显著回升(P<0.0001,图1C)。

图1 CCK8法检测fAβ25-35与SFN对BV-2细胞活性的影响Fig.1 CCK8 assay for assessing the effects of Aβ25-35 and SFN on BV-2 cell viability.A:BV-2 cell viability following treatment with different concentrations of fAβ25-35 for 24 h(**P<0.01,****P<0.0001 vs control group).B:BV-2 cell viability following treatment with different concentrations of SFN for 24 h (*P<0.05,**P<0.01,***P<0.001 vs control group).C:BV-2 cell viability following treatments with vehicle,fAβ25-35(50 μmol/L)and fAβ25-35(50 μmol/L)+SFN(10 μmol/L)for 24 h(****P<0.0001).
2.2 fAβ25-35、SFN和p38抑制剂SB203580对BV-2细胞M1/M2极化的影响
与溶媒对照组相比,Aβ组BV-2细胞IL-6和TNF-α mRNA表达显著升高(P<0.001;P<0.0001);与Aβ组相比,Aβ+SFN 组和Aβ+SB203580 组BV-2 细胞IL-6 和TNF-αmRNA表达显著降低(P<0.001,图2A、B)。Elisa结果显示,与溶媒对照组相比,Aβ组BV-2细胞上清中IL-6和TNF-α浓度显著升高(P<0.001);与Aβ组相比,Aβ+SFN组和Aβ+SB203580组BV-2细胞上清中IL-6和TNF-α浓度显著降低(P<0.01,图2C、D)。流式细胞结果显示,与溶媒对照组相比,Aβ组BV-2细胞的M1型小胶质细胞标志物CD16/32表达显著升高(P<0.05),M2型小胶质细胞标志物CD206表达降低(P<0.05);与Aβ组相比,Aβ+SFN组和Aβ+SB203580组BV-2细胞CD16/32表达降低(P<0.05),CD206表达升高(P<0.01),两组与溶媒对照组比较无显著性差异(图2E~G)。
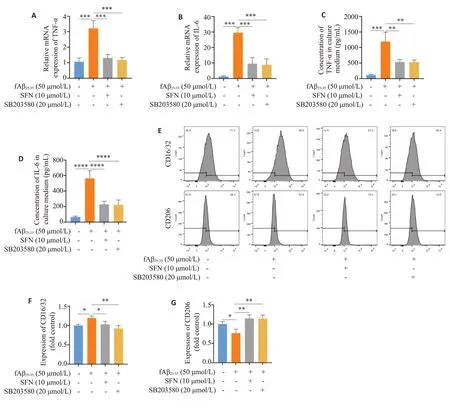
图2 fAβ25-35、SFN和p38抑制剂SB203580对BV-2细胞M1/M2极化的影响Fig.2 Effects of 50 μmol/L fAβ25-35,10 μmol/L SFN and 20 μmol/L SB203580 on M1/M2 polarization in BV-2 cells.A,B:Expression levels of TNF-α and IL-6 mRNA in BV-2 cells treated with vehicle,fAβ25-35,fAβ25-35+SFN,and fAβ25-35+SB203580 for 24 h.C,D:Supernatant TNF-α and IL-6 concentration in BV-2 cell cultures treated with vehicle,fAβ25-35,fAβ25-35+SFN,and fAβ25-35+SB203580 for 24 h.E: Expression levels of CD16/32 and CD206 in BV-2 cells with different treatments analyzed by flow cytometry.F,G: Quantification of CD16/32 and CD206 expressions.*P<0.05,**P<0.01,***P<0.001,****P<0.0001.
2.3 Aβ25-35、SFN 和SB203580 对BV-2 细胞p-p38 和pp65的影响以及对神经干细胞的间接保护作用
与溶媒对照组相比,Aβ组BV-2细胞p-p38和p-p65表达显著升高(P<0.05,图3B、D);与Aβ组相比,Aβ+SFN组和Aβ+SB203580组BV-2细胞p-p38和p-p65表达显著降低(P<0.05,图3B、D)两组与溶媒对照组比较无显著性差异。与溶媒对照组相比,Aβ组C17.2的p-mlkl表达显著升高(P<0.01,图3E、F);与Aβ组相比,Aβ+SFN组和Aβ+SB203580 组C17.2 的p-mlkl 表达显著降低(P<0.01,图3E、F),与溶媒对照组比较无显著性差异。

图3 fAβ25-35、SFN和p38抑制剂SB203580对BV-2细胞p-p38和p-p65的影响以及对C17.2神经干细胞的间接保护作用Fig.3 Effects of 50 μmol/L fAβ25-35,10 μmol/L SFN and 20 μmol/L SB203580 on p-p38 and p-p65 in BV-2 cells and their indirect protective effects on neural stem cells C17.2.A:Protocol of Transwell co-culture assay of BV-2 and C17.2 Cells.B: Protein expression of p-p38 and p-p65 in BV-2 cells with different treatments for 24 h.C,D:Quantification of p-p38 and p-p65.E,F:Protein expression of p-mlkl in C17.2 cells detected by Western blotting.*P<0.05,**P<0.01,***P<0.001.
3 讨论
中国已经成为AD患者最多的国家[8]。2000~2019年,死于中风、心脏病和艾滋病毒的人数有所下降,而死于AD的人数却增加了145%以上。2020年和2021年新冠肺炎大流行可能加剧了AD患者的死亡[9]。AD的诊治是中国老龄化社会正在面对的巨大挑战之一。
Aβ过度沉积和神经炎症反应是AD的主要发病机制之一[3]。Aβ具有不同折叠状态,包括寡聚体、原纤维和纤维等,而过度折叠的Aβ纤维是最终聚集形成Aβ斑块[10]。Aβ纤维长期刺激导致的慢性炎症可能是AD的重要病理机制之一。
小胶质细胞是颅内炎症的关键细胞之一。部分学者认为,小胶质细胞具有M1和M2两种分型[11,12]。研究发现,Aβ可诱导小胶质细胞M1型极化,并释放TNF-α、IL-6等炎症因子[13]。小胶质细胞是中枢神经系统炎症的关键细胞并影响体内NSCs 死亡、迁移和分化[4,5]。NSCs在修复CNS过程中发挥重要作用,NSCs的丢失也会降低神经发生和认知发育[6],当体内NSC消耗殆尽时,可能导致AD等许多神经退行性疾病进入失代偿期。
莱菔硫烷(SFN)具有抗氧化、抗癌、抗炎以及治疗退行性疾病的作用[1]。SFN是AD早期治疗的候选药物之一[2]。既往研究发现SFN 能有效抑制小胶质细胞MAPK/NF-κB信号通路介导的神经炎症进而降低小胶质细胞介导的神经元程序性坏死[7]。但是SFN通过小胶质细胞保护神经干细胞的作用目前还没有直接证据。因此本研究进行了体外细胞实验,运用BV-2 和C17.2细胞共培养技术,探讨SFN作为AD治疗药物的潜在机制。
与既往THP-1细胞相关研究结果一致[13],本研究结果显示,fAβ25-35浓度大于50 μmol/L作用24 h时对BV-2具有毒性作用,但值得注意的是,在6.25 μmol/L浓度作用24 h时存在一个正相峰,呈先高后低的变化趋势,提示fAβ25-35对BV-2细胞存在hormesis效应。hormesis效应是指细胞在受到轻度压力或弱毒性药物时,产生的有益作用的反应[14]。SFN在0~10 μmol/L范围内,对BV-2细胞作用24 h 后,无显著性差异,提示在此作用时间SFN的安全浓度是0~10 μmol/L。基于以上实验结果本研究选取研究选用50 μmol/L浓度fAβ25-35和10 μmol/L SFN作为实验药物浓度,以24 h作用时间作为体外细胞模型条件,分别设置溶媒对照组、Aβ组和Aβ+SFN组。Aβ组与其他两种组相比细胞活性下降,提示SFN可逆转fAβ25-35对BV-2细胞造成的毒性作用。
IL-6 和TNF-α常作为M1 型小胶质细胞的标志物[15-18]。SB203580是p38的常用抑制剂[19-21]。结合既往研究阳性结果,SFN能有效抑制小胶质细胞MAPK/NF-κB信号通路介导的神经炎症进[7]。因此我们设立了溶媒对照组、Aβ组、Aβ+SFN 组、Aβ+SFN 组和Aβ+SB203580组四组,以探讨Aβ和SFN通过MAPK/NF-κB信号通路对小胶质细胞M1/M2极化的影响。RT-qPCR、ELISA、流式细胞术以及Western blotting结果显示,在BV-2细胞中,SFN能通过抑制Aβ诱导MAPK/NF-κB信号通路活化,逆转小胶质细胞的M1型极化,降低IL-6和TNF-α释放。
M1型小胶质细胞具有诱导NSCs向星形胶质细胞分化、促进NSCs 迁移和抑制NSCs 增殖的作用[22]。TNF-α既往被认为可用于诱导细胞凋亡,但最近研究表明,TNF-α所诱导的细胞死亡是一种非凋亡形式的细胞死亡,而这种细胞死亡被称为程序性坏死,其中mlkl蛋白的磷酸化过程是程序性坏死的关键过程[23]。因此我们检测了不同分组C17.2 p-mlkl的表达,以评估mlkl的磷酸化情况。为了排除Aβ、SFN和SB203580等药物直接作用C17.2干扰结果,本研究设计了以下transwell共培养实验。药物首先作用于transwell上室的BV-2细胞24 h,然后使用培养基洗去上室中的药物,再与种有C17.2 的孔板结合。Western blotting 结果显示,在C17.2细胞中,Aβ组与其他3组相比p-mlkl表达升高,提示SFN逆转了fAβ25-35通过激活BV-2细胞MAPK/NFκB信号通路,降低了C17.2细胞的程序性坏死。
本研究新的发现是,SFN能通过小胶质细胞保护神经干细胞的作用,并排除了药物直接影响神经干细胞对实验结果的影响。但是细胞间信号通路是复杂多样的,在体内微环境中,小胶质细胞不仅能通过分泌炎症因子影响神经干细胞的细胞活动,还能通过直接接触等其他方式影响神经干细胞,本研究仅分析讨论了小胶质细胞炎症相关信号通路对神经干细胞的影响,未来实验可以进一步完善小胶质细胞通过如直接接触等方式对神经干细胞或其他细胞的影响。
综上所述。Aβ纤维能诱导BV-2 小胶质细胞MAPK/NF-κB信号通路上调并向M1型极化转化,释放IL-6和TNF-α。这些炎症因子会进一步诱导C17.2发生程序性坏死。而SFN能通过抑制Aβ诱导MAPK/NFκB信号通路活化,逆转小胶质细胞的M1型极化,降低IL-6和TNF-α释放,从而减少NSCs程序性坏死,有助于逆转AD的进程。因此,SFN干预及抑制小胶质细胞MAPK/NF-κB信号通路可能成为治疗AD的手段。

