肠内外营养治疗炎症性肠病的临床疗效分析
舒宝莲,郑新平,王晓洋,张丹霞,盛尧慧,廖辉,彭惠,桂若虎
衡阳市中心医院消化内科,湖南衡阳 421001
炎症性肠病属于非特异性慢性肠道炎性疾病,包含溃疡性肠炎及克罗恩病两种类型。该疾病损害患者肠道,引起腹痛、腹泻,甚至血便等多种症状[1]。目前,临床尚未明确本病的发病机制,但多数学者认为和遗传、免疫、环境、感染等因素相关[2]。就目前的医疗水平和相关性研究而言,该病的治疗较为棘手,无论是药物治疗,还是手术治疗,都难以达到彻底根治的效果,并且还存在一定的癌变风险,必须引起足够的重视,若疾病反复发作,还会导致营养不良,降低患者的免疫力,进一步加重病情[3]。有学者提出,进行肠内外营养支持是辅助治疗该疾病的有效方式,具有改善肠道功能、提升肠道黏膜屏障作用的效果,可以提高患者的抗病能力、免疫能力等[4]。为进一步明确其效果,本研究选取2020 年1 月—2023 年1 月衡阳市中心医院收治的100 例炎症性肠病患者为研究对象,进行分组对比。现报道如下。
1 资料与方法
1.1 一般资料
选取本院收治的100 例炎症性肠病患者为研究对象,采用随机抽签法分为参照组和研究组,每组50 例。两组患者治疗方案分别是常规治疗、常规治疗+肠内外营养支持。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经过医院医学伦理委员会批准审核。
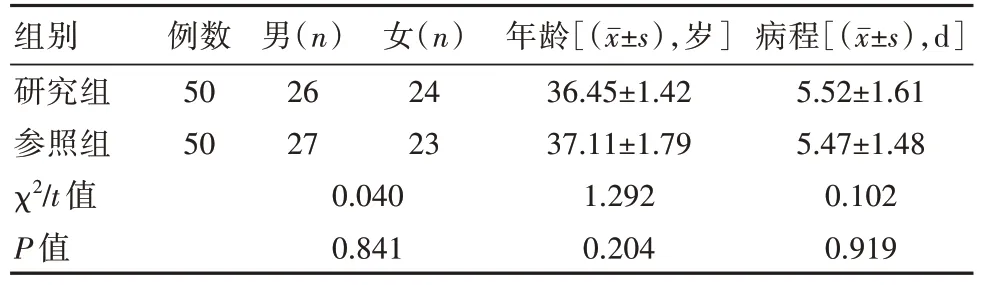
表1 两组患者一般资料对比
1.2 纳入与排除标准
纳入标准:肠镜等相关检查结果符合炎症性肠病诊断,患者入院时有不同功能程度的营养不良、腹泻、腹痛等症状;患者本人同意研究;符合肠内外营养治疗适应证。
排除标准:精神障碍者;患胃肠道恶性肿瘤者;中途退出者;患免疫性疾病者。
1.3 方法
参照组实施常规治疗。美沙拉嗪缓释颗粒(国药准字H20143164;规格:0.5 g)口服治疗,1 g/次,3 次/d,共治疗8 周。直肠或乙状结肠受累患者,以美沙拉嗪栓剂进行治疗,1 粒/次,夜间用药。同时,根据患者病情予以抗炎治疗、调节肠道菌群治疗等。病情严重患者,以醋酸泼尼松进行治疗,用量为1~2 mg/(kg·d)。
研究组在参照组基础上,采取肠内外营养支持治疗。肠内营养治疗:经鼻饲管输注营养液,对患者应用状况、机体需求等评估后,量化各类营养的需求量,合理搭配非要素膳、要素膳及组件膳等营养素。输注时,营养液须加热到38℃左右,浓度与正常体液渗透压相近,输注速度为50 mL/h 左右。肠外营养治疗:严重营养不良者,需在术前5 d 进行治疗,口服益生菌胶囊(国食健字G20110138;规格:0.3 g/粒),2 粒/次,2 次/d,或经管饲用药,共治疗8 周。
1.4 观察指标
比较两组患者治疗总有效率。腹痛、腹泻、血便病症完全消失,肠镜检查未见异常视为显效;病症减轻,肠道检查可见肠道黏膜病变改善,轻微炎症视为有效;在上述描述外视为无效。总有效率=1-无效率。
比较两组患者症状缓解时间。包括腹泻、腹痛、血便。
比较两组患者炎症因子水平。包括超敏C 反应蛋白(hypersensitive C-reactive protein, hs-CRP)、白细胞介素-6(interleukin, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)。
比较两组患者不良反应发生情况。包括纳差、头痛、恶心。
以生活质量评估简表评定不同治疗方式下患者的生活质量,量表从物质生活、精神、生理及社会生活几个维度评定,每个维度分值0~100 分,分数高则生活质量高。
1.5 统计方法
使用SPSS 24.0 统计学软件进行数据分析。计量资料均符合正态分布,用(±s)表示,组间及组内比较用t检验;计数资料用例数(n)和率(%)表示,组间及组内比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗效果对比
研究组治疗总有效率高于参照组,差异有统计学意义(P<0.05)。见表2。

表2 两组患者治疗效果对比
2.2 两组患者症状缓解时间对比
研究组腹痛、腹泻、血便缓解时间短于参照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者症状缓解时间对比[(±s),d]
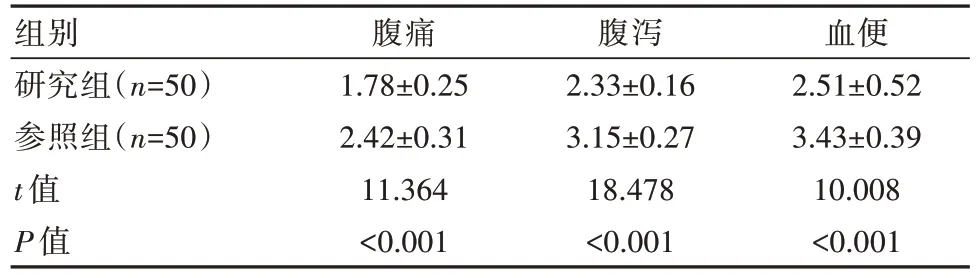
表3 两组患者症状缓解时间对比[(±s),d]
组别研究组(n=50)参照组(n=50)t 值P 值腹痛1.78±0.25 2.42±0.31 11.364<0.001腹泻2.33±0.16 3.15±0.27 18.478<0.001血便2.51±0.52 3.43±0.39 10.008<0.001
2.3 两组患者炎症因子水平对比
治疗前,两组患者hs-CRP、IL-6 及TNF-α 水平对比,差异无统计学意义(P>0.05)。治疗后,研究组hs-CRP、IL-6 及TNF-α 水平低于参照组,差异有统计学意义(P<0.05)。见表4。
表4 两组患者炎症因子水平对比(±s)

表4 两组患者炎症因子水平对比(±s)
组别研究组(n=50)参照组(n=50)t 值P 值TNF-α(ng/L)治疗前15.63±2.47 15.16±2.25 0.995 0.322治疗后7.27±1.15 10.2±1.28 12.040<0.001 IL-6(ng/L)治疗前75.42±10.14 75.72±12.77 0.130 0.897治疗后47.62±5.25 58.18±5.09 10.212<0.001 hs-CRP(mg/L)治疗前14.12±2.93 14.52±2.19 0.773 0.441治疗后8.03±1.14 12.14±2.55 10.404<0.001
2.4 两组患者不良反应发生情况对比
研究组不良反应总发生率低于参照组,差异有统计学意义(P<0.05)。见表5。

表5 两组患者不良反应发生情况对比
2.5 两组患者生活质量评分对比
研究组生活质量评分高于参照组,差异有统计学意义(P<0.05)。见表6。
表6 两组患者生活质量评分对比[(±s),分]
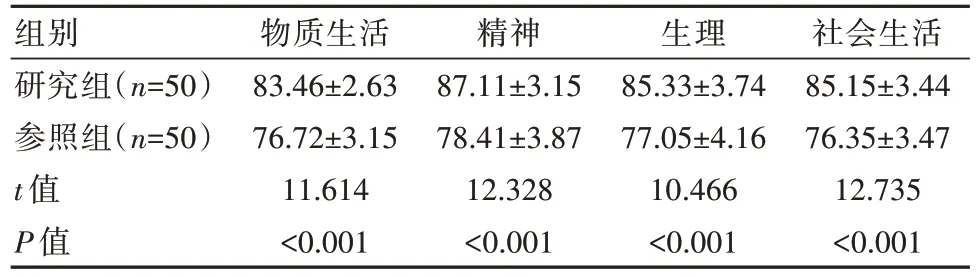
表6 两组患者生活质量评分对比[(±s),分]
组别研究组(n=50)参照组(n=50)t 值P 值物质生活83.46±2.63 76.72±3.15 11.614<0.001精神87.11±3.15 78.41±3.87 12.328<0.001生理85.33±3.74 77.05±4.16 10.466<0.001社会生活85.15±3.44 76.35±3.47 12.735<0.001
3 讨论
近几年,越来越多的学者对炎症性肠病展开了研究,但仍未明确该疾病的具体病因,一些学者认为本病是由多种因素共同作用导致的,并具有进展为肠癌的风险[5-6]。该疾病将导致肠动力障碍和肠屏障功能障碍,引起腹痛、腹泻等典型的胃肠道疾病症状,严重损害患者健康,降低了患者的生活质量[7]。肠黏膜屏障功能受损是各类肠道疾病发病的始动环节,在其受到损害之后,就可能引起肠内抗原、致病微生物感染,并导致促炎症因子释放[8-9]。因此,在本病的治疗中,应注意恢复肠黏膜屏障功能,并改善炎症反应。
肠内外营养治疗可以帮助改善机体营养状况,提升免疫力,可以作为临床治疗炎症性肠病的辅助方案。其中肠外营养治疗主要是通过静脉输注营养物质,以避免营养不良,维持机体的营养物质供应,其缺陷是弱化胃肠道功能,甚至导致胃肠功能紊乱,无法直接促进胃肠道黏膜修复,甚至可能造成黏膜屏障功能损耗及血管炎,加重炎症及致病因子的侵入[10-11]。肠内营养治疗则是通过鼻饲管输送营养物质,经胃肠道吸收,可以调节患者胃肠道功能,改善其消化功能,增强胃肠道蠕动,并促进肠道黏膜的修复。该营养支持方式的不足之处在于:介入时间较晚,无法在早期进行营养支持,同时对于胃肠道功能差的患者,吸收效果较差,可能会导致长期性的营养不良[12]。基于两种营养支持方式的优缺点,本研究将两种方式联合用于研究组患者的治疗,结果显示:研究组治疗总有效率为94.00%高于参照组(P<0.05)。与夏瑜雯等[13]学者研究中的肠内营养组患者治疗的总有效率90.24%高于参考组(P<0.05)的结果具有一致性。可见,联合肠内外营养支持治疗可以改善炎症性肠病患者的治疗效果,获得更高的治疗有效率。
本研究结果显示,研究组腹痛、腹泻、血便缓解时间短于参照组(P<0.05)。分析其原因在于:肠内外营养支持治疗一方面满足了患者的营养需求,可以改善营养不良状况,提升患者免疫力。另一方面,可以促进胃肠道功能的恢复,提升肠道黏膜抵御能力,减少炎症因子释放,改善病情,故有效促进了病症的消失[14]。本研究中,研究组各炎症因子水平低于参照组(P<0.05),也充分证实了这一观点。
本研究同时将不良反应及生活质量评分进行了对比,所见结果均为研究组优于参照组(P<0.05)。可见,肠内外营养支持治疗能够减少不良反应,让患者获得较高的生活质量。
综上所述,肠内外营养治疗炎症性肠病取得了较好的疗效,该治疗方式下,患者病症加快改善,炎症因子水平降低,生活质量评分高,不良反应也更少。

