玉米源活性肽对脂质过氧化的抑制作用研究
党佳敏, 杜双奎,2, 王丽英,2
(西北农林科技大学食品科学与工程学院1,杨凌 712100)
(粮油功能化加工陕西省高校工程研究中心2,杨凌 712100)
玉米肽是以玉米蛋白粉作为原料,通过酶解或微生物发酵获得的小分子肽,一般由2~20个氨基酸构成,分子质量通常为300~3 000 u。与蛋白质和游离氨基酸相比,肽类具有营养价值高、生物活性强等优势[1]。研究发现,玉米肽具有多种生物活性,如抗氧化活性、抗癌活性、改善糖脂代谢、免疫调节和预防酒精性肝损伤等[2-4],在食品和医药等领域具有良好应用前景。目前,玉米肽已被国家食品药品监督管理局认定为首批纳入食品资源名录的肽类产品之一[5]。因此,研究开发玉米源活性肽不仅能够有效提升玉米加工副产品玉米蛋白粉的应用价值,同时具有作为功能因子应用于健康食品和功能食品的潜力。
酶解食源性蛋白是制备活性肽的主要方法。许多食源性蛋白例如鱼、牛奶、鸡蛋、大豆、小麦和玉米等都被开发利用来制备具有抗氧化活性的酶解物或肽。由于酶解是不完全水解,水解产物为多肽而蛋白质中原有的氨基酸不发生任何变化,所以保留了氨基酸本身的生物活性,且反应温和、高效、安全性好[6]。
玉米肽的抗氧化活性是玉米肽研究的热点。在前期研究中,利用碱性蛋白酶制备玉米肽,发现其具有良好的体外自由基和细胞内活性氧清除活性,并且玉米肽还能够升高过氧化氢诱导氧化损伤细胞内过氧化氢酶以及谷胱甘肽还原酶的活性[7]。脂质过氧化是指多不饱和脂肪酸中发生的一种自由基链式反应,可引起机体细胞膜流动性及通透性发生改变、造成DNA及蛋白质损伤[8,9],进而影响细胞功能,导致动脉硬化、肿瘤、衰老、神经退行性疾病等慢性疾病的产生[10]。目前,对玉米肽抗氧化活性的研究主要集中于自由基或活性氧清除活性方面[11-15],而对其脂质过氧化抑制活性的研究报道较少,限制了玉米源抗氧化肽在含脂质食品中的应用。
研究以玉米蛋白粉为原料,通过多种蛋白酶水解制备玉米肽,利用亚油酸过氧化、卵黄脂质过氧化及小鼠肝组织脂质过氧化模型,系统评价玉米肽对不同来源脂质过氧化的抑制作用,为玉米肽在预防或抑制含脂质食品中脂质过氧化中的应用提供参考。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉(蛋白质量分数为62%),碱性蛋白酶(酶活力1 000 U/mg),风味蛋白酶(酶活力1 000 U/mg),中性蛋白酶(酶活力1 000 U/mg),胃蛋白酶(酶活力 3 200 U/mg),胰液酶(酶活力3×USP specifications),L-亮氨酸,2,4,6-三硝基苯磺酸(TNBS),2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),2,2’-偶氮二异丁基脒二盐酸盐(AAPH),6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox),SPF级2月龄C57BL/6J小鼠(合格证书编号:20220526Abzz0600000940),所有试剂均为分析纯。
1.2 仪器与设备
FW100高速粉碎机,HC-3013R高速冷冻离心机,FA200C电子天平,LNG-HFM-101膜分离装置,Xiande-2000A旋转蒸发仪,LGJ-10C真空冷冻干燥装置,SparkTM多功能酶标仪。
1.3 实验方法
1.3.1 玉米肽制备
玉米蛋白水解制备玉米肽参考You等[16]的方法并做适当修改。取玉米蛋白粉溶于去离子水,配置一定浓度的玉米蛋白溶液,在温度为90 ℃条件下加热10 min使蛋白变性,冷却后用1 mol/L NaOH或HCl调节pH。分别添加一定量的碱性蛋白酶、风味蛋白酶、中性蛋白酶于冷却后的玉米蛋白溶液中,持续水解180 min,具体水解条件如表1所示。将反应体系再次加热至90 ℃并保持10 min使蛋白酶失活。

表1 不同蛋白酶酶解条件及水解度
另外配置2 g/100 mL玉米蛋白溶液,参考Ding等[17]的方法,对玉米蛋白进行体外模拟胃肠道消化,即90 ℃条件下加热10 min使蛋白质变性,冷却至37 ℃,先使用1 mol/L HCl调节pH至2.0,加入胃蛋白酶,在pH=2.0、37 ℃的条件下水解90 min,然后使用1 mol/L NaOH调节pH至7.0,加入2 mg/100 mg胰液酶,在pH=7.0、37 ℃的条件下水解240 min,加热至90 ℃保持10 min,使蛋白酶失活。
前述酶解液一部分直接收集后冷冻干燥,用于水解度及玉米肽总得率测定,另一部分通过4 000 r/min离心10 min,收集上清液,利用截留分子质量为1 000 u和3 000 u的超滤膜进行超滤分离,收集分子质量<1 000 u的玉米肽组分1(CPF1)和分子质量1 000~3 000 u的玉米肽组分2(CPF2),旋转蒸发浓缩,真空冷冻干燥,称重CPF1和CPF2组分计算得率,于-20 ℃保存。
1.3.2 玉米蛋白水解度的测定
参考周慧江等[18]的方法并稍作改进。向96孔板中加入5 μL 0.5 mg/mL的玉米蛋白水解液,再加入40 μL 0.212 5 mg/mL pH为8.2的磷酸盐缓冲液和40 μL 0.1 g/100 mL的TNBS水溶液,在避光条件下,50 ℃恒温振荡60 min,取出后,再加入80 μL 0.1 mol/L的HCl终止反应,震荡混匀后,室温冷却30 min,在340 nm下测定吸光值。以未经酶解的玉米蛋白溶液为空白对照组,以L-亮氨酸为标准品绘制标准曲线。蛋白水解度(DH)计算公式见式(1)和式(2)。
(1)
(2)
式中:cs为样品组对应的L-亮氨酸浓度/mmol/L;c0为空白对照组对应的L-亮氨酸浓度/mmol/L;hs为样品组肽键数/mmol/g;h0为空白对照组肽键数/mmol/g;ht为玉米蛋白肽键总数/7.8 mmol/g;V为样品体积/L;m为样品质量/g。
1.3.3 ABTS自由基清除活性测定
参考王晨阳等[19]的方法并稍作改进。ABTS工作液的配制:将14 mmol/L ABTS溶液与4.9 mmol/L过硫酸钾溶液等体积混合,放置在暗处反应12~16 h。使用前,用PBS缓冲液(75 mmol/L,pH 7.4)进行稀释,直至在734 nm下的吸光值为0.70±0.02。取96孔板,每孔加入150 μL稀释后的ABTS工作液,实验分为样品组和对照组,样品组中每孔加入50 μL玉米肽溶液(终质量浓度分别为6.25、12.50、25.00、62.50、125.00 μg/mL),空白对照组每孔加入50 μL蒸馏水,阳性对照组每孔加入50 μL终质量浓度分别为6.25、12.50、25.00、62.50、125.00 μg/mL的Trolox溶液。室温反应10 min后,测定其在734 nm下的吸光值,ABTS自由基清除率计算公式见式(3)。

(3)
根据Trolox的浓度与ABTS自由基清除率回归方程,计算玉米肽样品的Trolox当量(Trolox equivalent, TE),即mmol TE/g肽。
1.3.4 硫氰酸铁(FTC)法测定玉米肽对亚油酸脂质过氧化的抑制作用
参考Bakir等[20]的方法测定,测定方法如下:取亚油酸13 μL与99.5%体积分数的乙醇溶液1 mL配制成亚油酸-乙醇溶液。取离心管分别加入0.5 mL 0.2 mg/mL的玉米肽溶液、0.5 mL 5 mmol/L PBS缓冲液、1.013 5 mL亚油酸-乙醇溶液,放入40 ℃烘箱进行孵育,每隔24 h取出,取30 μL反应液体,加入1.41 mL 75%体积分数的乙醇、30 μL 30 g/100 mL的硫氰酸铵、30 μL 20 mmol/L氯化亚铁(用3.5%体积分数的盐酸配制),反应3 min,在500 nm下测量吸光度值,连续测量7 d,以维生素C作为阳性对照。玉米肽对亚油酸脂质过氧化的抑制率计算公式见式(4)。

(4)
1.3.5 硫代巴比妥酸(TBA)法测定玉米肽对卵黄脂质过氧化的抑制作用
卵黄脂质过氧化测定参照韩娅婷等[21]的方法并作修改,具体操作如下:鸡蛋去卵清,取卵黄用等体积0.1 mol/L、pH 7.4的PBS缓冲液配置成1∶1的悬液,室温下均质30 s,再次使用PBS缓冲液稀释成1∶25的卵黄悬液,均质30 s。取离心管分别加入60 μL 1∶25卵黄悬液、60 μL 25 mmol/L FeSO4溶液和180 μL PBS缓冲液,样品组加入300 μL玉米肽溶液(终质量浓度分别为5.71、11.43、17.14、22.86、28.57 mg/mL),空白对照组加入300 μL PBS缓冲液,混合均匀,37 ℃水浴下反应4 h,依次加入150 μL 50 g/100 mL的TCA,300 μL 0.8 g/100 mL的TBA,沸水浴20 min,冷却后3 500 r/min 离心15 min,测量532 nm下吸光度值。玉米肽对卵黄脂质过氧化的抑制率计算公式见式(5)。

(5)
1.3.6 玉米肽对动物肝脏脂质过氧化的抑制作用
小鼠肝脏脂质过氧化测定参考郭红英等[22]的方法并稍作改进。小鼠禁食12 h后,利用颈椎脱臼法处死,迅速取出其肝脏组织,置于冷生理盐水漂洗干净,以生理盐水为匀浆介质,制成10 g/100 mL组织匀浆,3 500 r/min离心10 min,取上清液,4 ℃冷藏备用。
取200 μL 10 g/100 mL小鼠肝脏匀浆于各试管,实验组加入100 μL玉米肽溶液(终质量浓度分别为0.11、1.11、2.22、5.55、8.89、11.11 mg/mL),空白对照组加入100 μL蒸馏水,37 ℃水浴振荡反应30 min。加入200 μL 200 mmol/L的AAPH溶液,37 ℃水浴振荡,反应120 min,冷却至室温后,加入200 μL 20 g/100 mL的TCA终止反应。加入200 μL 0.67 g/100 mL的TBA,混合均匀,沸水浴15 min,冷却至室温后,3 500 r/min离心10 min,测定其在532 nm处的吸光值。玉米肽对小鼠肝脏脂质过氧化的抑制率计算公式见式(6)。

(6)
1.3.7 数据处理
所有实验数据均为3次平行实验结果的平均值,以平均值±标准偏差形式表示。采用SPSS 20.0进行数据处理,利用单因素方差分析(ANOVA)以及Duncan 多重比较来确定数据间的显著性,差异显著水平为P<0.05。采用Origin 2021软件进行图表的绘制。
2 结果与讨论
2.1 玉米肽的ABTS自由基清除活性
如表1所示,中性蛋白酶对玉米蛋白的水解度最高,为(33.43±6.89)%;碱性蛋白酶次之,为(26.74±3.45)%;模拟胃肠道消化(胃蛋白酶+胰液酶)和风味蛋白酶水解得到的玉米肽水解度最低,为(22.89±3.25)%和(18.21±3.84)%(P<0.05)。
玉米肽总肽及CPF1、CPF2组分的得率如表2所示。总肽得率中模拟胃肠道消化制备的玉米肽得率最高,为(90.42±8.81)%;在CPF1组分得率中,碱性蛋白酶制备的CPF1得率最高,为(10.37±0.51)%;在CPF2组分得率中,中性蛋白酶制备的CPF2得率最高,为(18.83±0.28)%。
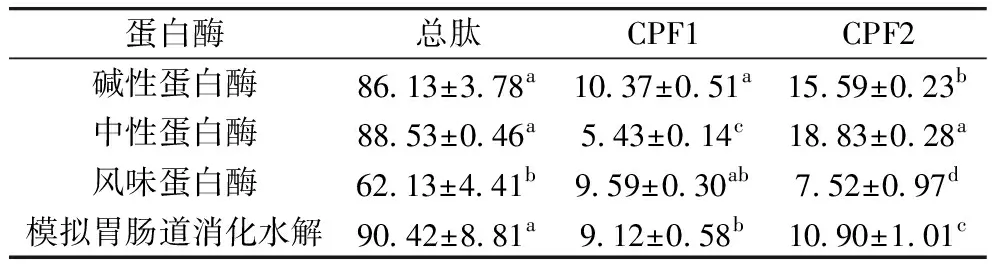
表2 玉米肽得率/%
ABTS自由基清除活性评价体系同时适用于脂溶性和水溶性两类化合物,尤其适用于蛋白水解物等肽类物质的自由基清除活性评价,在ABTS体系中,抗氧化肽可以作为供电子体或供质子体与自由基发生反应[23]。因此,本研究测定了玉米肽的ABTS自由基清除活性。实验结果表明,不同蛋白酶水解得到的玉米肽均具有较强的ABTS自由基清除活性,且呈剂量依赖效应(P<0.05)。当质量浓度为125.00 μg/mL时,不同蛋白酶水解得到玉米肽的ABTS自由基清除活性为53.43%~78.61%,如图1所示。对于CPF1(图1a),当玉米肽的质量浓度达到125.00 μg/mL时,模拟胃肠道消化所制备的玉米肽ABTS自由基清除活性最高,为(78.61±0.56)%,中性蛋白酶和风味蛋白酶制备的玉米肽ABTS自由基清除活性次之,分别为(66.18±1.62)%和(65.93±1.56)%,而碱性蛋白酶制备的玉米肽ABTS自由基清除活性相对较弱,为(55.32±0.69)%(P<0.05)。对于CPF2(图1b),当玉米肽的质量浓度达到125.00 μg/mL时,中性蛋白酶制备的玉米肽ABTS自由基清除率最高,为(74.09±0.44)%,碱性蛋白酶和模拟胃肠道消化制备的玉米肽ABTS自由基清除活性次之,分别为(71.70±0.37)%和(68.21±0.32)%,而风味蛋白酶制备的玉米肽ABTS自由基清除活性相对较弱,为(53.43±0.76)%(P<0.05)。使用不同的蛋白酶水解玉米蛋白时由于其酶切位点不同,所保留特定氨基酸的残基种类、位置不同,造成了玉米肽清除ABTS自由基活性的差异性。例如,碱性蛋白酶的酶切位点主要为疏水性或芳香族氨基酸的肽键;中性蛋白酶的酶切位点主要是疏水性氨基酸;风味蛋白酶具有外切酶和内切酶的效果,酶解得到寡肽的可能性很高;胰蛋白酶主要作用于碱性氨基酸,仅将蛋白水解成大片段的多肽;而胃蛋白酶属于酸性蛋白酶,其作用位点通常为Phe、Trp、Tyr等疏水性氨基酸,具有广泛的特异性[24]。研究发现,一些特殊的氨基酸如His、Tyr、Met、Leu、Trp、Lys和Cys等均具有较强的抗氧化活性,另外疏水性氨基酸Ala、Met、Ile、Leu、Phe、Pro和Trp也可能与肽的抗氧化活性相关[25,26]。
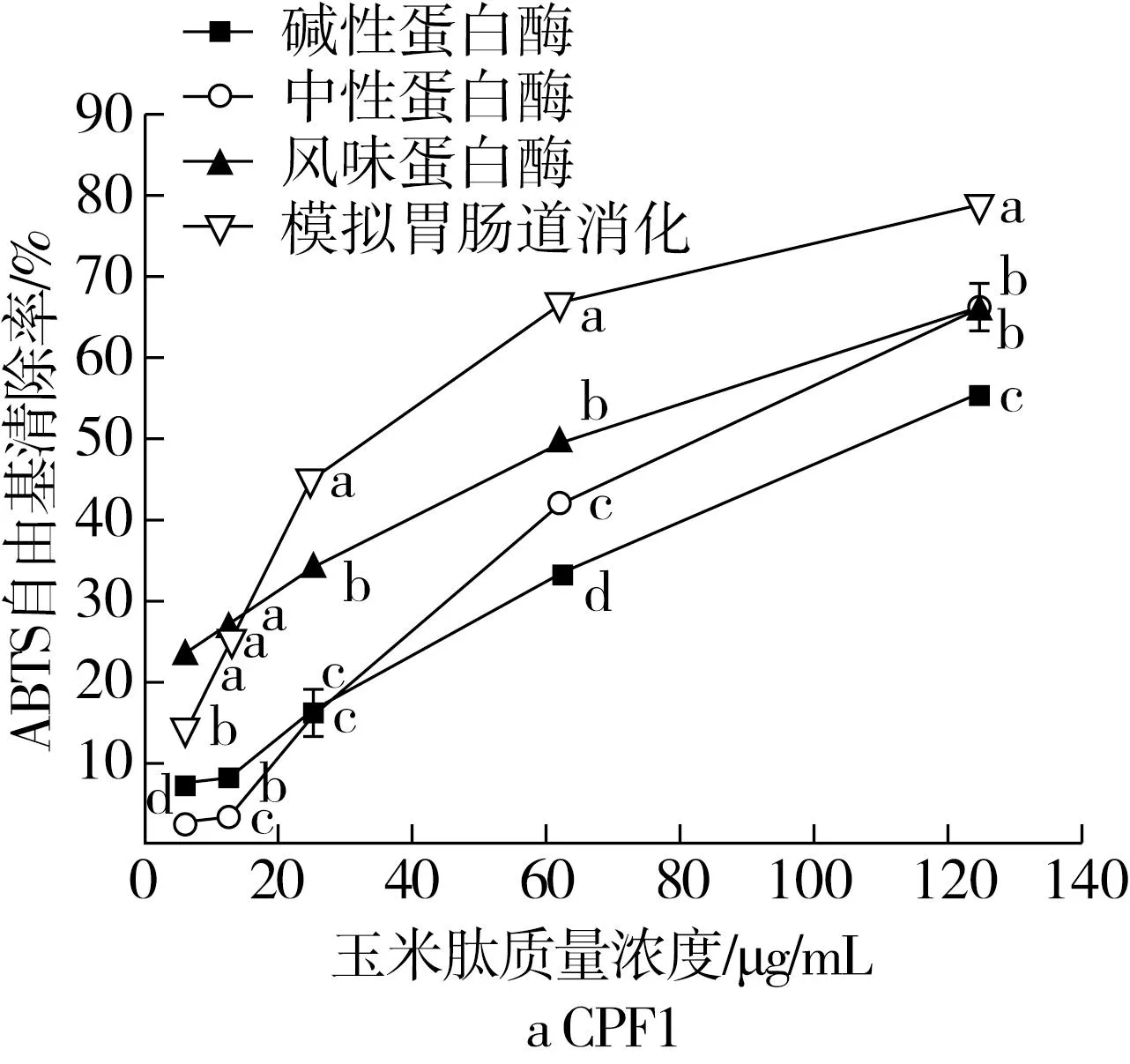
注:不同字母表示相同玉米肽质量分数下,利用不同蛋白酶水解所得玉米肽的ABTS自由基清除率之间差异显著(P<0.05)。图1 玉米肽ABTS自由基清除活性
玉米肽ABTS自由基清除活性的IC50及Trolox当量如表3所示。其中,模拟胃肠道消化制备的玉米肽CPF1组分的ABTS自由基清除活性IC50最低,为(32.65±0.95)μg/mL,其Trolox当量为(3.65±0.11)mmol TE/g肽,碱性蛋白酶制备的玉米肽CPF2组分次之,其IC50和Trolox当量分别为(49.19±1.89) μg/mL和(2.42±0.09)mmol TE/g肽。风味蛋白酶制备的玉米肽CPF1、中性蛋白酶和模拟胃肠道消化制备的玉米肽CPF2也具有较强的ABTS自由基清除活性,IC50分别为(56.81±2.37)、(58.70±1.54)、(63.61±1.39)μg/mL,其Trolox当量分别为(2.10±0.09)、(2.03±0.05)、(1.87±0.04)mmol/L TE/g肽。

表3 玉米肽ABTS自由基清除活性IC50及Trolox当量
2.2 玉米肽的亚油酸过氧化抑制作用
亚油酸是人体所必需的重要不饱和脂肪酸,对降低血脂、软化血管、降低血压等有促进作用。由于亚油酸双键电子云密度大,化学性质很不稳定,容易受到过氧化作用损伤,产生有细胞毒性的脂质过氧化物[27]。中间产物自由基导致蛋白质分子的聚合,亚油酸脂质过氧化能够破坏人体细胞正常生理功能,促使人体衰老以及诱发癌症和动脉粥样硬化[28]。
本研究以硫氰酸铁法测定玉米肽的亚油酸脂质过氧化抑制作用,亚油酸氧化产物丙二醛的生成量以反应液的吸光度值表示,吸光度值越小,丙二醛生成量越少,即玉米肽的亚油酸过氧化脂质抑制能力越强。由图2可知,所有蛋白酶所制备出的玉米肽组分CPF1和CPF2的吸光度值均低于空白对照组,即均表现出一定的亚油酸过氧化抑制能力,且抑制能力随作用时间的延长而上升。第7天时,玉米肽在终质量浓度为28 μg/mL时的亚油酸过氧化抑制率如图3所示。分析发现,风味蛋白酶制备的玉米肽CPF1组分的亚油酸过氧化抑制活性最高,为(72.54±1.15)%,风味蛋白酶制备的玉米肽CPF2组分次之,为(62.04±3.27)%。模拟胃肠道消化和中性蛋白酶制备的玉米肽CPF2组分也具有较高的亚油酸过氧化抑制活性,为(45.02±0.94)%和(54.82±17.35)%;而其CPF1组分的亚油酸过氧化抑制活性相对CPF2较低,为(40.89±12.48)%和(31.88±13.08)%。碱性蛋白酶制备的玉米肽CPF1和CPF2的亚油酸过氧化抑制活性均低于10%。当多肽的N-端为疏水性氨基酸时,可以与脂肪酸相互反应,从而使得多肽具有捕捉脂质自由基的能力[29]。风味蛋白酶是一种混合型蛋白酶,含有内切酶和外切酶,在酶解初期内切酶将蛋白水解成多肽,内切酶切位点多位于疏水性氨基酸残基,之后在外切酶作用下从肽链末端释放氨基酸,继而形成更多氨基酸和短肽,具有较高的酶解效率和特异性[30]。类似研究结果也有文献报道,如任玮等[31]测定了工业化生产的食源性低聚肽在亚油酸自氧化体系中的抗氧化活性,结果发现当终质量浓度为27.00 μg/mL时,2 h内大豆肽和海洋胶原肽对于亚油酸自氧化的抑制率分别达到75.16%和58.69%,玉米肽抑制率约为33.00%,海洋骨原肽的抑制率为45.66%。值得注意的是,在本研究中,利用风味蛋白酶制备的玉米肽CPF1和CPF2组分以及利用中性蛋白酶和模拟胃肠道消化制备的玉米肽CPF2组分的亚油酸过氧化抑制活性均大于阳性对照维生素C(42.56±1.35)%,显示出其作为亚油酸过氧化抑制剂应用于含脂质食品的良好潜力。

注:不同字母表示相同玉米肽浓度下不同蛋白酶制备玉米肽的亚油酸过氧化抑制作用数据之间差异显著(P<0.05)。图2 玉米肽的亚油酸过氧化抑制作用
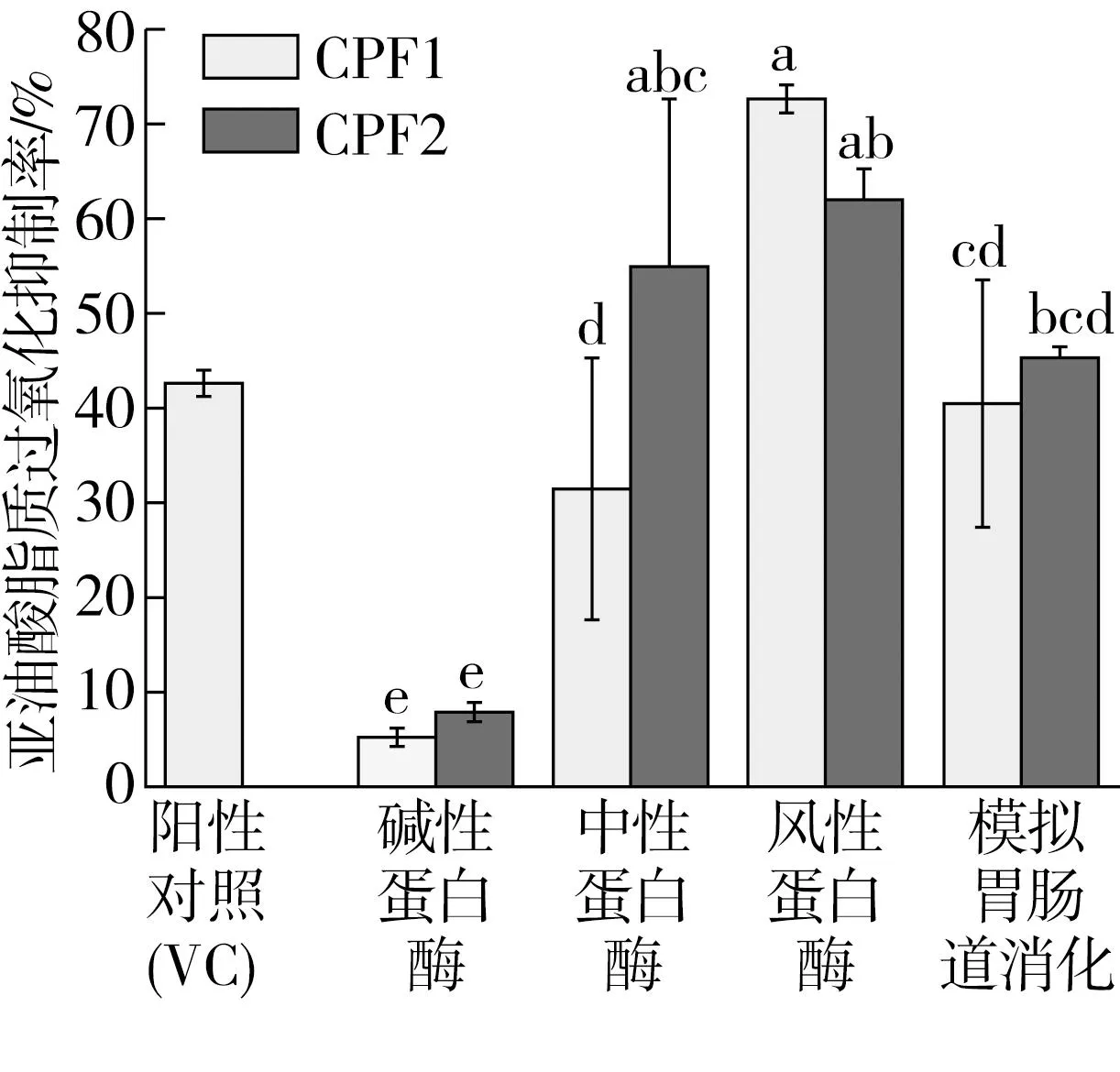
注:不同字母表示数据间差异显著(P<0.05)。图3 第7天时玉米肽的亚油酸过氧化抑制作用
2.3 玉米肽的卵黄脂质过氧化抑制作用
卵黄脂蛋白溶液富含多不饱和脂肪酸,在Fe2+催化下易发生脂质过氧化,生成丙二醛(MDA),MDA在酸性条件下可与硫代巴比妥酸反应产生粉红色反应物,在532 nm处有特征吸收[32]。研究利用FeSO4诱导卵黄脂质过氧化体系,采用硫代巴比妥酸法测定玉米肽的卵黄脂质过氧化抑制作用。如图4所示,不同蛋白酶水解得到的玉米肽CPF1和CPF2组分均具有一定的卵黄脂质过氧化抑制作用且其抑制作用与浓度呈剂量依赖关系(P<0.05)。

注:不同字母表示相同玉米肽浓度下不同蛋白酶水解所得玉米肽的卵黄脂质过氧化抑制活性数据之间差异显著(P<0.05)。图4 玉米肽的卵黄脂质过氧化抑制作用
碱性蛋白酶制备的玉米肽CPF1组分的卵黄脂质过氧化抑制作用最强,在质量浓度为17.14 mg/mL时,其卵黄脂质过氧化抑制作用为(84.75±0.48)%;碱性蛋白酶制备的玉米肽CPF2组分和模拟胃肠道消化制备的玉米肽CPF1组分次之,在质量浓度为17.14 mg/mL时,其卵黄脂质过氧化抑制作用分别为(69.20±2.02)%和(68.42±0.56)%。其他蛋白酶制备的玉米肽CPF1和CPF2组分在质量浓度为28.57 mg/mL时,其卵黄脂质过氧化抑制作用处于(48.24±2.37)%~(61.35±0.10)%。研究显示,活性肽的卵黄脂质抗氧化活性与其分子组成、结构、疏水性和氨基酸的残基位点有关[33],但具体的抗氧化机制还不清楚。对于玉米肽的亚油酸脂质过氧化相关内容报道较少,刘小芳等[34]利用碱性蛋白酶酶解南极磷虾蛋白,发现当南极磷虾蛋白肽质量浓度为0.1 mg/mL时,对Fe2+诱导的卵黄脂质过氧化抑制率为(67.56±1.36)%。
不同蛋白酶制备的玉米肽的卵黄脂质过氧化抑制作用IC50如表4所示,碱性蛋白酶制备的玉米肽CPF1和CPF2组分卵黄脂质过氧化抑制作用的IC50最低,分别为(8.64±0.07)mg/mL和(14.02±0.23)mg/mL。进一步分析发现,玉米肽CPF1组分的卵黄脂质过氧化抑制作用普遍强于CPF2组分(P<0.05),原因可能是分子质量越小,其抗氧化基团更容易暴露在分子外部,且小分子肽组分中含有更多末端氨基酸使其能与氧化基团进行吸附[35]。

表4 玉米肽卵黄脂质过氧化抑制作用IC50
2.4 玉米肽的肝脏脂质过氧化抑制作用
丙二醛(MDA)是脂质过氧化物的主要分解产物,其含量反映了组织脂质过氧化程度,也间接反映了组织受自由基攻击的严重程度[36]。研究利用AAPH诱导小鼠肝脏脂质过氧化体系,采用硫代巴比妥酸法测定玉米肽的肝脏脂质过氧化抑制作用,如图5所示。结果发现,不同蛋白酶水解得到的玉米肽组分均具一定的肝脏脂质过氧化抑制作用,且呈剂量依赖关系(P<0.05)。

注:不同字母表示相同玉米肽浓度下不同蛋白酶水解所得玉米肽的肝脏脂质过氧化抑制活性数据之间差异显著(P<0.05)。图5 玉米肽的肝脏脂质过氧化抑制作用
在玉米肽质量浓度为22.22 mg/mL时模拟胃肠道消化和碱性蛋白酶制备的玉米肽CPF1组分其肝脏脂质过氧化抑制作用最强,分别为(61.96±0.34)%和(58.35±2.78)%;中性蛋白酶制备的玉米肽CPF1组分和风味蛋白酶制备的玉米肽CPF1组分次之,分别为(57.30±0.61)%和(55.22±2.55)%,而玉米肽CPF2组分的肝脏脂质过氧化抑制作用相对于CPF1普遍较弱,低于55%。通过对结果进行分析,发现低分子质量的玉米肽组分其动物肝脏脂肪过氧化能力强于高分子质量的玉米肽组分。研究发现,肽的分子质量是影响其穿膜吸收的最重要的因素之一,分子质量越大,越难以被完整吸收[37]。小分子质量的肽容易被肝脏细胞吸收从而对脂质过氧化起到更好的抑制作用。由此可见,蛋白酶解的特异性和酶解产物中肽段分子质量的大小共同影响其脂质过氧化活性的高低。类似研究结果也有文献报道,陈红漫等[38]利用碱性蛋白酶水解玉米醇溶蛋白获得了玉米肽组分,发现分子质量位于400~1 000 u的组分具有较强的抗脂质氧化作用,在质量浓度为6 mg/mL时对小鼠肝组织体外脂质过氧化抑制率达到30.65% 。
不同蛋白酶制备的玉米肽的肝脏脂质过氧化抑制作用IC50如表5所示,中性蛋白酶制备的玉米肽CPF1抑制肝脏脂质过氧化作用的IC50最低,为(9.79±0.76)mg/mL,模拟胃肠道消化水解和碱性蛋白酶制备的玉米肽CPF1次之,IC50分别为(10.68±1.33)、(10.99±1.07)mg/mL,模拟胃肠道消化制备的玉米肽CPF2的IC50较高,为(19.16±3.97)mg/mL。

表5 玉米肽肝脏脂质过氧化抑制作用IC50
3 结论
研究利用碱性蛋白酶、中性蛋白酶、风味蛋白酶及模拟胃肠道消化(胃蛋白酶+胰蛋白酶)制备玉米肽,在测定了玉米肽的ABTS自由基清除活性基础上,重点从亚油酸、卵黄脂质和动物肝脏脂质3个层次系统评价了玉米肽对脂质过氧化的抑制作用。结果表明,玉米肽组分对亚油酸、卵黄脂质及动物肝脏脂质的过氧化物均具有较好的抑制作用,而所使用的蛋白酶种类以及玉米肽组分的分子质量皆会影响其ABTS自由基清除活性及脂质过氧化抑制活性。本实验为玉米源活性肽的脂质过氧化抑制作用提供了参考,玉米源活性肽可用作含脂质食品的脂质过氧化抗氧化剂,用来改善食品的品质或延长保质期,具有广阔的应用前景。

