花生蛋白钙螯合肽的制备、富集及表征
张春芝, 王明清, 黄国清, 肖军霞
(青岛农业大学食品科学与工程学院1,青岛 266109)
(山东省花生研究所2,青岛 266109)
钙是机体内一种重要的营养素,对维持机体的健康起着无法替代的作用,其与细胞代谢、神经传导、骨骼生长、肌肉收缩和心脏功能密切相关[1]。当钙摄入量不足时可导致诸多疾病,如骨质疏松、骨折、退行性骨病、儿童佝偻病及高血压、结肠癌、肥胖症和肾结石等[2,3]。饮食摄入是机体补充骨骼中钙储存的唯一来源[4]。目前市场上已有多种补钙产品,其中以无机(如碳酸钙)和有机钙(如葡萄糖酸钙)为主,这些产品在胃酸中释放出游离的钙离子,后者在碱性肠道条件下形成不溶性氢氧化钙,从而导致钙吸收困难[5];此外,氢氧化钙会附着在肠壁表面,进而对其他营养素的吸收造成不利影响[6]。氨基酸螯合钙克服了上述钙补充剂的缺点,但是其成本较高且有引起脂肪氧化的倾向,这在一定程度上限制了其应用[7]。肽钙螯合物具有独特的吸收转运机制,能够显著提高机体对钙的吸收,同时多肽还可以提高其他矿物元素的生物利用度,因此肽钙螯合物是一种有潜力的新型钙补充剂。目前已从多种不同来源的蛋白质中制备得到了钙螯合肽,如酪蛋白磷酸肽、太平洋鳕鱼骨胶原肽、大豆肽等[7]。已有学者从多肽分子质量、氨基酸组成及与钙离子的螯合方式等角度初步揭示了钙螯合肽的构效关系[8],并对其体内吸收途径及生物利用度进行了一定研究[9,10],这为新型肽钙螯合物的开发及其在食品工业中的应用提供了参考。
花生是全世界及我国的重要农作物,其总产量的54%用于榨油。由于高温压榨使花生蛋白发生变性导致其功能性质较差,榨油后的花生饼粕并未得到充分利用,这造成了较严重的资源浪费[11]。花生蛋白氨基酸种类齐全,必需氨基酸质量分数高达38.29%,生物活性肽是花生蛋白重要的综合利用途径之一,已从花生蛋白成功制备了具有降血压[12]、抗氧化[13]、抗菌[14]等多种生理功能的多肽水解物。
以花生蛋白为原料来制备钙螯合肽的研究已有少量报道。冯文君[15]用蛋白酶M(protease M)对花生蛋白进行单酶水解,然后再用谷氨酰胺酶进行脱酰胺处理,得到了钙结合能力为110.8 mg/g 的花生多肽;在此基础上,又对花生蛋白水解物进行超滤,得到了钙结合能力达(124.70±0.80)mg/g的级分,该级分可以有效提高钙在骨骼中的积累[9],并促进钙离子在Caco-2细胞中的转运且不会影响细胞的通透性[10]。
花生肽与钙离子形成的螯合物具有显著的生理功能,但是其钙结合能力仍然有提升的空间。本实验以花生蛋白为原料,通过多酶水解的方式来进一步提高花生蛋白的水解度和花生肽的钙结合能力,利用大孔树脂吸附对钙螯合肽进行富集,并对所得钙肽螯合物的性质进行表征,以期为花生蛋白的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
花生蛋白粉(山东,蛋白质质量分数47%);Alcalase 2.4 L碱性蛋白酶(2.4 AU/g)、Neutrase 0.8 L中性蛋白酶(600 U/mg)、Protamex复合蛋白酶(1.5 AU/g)、FlavourzymeTM蛋白酶(1 000 LAPU/g)、木瓜蛋白酶(800 U/mg)、酸性蛋白酶(800 U/mg)、Corolase®LAP外切蛋白酶(350 LAP/g)、ProteAXH肽酶(1 400 U/g);大孔树脂D101、ADS-7、AB-8、DM301、XAD-2,离子交换树脂IRA900C1、IRC76RCF,其余试剂均为分析纯。
1.2 仪器与设备
Nano ZS90纳米粒度及zeta电位分析仪,F2700荧光分光光度计,Chiransan圆二光谱仪,NicoletIR200傅里叶变换红外光谱仪,SHA-B水浴恒温振荡器,UV-1200紫外可见分光光度计。
1.3 方法
1.3.1 蛋白酶的筛选
按酶底比0.05%(质量分数)分别将Alcalase 2.4 L、Neutrase、酸性蛋白酶、木瓜蛋白酶、Protamex和FlavourzymeTM加入装有100 mL质量浓度为2 mg/100 mL的花生蛋白悬浮液的三角瓶中,然后在各自推荐的最适条件下(详见表1)在水浴中振荡4 h。反应结束后,100 ℃沸水浴灭酶10 min,然后在8 000 g下离心15 min,取上清液冻干,测定水解度、氮回收率及钙结合能力。
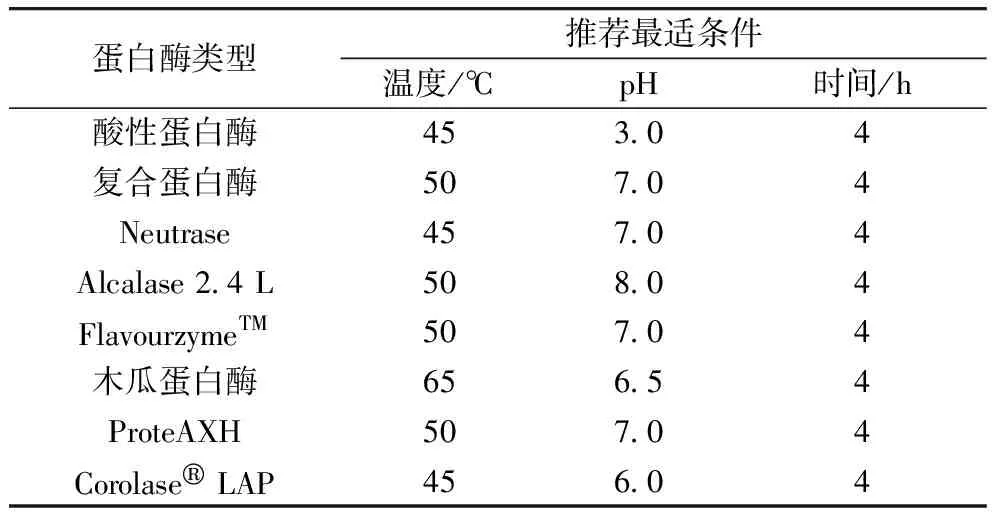
表1 8种市售蛋白酶的推荐最适反应条件
1.3.2 复合蛋白酶体系的筛选
按酶底比0.05%(质量分数)将Alcalase 2.4 L碱性蛋白酶加入装有100 mL质量浓度为2 mg/100 mL的花生蛋白悬浮液的三角瓶中,然后在其推荐的最适条件下(见表1)水浴中振荡4 h;反应结束后,用0.1 mol/L NaOH或HCl溶液调节到合适的pH值,再按照酶底比0.05%(质量分数)分别加入ProteAXH肽酶、木瓜蛋白酶、Protamex复合蛋白酶或Corolase®LAP外切蛋白酶,按照表1的最适条件继续水解4 h。反应结束后,100 ℃沸水浴灭酶10 min,然后在8 000 g下离心15 min,取上清液冻干,测定水解度、氮回收率及钙结合能力。
1.3.3 花生肽脱酰胺
采用酸化法对花生肽进行脱酰胺处理[16]。准确称取花生肽冻干粉溶于0.4 mol/L的盐酸中使其质量浓度达到3 mg/100 mL,密封后于90 ℃下反应4 h。反应结束后,用NaOH调节其pH至7.0,利用分子截留量为100 u的透析袋在去离子水中透析以除去盐份,冷冻干燥后测定其钙结合能力。
1.3.4 花生肽钙螯合物制备条件的优化
以CaCl2为钙离子来源,采用单因素实验设计对花生肽钙螯合物的制备工艺进行优化。向质量浓度为3 mg/100 mL的脱酰胺花生肽溶液中加入CaCl2,使多肽与钙离子的质量比达到1∶1、2∶1、3∶1、4∶1、5∶1,用0.1 mol/L HCl调节pH值至3.0、4.0、5.0、6.0、7.0、8.0,然后在30、40、50、60、70 ℃下静置20、40、60 、80、100、120 min,使花生肽与钙离子发生螯合作用。反应结束后,向体系中加入5倍体积的无水乙醇,8 000 g下离心15 min,收集沉淀即得花生肽钙螯合物,冷冻干燥后备用。
1.3.5 花生钙螯合肽富集条件的优化
1.3.5.1 大孔树脂的筛选
称取处理好的D101、AB-8、DM301、XAD-2、ADS-7、IRA900C1、IRC76RCF树脂各10 g,分别放入200 mL具塞锥形瓶中,随后分别加入50 mL质量浓度为20 mg/mL的脱酰胺花生肽溶液,置于30 ℃恒温摇床中150 r/min振荡12 h,然后抽滤收集滤液,测定剩余多肽的钙结合能力及损失率。
1.3.5.2 大孔树脂吸附富集工艺优化
称取处理好的最优树脂10 g,放入200 mL具塞锥形瓶中,按照大孔树脂与多肽质量比5∶1、7.5∶1、10∶1、12.5∶1、15∶1加入脱酰胺花生肽溶液,调节其pH值至1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0,在25、30、35、40、45、50 ℃下反应3、6、9、12、18 h,然后抽滤收集滤液,测定其钙结合能力。
1.3.6 脱酰胺花生肽及其钙螯合物的表征
1.3.6.1 粒径及ζ电位分析
将经过树脂富集的脱酰胺花生肽及其钙螯合物的冻干粉溶解于去离子水中,在25 ℃条件下利用Nano ZS90纳米粒度及zeta电位分析仪测定其ζ电位和粒径。
1.3.6.2 荧光光谱分析
将经过树脂富集的脱酰胺花生肽溶于去离子水中使其质量浓度达到0.2 mg/mL,再加入一定体积的1 mol/L CaCl2溶液,使反应体系中的Ca2+浓度达到0、5、10、15、20、25 μmol/L,根据1.3.4确定的花生肽与钙螯合的最适条件进行反应。反应结束后立即进行荧光光谱扫描,激发波长设置为280 nm,发射波长设置为为290~500 nm,发射光与激发光缝宽均设为10 nm[17]。
1.3.6.3 圆二色谱分析
将经过树脂富集的脱酰胺花生肽及其钙螯合物的冻干粉溶解于去离子水中,使其质量浓度达到0.1 mg/mL,于190~260 nm 的波长范围内进行圆二色光谱扫描,扫描速率为 100 nm/min,扫描间隔为 0.5 nm,以去离子水作为空白,每个样品重复扫描3次。
1.3.6.4 傅里叶红外光谱分析
取1 mg将经过树脂富集的脱酰胺花生肽及其钙螯合物冻干粉与100 mg KBr混合均匀,压片后进行红外光谱分析,扫描范围为4 000~400 cm-1,仪器分辨率为4 cm-1,扫描次数为64。
1.3.7 水解度及蛋白质回收率的测定
采茚三酮法测定花生蛋白的水解度(DH),其水解度计算公式为[18]:
式中:h为水解液中每克蛋白被裂解的肽键数;htot为每克花生蛋白质中的总肽键数/mmol/g,其值为7.13 mmol/g[19]。
通过凯氏定氮法测定反应体系中花生蛋白的蛋白质含量(m1)及水解结束后离心上清液中的蛋白质含量(m2),通过公式计算蛋白质回收率(Pr):
1.3.8 钙结合能力测定
采用EDTA配位滴定法测定钙离子含量[20]。将10 mg花生肽钙螯合物溶解于去离子水中,定容至25 mL,加入1 mL掩蔽剂三乙醇胺并滴用KOH调节pH至12.0,加入3滴钙红指示剂,摇匀后用EDTA标准溶液滴定,直至指示剂由紫红色变蓝色。记录消耗体积,按公式计算花生肽的钙结合能力:

式中:C为EDTA标准溶液浓度/mol/L;V为滴定螯合物所消耗的EDTA标准溶液体积/L;V0为滴定空白所消耗的EDTA标准溶液的体积/L;M为钙的摩尔质量/g/mol;m为肽钙螯合物的质量/g。
1.4 统计分析
所有实验数据均至少有3个重复,结果以平均值±标准差的形式表示。采用SPSS 16.0进行统计分析,组间差异采用方差分析(ANOVA)中的Tukey HSD 测试,当P<0.05 时认为差异显著。
2 结果与分析
2.1 花生蛋白酶解工艺的优化
2.1.1 蛋白酶种类的影响
由图1可知,蛋白酶种类对花生蛋白的水解度和氮回收率以及水解产物的钙结合能力有重要影响,其中Alcalase 2.4 L的效果最好,木瓜蛋白酶次之,酸性蛋白酶效果最差。同时,Alcalase 2.4 L碱性蛋白酶对花生蛋白的水解度也远高于最适pH值为3.0的蛋白酶M(16.7%)[15],这是由于花生蛋白在碱性条件下可溶,因此能够与碱性蛋白酶充分接触而使得水解更为充分。这一超高的蛋白质回收率和水解度对于花生蛋白的综合利用具有重要意义,Ge等[21]也采用这一策略显著提高了玉米蛋白粉水解物的蛋白质回收率。同时,由图1还可以看出,花生蛋白水解物的钙结合能力与花生蛋白的水解度之间呈正相关,表明花生多肽可能主要通过其羧基与钙离子结合[7]。
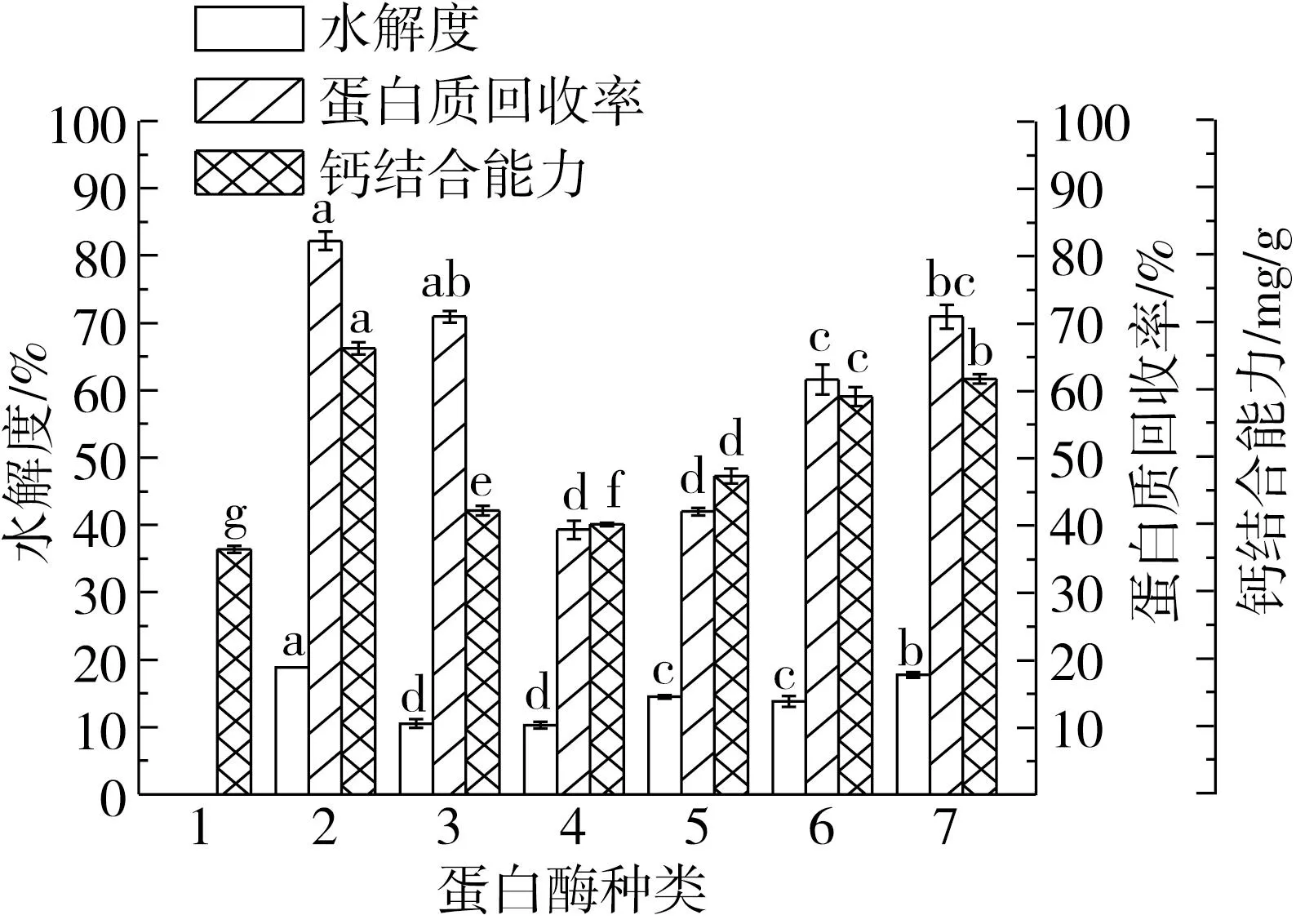
注:1为花生蛋白;2为Alcalase 2.4 L碱性蛋白酶;3为Neutrase 0.8 L中性蛋白酶;4为酸性蛋白酶;5为FlavourzymeTM蛋白酶;6为Protamex复合蛋白酶;7为木瓜蛋白酶。同一系列数据带不同字母表示差异显著,下同。图1 蛋白酶种类对花生蛋白水解度、蛋白质回收率及水解物钙结合能力的影响
2.1.2 双酶复合水解的影响
由于Alcalase 2.4 L对花生蛋白的水解能力及所得水解产物的钙结合能力均最强(图1),本实验将Alcalase 2.4 L与另外几种蛋白酶,包括木瓜蛋白酶、Protamex复合蛋白酶以及Corolase®LAP外切蛋白酶、ProteAXH肽酶进行复配,以期进一步提高花生蛋白的水解效果。由图2可知,双酶复合水解可以显著提高花生蛋白的水解效果以及水解物的钙结合能力,其中与ProteAXH肽酶复配时效果最好,花生蛋白的水解度、蛋白质回收率及水解产物的钙结合能力分别达到了32.19%、87.89%和84.09 mg/g,与Alcalase 2.4 L单酶水解时分别增加了70.95%、6.84%和26.98%。目前已知的对花生蛋白水解能力最强的是来自于黑曲霉HN 3.042(AspergillusnigerHN 3.042)的蛋白酶提取物,其水解度高达43.4%,但是蛋白质回收率为86.6%[22],与本实验相当;另外,本实验利用双酶水解法得到的花生肽的钙结合能力与用蛋白酶M水解得到的花生蛋白水解物的结果接近(82.5 mg/g)[23]。

注:1为 Alcalase 2.4 L;2为Alcalase 2.4 L+ProteAXH;3为Alcalase 2.4 L+Corolase® LAP;4为Alcalase 2.4 L+Protamex;5为Alcalase 2.4 L+木瓜蛋白酶。图2 Alcalase 2.4 L与其他蛋白酶复配对花生蛋白水解度、蛋白质回收率及水解物钙结合能力的影响
2.2 脱酰胺对花生肽钙结合能力的影响
脱酰胺可以将Asn和Gln转化为Asp和Glu从而释放出更多的羧基,进而增强多肽的钙结合能力。Yuan等[9]和Bao等[10]采用酶法实现了花生蛋白钙螯合肽的脱酰胺,本实验则采用酸法进行处理。由图3可知,用Alcalase 2.4 L单酶水解得到的花生肽脱酰胺后的钙结合能力达到了95.57 mg/g,相比未处理之前提高了44.32%;而Alcalase 2.4 L和ProteAHX肽酶双酶水解产物经脱酰胺后的钙结合能力更是达到了132.04 mg/g,与对照相比提高了57.10%,表明脱酰胺是提高花生肽钙结合能力的有效手段。这与袁兴宇等[23]的结果一致,即用谷氨酰胺酶对花生蛋白的蛋白酶M水解物进行脱酰胺处理后,水解物的钙结合能力由82.5 mg/g显著提高至135.26 mg/g,同时在大豆蛋白肽中也观察到了类似的效果[24,25]。这可能与花生蛋白中含酰胺的氨基酸含量较高有关,有研究表明,花生蛋白经硫酸脱酰胺化处理之后其在酸性条件下的溶解性提高了近5倍[26]。
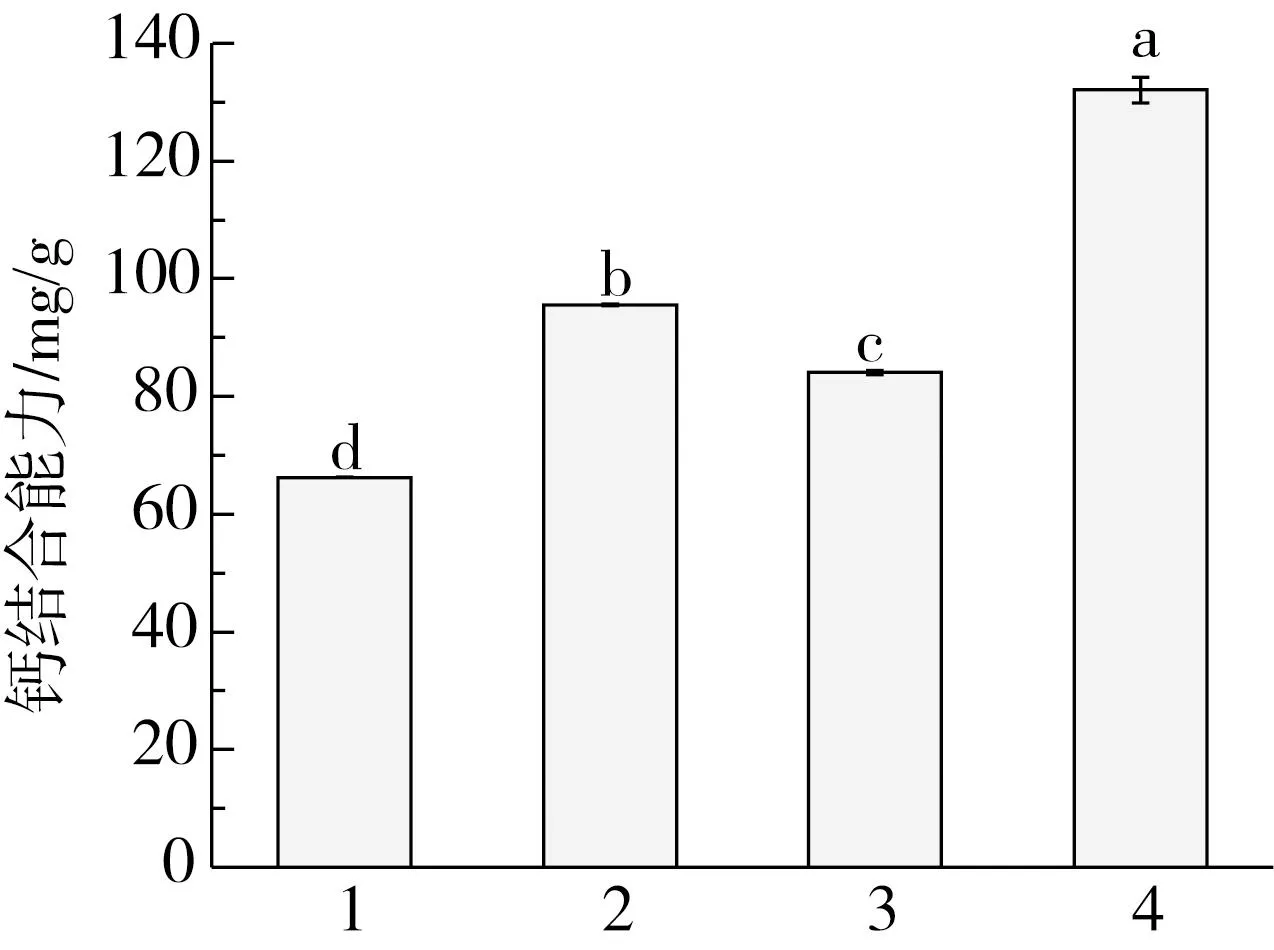
注:1为Alcalase 2.4 L;2为Alcalase 2.4 L+脱酰胺;3为Alcalase 2.4 L+ProteAXH;4为Alcalase2.4 L+ProteAXH+脱酰胺。图3 酸法脱酰胺处理对花生肽钙结合能力的影响
2.3 脱酰胺花生肽钙螯合工艺的优化
本研究采用单因素实验对脱酰胺花生肽的钙螯合工艺进行了优化。由图4可知,在pH 3.0时多肽的钙螯合能力最弱,为109.79 mg/g,在pH 4.0时显著增至116.40 mg/g,但与pH 5.0~7.0时相比无显著差异,在pH 8.0时则进一步显著增加至131.43 mg/g。这可能是由于花生肽的pKa值在pH 3.0左右,在此pH值下,部分羧基处于未解离状态,因此不能与钙离子结合或只能以配位键的形式与钙结合;当pH大于3.0时,多肽中的羧基处于解离状态,因此能够充分参与钙离子的结合;当pH值进一步提高时,钙离子的溶解性有所降低,化学反应平衡向着肽钙螯合物的方向偏移,导致多肽的钙结合能力进一步提升。这与猪骨胶原肽[16]和核桃肽[26]与钙的结合行为类似,即碱性环境有利于螯合物的形成。
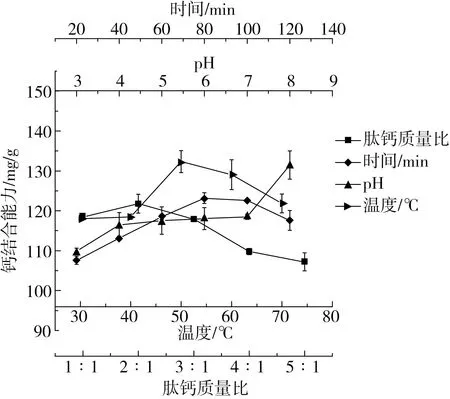
图4 不同因素对脱酰胺花生肽钙结合能力的影响
脱酰胺花生肽与钙离子结合的最适温度为50 ℃,随着温度的进一步升高或降低,多肽的钙结合能力均有所降低,这一温度与猪骨胶原蛋白肽与钙的结合行为相同[17]。这是由于温度升高加速了分子的迁移,从而使得多肽与钙离子的结合速度加快;但是当温度进一步升高时,多肽的结构发生了变化导致结合能力降低,同时温度过高也会加速螯合物的解离,进而导致多肽的结合能力下降。
脱酰胺花生肽与钙离子结合的最适时间为80 min,当反应时间进一步延长时结合能力略有下降,这与猪骨胶原肽与钙的结合行为类似,但后者的最适结合时间为40 min[17],表明花生肽与钙离子的结合过程是一个相对比较缓慢的过程。从图4可知,随着肽钙质量比的增大,钙结合能力呈先增大后减小的趋势,在2∶1时达到最大值,表明在此比例下两者达到了平衡。
脱酰胺花生肽与钙离子结合的最适条件为在pH 8.0和50 ℃下按照2∶1的质量比反应80 min,此时脱酰胺花生肽的钙结合能力达到了132.04 mg/g,与袁兴宇等[23]用谷氨酰胺酶对花生蛋白的蛋白酶M水解物进行脱酰胺处理后的水解物的钙结合能力接近(135.26 mg/g)。
2.4 脱酰胺花生肽的富集
Yuan等[9]通过超滤法对花生蛋白的蛋白酶M单酶水解物进行精制,得到了钙结合能力为(124.70±0.80)mg/g的级分。为了进一步提高花生肽的钙结合能力,本实验采用大孔树脂吸附的方式对其富集。在这种方法中,既可以通过吸附目标多肽然后再洗脱收集的方式得到高活性组分,也可以通过吸附除去低活性多肽的方式得到高活性组分,其中后者更加简单可行,因此本实验采用第2种策略对花生肽进行了富集,共选用了5种不同极性的大孔吸附树脂,包括非极性的D101和XAD-2、弱极性的AB-8、中极性的DM301和强极性的ADS-7,以及2种离子交换树脂,包括强碱性阴离子交换树脂IRA900CI和弱酸性强离子交换树脂IRC76RCF,进行了测试。
2.4.1 树脂的筛选
从图5中可以看出,大孔树脂种类对吸附液中剩余多肽的钙结合能力有重要影响,总体而言,经中等极性和强极性树脂吸附后剩余多肽的钙结合能力最强、多肽的损失率也最低,其中DM301吸附后剩余多肽的钙结合能力最高,达到157.49 mg/g,多肽损失率20.00%;经弱极性树脂AB-8吸附时多肽的损失率最大,剩余多肽的钙结合能力最弱。离子交换树脂类型对剩余多肽的钙结合能力也有重要影响,其中经阴离子交换树脂吸附后剩余多肽的钙结合能力要显著高于阳离子交换树脂,但是仍略低于DM301的吸附液。结果表明,疏水性较强且携带正电荷的多肽似乎更加有利于其结合钙离子,采用极性树脂或阴离子交换树脂是除去水解液中低钙结合能力组分的有效手段。
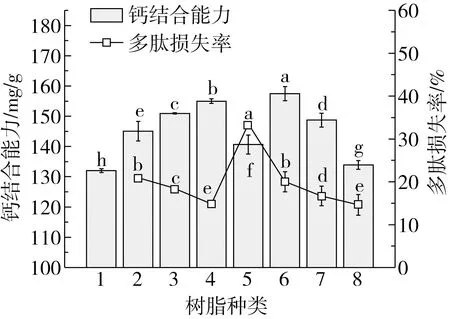
注:1为对照组;2为D101;3为XAD-2;4为ADS-7;5为AB-8;6为DM301;7为IRA900C1;8为IRC76RCF。 图5 树脂种类对脱酰胺花生肽钙结合能力及多肽损失率的影响
目前关于钙螯合肽构效关系的研究较少,现有文献表明多肽的分子质量及其携带基团如羧基、磷酸基等的数量对其钙结合能力有一定的影响[28],但是关于多肽极性及荷电特性的影响鲜见报道。由于DM301对水解液中低钙结合能力组分的吸附能力最强、造成的多肽损失率较小,因此对其吸附条件进行了进一步优化。
2.4.2 花生钙螯合肽富集条件优化
图6为pH值、温度、时间及质量比对脱酰胺花生肽钙结合能力的影响,当pH值为2.0时钙结合能力最强;当吸附温度为30 ℃时吸附液中多肽的钙结合能力最强,这与极性树脂的吸附特性较为一致;当吸附时间为12 h时树脂的吸附达到完全,进一步延长吸附时间不能继续提高多肽的钙结合能力;当树脂与多肽的质量比为10∶1时,水解液的钙结合能力趋于稳定,为162.08 mg/g。
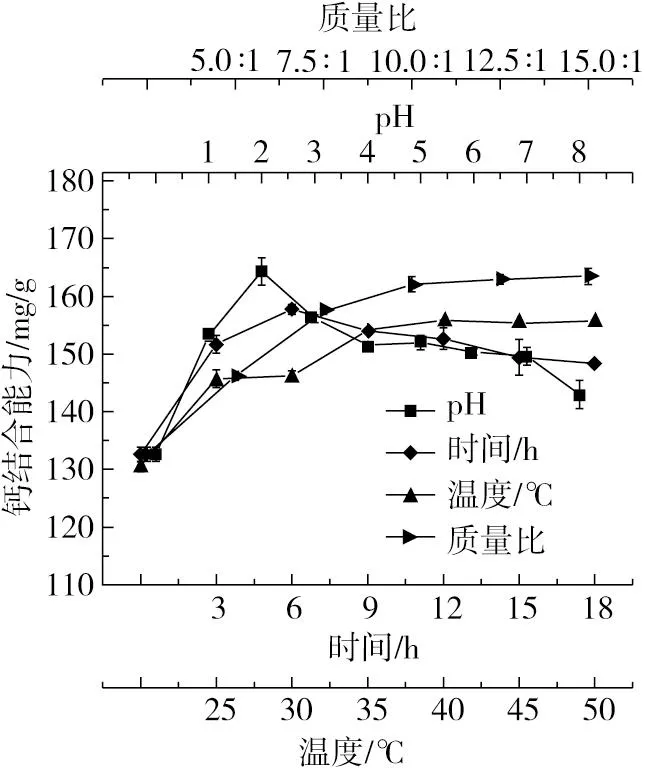
图6 不同因素对DM301大孔吸附树脂富集脱酰胺花生肽钙结合能力的影响
因此,图6表明,利用DM301富集脱酰胺花生肽的最佳条件为pH2.0、温度30 ℃、吸附时间12 h、树脂与多肽质量比10∶1,在此条件下,吸附液中多肽的钙结合能力达到了164.34 mg/g,与未富集前的132.04 mg/g相比增加了24.46%。该结合能力显著高于Yuan等[9]通过超滤富集得到的花生肽的(124.70 ± 0.80)mg/g,多肽的回收率也较高,表明本研究的双酶水解结合酸法脱酰胺及DM301树脂富集是从花生蛋白高效制备高活性钙螯合肽的有效方法。同时,本研究所得的多肽的钙结合能力也远高于葵花籽蛋白肽的83.50 mg/g[15]、大豆蛋白肽的53.03 mg/g[29]以及乳清蛋白肽的67.81 mg/g[30],表明花生肽是一种活力非常强的钙螯合剂。
2.5 脱酰胺花生肽及其钙螯合物的表征
2.5.1 荧光光谱分析
图7为不同浓度的CaCl2(5~25 μmol/L)分别与 0.2 mg/mL 的脱酰胺花生肽溶液混合后的荧光光谱图。可以看出,随着 CaCl2浓度的增加,355 nm处的发射峰强度减弱,这是因为钙离子的引入使花生肽的内源荧光发生淬灭。荧光强度降低是多肽螯合钙离子时结构发生变化的一个典型特征[31],在乳清蛋白[32]及鸭蛋白肽[33]与钙离子结合时也观察到了类似的现象,证实了花生肽与钙离子与发生了螯合作用。
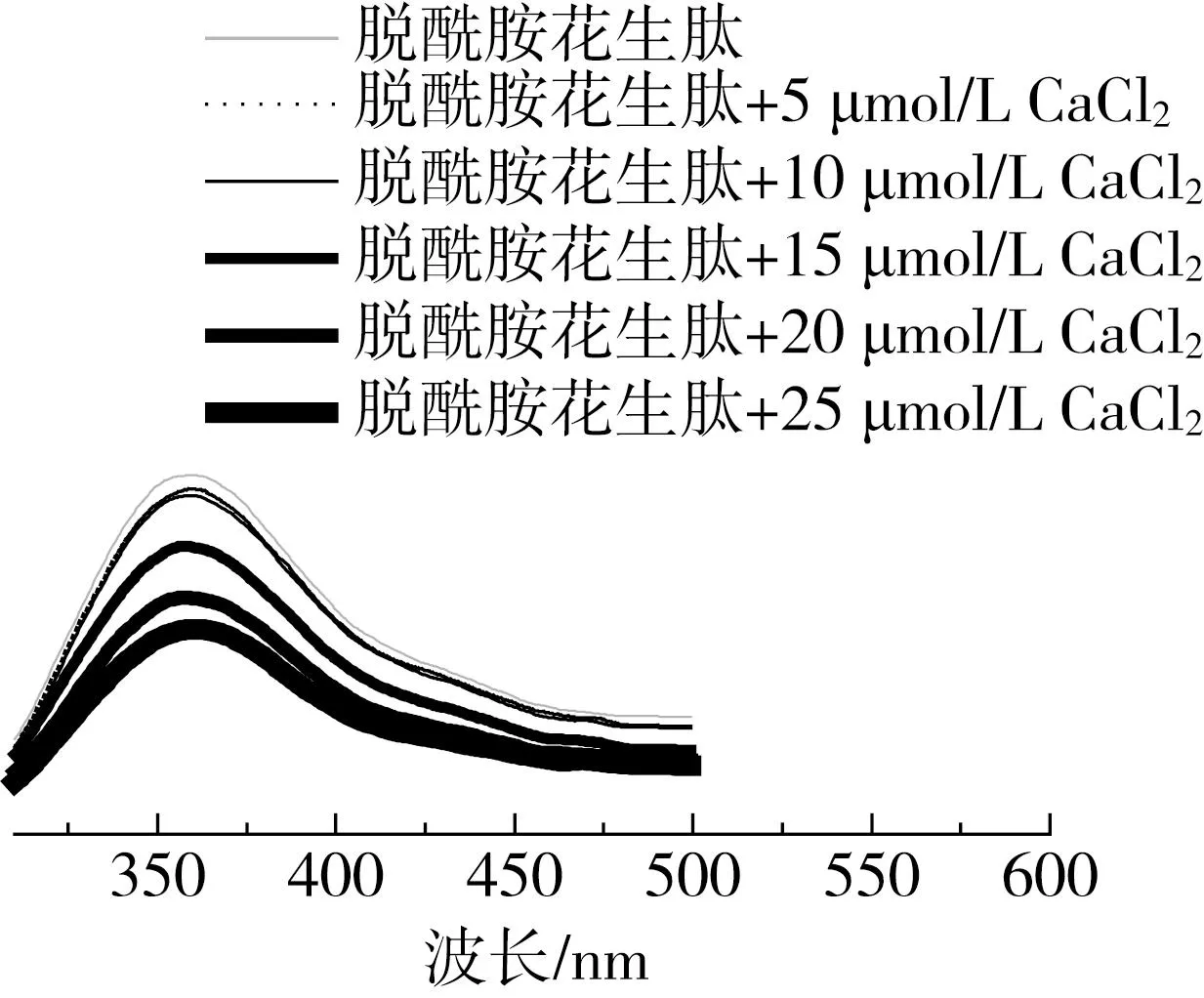
图7 脱酰胺花生肽及其钙螯合物的荧光光谱图
2.5.2 圆二色谱分析
由图8及表2可知,脱酰胺花生肽的α-螺旋、β-折叠、β-转角和无规则卷曲结构质量分数分别为13.6%、15.4%、21.5%和49.5%;与Ca2+螯合后,其α-螺旋和β-转角的含量无明显变化,但是β-折叠的质量分数增加至32.3%,而无规则卷曲质量分数降至29.4%,表明花生肽由原先的无序结构向更加有序、致密的结构转变。这一现象与Zhang等[34]的观察一致,即鳕鱼多肽与Ca2+螯合后其松散的二级结构变得规则、有序且紧密,进一步证实了花生肽与钙离子形成了螯合物。
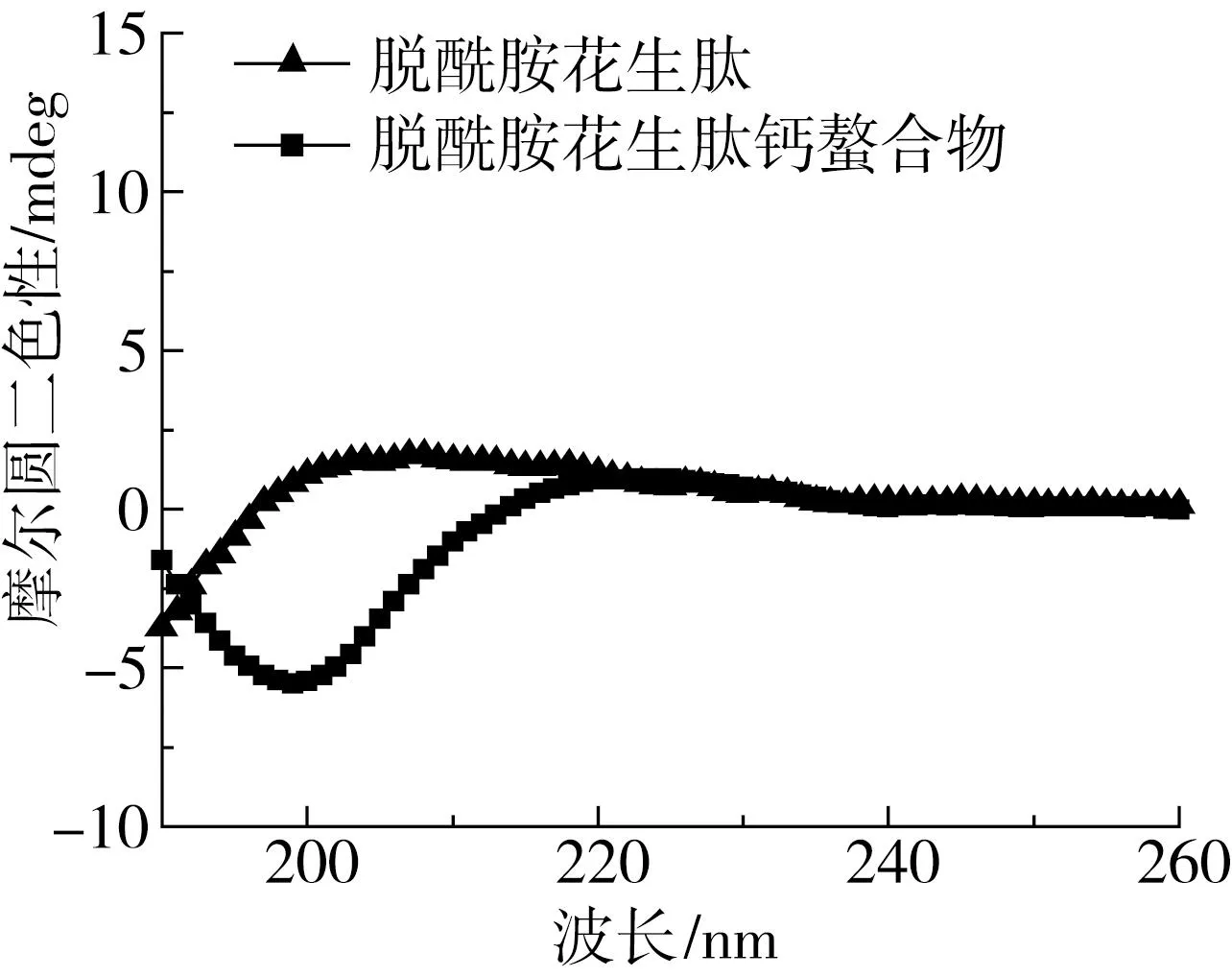
图8 脱酰胺花生肽及其钙螯合物的圆二色光谱图
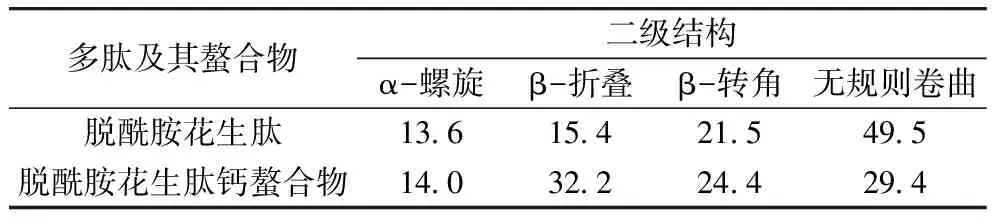
表2 脱酰胺花生肽及其钙螯合物的二级结构质量分数/%
2.5.3 傅里叶红外光谱分析

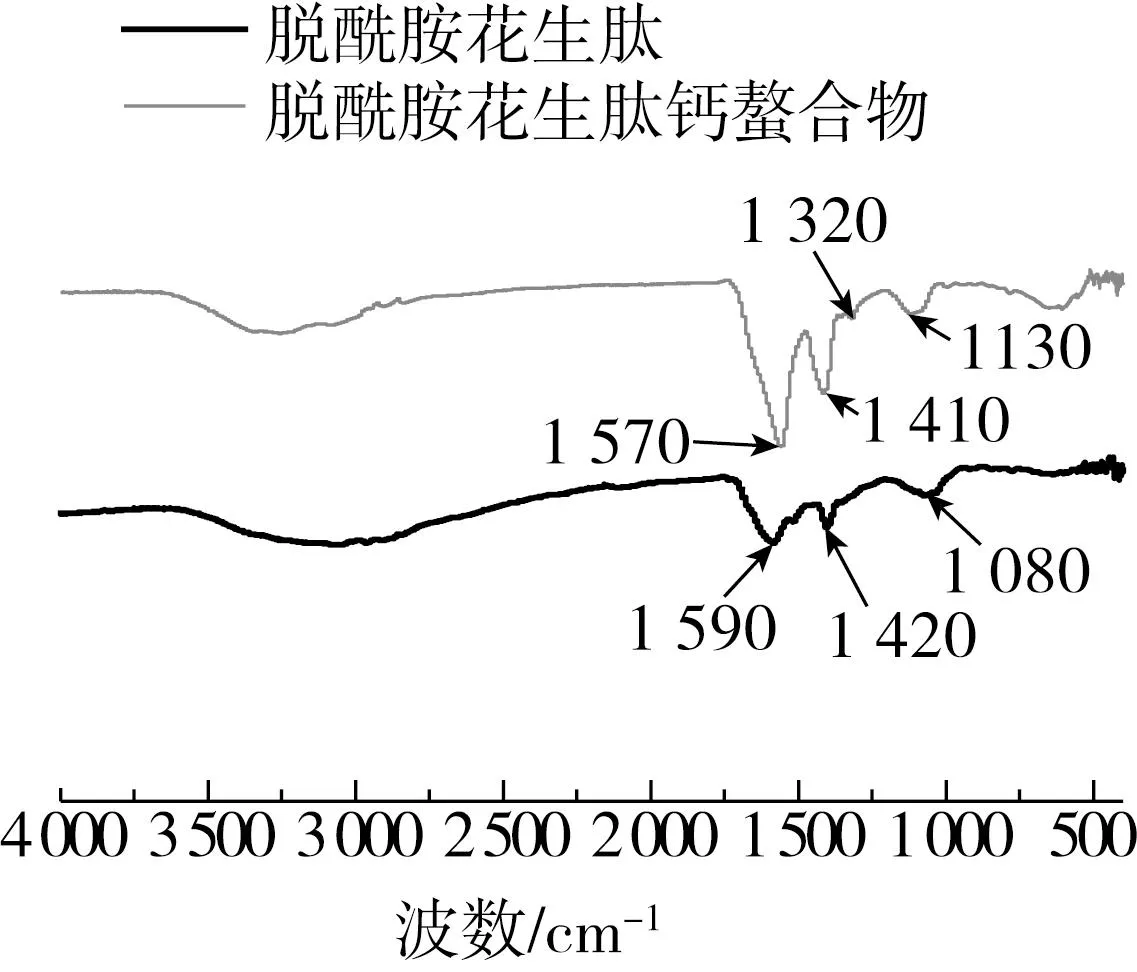
图9 脱酰胺花生肽及其钙螯合物的傅里叶红外光谱图
2.5.4 粒径、电势分析
如图10所示,与钙离子螯合后,花生肽的ζ电位从-38.1 mV 变为-10.5 mV,表明Ca2+与花生蛋白肽中带负电荷的羧基发生了螯合,这与图9的结果一致,这一现象和大豆蛋白肽与钙离子结合后电势的变化趋势一致[29];另外,与钙离子结合后,花生肽的粒径由244 nm急剧增加至831 nm,这可能是由于钙离子屏蔽了多肽链上的负电荷,降低了多肽链之间的静电斥力,并通过形成盐桥促进了多肽的聚集所致[36]。Fang等[27]研究核桃多肽与钙离子的结合行为时,也发现了添加钙离子会促进核桃多肽发生凝聚现象从而导致粒径增大。
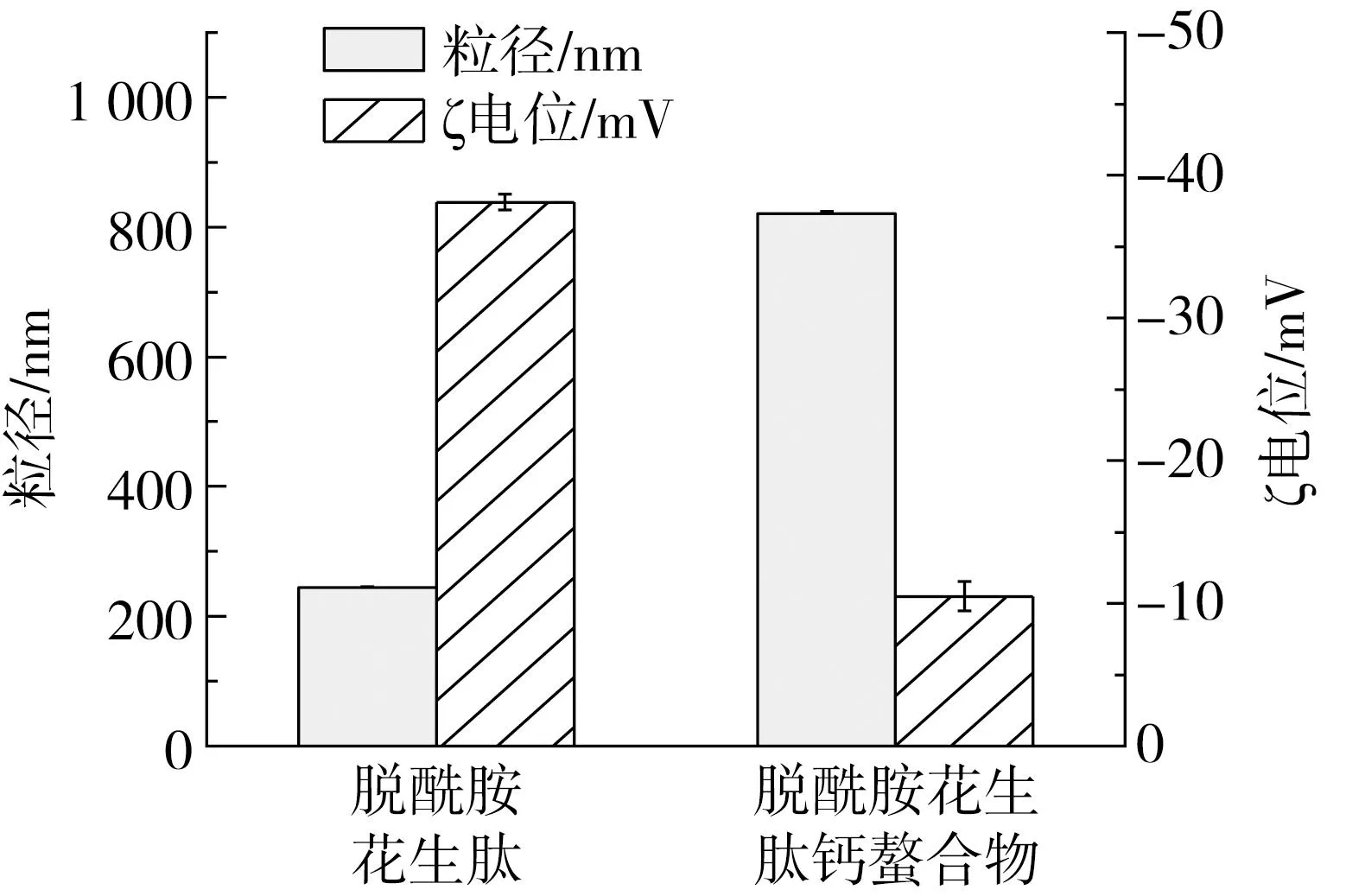
图10 脱酰胺花生肽及其钙螯合物的粒径与ζ电位
3 结论
采用Alcalase 2.4 L碱性蛋白酶和ProteAXH肽酶复合水解结合酸法脱酰胺和DM301大孔树脂吸附得到了钙结合能力达到164.34 mg/g的花生肽,该工艺的多肽总回收率达到72%。红外光谱分析表明,花生蛋白肽主要通过其羧基与钙离子发生结合作用。本实验所得花生蛋白肽的钙结合能力较高,同时制备工艺较为简单、蛋白质回收率高,因此具有较好的工业化生产价值,这对于提升花生蛋白的综合利用具有重要意义。在后续的产业化应用中,还需要对生产工艺进行进一步优化如适当提高酶解温度或加酶量以缩短酶解反应时间,并对被吸附多肽的洗脱工艺和功能性质进行系统研究,有利于花生多肽综合利用和降低生产成本。

