青稞蛋白降血糖肽的纯化、结构鉴定及体外降血糖和抗氧化活性
陶 瑾, 张莉方, 徐宁莉, 朱雪洋, 张国强
(安徽工程大学生物与食品工程学院,芜湖 241000)
青稞(HordeumvulgareL. var. nudum Hook. f.),属禾本科大麦属谷物,种植历史悠久,是藏区居民主要食粮和重要农产品加工原料[1]。青稞主要分布于青藏高原裸大麦区,一年一熟制,具有耐寒性强、生育期短、适应性广、产量稳定等优点[2,3]。青稞含有较高的蛋白质和不饱和脂肪酸,而且赖氨酸和色氨酸含量较其他谷物相比更高,“三高两低” 即高蛋白、高膳食、高维生素和低糖、低脂的膳食结构被当代健康生活饮食所提倡[4]。研究表明,饮食中长期添加大麦粉可以对高脂血症、糖尿病和动脉硬化起到一定的预防作用[5,6]。目前对于青稞中的β-葡聚糖[7]、酚类、黄酮类[8]和抑制性神经递质γ-氨基丁酸[9]研究较多。青稞的价值随着科技的发展在不断被挖掘,其应用范围也将扩大。然而,关于从青稞中提取具有降血糖活性肽的报道不多。
近年来,因为肽具有结构简单、活性高、生物友好性等优点[10],食源性生物活性肽研究数量的显著增加[11]。可以通过酶、化学和微生物水解的方法来制备生物活性肽,其中酶水解是最为有效和经济的方法[12]。特定的蛋白酶有独特的酶切位点,使蛋白质水解具有可预测性。由于肽结构的激素样特性或作为拮抗受体抑制剂的作用,可以发挥它们的生物活性,并且其生物活性主要是受到特定氨基酸序列的影响[13,14]。天然活性肽较合成降血糖和抗氧化剂相比,具有安全、无毒害的优势。多项研究已成功在动植物中分离和鉴定出具有降血糖活性的肽[15]。Shibu等[16]通过碱性蛋白酶水解马铃薯蛋白制备具有降血糖活性的马铃薯蛋白多肽(肽序列:DIKTNKPVIF),通过动物实验验证十肽可调节小鼠血糖、控制了血浆总甘油、总胆固醇、胰岛素和糖化血红蛋白水平,有益于改善胰岛和肝、心、肾组织损害。Gu等[17]通过木瓜蛋白酶水解小米蛋白分离出具有降血糖活性的小米蛋白多肽(肽序列:AATHTGPLS、TTPHGGPPILT),分子对接表明,2种多肽均可通过氢键和π-π占据DPP-IV的活性中心。胡宇航等[18]等通过碱性蛋白酶水解玉米蛋白获得具有α-糖苷酶抑制活性的玉米蛋白多肽(肽序列:APALLPF),通过细胞实验验证玉米蛋白多肽能抑制HepG2细胞(人体肝癌细胞)生物活性,促进细胞凋亡。
因此,植物蛋白拥有降血糖的潜力,综合青稞具有的降血糖功效,研究以青稞蛋白(藏青2000)为原料,探究青稞蛋白水解物的降血糖和抗氧化活性。通过评估α-葡萄糖苷酶抑制力和水解度筛选蛋白酶,确定酶解最佳工艺条件。然后以α-葡萄糖苷酶抑制活性为指标通过超滤和Sephadex G-15对粗肽分级纯化,测定其抗氧化、降血糖活性。纯化后活性最高的组分通过多肽测序进行进一步分析。研究旨在深入了解青稞肽的降血糖和抗氧化能力,并为未来具有降血糖功能的食品或药品开发提供参考。
1 材料与方法
1.1 材料与试剂
青稞蛋白:碱溶酸沉法制备;木瓜蛋白酶(2.0×105U/g)、菠萝蛋白酶(3.0×105U/g)、胰蛋白酶(1.3×105U/g)、中性蛋白酶(1.0×105U/g)、酸性蛋白酶(7.0×105U/g)、碱性蛋白酶(2.0×105U/g)、ABTS、DPPH、α-葡萄糖苷酶、4-硝基苯基-α-D-呋喃葡萄糖苷(pNPG)、α-淀粉酶(枯草杆菌)、葡聚糖凝胶G-15、3,5-二硝基水杨酸、碳酸钠、38%甲醛水溶液、酒石酸钾钠,试剂均为分析纯。
1.2 仪器与设备
PHSJ-5雷磁pH计,LGJ-10真空冷冻干燥机,超滤离心管(3、10、30 ku),SPECTRAMAX M5酶标仪,HL-1S恒流泵,BSZ-100型自动收集器,UV- 5200紫外可见分光光度计,Thermo EASY nLC液相色谱仪、Thermo Orbitrap Fusion Lumos质谱仪。
1.3 方法
1.3.1 蛋白酶的筛选
选取胰蛋白酶、菠萝蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、酸性蛋白酶,底物质量浓度取2 g/100 mL,加酶量取10 000 U/g,分别在各自最适酶解温度、最适pH的条件下,酶解4 h[19],选定α-葡萄糖苷酶抑制活性为主要测定指标,选定水解度为辅助参考指标,考察各蛋白酶酶解物的降血糖活性,确定最适蛋白酶。水解度(degree of hydrolysis,DH)的测定采用甲醛滴定法[20]进行测定,DH计算中氮含量采用GB/T 5009.5—2016 《食品中蛋白质的测定》测定。
1.3.2 酶解条件的确定及优化
取青稞蛋白以超纯水溶解,调节pH,加入选定最适蛋白酶,恒温且不停搅拌一段时间,酶解过程中保持溶液pH恒定,酶解结束后,在100 ℃水浴15 min灭酶,4 000 r/min的条件下离心15 min,取上清液即为青稞粗肽。考察在底物质量浓度(1、2、3、4、5 g/100 mL),加酶量(6 000、8 000、10 000、12 000、14 000 U/g),酶解时间(1、2、3、4、5、6 h)和酶解温度(30、40、50、60、70 ℃)条件下,以α-葡萄糖苷酶抑制活性为指标的降血糖活性。在此基础上,通过Box-Behnken响应面实验优化,选定自变量为底物浓度(A)、加酶量(B)、酶解时间(C),α-葡萄糖苷酶抑制率为相应值,响应面设计方案见表1。

表1 Box-Behnken设计因素水平表
1.3.3 体外降血糖活性的测定
1.3.3.1 α-葡萄糖苷酶抑制活性测定
依次取20 μL样品,50 μL PBS(0.2 mol/L,pH 6.8)和50 μL pNPG(1 mg/mL)溶液加入96孔酶标板, 37 ℃反应10 min,再加入50 μL α-葡萄糖苷酶,在37 ℃中反应30 min,最后添加80 μL Na2CO3(0.2 mol/L)终止反应,并在405 nm波长下测定吸光值[21]。
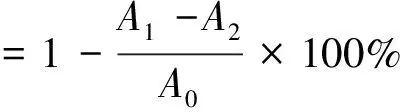
(1)
式中:A0为对照组吸光度;A1为样品组吸光度;A2为背景组吸光度。
1.3.3.2 α-淀粉酶抑制活性测定
取50 μL样品和50 μL α-淀粉酶加入5 mL离心管,37 ℃反应10 min,后加入150 μL 质量分数5%的淀粉溶液,37 ℃反应10 min,最后加入200 μL DNS试剂,沸水浴5 min终止反应,冷却后稀释至3 mL在540 nm处测定吸光度值[22]。计算同式(1)。
1.3.4 体外抗氧化活性的测定
1.3.4.1 ABTS+自由基清除率测定
ABTS+工作液的配制参考文献[23]。在96孔酶标板中加入50 μL样品和200 μL ABTS+溶液混匀静置10 min,于734 nm处测定吸光值。计算同式(1)。
1.3.4.2 DPPH自由基清除率测定
取样品1 mL和0.2 mmol/L DPPH 2 mL于比色管,混匀,室温下避光反应30 min,在517 nm波长处测定吸光值[24]。计算同式(1)。
1.3.5 青稞降血糖肽的分离纯化
1.3.5.1 超滤分级
将青稞粗肽酶解液依次通过30、10、3 ku的超滤离心管,离心条件为3 000 g,30 min。收集各截留液和过滤液可得4个组分分别为:>30 ku(E-1)、10~30 ku(E-2)、3~10 ku(E-3)和<3 ku(E-4)。冷冻干燥后测定4个组分的抗氧化、降血糖活性。
1.3.5.2 凝胶分离纯化
选定Sephadex G-15凝胶分离青稞小分子质量粗肽。将经过预处理的Sephadex G-15凝胶装入层析柱(2 cm×6 cm)中,样品溶液(20 mg/mL)经0.22 μm 滤膜处理后,上样量为1 mL,以超纯水洗脱,流速为0.5 mL/min,检测波长为214 nm,按出峰情况收集各个峰洗脱液并进行冷冻干燥[25],测定各个组分体外降血糖及抗氧化活性,将降血糖活性最强的组分进行结构鉴定。
1.3.6 降血糖肽结构鉴定
使用液质联用LC-MS鉴定肽结构。首先将E-4用20 μL溶解液(体积分数0.1%甲酸、5%乙腈)溶解,充分振荡涡旋,14 000 r/min,4 ℃离心20 min,上清液转移到上样管中,吸取8 μL液质联用检测。流动相A为0.1%甲酸(体积分数),流动相B为0.1%甲酸、80%ACN(体积分数)。梯度洗脱条件:0~7 min,VA∶VB=97∶3;7~46 min,VA∶VB=92∶8;46~51 min,VA∶VB=68∶32;51~56 min,VA∶VB=56∶54;56~60 min,VA∶VB=1∶99。质谱参数:分析时长60 min,一级质谱质核比扫描范围50 ~1 550m/z,分辨率为12×104,自动增益控制(AGC)4e5,最大进样时间50 ms;二级质谱分辨率 3×104,最大进样时间100 ms,自动增益控制(AGC)1e5,分离窗口m/z,TopN: 20,NCE/stepped NCE: 32。采用PEAKS软件进行数据库检索。
1.3.7 数据处理
实验均重复3次,实验数据均以平均值±标准偏差表示。采用Design Expert 11.0中的Box-Behnken设计优化酶解条件,Origin 2021和 SPSS 24.0统计数据和作图;采用Duncan和ANOVA法进行差异显著性检验和方差分析。
2 结果与分析
2.1 蛋白酶的筛选
由于不同蛋白酶的酶切位点及作用方式不同,对其生物活性大小也有影响[26]。由图1可知,不同蛋白酶水解产物对水解度和α-葡萄糖苷酶抑制活性均有差异,其中胰蛋白酶水解产物的水解度(达24.25%)和α-葡萄糖苷酶抑制活性(达61.63%)最高,显著高于其他蛋白酶(P<0.05)。其次为碱性蛋白酶,中性蛋白酶水解效果最差且α-葡萄糖苷酶抑制活性最低。研究表明,降血糖活性水解效果好的酶主要集中在胰蛋白酶和胃蛋白酶、碱性蛋白酶中[27]。冯俊[28]通过碱性蛋白酶水解茶籽粕蛋白,水解度最高的组分其α-葡萄糖苷酶抑制活性也是最佳的。实验表明水解度与α-葡萄糖苷酶抑制活性有一定相关性,根据实验结果选定胰蛋白酶进行后续实验。
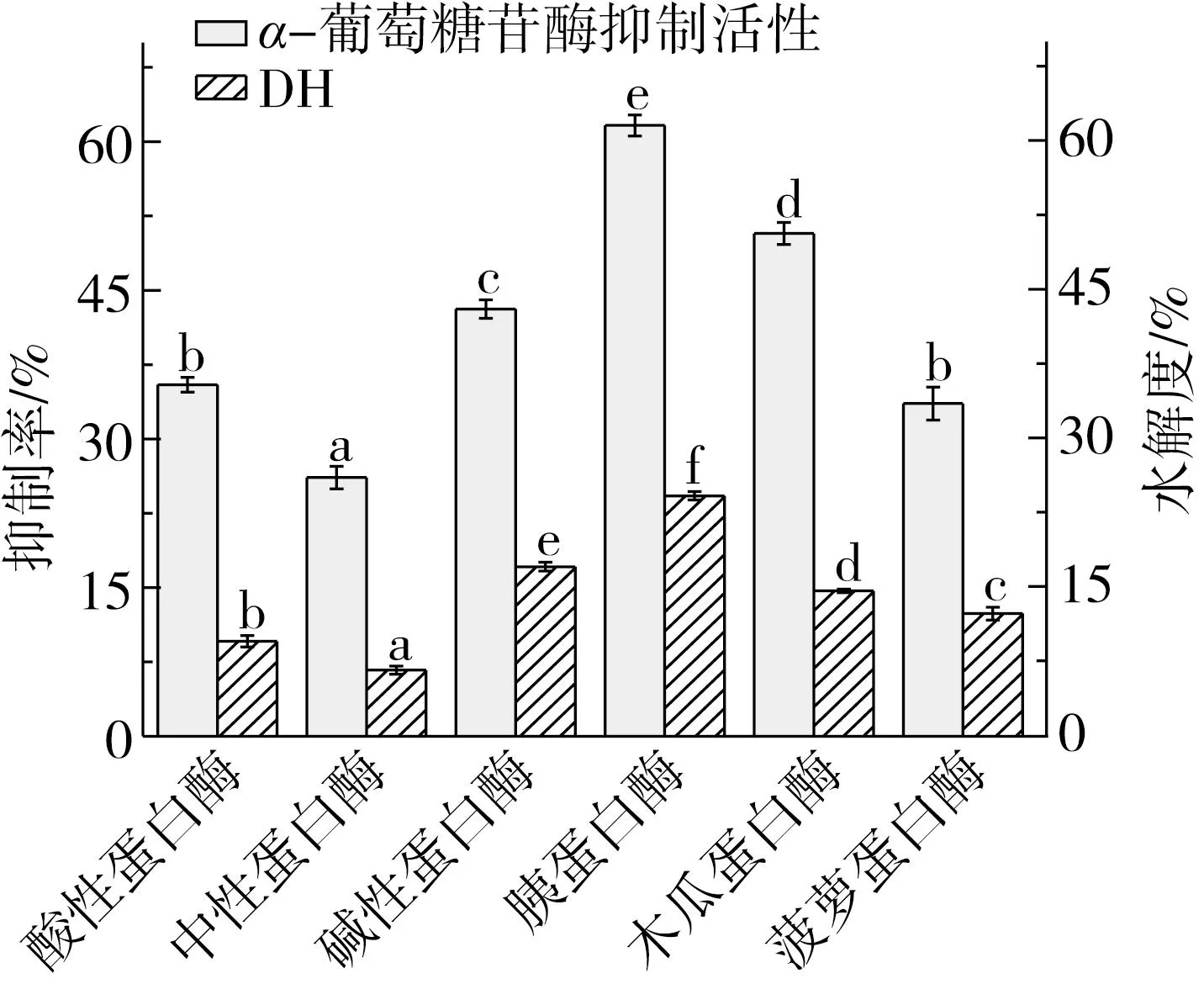
图1 不同蛋白酶水解产物的α-葡萄糖苷酶抑制率和水解度
2.2 单因素实验结果
由图2可知,底物浓度对α-葡萄糖苷酶抑制活性的影响最大,底物质量浓度在3 g/100 mL达到最大,呈现先上升后下降的趋势,说明增加一定的底物浓度有利于获得较高α-葡萄糖苷酶抑制活性的肽。其次的影响因素为酶解时间,3 h后,酶作用于酶切位点,肽链长度缩短,氨基酸组成改变,从而使得抑制率明显降低[29],随着酶解时间到4 h后,α-葡萄糖苷酶抑制活性趋于稳定略有下降,可能的原因为蛋白被过度水解为短肽降低了α-葡萄糖苷酶抑制活性。底物浓度固定后,随着加酶量的增加,酶解程度增加,α-葡萄糖苷酶抑制活性也相应增加,在添加量达10 000 U/g后趋势变缓。当酶解达到饱和状态时反应速率由底物质量分数决定,继续增加酶量对水解度的影响不大[30]。酶解温度在35 ℃时,α-葡萄糖苷酶抑制活性最高,整体随酶解温度的升高呈现先上升后下降的趋势,在酶的最适温度范围附近,酶解效率越高,高温会破坏蛋白酶的结构从而降低水解效率[31]。
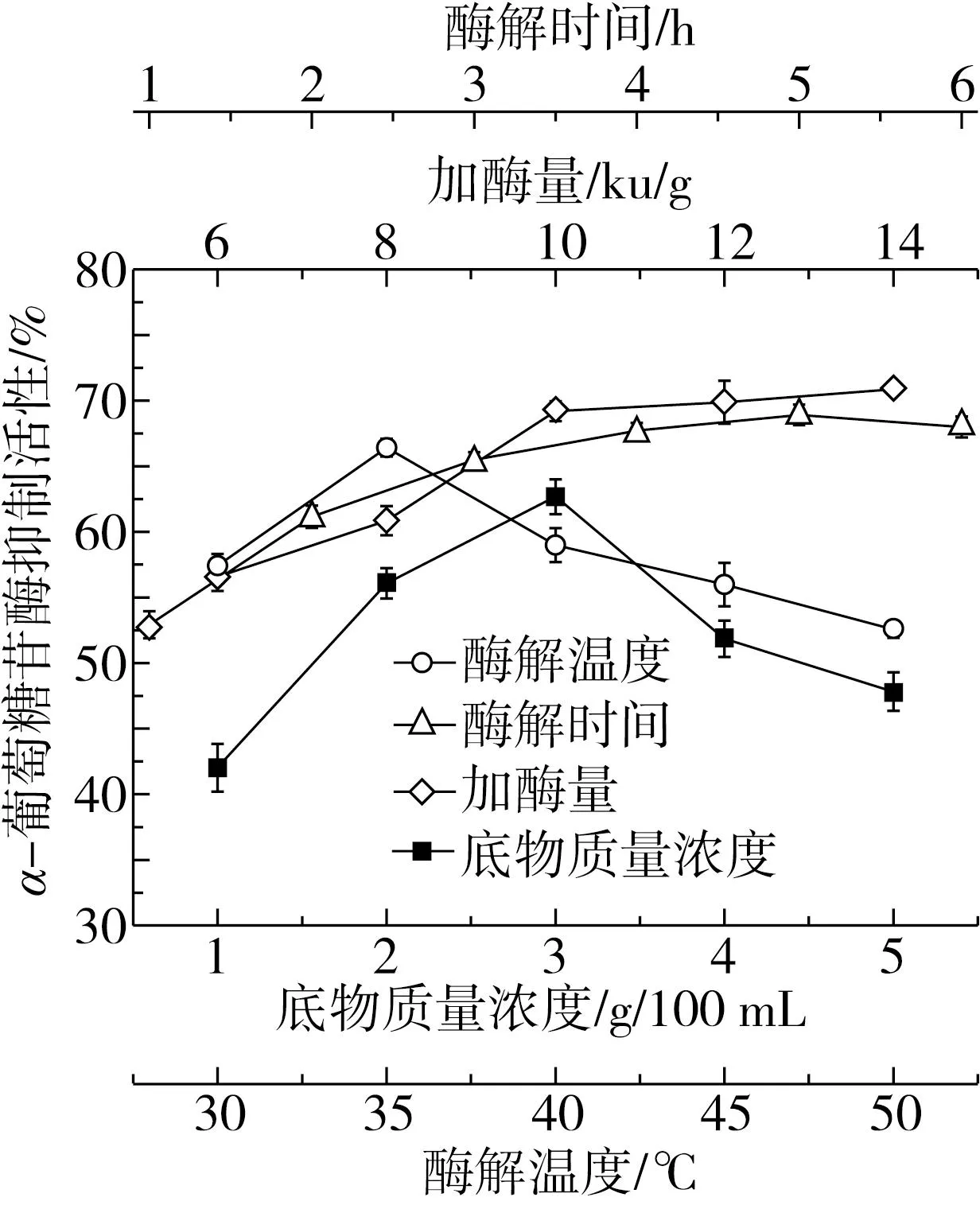
图2 单因素对α-葡萄糖苷酶抑制活性的影响
2.3 响应面分析结果
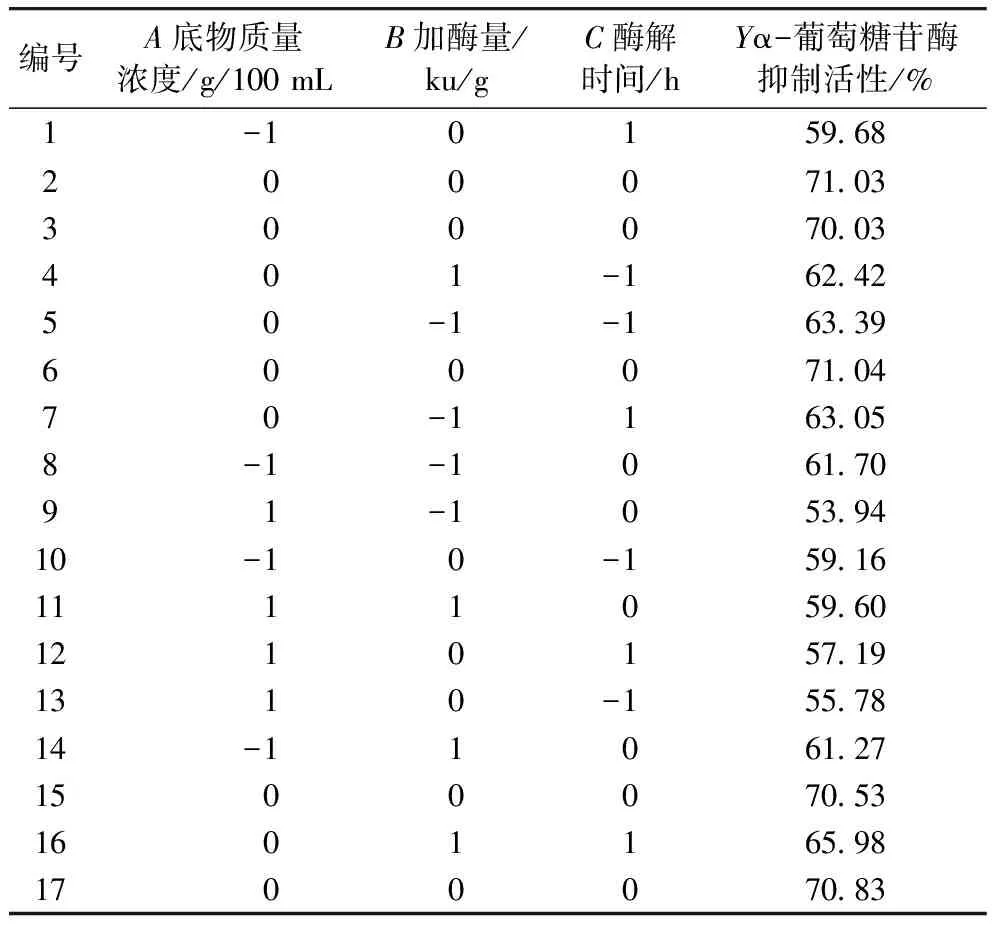
表2 响应面设计及结果
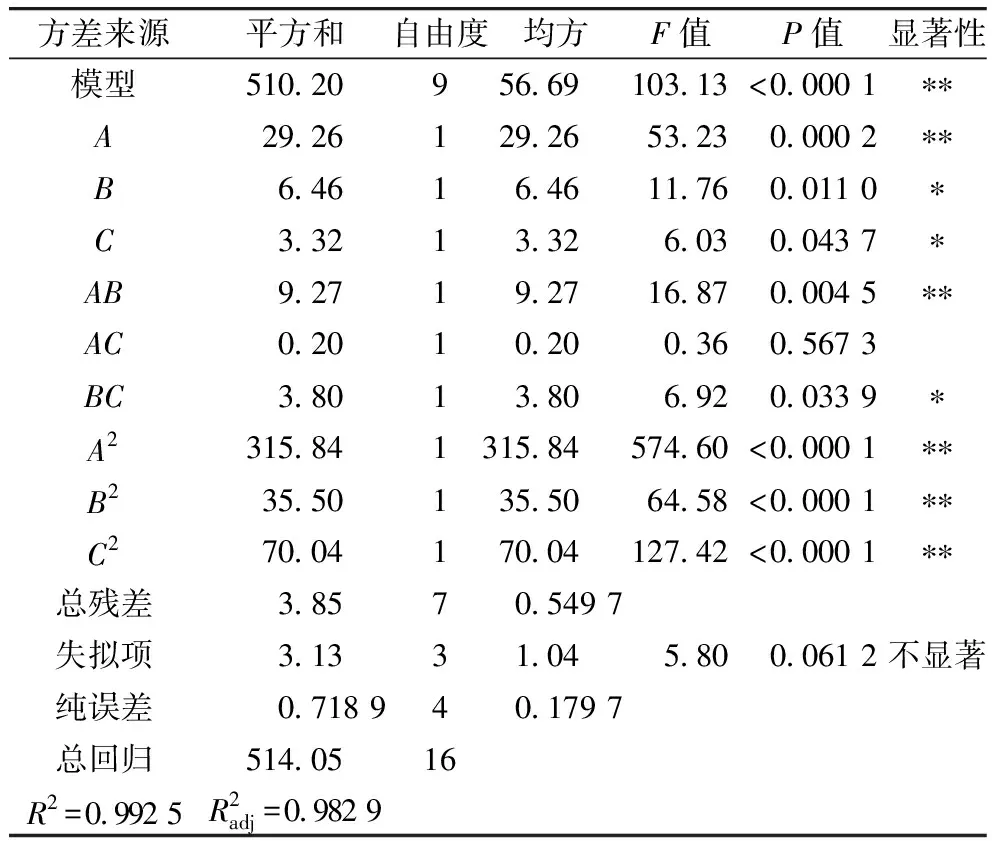
表3 方差分析结果
由表3可知,AB、BC两两因素具有交互作用(P<0.05),AC两两因素间差异不显著(P>0.5)。软件分析得出最佳酶解工艺参数为:底物质量浓度为2.903 g/100 mL、加酶量为12 291 U/g、酶解时间为5.093 h,此条件下,α-葡萄糖苷酶抑制活性为70.88%,根据实际实验情况,将制备工艺参数修正为底物质量浓度为3 g/100 mL、加酶量为12 000 U/g、酶解时间为5 h,在此条件下做3次平行验证实验,α-葡萄糖苷酶抑制活性为70.96%,与模型预测值基本一致,实验设计方案可行。
2.4 超滤分级
采用胰蛋白酶进行青稞蛋白水解,水解液依次通过装有截留分子质量为 3、10、30 ku 的超滤离心管后,分离可得分子质量分别为>30、10~30、3~10、<3 ku的4种不同分子质量段的超滤组分并对其命名。超滤后的各组分均具有抗氧化和降血糖活性,4个组分降血糖及抗氧化能力见表4。分级后的水解产物有显著差异(P<0.05)。降血糖活性中,E-4的α-淀粉酶和α-葡萄糖苷酶抑制活性显著高于其他组分(P<0.05),为(1.790±0.066)、(15.21±0.096)mg/mL;抗氧化活性中,E-4对ABTS和DPPH自由基的能力也显著高于其他组(P<0.05),达(5.120±0.082)、(8.070±0.057)mg/mL。此结果与赵婉宏等[32]得到超滤后最小的组分具有最好的降血糖活性和抗氧化活性,对α-葡萄糖苷酶抑制率最高,对DPPH、羟自由基清除能力和还原力也远高于其他超滤组分的结果一致。张一帆等[33]对杨梅蛋白水解液超滤得到具有良好的抗氧化和α-葡糖糖苷酶抑制活性的最佳分子质量段为<5 ku。芦鑫等[34]研究表明,芝麻蛋白水解物显示出较强的抗氧化活性的组分也为低分子质量组。这些肽具有较强生物活性可能归因于其低分子质量,因此选定分子质量<3 ku的E-4组分为下一步分离对象。
2.5 凝胶分离
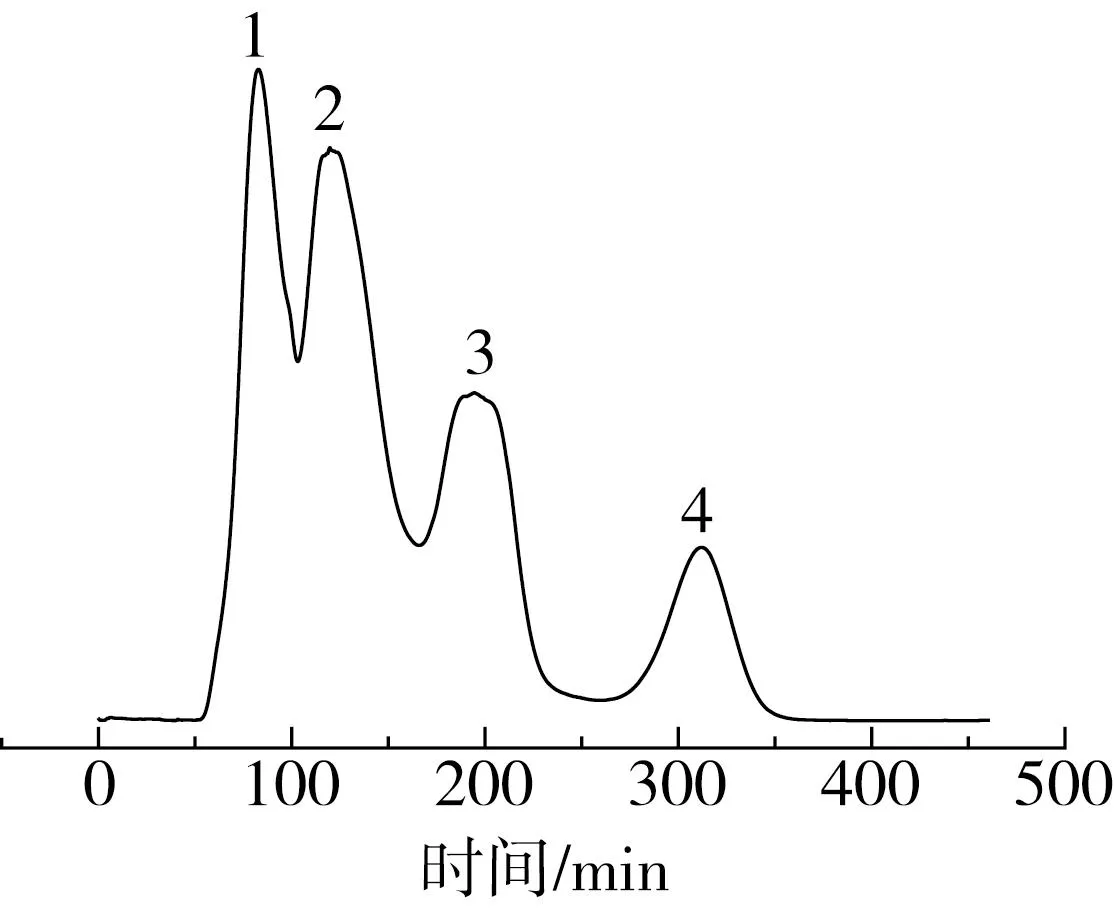
图3 Sephadex G-15分离图谱
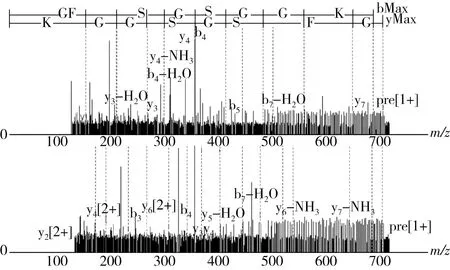
图4 青稞蛋白多肽的二级质谱图
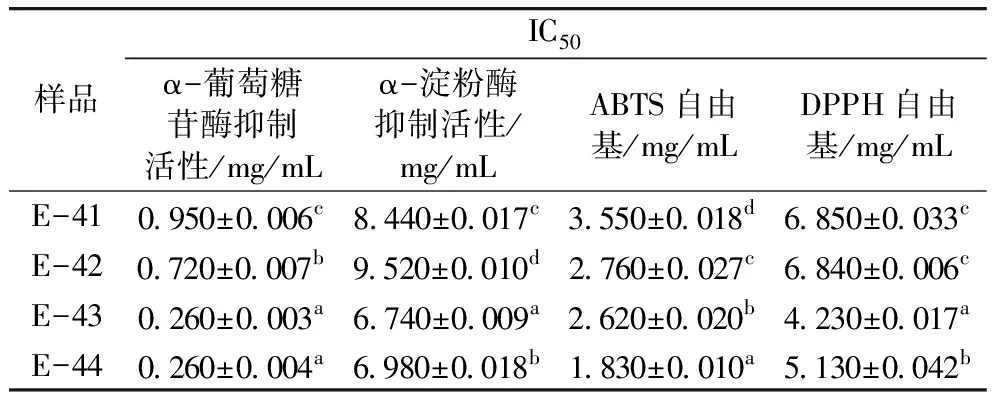
表5 凝胶分离组分的降血糖及抗氧化活性
2.6 质谱鉴定
通过LC-MS/MS测定和对比数据库检索,可得2条八肽,氨基酸序列为GFSGSGGK,即甘氨酸(Gly)-苯丙氨酸(Phe)-丝氨酸(Ser)-甘氨酸(Gly)-丝氨酸(Ser)-甘氨酸(Gly)-甘氨酸(Gly)-赖氨酸(Lys),分子质量分别为695.32 u,荷质比m/z为348.67;氨基酸序列为GVGAGAAR即甘氨酸(Gly)-缬氨酸(Val)-甘氨酸(Gly)-丙氨酸(Ala)-甘氨酸(Gly)-丙氨酸(Ala)-丙氨酸(Ala)-精氨酸(Arg),分子质量分别为657.36 u,荷质比m/z为329.68。2条肽链均由亲水、疏水和碱性氨基酸组成,其N端为亲水氨基酸且C端为碱性氨基酸。Famuwagun等[36]研究发现对碱性蛋白酶水解茄子叶蛋白中α-淀粉酶抑制活性最好的肽段氨基酸序列含有碱性、疏水碱性氨基酸结构。Li等[37]以胃蛋白酶和胰蛋白酶水解小球藻中分离出具有DPP-IV抑制活性的多肽结构末端氨基酸为碱性氨基酸。Fernando等[38]以枯草杆菌蛋白酶-胰蛋白酶-风味酶三酶复合水解沙丁鱼毛囊蛋白分离出2条六肽氨基酸,其序列N端为亲水氨基酸,C端为碱性氨基酸。因此,推测青稞蛋白多肽的降血糖活性可能与氨基酸序列的组成有关。
3 结论
研究筛选出胰蛋白酶为最适蛋白酶水解青稞蛋白,确定青稞蛋白水解最佳工艺条件为底物质量浓度为3 g/100 mL、加酶量为12 000 U/g、酶解时间为5 h。将酶解后的粗肽通过超滤和Sephadex G-15柱分离纯化得到具有较高生物活性的目标蛋白肽。最佳组分E-43的α-葡萄糖苷酶和α-淀粉酶抑制活性抑制能力、ABTS和DPPH自由基清除能力的IC50分别为0.26、6.74、2.62、4.23 mg/mL。质谱测得活性肽氨基酸序列为:Gly-Phe-Ser-Gly-Ser-Gly-Gly-Lys、Gly-Val-Gly-Ala-Gly-Ala-Ala-Arg,荷质比m/z为348.67、329.68,分子质量为695.32、657.36 u。2条八肽的氨基酸序列N端均为亲水氨基酸,C端均为碱性氨基酸。通过将氨基酸序列与现有研究中具有降血糖活性的氨基酸序列比较推断其较强的降血糖能力可能与氨基酸组成有关。证明了青稞蛋白肽具有潜在药理价值。

