大熊猫白血病抑制因子RNAi干扰载体的构建及应用
李非平,刘玉良,王神飞,张梦诗,胡贤彪,安俊辉,王东辉,张名岳,侯 蓉,蔡开来
(成都大熊猫繁育研究基地四川省濒危野生动物保护生物学重点实验室,四川 成都 610081)
大熊猫(Ailuropoda melanoleuca)是中国特有的珍稀濒危动物.根据第四次全国大熊猫调查,全球野生大熊猫数量已达到1 864只,其中80%以上分布在四川.由于栖息地的缩小及破碎化,导致遗传交流中断,遗传多样性不断缺失[1],经过我国的不懈努力使得大熊猫的数量明显上升,虽然国际自然保护联盟已将这一标志性物种从“濒危”列为“易危”.但是,大熊猫的保护仍需要持续努力,为了防止大熊猫重新面临濒危,我国已经进行了多方面的科学研究及管理工作.目前,大熊猫的研究主要集中在栖息地的分布[2]、肠道微生物[3]、疾病的预防和治疗[4]及分类[5]等.本实验室已经成功地从大熊猫的骨髓中分离了间充质干细胞(MSCs)[6],为大熊猫细胞生物学相关的基础研究提供了新的资源.
骨髓间充质干细胞(BM-MSCs)是存在于骨髓和身体大多数结缔组织中的一类具有高度的自我更新能力的成体干细胞[7].因其来源丰富,在体外易分离和扩增,低免疫源性,且不存在伦理问题,可用于同种异体移植等特性成为继胚胎干细胞后备受关注的细胞.BM-MSCs 可分化成多种细胞,如成骨细胞[8]、软骨细胞[9]、脂肪细胞[10]、神经细胞[11]、心肌细胞[6]及肝细胞[12]等.同时,BM-MSCs 还因其独特的增殖分裂模式使外源基因易于导入和表达[13],可作为基因治疗载体[14],在组织损伤修复,如神经系统损伤后再生修复[15]、自身免疫疾病治疗[16]中有广阔的应用前景.
LIF 是白细胞介素-6(interleukin-6,IL-6)家族中的一个多效性细胞因子,是一种分子量介于38 kD~67 kD的分泌型糖蛋白.LIF的生物学活性主要有:(1)调节细胞的增殖、分化和表型;(2)抑制脂蛋白脂酶活性,降低3T3-L1脂肪细胞对游离脂肪酸的摄取;(3)促进骨的重吸收,这种作用可能是通过 LIF 刺激成骨细胞合成前列腺素所介导的;(4)诱导肝脏急性期蛋白的产生.同时,Oskowit等通过miRNA干扰hBMSCs的LIF表达发现,其成骨及成脂分化能力加强[17];体内 LIF 受体的缺失导致了胎儿骨组织和其他间叶组织分化异常则进一步说明了 LIF 对维持 MSCs 功能的重要性.
然而,到目前为止LIF对大熊猫干细胞生长及发育的调控作用还未有报道.因此,本研究拟通过构建LIFRNAi 慢病毒 pLKO.1 puro-LIF-down无扰质粒,以慢病毒感染的方式将其导入PDBM-MSCs 中,抑制LIF在PDBM-MSCs的表达,进而研究LIF抑制后对PDBM-MSCs生长及干性的影响,为大熊猫干细胞的体外培养及干性机制的研究奠定基础.
1 材料方法
1.1 材料
low-glucose Dulbecco’s modified Eagle medium (LG-DMEM 货号:3160083,美国Gibco);胎牛血清(FBS 货号:FSP500,美国 Prime);basic fibroblast growth factor (bFGF,货号:PHG0026,美国 Gibco);Anti-antibiotic (货号:15240052,美国 Gibco);青链霉素 (货号:SV30010,美国 HyClone);Phosphate-Buffered Saline (PBS,货号:C2012500BT,美国 Gibco);TrypLE Express (货号:12604-013,美国Gibco);pLKO.1 puro载体 (货号:LM-1792,上海 LMAI Bio );DNA凝胶回收试剂盒 (货号:D0056,上海 碧云天);氨苄霉素 (货号:ST007,上海 碧云天);LipofectamineTM2000 转染试剂 (货号:11668019,美国 Thermo);嘌呤霉素 (货号: ST551,上海 碧云天 );Rneasy MiNi Kit(50) (货号:163050725,德国Qiagen );PrimeScript RT reagent Kit(货号:RR047A,日本TaKaRa);FastStart Essential DNA Green Master (货号:6402712001,瑞士Roche) .
1.2 大熊猫骨髓间充质干细胞培养
MSCs 的分离参照刘玉良等[6]对PDBM-MSCs的分离方法.在无菌条件下,切除死亡后的大熊猫的股骨和胫骨,剔除骨头上的所有结缔组织.剪开骨头的两端,用20 mL的注射器抽满完全培养基反复冲洗骨髓至60 mm培养皿中.完全培养基成分:LG-DMEM,10% FBS,1×Anti-antibiotic,10 ng/mL bFGF.轻轻吹打所得细胞制成单细胞悬液,将细胞在37 ℃,5% CO2下孵育.4 h后,移除培养基,用PBS溶液冲洗3次,再加入完全培养基培养贴壁细胞5 d,每2 d换液1次.细胞达到80%融合,用TrypLE Express消化,以5×103/cm2的细胞密度进行接种.
1.3 LIF RNAi 慢病毒载体的构建包装与转染
1.3.1LIFRNAi 载体的构建
设计3对大熊猫LIF基因靶点序列(siRNA1-3,如表1),并将其构建到pLKO.1 puro慢病毒载体,载体中含有Puro 抗性和Amp 抗性,酶切位点选用AgeI和EcoRI,双酶切后用 1% 琼脂糖凝胶电泳分离,从胶上切取目的载体,使用胶回收试剂盒回收纯化目的载体.siRNA 经3′和5′的单链退火获得shRNA后,与线性回收纯化目的载体行连接反应后转化DH5α感受态细胞,在含氨苄霉素的LB平板37 ℃培养过夜筛选重组克隆.平板挑选克隆接种至LB培养基37 ℃ 250 r/min摇菌14 h,将菌液送擎科生物技术有限公司测序.
1.3.2 HEK293T 细胞病毒包装及滴度检测
HEK293T细胞融合率达到60%~70%进行转染,转染体系:100 mm 平板中,加入 10 μg 慢病毒表达载体,10 μg 慢病毒包装质粒,50 μL Lipofectamine2 000.4 h后除去含转染试剂的培养基,加入10 mL HEK293T新鲜培养基,37 ℃ 孵育48 h,收集含病毒颗粒的上清.4 ℃ 2 000×g离心10 min,除去细胞碎片.用 0.45 μm 滤器过滤收集上清.通过荧光显微镜应用倍比稀释法检测病毒的滴度.
1.3.3 慢病毒转染
将P2代 PDBM-MSCs 以 5×103/cm2的细胞密度接种于六孔板中,完全的培养基成分为 LG-DMEM,10% FBS,1×青链霉素,10 ng/mL bFGF,置于二氧化碳培养箱中培养24 h,分别加入3种 pLKO.1 puro-LIF-down 抑制表达慢病毒及阴性对照组pLKO.1-puro-Scramble,继续培养 12 h 后更换新鲜培养液,继续培养48 h后加入嘌呤霉素筛选阳性转染克隆.应用 q-PCR 检测LIFmRNA 表达水平.
1.4 q-PCR 检测
选P2代PDBM-MSCs分别进行pLKO.1 puro-LIF-down抑制表达慢病毒及阴性对照组pLKO.1-puro-Scramble感染72 h后的细胞,使用Rneasy MiNi Kit 提取总 RNA,方法参照试剂盒说明书进行.PrimeScript RT reagent Kit试剂盒逆转录为cDNA,方法参照厂商说明书.FastStart Essential DNA Green Master 检测LIF、CDK2、CCNB2、CCND3、P53、P16、P27、Caspase3等基因在 mRNA 水平的表达量,方法参照厂商说明书.q-PCR循环95 ℃变性3 min,95 ℃ 10 s、58 ℃~60 ℃ 20 s、72 ℃ 30 s,循环 40 次.用于扩增的引物列于表 2 中.

表2 引物序列
1.5 统计学分析
所有结果均来自至少3个独立的实验.应用统计软件 SPSS for Windows 13.0 t 检验来确定差异显著性.P<0.05 时为差异显著.
2 结果
2.1 LIF RNAi 慢病毒重组质粒构建与筛选
DNA测序结果证明 3 个重组质粒pLKO.1 puro-LIF-down中的目的片段均与预期的序列一致(图 1),说明目的片段已成功克隆至慢病毒表达载体中.将重组质粒pLKO.1 puro-LIF-down与空质粒pLKO.1-puro-Scramble分别包装至HEK293T细胞 48 h 后,分别对其病毒滴度进行测定,结果显示重组质粒pLKO.1 puro-LIF-down-1的病毒滴度为(1×106TU/mL),pLKO.1 puro-LIF-down-2的病毒滴度为(1.5×106TU/mL),pLKO.1 puro-LIF-down-3的病毒滴度为(0.9×106TU/mL),对照组空质粒pLKO.1-puro-Scramble的病毒滴度为(3×106TU/mL).

图1 重组质粒 pLKO.1 puro-LIF-down 中的目的片段测序
2.2 LIF RNAi 慢病毒转染 PDBM-MSCs
将 PDBM-MSCs 分别用重组质粒 pLKO.1 puro-LIF-down 慢病毒与空质粒 pLKO.1-puro-Scramble 慢病毒进行感染,72 h 后空质粒 pLKO.1-puro-Scramble 组细胞增殖融合至 80%~90%,呈旋涡状或簇状有序排列(图2-A),而LIF抑制组细胞增殖融合至 60%~70%,细胞排列不规则(图2-A).采用 q-PCR 的方法检测 pLKO.1 puro-LIF-down 慢病毒对 PDBM-MSCs 中LIF的抑制效果,结果显示感染 3 种慢病毒后 PDBM-MSCs 的LIF在 mRNA 水平上的表达量相对于空质粒 pLKO.1-puro-Scramble 慢病毒均显著降低(图2-B),但是相比于 pLKO.1 puro-LIF-down-2(0.80±0.02)、pLKO.1 puro-LIF-down-3(0.74±0.17)的抑制作用 pLKO.1 puro-LIF-down-1(0.55±0.03)抑制效果更为显著(图2-B),因此本实验后期均采用 pLKO.1 puro-LIF-down-1 慢病毒作为实验材料.
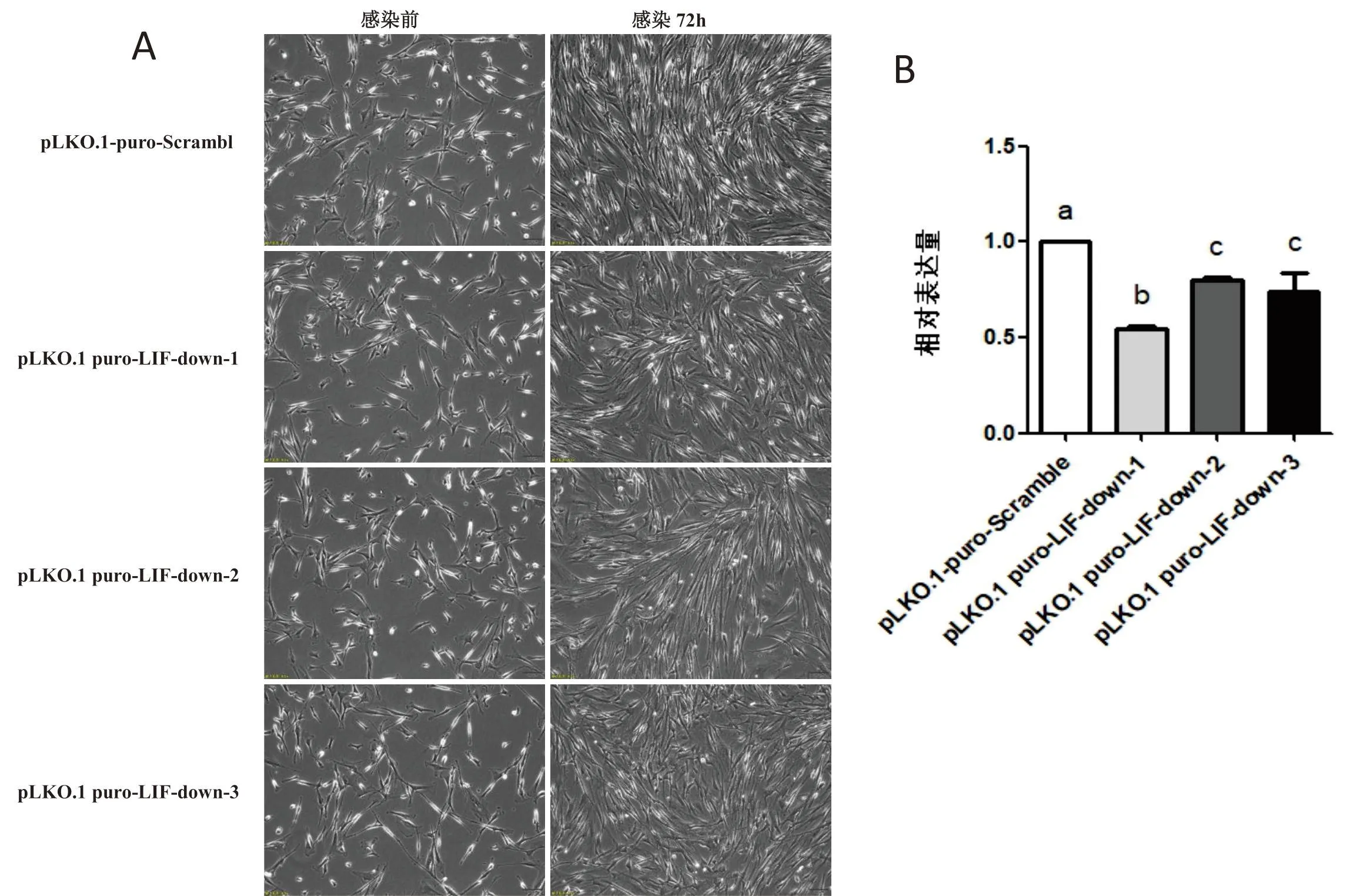
(A)LIF抑制慢病毒感染后72 h后PDBM-MSCs生长状态(200×);(B)抑制慢病毒感染后PDBM-MSCs的LIF在mRNA水平上的相对表达量
2.3 LIF 抑制后对 PDBM-MSCs 生长影响
将PDBM-MSCs分别用重组质粒pLKO.1 puro-LIF-down-1慢病毒与空质粒pLKO.1-puro-Scramble慢病毒进行感染,72 h后观察空质粒组细胞融合率达明显高于LIF抑制组细胞.用q-PCR的方法对LIF抑制后PDBM-MSCs关键周期基因检测显示CDK2(P=0.028 2)、CCNB2(P=0.000 1)及CCND3(P=0.008 4)等促周期基因在mRNA水平上显著下调,而CCNYL1 也呈下降趋势(图3-A).同时对凋亡分子P53(P=0.001 8)、P16(P=0.000 1)、P27(P<0.000 1)、Caspase3(P=0.002 7)等进行检测结果显示这些分子均在mRNA水平上显著提高(图3-B).表明LIF抑制能够显著的抑制PDBM-MSCs周期,同时促进细胞发生凋亡.
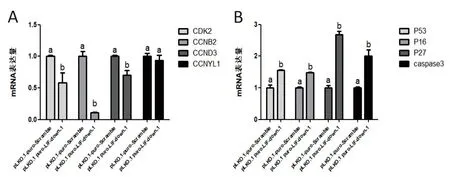
(A)LIF抑制慢病毒感染后PDBM-MSCs周期基因的表达情况;(B)LIF抑制慢病毒感染后PDBM-MSCs凋亡基因的表达情况
2.4 LIF抑制后对PDBM-MSCs干性影响
为了研究LIF对PDBM-MSCs的干性是否产生影响,细胞同上述处理后,对PDBM-MSCs的干性分子表达进行检测,结果发现,LIF抑制后PDBM-MSCs的干性分子KLF4(P=0.009 8)、SOX2(P<0.000 1)在mRNA水平上显著下调(图4),表明LIF对 PDBM-MSCs 的干性起到维持作用.
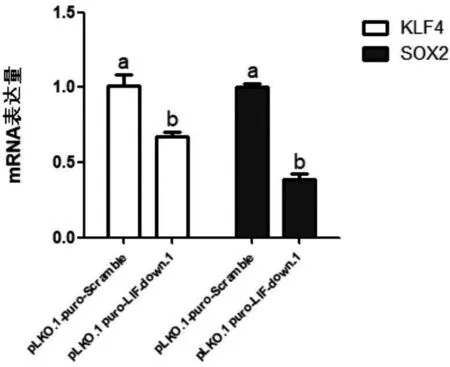
图4 LIF 抑制后 PDBM-MSCs 干性基因的表达情况
3 讨论
MSCs 具有跨系谱,甚至跨胚层分化的潜能,可分化成多种组织细胞[18].研究发现,MSCs 具有去分化和跨胚层转分化能力,且在这种转分化过程中,MSCs 分化的是首先进行去分化,回到原始状态再转分化为其他组织.而 BM-MSCs 由于具有强大的增殖能力和跨胚层分化潜能的同时也具有免疫调节功能等特性,在细胞治疗中具有潜在的应用价值,是研究大熊猫等珍贵野生动物干细胞的宝贵资源.本研究筛选所得LIF表达抑制的 MSCs 为进一步研究大熊猫干细胞分化机制提供了数据及材料支撑.
LIF 是一种多效性细胞因子,具有广泛的活性,其功能性受体存在于多种器官中,包括肝[19]、骨[20]、子宫[21]、肾和中枢神经系统[22]等.研究发现 LIF 在小鼠胚胎干细胞中起到抑制分化保持在全能状态的作用,并能够有效地促进其自我更新[23];Harris 等研究表明 LIF具有促进牛成纤维细胞重编程为多能干细胞的潜力,也证实了其在牛多能干细胞分离培养以及建系上的潜力[24];Oskowitz 等研究证明 LIF对维持 MSCs 功能具有重要作用,如维持 MSCs 的干性抑制成脂肪、成骨的分化[17],以上结果表明 LIF 是维持细胞干性的重要调控分子.本研究采取 RNAi 干扰的方式降低了PDBM-MSCs 的LIFmRNA 的表达水平,同时定量检测结果显示 BM-MSCs 的干性标记基因KLF4、SOX2 的表达量伴随着LIF的下调呈现出显著下调趋势.说明本研究所得LIF抑制后 BM-MSCs 的干性下降这一结果与前人的研究相一致.同时 Jiang 等发现LIF对间充质干细胞的生长起促进作用[25],同样在本次研究过程中发现,降低 BM-MSCs 的LIF表达水平后,相关周期调控基因CDK2、CCNB2、CCND3 显著下调,关键凋亡基因P53、P16、P27、caspase3 的表达显著上调,也证实了LIF对大熊猫间充质干细胞的生长起促进作用,这一结果与前人的研究结果也是一致的.进一步证明本研究构建的大熊猫LIFRNAi 质粒在 BM-MSCs 表达是成功的.
通过 q-PCR 的方法检测LIF在 RNA 水平上的变化,结果显示与空质粒 pLKO.1-puro-Scramble 对照组相比感染重组质粒 pLKO.1 puro-LIF-down-1 后PDBM-MSCs 的LIF在 RNA 水平上显著下调.与小鼠子宫内膜细胞[26]LIF干扰效率相比,此次对 PDBM-MSCs 进行LIF干扰后其干扰效率较低,这可能是干扰位点、条件及方式不合适造成的,还需继续探索.然而,感染重组质粒 pLKO.1 puro-LIF-down-1 病毒的细胞与空质粒 pLKO.1-puro-Scramble 对照组相比也表现出生长被抑制以及干性下降的趋势,这说明该LIF抑制载体已经发挥了其生物学功能.本次研究由于没有针对大熊猫的抗体,因此我们只能选取抗人或大鼠的 LIF 抗体进行 Western Blot 蛋白分析,但是无论是抗人或大鼠的抗体都未检测出阳性特异结合(数据未给出),这可能是由于PDBM-MSCs 中 LIF 的肽段同源性与人或大鼠相差较大,因此开发大熊猫特异的 LIF 抗体进一步完善实验结果是我们下一步研究所必须的.
4 结论
本研究成功构建了大熊猫的LIFRNAi 慢病毒载体,通过感染的方式成功转入PDBM-MSCs 中.经试验证明大熊猫LIF对 BM-MSCs 的生长及干性均起到调节的作用,为LIF在大熊猫干细胞中的功能研究提供了一定的技术及理论支撑.然而,LIF在大熊猫干细胞生长、分化过程中所涉及的具体调控机制目前尚不明确,还需进一步进行研究.

