脑蛋白水解物干预VaD小鼠海马神经元凋亡及可能的机制
王素平 武筱林 王 帅 宋 涛 庄 洁 兰小磊
(1.青岛市第三人民医院神经康复科,山东 青岛,266041;2.青岛大学医学部中西医结合中心,山东 青岛,266021;3.青岛大学附属医院神经外科,山东 青岛,266003)
随着人口的老龄化,老年性疾病发病率越来越高。其中,血管性痴呆 (Vascular dementia,VaD)是由脑血管疾病引起的一种脑损害[1]。目前关于VaD的标准定义国际上尚未统一,但Vad肯定会导致认知以及智能障碍,其根本的治疗方法是防治脑血管病及其危险因素[2-4]。研究证明,VaD发病后,随着病情的发展,神经元逐渐出现大量死亡和凋亡,因此,抑制神经元的凋亡可能是治疗VaD有效措施之一[5-6]。近年研究发现,脑蛋白水解物制剂等能通过恢复脑功能而提高患者的认知和智力水平,但具体作用机制尚不明确[7]。神经肽制剂脑活素( Cerebrolysin,CBL)是从纯化的脑蛋白中提取的,主要有效成分是氨基酸(80%)和小肽(20%),具有一定的神经营养作用,可改善VaD患者认知能力、抑制大脑中动脉远端闭塞后引起的大鼠丘脑神经元凋亡,改善大鼠神经功能等[8-11]。国内注射用脑蛋白水解物-I(Cerebroprotein Hydrolysate-I,CH-I)采用类似CBL的提取工艺和质量标准。已研究证明,注射用CH-I可以通过提高端粒酶活性从而延缓脑衰老,改善脑梗死大鼠的行为功能,其改善VaD大鼠学习认知能力可能与促进脑损伤后的神经元修复和生长有关[12-14]。本实验旨在探讨CH-I干预VaD小鼠海马区神经元凋亡的作用和可能的机制。
1 材料
1.1 实验动物
成年健康雄性昆明小鼠70只,SPF级,鼠龄4~6周,体质量25~30 g,动物合格证号:SCXK(鲁)20190003,由济南朋悦实验动物繁育有限公司提供。实验前将动物置于实验室鼠龄适应环境1周,自由饮食,室温(3±2)℃,12 h间隔昼夜明暗环境。整个实验过程严格遵守动物伦理学要求(QDYXB-WZLL20230523)。
1.2 药品与主要试剂
注射用脑蛋白水解物-I(CH-I)(生产企业:河北智同生物制药股份有限公司,生产批号:0190501-1);脑活素(CBL)(生产企业:EVER Neuro Pharma GmbH,生产批号:PB0947);HE染色试剂盒(G1120)(生产企业:北京索莱宝科技公司)、DAB显色试剂盒(DA1015)(生产企业:北京索莱宝科技公司);TUNEL细胞凋亡检测试剂盒(MK1020)(生产企业:博士德生物工程公司);Akt(8200S)(生产企业:Cell Signaling Technology Co. Ltd.)、p-Akt(8200S)(生产企业:Cell Signaling Technology Co. Ltd.)、山羊抗兔抗体(7074P2)(生产企业:Cell Signaling Technology Co. Ltd.);Bcl-2(ab182858)(生产企业:Abcam);Casp-3(AF6311)(生产企业:Affinity Co. Ltd.)、Casp-9(AF6348)抗体(生产企业:Affinity Co. Ltd.)、双敏化学发光试剂均(KF005)(生产企业:Affinity Co. Ltd.);BCA蛋白浓度测定试剂盒(生产企业:Biosharp Life Science Co. Ltd)。
1.3 实验仪器
小鼠Y型电迷宫(生产企业:中国药物研究所,型号:MG-I);光学显微镜(生产企业:Olympus,型号:IX70);全自动酶标检测仪(生产企业:Bio-TekCo. Ltd.,型号:H1M);基础电泳仪电源(生产企业:Bio-RadCo. Ltd.)、转膜仪(生产企业:Bio-RadCo. Ltd.)。
2 方法
2.1 学习训练
在黑暗、安静的环境进行学习训练。先将小鼠放入三等臂Y型电迷宫,适应性自由活动5 min。然后,按以往报道的学习训练方法[15],将小鼠放至Y型电迷宫一臂内,持续电刺激持续2 s(60 V,0.5~0.7 mA)。固定时间训练10次/d,连续5 d,将测试成绩达到连续10次中有9次(9/10)正确反应者(60只)纳入试验,反应迟钝者(10只)被淘汰。
2.2 记忆测试
小鼠学习训练完成24 h后测试10次,正确反映记为A,以其所占测试总数的百分比评价小鼠的记忆能力(A/10×100%),此值越高说明小鼠记忆能力越好。
2.3 VaD小鼠模型制备
将60只小鼠随机分为假手术(Sham)组10只和造模组50只。采用 双侧颈总动脉阻断结合尾部放血法[16]造模。10%水合氯醛(4.6 mL/kg)腹腔注射麻醉,仰卧固定,颈部正中切口,钝性分离双侧颈总动脉,套4号丝线扣。拉紧丝扣,并夹闭动脉阻断血流20 min,同时剪尾放血;松开丝扣灌注10 min后,再次阻断血流20 min,第2次再灌后观察10 min。假手术组仅分离颈总动脉,套丝扣,不阻断血流,尾部不放血,其余步骤同模型组。
2.4 实验动物分组及给药
将造模成功的小鼠40只,随机分为模型组(VaD)、CH-I给药低( VaD +CH-I-L)、中(VaD +CH-I-M)、高(VaD +CHI-H)三个剂量组和CBL阳性药(VaD+CBL)组,每组各8只。造模后小鼠正常喂养,Sham组和VaD组每天按时注射0.9%氯化钠溶液0.5 mL,VaD +CH-I-L、VaD +CH-I-M、VaD+CH-I-H各组按照10、20、30 mg/kg体质量、VaD+CBL组按照10 mg/kg体质量给药,均为腹腔注射,0.5 mL,连续4周。
2.4 HE染色检测 小鼠海马区神经细胞损伤程度
末次给药后进行行为学测试。每组取4只小鼠,水合氯醛腹腔注射麻醉,经心脏灌注生理盐水和多聚甲醛固定,完整取脑,常规脱水、浸蜡、包埋,连续冠状切片(8 μm)。切片脱蜡水化,苏木素染色3 min,分化液分化10 s,伊红染色1 min。常规脱水、透明、封片。光镜下观察海马结构,细胞核呈蓝色、细胞质呈不同程度的红色。每张切片随机观察5个不重叠的高倍(40×)视野,计数细胞,取其均值。以变性细胞指数(DCI=变性细胞数/细胞总数)表示损伤程度。
2.5 小鼠海马区神经细胞凋亡检测
按照TUNEL试剂盒说明操作,取上述石蜡切片,常规脱蜡水化,3%H2O2室温处理脑片10 min,蛋白酶K(1:200)37℃消化15 min;滴加标记液(TdT和Dig-d-UTP)20 μL/片,37℃标记2 h,室温封闭30 min;滴加生物素化抗Dig抗体(效价1:100),37℃反应30 min;滴加SABC(效价1:100)50μL/片,37℃反应30 min,DAB显色15 min,苏木素复染5 s;常规脱水、透明、封片。光镜下观察胞核有棕色颗粒者为阳性细胞。阴性对照切片不加探针,用0.1M PBS代替染色不出现阳性反应。每只小鼠取4张连续切片,随机计数每张切片4个高倍视野中阳性细胞数,取其均值。
2.6 Western Blot分析蛋白表达水平
每组取4只小鼠,水合氯醛麻醉,取海马组织40 mg,提取蛋白,使用BCA法测定蛋白浓度。SDS-PAGE电泳分离蛋白,湿转至PVDF膜,5%脱脂奶粉室温封闭2 h,TBST洗5 min×3次。滴加兔抗小鼠Akt、p-Akt、Casp-3、Casp-9、Bcl-2和β-actin抗体(效价1:1000),4℃孵育过夜。次日TBST溶液洗5 min×3次,HRP标记山羊抗兔IgG(效价1:10000),室温孵育2 h,以β-actin作为内参,ECL化学发光显影。凝胶成像分析各条带灰度值,以相对灰度值(relative value of protein,RVP)表示蛋白表达水平。RVP=目的蛋白灰度值/内参灰度值。
2.7 统计学分析
3 结果
3.1 动物存活情况
模型组小鼠死亡10只,剩余40只随机分为VaD组、VaD +CH-I-L、VaD +CH-I-M、VaD+CH-I-H组和VaD+CBL组,各8只;Sham组死亡2只,剩余8只。
3.2 CH-I改善VaD小鼠学习记忆能力
图1A所示:造模前,各组小鼠达标所需要的学习次数比较,差异无统计学意义(P>0.05);造模小鼠出现尝试次数较Sham组小鼠显著性增多,差异有统计学意义(P<0.05),表明造模成功后小鼠的学习能力均显著下降。治疗结束后,VaD组、VaD+CH-I-H组和VaD+CBL组小鼠尝试次数较Sham组显著增加,差异有统计学意义(P<0.05);但VaD+CHI-L组和VaD+CH-I-M组与Sham组比较,差异无统计学意义(P>0.05);VaD+CH-I-L、VaD+CH-I-M、VaD+CH-I-H组和VaD+CBL组小鼠尝试次数较VaD组均显著减少,差异有统计学意义(P<0.05)。图1B显示,造模前,各组小鼠的学习记忆能力比较,差异无统计学意义(P>0.05);造模后各组小鼠测试成功率较Sham组均显著降低,差异有统计学意义(P<0.05);给药干预后,VaD组、VaD+CH-I-H组和VaD+CBL组小鼠测试成功率仍然低于Sham组,差异有统计学意义(P<0.05);VaD+CH-I-L、VaD+CH-I-M组测试成功率较VaD组显著升高,差异有统计学意义(P<0.05),但VaD+CH-I-H组和VaD+CBL组与VaD组之间比较,差异无统计学意义(P>0.05)。综上表明,CH-I高剂量和CBL组小鼠的学习能力的改善程度低于CH-I低、中剂量组。
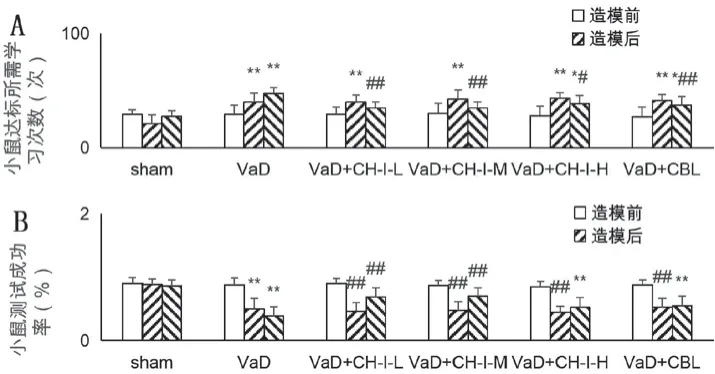
图1 各组小鼠实验前后学习记忆能力比较分析 (, n=8)
3.3 CH-I减少VaD小鼠海马区域神经细胞异常
造模成功后,VaD组小鼠海马神经元细胞变性数量较Sham组显著增多,差异有统计学意义(P<0.05),细胞形态异常,数量减少,胞核固缩,染色加深,排列紊乱。经药物干预治疗后,Va D+CH-I-L组、VaD+CH-I-M组、VaD+CH-I-H组、Va D+CBL组小鼠海马变性细胞数量较VaD组显著性减少,差异有统计学意义(P<0.05);其中,VaD+CH-I-L组和VaD+CH-I-M组的疗效优于VaD+CH-I-H组,差异有统计学意义(P<0.05),而与VaD+CBL组相比较,差异无统计学意义(P>0.05),见图2。
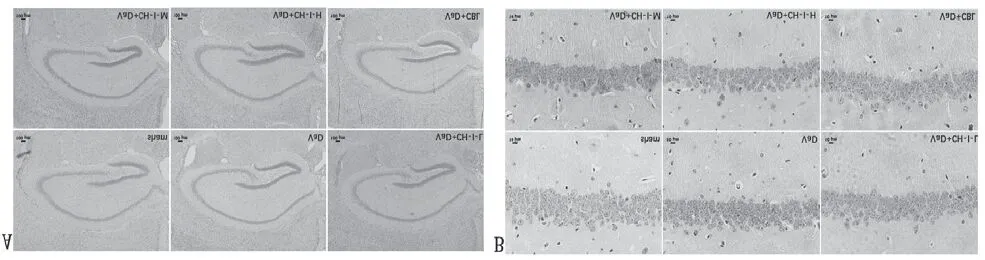
图2 治疗后各组小鼠海马区域HE染色不同倍数观察结果 (, n=4)
3.4 CH-I降低VaD小鼠海马区域凋亡细胞数
造模成功后,VaD组小鼠海马凋亡细胞数较Sham组显著明显增加,差异有统计学意义(P<0.05)。经药物干预治疗后,各给药组海马区域凋亡细胞数减少,与VaD组比较,差异有统计学意义(P<0.05);与VaD+CH-I-H组比较,VaD+C H-I-L组的效果更佳,差异有统计学意义(P<0.05);而VaD+C H-I-L组和VaD+CH-I-M组与VaD+CBL组相比较,差异无统计学意义(P>0.05),见图3。
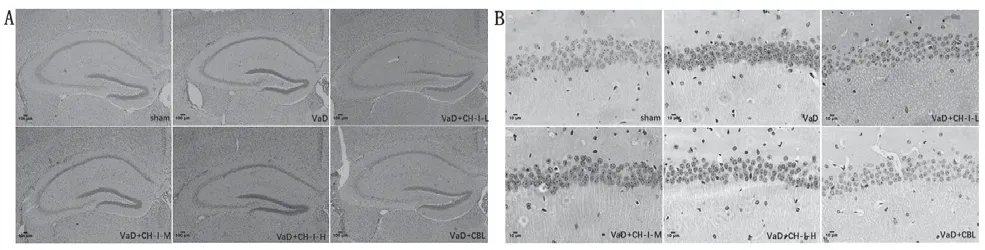
图3 治疗后各组小鼠海马区神经元凋亡数的高差结果 (, n=4)
3.5 CH-I对VaD小鼠海马组织Akt、p-Akt表达的影响
造模成功后,VaD组小鼠的p-Akt/Akt表达较Sham组显著降低,差异有统计学意义(P<0.05)。经药物干预治疗后,给药各组p-Akt/Akt表达增加,与VaD组比较,差异有统计学意义(P<0.05);但VaD+CH-I-L组和VaD+CH-I-M组的治疗效果与VaD+CBL组相比较,差异无统计学意义(P>0.05),见图4。
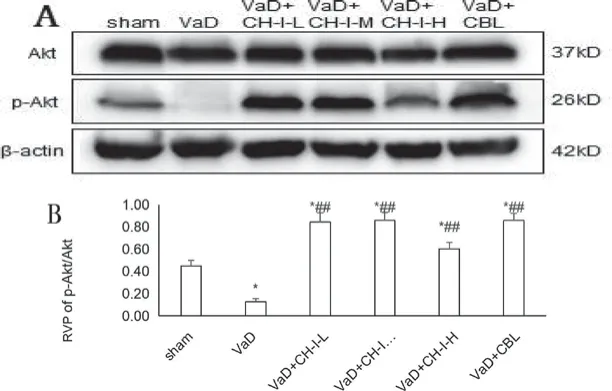
图4 治疗后各组海马组织Akt、p-Akt表达情况 (, n=4)
3.6 CH-I对VaD小鼠海马组织Casp-9、Casp-3、Bcl-2的影响
造模成功后,VaD小鼠海马组织Casp-9及Casp-3表达较Sham组显著升高,差异有统计学意义(P<0.05),而Bcl-2表达显著降低,差异有统计学意义(P<0.05)。经药物干预治疗后,VaD+CH-I-L 组、VaD+CH-I-M组和VaD+CH-I-H组Casp-9及Casp-3表达较VaD组显著降低,差异有统计学意义(P<0.05),但VaD+CBL组表达未见显著性变化,差异无统计学意义(P>0.05);Bcl-2表达相比较,VaD+CH-I-L组和VaD+CH-I-M组表达较VaD组均显著升高,差异有统计学意义(P<0.05),VaD+CH-I-H 组与VaD组比较,差异无统计学意义(P>0.05);但VaD+CBL组表达显著低于Sham组和VaD组,差异有统计学意义(P<0.05),见图5。

图5 各组海马组织Casp-9、Casp-3、Bcl-2表达情况( , n=4)
4 讨论
缺血性卒中是严重危害人类健康的疾病,血管性痴呆和卒中后抑郁症是其后遗症,给患者自身、家庭和社会均带来严重的负担。血管性痴呆的发展过程与慢性脑缺血相关[17]。本实验采取双侧颈总动脉阻断结合尾部放血的改良方法,尽可能避免大脑动脉环的代偿作用,以达到更好的脑缺血效果[16]。前海马体是脑组织中负责情节记忆、认知的部分[18],对缺血十分敏感,夹闭沙鼠双侧颈总动脉5 min再灌注后,海马CA1区域神经元明显丢失[19]。本实验发现,VaD小鼠CA1区域的海马神经细胞数量减少,形态异常,经CH-I作用后,异常细胞数量减少。
本研究显示,造模成功后的VaD小鼠海马CA1区凋亡阳性细胞显著增加,经CH-I干预作用后,凋亡阳性细胞数目明显减少,结果表明CH-I可以在一定程度上抑制海马神经细胞的凋亡。细胞凋亡有外源性和内源性两条基本的凋亡信号转导途径。其中,内源性的凋亡途径是由细胞内的各种刺激因素而激活的,它依赖于细胞膜发生内陷、分割包裹胞质形成的凋亡小体(Apoptoticbody)而发挥作用。天冬氨酸蛋白酶-9(Casp-9)是组成凋亡小体的部分之一,在哺乳动物中,Caspases是细胞凋亡的主要执行者,其中Casp-3被称为“凋亡步兵”,其激活过程受到B淋巴细胞瘤-2基因(Bcl-2)家族蛋白的严格控制[20]。本实验中,通过TUNEL和免疫组化及WesternBlot对Bcl-2、Casp-9、Casp-3蛋白的检测,证实了在VaD小鼠模型的海马组织中存在着神经元的凋亡。在CH-I干预治疗后,VaD小鼠海马神经细胞Casp-9、Casp-3蛋白水平降低,同时伴随Bcl-2蛋白水平升高,这一结果表明,CH-I能抑制海马区域与这些凋亡相关蛋白有关的神经细胞凋亡过程。磷酸肌醇3-激酶(PI3K)/蛋白激酶B(PKB/Akt)信号转导通路是一条极为重要的促进神经细胞生长和存活的信号通路,已被证实与抑制凋亡相关[21]。在脑缺血损伤模型、脊髓损伤模型以及多种其他形式的神经元损伤中,也已证实PKB/Akt信号转导在促神经元存活中发挥着重要作用[22]。本研究结果表明,VaD小鼠模型的海马神经细胞中,p-Akt/Akt的比值显著降低,而经过CH-I干预治疗后,各组p-Akt/Akt的比值均明显升高,表明CH-I可能通过激活Akt二产生p-Akt,使其发挥了重要的促神经细胞生存作用。
综上所述,CH-I可能是通过激活VaD小鼠海马神经细胞的Akt基因,上调Bcl-2表达,同时下调Casp-9及Casp-3表达,抑制海马神经细胞凋亡,从而改善VaD小鼠的学习记忆能力。

