阿帕替尼联合白蛋白紫杉醇化疗二线治疗晚期胃癌的疗效及不良反应分析
张晓洁
(赤峰市医院肿瘤内科,内蒙古 赤峰,024000)
胃癌是一种严重的疾病,危及患者的生命和健康,尤其是晚期胃癌,给患者的治疗带来了巨大的挑战。当前,手术切除、化疗、放疗等治疗方法仍然是治疗晚期胃癌的主要手段,然而,治疗的效果仍然不理想,生存率令人担忧[1]。阿帕替尼是一种口服酪氨酸激酶抑制剂,已被广泛用于多种肿瘤的治疗中。近年来,阿帕替尼联合化疗治疗晚期胃癌的应用也引起了研究人员的关注。然而,对于阿帕替尼联合化疗治疗晚期胃癌的临床疗效及不良反应方面的研究仍然不足[2]。因此,本研究选取2021年3月—2022年5月赤峰市医院收治的120例晚期胃癌患者作为研究对象,旨在评估阿帕替尼联合化疗治疗晚期胃癌的临床疗效及不良反应,以期提供更有效、安全和个体化的治疗策略,以改善患者的生存质量和延长生存期。
1 资料与方法
1.1 一般资料
选取2021年3月—2022年5月赤峰市医院收治的120例晚期胃癌患者作为研究对象,应用随机数表法分为对照组和观察组,每组60例。观察组中,男性32例,女性28例;年龄38~69岁,平均年龄(56.92±4.20)岁;病灶大小:>5 cm 25例,≤5 cm 35例;发病部位:胃底29例,胃体21例,胃窦10例;病理类型:管状腺癌35例,印戒细胞癌25例。对照组中,男性31例,女性29例;年龄37~69岁,平均年龄(56.99±4.34)岁;病灶大小:>5 cm 19例,≤5 cm 41例;发病部位:胃底27例,胃体21例,胃窦12例;病理类型:管状腺癌36例,印戒细胞癌24例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究所有患者及其家属均签署了知情同意书。本研究通过赤峰市医院医学伦理委员会审批。
1.2 纳入与排除标准
纳入标准:① 符合《中华医学会胃癌临床诊疗指南(2021版)》[3]中的相关诊断标准;②入院后,所有患者均经常规检查并结合临床表现确诊;③年龄≥18岁,伴有癌细胞肿瘤四期远隔脏器转移者;④无沟通障碍和意识障碍。
排除标准:① 严重精神障碍者;②患有其他恶性肿瘤疾病者;③病历数据缺失或未主动提供自己的临床数据;④研究依从性低;⑤对本研究中使用的治疗药物表现出严重不耐受的患者。
1.3 方法
对照组接受注射用紫杉醇(白蛋白结合型)(生产企业:石药集团欧意药业有限公司,国药准字H20183044,规格:100 mg)治疗,用量130~150 mg/m2。
观察组在对照组治疗方案上联合甲磺酸阿帕替尼片(生产企业:江苏恒瑞医药股份有限公司,国药准字H20140105,规格:0.425 g)治疗,250 mg/d。两组患者均接受为期6个周期的治疗,在治疗过程中根据患者化疗反应对用药剂量进行实时调整。
1.4 观察指标
均于治疗6周后对以下指标进行观察比较评价。①治疗近期疗效:参考RECIST1.1标准对近期治疗展开判定,完全缓解(CR,所有病灶消失,没有新的病灶出现)、部分缓解(PR,目标病灶的总和直径减小了至少30%,并没有新的病灶出现)、疾病稳定(SD,病灶的总和直径没有明显变化,没有新的病灶出现)及疾病进展(PD,病灶的总和直径增加了至少20%,或者有新的病灶出现)。记录评价组间客观缓解率(Objective Response Rate,ORR):指患者在干预后出现完全缓解(CR)或部分缓解(PR)的比例。疾病控制率(Disease Control Rate,DCR):指患者在干预后出现完全缓解(CR)、部分缓解(PR)或疾病稳定(SD)的比例。它是评估治疗是否能够控制肿瘤进展的指标。计算公式:DCR =(CR+PR +SD)例数/总例数×100%。ORR=(CR+PR)例数/总例数×100%。②血清肿瘤标志物:评价两组患者接受干预后肿瘤标志物水平的变化情况:应用酶联免疫吸附法(ELISA 试剂盒,生产企业:武汉赛培生物,规格:96T/48T)对鳞状细胞癌相关抗原(Squamous Cell Carcinoma Antigen,SCC-Ag)水平进行检测;应用化学发光法( REK-20N型化学发光定氮仪)对癌胚抗原(Carcino-Embryonic Antigen,CEA)水平进行检测;应用双抗体夹心ELISA检测法(癌胚抗原测定试剂盒,生产企业:上海科华生物工程股份有限公司)对人糖类抗原125(CA125)水平进行检验。③判定患者的免疫功能: 应用酶联免疫吸附法(血管内皮生长因子测定试剂盒,生产企业:北京键平九星生物医药科技有限公司)和放射免疫测定法(放射免疫试剂盒,生产企业:上海恒远生物科技有限公司)检测免疫球蛋白M(Immunoglobulin M,IgM)和免疫球蛋白G(Immunoglobulin G,IgG)、免疫球蛋白A(Immunoglobulin A,IgA),流式细胞术检查患者自然杀伤细胞(Natural Killer Cell,NK)。④记录评价组间用药不良反应: 血小板降低、呕吐、中性粒细胞降低。不良反应发生率=(血小板降低+呕吐+中性粒细胞降低)例数/总例数×100%。
1.5 统计学分析
采用SPSS 24.0统计学软件分析数据,计数资料采用[n(%)]表示,结果行χ2检验;计量资料采用()表示,结果行t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
经为期6个周期化疗干预后,观察组患者客观缓解率、疾病控制率均明显高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组近期疗效比较 [n(%)]
2.2 两组患者干预前后肿瘤标志物水平的变化情况比较
干预前,两组患者的血清SCC-Ag、CEA及CA125水平比较,差异无统计学意义(P>0.05);干预后,观察组血清SCC-Ag、CEA、CA125水平低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者干预前后肿瘤标志物水平的变化情况比较 ()

表2 两组患者干预前后肿瘤标志物水平的变化情况比较 ()
组别例数SCC-Ag(µg/L)tPCEA(µg/L)tPCA125(ku/L)tP干预前干预后干预前干预后干预前干预后观察组604.88±0.522.49±0.213.002<0.00128.21±3.1014.98±2.878.992<0.00138.29±1.2924.72±4.565.023<0.001对照组604.67±0.563.35±0.563.022<0.00128.27±3.4520.61±2.728.152<0.00138.71±1.2131.51±4.835.203<0.001 t 2.128 11.1380.100 11.0291.839 7.918 P 0.035<0.0010.920<0.0010.068<0.001
2.3 干预后2周两组患者的免疫功能各评价维度比较
干预后2周,观察组患者的IgM、IgG、IgA、NK细胞活性等指标均明显高于对照组,差异有统计学意义(P<0.05),见表3。
表3 干预后2周两组患者的免疫功能各评价维度比较 ()
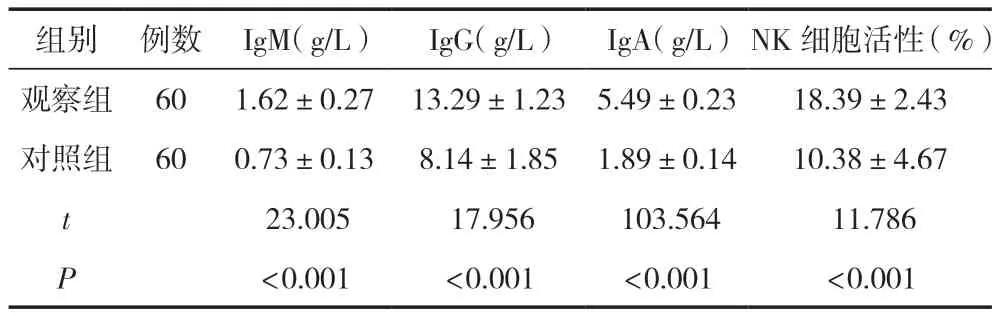
表3 干预后2周两组患者的免疫功能各评价维度比较 ()
组别例数IgM(g/L)IgG(g/L)IgA(g/L)NK细胞活性(%)观察组601.62±0.2713.29±1.235.49±0.2318.39±2.43对照组600.73±0.138.14±1.851.89±0.1410.38±4.67 t 23.005 17.956 103.564 11.786 P<0.001<0.001<0.001<0.001
2.4 两组用药不良反应发生率比较
两组用药不良反应发生率比较,差异无统计学意义(P>0.05),见表4。
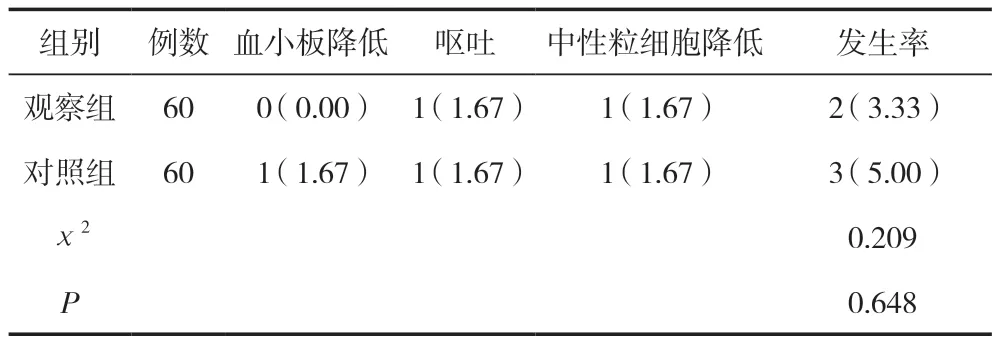
表4 两组用药不良反应发生率比较 [n(%)]
3 讨论
晚期胃癌是一种严重的疾病,其治疗方法包括化疗、手术和放疗等,其中化疗是最为常用的治疗方式之一,白蛋白紫杉醇和阿帕替尼是常用的化疗药物,它们可以通过不同的机制抑制肿瘤生长和扩散。最近的研究表明,白蛋白紫杉醇联合阿帕替尼治疗晚期胃癌可以显著提高患者的生存率并缓解症状,而且药物不良反应发生率与单独使用白蛋白紫杉醇治疗相比并没有显著差异[4]。首先,白蛋白紫杉醇和阿帕替尼的药理作用机制不同,白蛋白紫杉醇通过靶向微管蛋白,干扰肿瘤细胞有丝分裂和增殖,从而达到抑制肿瘤生长和扩散的效果,阿帕替尼则是一种多靶点酪氨酸激酶抑制剂,可以抑制肿瘤细胞的增殖和侵袭,并诱导肿瘤细胞凋亡,两种药物的作用机制不同,可以相互补充,从而提高治疗效果[3]。其次,白蛋白紫杉醇可以通过白蛋白作为载体,提高其在体内的稳定性和溶解度,降低其不良反应,而且,白蛋白作为一种生物大分子,可以在体内降解为氨基酸,不会对机体产生明显的不良反应,阿帕替尼的不良反应比较轻,主要表现为恶心、呕吐、腹泻等,而且可以通过调整剂量和给药时间来减轻不良反应[4-5]。最后,白蛋白紫杉醇联合阿帕替尼治疗晚期胃癌需要在医生的指导下进行,严格控制用药剂量和用药时间,以避免不良反应的发生,同时,患者也需要积极配合治疗,按时接受化疗并遵循医嘱,以提高治疗效果和减少不良反应的发生[6-7]。因此,白蛋白紫杉醇联合阿帕替尼治疗晚期胃癌与单独使用白蛋白紫杉醇治疗相比,药物不良反应发生率差异性不大的原因主要是两种药物的作用机制不同,可以相互补充,而且白蛋白作为载体可以提高药物的稳定性和溶解度,降低不良反应,在治疗过程中,医生和患者都需要积极配合,以提高治疗效果和减少不良反应的发生[8]。
对患者近期疗效展开统计分析可见,经为期6个周期化疗干预后,观察组患者ORR、DCR均明显高于对照组,差异有统计学意义(P<0.05)。丁根树[9]在其研究中为晚期胃癌患者实施阿帕替尼联合化疗治疗,近期疗效得到改善,结论与本研究高度一致。近年来,针对晚期胃癌的治疗出现了许多新的方案,阿帕替尼联合化疗方案是其中之一。阿帕替尼作为一种靶向治疗药物,可以抑制肿瘤细胞的生长和扩散,同时可以减轻化疗的不良反应。阿帕替尼联合化疗治疗晚期胃癌的疗效得到改善的原因,可能与其对肿瘤细胞的作用有关,具体包括抑制血管生成、减少肿瘤细胞增殖、增强化疗敏感性等多种机制[10]。
对肿瘤标志物水平进行检验比较可见,接受干预前,两组患者的血清SCC-Ag、CEA及CA125水平比较,差异无统计学意义(P>0.05);干预后,观察组血清SCC-Ag、CEA、CA125水平低于对照组,差异有统计学意义(P<0.05)。与韩俊伟等[11]研究结果高度一致。阿帕替尼是一种针对血管内皮生长因子受体(VEGFR)的酪氨酸激酶抑制剂,可通过阻断血管生成和诱导肿瘤细胞凋亡等机制发挥抗肿瘤作用,在阿帕替尼联合化疗方案下,阿帕替尼可与化疗药物相互作用,通过抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡等多种途径发挥抗肿瘤作用。具体来说,阿帕替尼通过靶向VEGFR的作用,能够抑制肿瘤新生血管的形成,减少肿瘤的血液供应,从而降低肿瘤的代谢活性和生长速率。此外,阿帕替尼还可调节免疫系统的功能,增强机体对肿瘤的免疫反应,该药物可抑制肿瘤细胞释放的免疫抑制因子,激活免疫细胞,促进T细胞的增殖和活化,从而促进机体免疫杀伤肿瘤细胞[12-13]。
统计分析患者免疫功能变化情况可见,干预后2周,观察组患者的IgM、IgG、IgA、NK细胞活性等指标均明显高于对照组,差异有统计学意义(P<0.05)。与马馨等[14]研究结果(研究组IgM 、IgG 、IgA 、NK细胞活性显著高于对照组)结论一致。阿帕替尼能够抑制一些免疫细胞,如NK和T细胞,从而抑制肿瘤生长和扩散,同时,阿帕替尼也可以促进其他类型的免疫细胞的活化和功能,如B细胞和巨噬细胞,这些免疫细胞的活化和功能可以促进免疫系统的应答,从而提高患者的免疫功能。其次,阿帕替尼可以影响肿瘤细胞的免疫逃逸机制,肿瘤细胞通过减少表达抗原、增加免疫抑制分子的表达等方式来逃避免疫系统的攻击[15]。而阿帕替尼可以逆转这种免疫逃逸机制,增加肿瘤细胞表达抗原,并减少免疫抑制分子的表达,这些作用可以增强免疫系统对肿瘤的攻击,从而提高患者的免疫功能。最后,阿帕替尼可以影响肿瘤微环境,肿瘤微环境是指肿瘤周围的细胞和分子环境,包括肿瘤细胞、免疫细胞、血管和基质等,肿瘤微环境对肿瘤的生长和转移有重要影响,而阿帕替尼可以抑制肿瘤微环境的形成,减少免疫细胞的浸润,从而增强患者的免疫功能。
对用药不良反应进行统计比较可见,两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。阿帕替尼联合化疗与白蛋白紫杉醇治疗在药理学方面存在显著差异,阿帕替尼是一种酪氨酸激酶抑制剂,可以靶向性地抑制肿瘤细胞生长和扩散,具有较好的抗肿瘤效果。相比之下,白蛋白紫杉醇是一种紫杉醇类抗肿瘤药物,具有广泛的抗肿瘤作用,但也有一定的不良反应,但与联合使用患者用药不良反应比较虽有一定的差异,但差异性不大,表明了联合方案的安全性[16]。
综上所述,为晚期胃癌患者实施阿帕替尼联合化疗治疗,可改善患者近期疗效,提升患者免疫功能,用药不良反应可控,值得作为晚期胃癌治疗方案展开应用。

