伏立康唑TPGS-Cremophor EL眼用纳米胶束的制备及体外抗白色念珠菌评价
曾 甜 王欣宜 彭 澳 刘 雪 文宝程 王凯月 田宝成
滨州医学院药学院药剂学教研室 山东 烟台 264003
真菌性角膜炎是一种严重威胁视力的疾病,不仅给患者带来较大的经济压力,而且存在高致盲和失明的可能性[1]。真菌是角膜炎的重要诱因之一,白色念珠菌是真菌性眼内炎最常见的病原体。局部或全身免疫抑制是酵母菌感染的主要危险因素[2],目前念珠菌是医院获得性感染最重要的病原体之一,特别是在身体虚弱或免疫功能低下的患者中[3]。在眼科中,酵母菌感染在眼表疾病和免疫抑制下更为普遍,并且通常对常规治疗更有抵抗力。
伏立康唑(voriconazole,VRC)是一种广谱的三唑类抗真菌药物,已被批准用于治疗侵袭性念珠菌病、侵袭性曲霉病及由尖孢梭菌和镰刀菌引起的真菌感染[4]。然而,VRC引起一些不良反应[5],包括发热、视觉障碍、恶心、呕吐、皮疹、腹痛等,同时也存在水溶解度有限、生物利用度低等问题[1],且白色念珠菌对VRC的耐药性增加[6]。
胶束是通过表面活性剂/两亲性聚合物在超过临界胶束浓度的水体系中自发自组装而形成的纳米结构。近年来,由两种或多种不同嵌段共聚物或表面活性剂组成的混合胶束作为一种新型给药系统备受关注。这些载体比它们的单组分载体更有优势,例如更大的热力学和动力学稳定性以及更高的包封低水溶性药物的能力[7]。Albayaty[8]等制备包载有伊曲康唑的pH响应型纳米胶束对白色念珠菌生物膜具有很高的亲和力,能显著抑制白色念珠菌生物膜的活性。
α-生育酚聚乙二醇琥珀酸酯(alpha-tocopheryl polyethylene glycol succinate,TPGS)是美国食品药品监督管理局批准的水溶性安全药用辅料之一。TPGS是维生素E的水溶性形式,有助于增强药物在纳米颗粒递送中的包封作用,改善细胞摄取,增强治疗效果,延长循环时间,提高口服生物利用度[9]。TPGS不仅可以作为分子生物材料增强药物通过细胞膜的渗透性,而且作为P-糖蛋白的抑制剂和底物可显著减少药物的外排[10]。
本研究旨在设计负载VRC的TPGS和聚氧乙烯蓖麻油EL混合胶束,以增加VRC的溶解度、改善渗透性和吸收,从而提高其生物利用度及抗菌效果,并在一定程度降低VRC自身的毒副作用,并对纳米胶束进行了详尽的性质表征,包括粒径、Zeta电位及形貌特征等,还对其体外安全性、细胞摄取能力、细胞摄取途径和体外抗菌性能进行了评价。
1 材料与方法
1.1 材料
1.1.1 菌种 白色念珠菌野生型菌株C.albicanSC 5314。
1.1.2 细胞 人永生化角膜上皮细胞(human corneal epithelial cells,HCE-T,BNCC341100)由北京北纳创联生物技术研究院提供。
1.1.3 药物与试剂 VRC(武汉维斯尔曼生物工程有限公司,纯度为99%);TPGS(TCI上海化成工业发展有限公司);聚氧乙烯蓖麻油EL(美国Sigma公司);盐酸氯丙嗪(Chlorpromazine, 北京百灵威科技有限公司);阿米洛利(Amiloride,大连美伦生物技术有限公司);甲基-β-环糊精(北京索莱宝生物科技有限公司);叠氮化钠(Sodium azide,天津市凯信化学工业有限公司);香豆素6(美国Sigma公司);CCK-8试剂盒(上海碧云天生物技术有限公司);H-DMEM高糖培养基(普诺赛生物科技有限公司);胎牛血清EDTA-胰蛋白酶消化液(普诺赛生物科技有限公司);YPD Broth 培养基(青岛海博生物技术有限公司);YPD Agar培养基(青岛宾德生物有限公司);受精鸡蛋(湖北荆门桃园生态养殖厂)。
1.1.4 仪器 Nano ZS90纳米激光粒度分析仪购自英国Malvern公司;JEM-1400透射电子显微镜购自日本电子株式会社;Agilent 1260高效液相色谱分析仪购自安捷伦科技有限公司;Synergy H2酶标仪购自美国赛默飞公司;BDCanto II流式细胞仪购自美国BD公司。
1.2 实验方法
1.2.1 α-生育酚聚乙二醇琥珀酸酯-聚氧乙烯蓖麻油EL/伏立康唑纳米胶束(TPGS-EL/VRC)的制备 通过薄膜水化法制备TPGS-EL/VRC、TPGS-EL。按照不同组成比例称取VRC、TPGS及EL置于茄形瓶,并加入适量二氯甲烷及乙醇超声、溶解,然后用旋转蒸发仪于50 ℃条件下除去有机溶剂,直至形成干燥的薄膜。用双蒸馏水在水浴中水化干燥薄膜即得。香豆素6负载胶束是通过用香豆素6代替VRC来配制的,用于细胞实验研究。制备方法与TPGS-EL/VRC相同。
1.2.2 粒径与Zeta电位测定 利用Zetasizer测量了新制备胶束的平均粒径[11]。用同一仪器在室温下测定纳米胶束的Zeta电位。在不稀释样品的情况下进行测量,并重复3次。
1.2.3 形貌特征考察 采用透射电镜考察了TPGS-EL/VRC胶束的形貌特性。将TPGS-EL/VRC滴于用碳涂层的铜网上,然后用1%磷钨酸对进行负染色,然后晾干得到薄膜。进行透射电镜观察并拍照。
1.2.4 载药量与包封率测定 采用高效液相色谱法测定纳米胶束中VRC的含量。将2.0 mL的TPGS-EL/VRC纳米胶束加入到超滤离心管中,6 000 rpm离心15 min后,滤液用甲醇稀释后,使用高效液相测定药物浓度。根据公式1和公式2计算VRC的载药量(DL%)和包封率(EE%)。
(公式1)
(公式2)
1.2.5 细胞学研究
1.2.5.1 HCE-T细胞培养 在DMEM培养基中添加1%青霉素/链霉素和10%胎牛血清作为HCE-T细胞培养基。细胞在37 ℃、95%湿度、5% CO2条件下孵育。隔天换液,细胞用0.25%胰蛋白酶/EDTA溶液传代培养。
1.2.5.2 细胞毒性试验 采用CCK-8法评估载体材料和载药制剂对HCE-T细胞的细胞毒性。将细胞以1×104个细胞/孔的密度接种于96孔板中,在37 ℃下培养过夜,然后加入不同组成比例的TPGS-EL混合材料和负载不同浓度药物的TPGS-EL/VRC制剂,培养4 h。最后,每孔加入10 μg/mL CCK-8试剂,继续培养1 h。使用酶标仪在450 nm处测定吸光度。
1.2.5.3 细胞摄取能力评价 使用流式细胞仪定量评估TPGS-EL纳米胶束对HCE-T细胞摄取能力的影响[12]。在6孔板中培养5×105个HCE-T细胞/孔2 d,然后分别加入200 μL的制剂,在37 ℃下孵育2 h。然后用PBS缓冲溶液冲洗2次,胰酶消化后再次离心,再次用PBS缓冲液冲洗后离心,重复3次。在实验结束时再次离心细胞,用450 μL PBS重悬,通过流式细胞仪在FITC通道中使用488 nm的绿色激光激发波长和525 nm的发射波长测定。
1.2.5.4 细胞摄取途径 采用香豆素6(C6)替代VRC制备载C6的TPGS-EL纳米胶束,将细胞接种于6孔板(5×105个细胞/孔),37 ℃、5% CO2条件下孵育48 h,然后在37 ℃条件下将细胞与H-DMEM、叠氮化钠、阿米洛利、甲基-β环糊精、氯丙嗪预孵育1 h后,向每孔中加入200 μL的C6标记TPGS-EL纳米胶束并孵育2.5 h后,按照“1.2.5.3项”中的方法处理细胞,使用流式细胞术评估短期孵育后纳米载体的摄取情况。结果表示为相对荧光强度,所有检测均为一式三份。
1.2.6 鸡胚尿囊膜试验 鸡胚绒毛尿囊膜(chorioallantoic membrane,CAM)已被描述为活体动物眼睛体内试验的另一种血管生成模型[13]。CAM具有广泛的毛细血管床,是一种有效且容易获得的视网膜模型。使用鸡胚绒毛尿囊膜(hen′s egg test-chorioalantoic membrane,HET-CAM)来作为模拟药物对眼粘膜血管及结缔组织的刺激性的潜在方法[14]。将受精鸡蛋放置在孵化箱中孵化8 d后,大头朝上,用镊子暴露出CAM,用生理盐水浸润内膜,直至内膜浸湿。滴入100 μL TPGS-EL/VRC的胶束溶液于CAM,立即观察血管5 min,记录有无充血、出血和凝血现象及其出现时间以评价对CAM的刺激性,并拍摄图像。以生理盐水和0.1 M NaOH分别为阴性对照和阳性对照。
1.2.7 体外抗菌作用评价
1.2.7.1 白色念珠菌的制备 挑取白色念珠菌野生型菌株C.albicanSC 5314于YPD琼脂平板上,置于30℃,培养24 h长出白色念珠菌单菌落,于4℃保存备用。
1.2.7.2 抑菌环试验 在30℃ 的YPD琼脂培养基表面铺上100 μL白色念珠菌悬液(5×103CFU/mL)。在琼脂平板表面上放置无菌滤纸,滴加10 μL的TPGS-EL/VRC和SOL/VRC,30℃孵育24 h,隔天进行抑菌环半径的测量。
1.2.7.3 体外抗真菌活性试验 将白色念珠菌稀释至1×105CFU/mL铺在96孔板上,以0.04、0.03、0.02、0.015、0.01 μg/mL药物浓度给药,30℃孵育12 h,使用酶标仪在600 nm处测得吸光度值。
2 结果
2.1 TPGS-EL/VRC的表征
2.1.1 粒径与Zeta电位 TPGS-EL/VRC纳米胶束的的粒径为(109.63±0.25)nm,Zeta电位为(-29.3±0.20)mV,见图1。
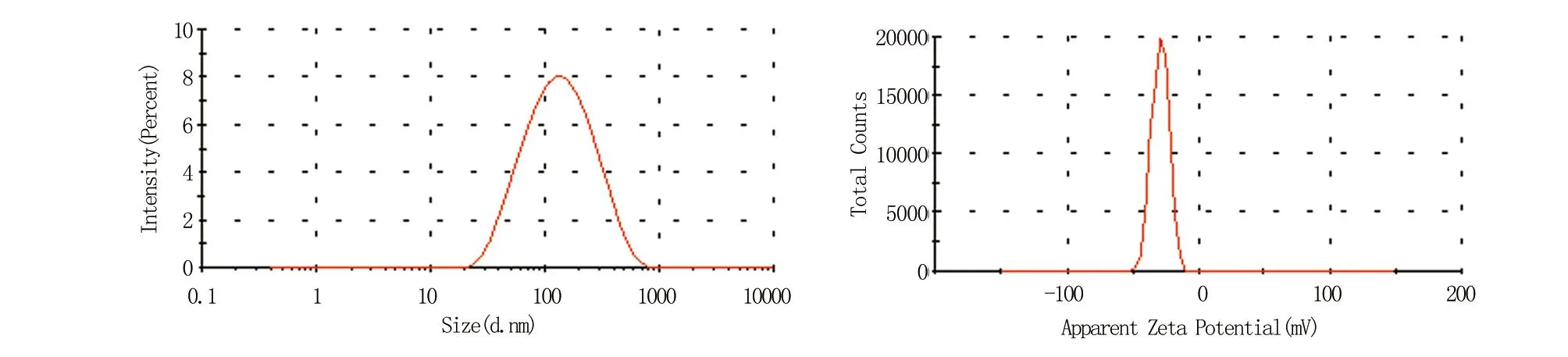
图1 TPGS-EL/VRC纳米胶束的粒径(左)及Zeta电位(右)
2.1.2 形貌特征 利用TEM观察TPGS-EL/VRC纳米胶束的形貌如图2所示,所制备载药胶束形态接近球形且分布较为均匀,无聚集现象。粒子直径在100 nm左右,与激光粒度仪测定结果较为一致。

图2 TPGS-EL/VRC纳米胶束的TEM图
2.1.3 载药量与包封率 建立VRC的标准曲线方程为A=28.605C-1.360 2 (r2=0.999 4),见图3。这表明,VRC在0~15 μg/mL浓度范围内与峰面积呈良好的线性。所测得纳米胶束的包封率为71.67%,载药量为10.27%。这说明,TPGS-EL混合胶束对VRC能够较好地进行负载。
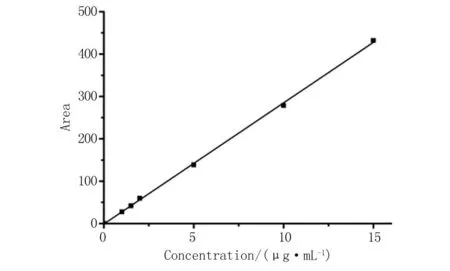
图3 VRC的浓度与峰面积线性关系
2.2 细胞毒性试验 CCK-8法评价不同浓度载药制剂和材料的细胞毒性结果见图4。与对照组比较,当混合胶束中载体材料EL∶TPGS的质量比为3∶1时,HCE-T细胞存活率最高,即载体的细胞毒性最小。因此,本研究采用EL∶TPGS=3∶1的组成作为纳米胶束的载体处方。以此比例负载药物VRC的纳米胶束的细胞毒性考察结果见图4。结果显示,在0~100 μg/mL药物浓度范围内,细胞存活率均大于80%。这说明,在此药物浓度范围TPGS-EL/VRC胶束制剂未产生明显的HCE-T细胞毒性,眼部应用的安全性较好。
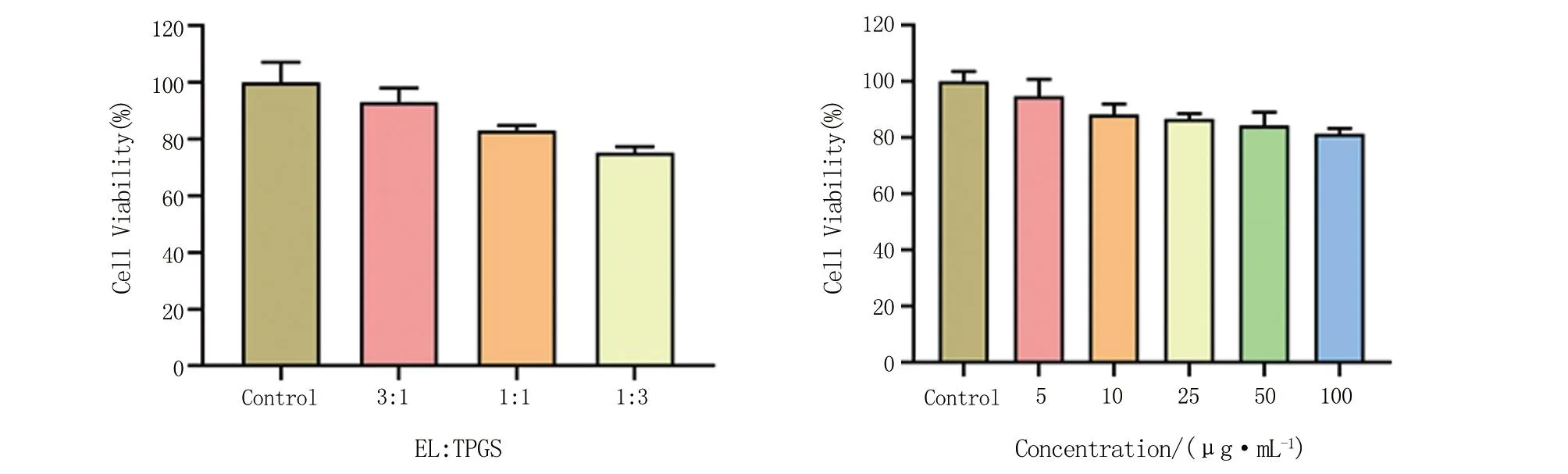
图4 TPGS-EL空白胶束(左)及TPGS-EL/VRC载药胶束(右)的细胞毒测定结果
2.3 细胞摄取能力评价 通过流式细胞术考察TPGS-EL纳米胶束对细胞内药物递送的促进作用,结果见图5。TPGS-EL纳米胶束组处理的细胞内平均荧光强度值为10 768,是溶液组平均荧光强度的5.8倍(P<0.001)。这说明,TPGS-EL纳米胶束显著提高了荧光探针C6的HCE-T细胞内递送。这是由于使用TPGS修饰纳米颗粒表面能够增加纳米颗粒与细胞的粘附,从而提高细胞对药物的摄取[15]。这证明TPGS-EL纳米胶束的促渗透能力。
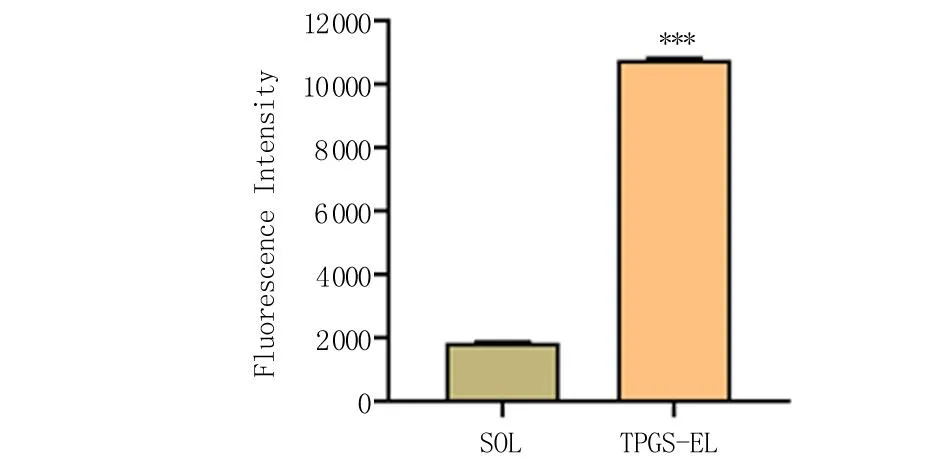
与SOL组比较,***P<0.001。
2.4 细胞摄取途径 采用流式细胞仪进行评估TPGS-EL纳米胶束的入胞机制,对照组不进行任何处理,直接与材料进行孵育。叠氮化钠是一种ATP酶抑制剂,从而干扰能量依赖性内吞过程[16]。结果见图6,与对照组比较,经过叠氮化钠处理后的细胞摄取率明显下降(P<0.05)。这表明,细胞摄取过程受到了叠氮化钠的抑制,纳米胶束的入胞过程具有一定程度的能量依赖性,即存在主动摄取。
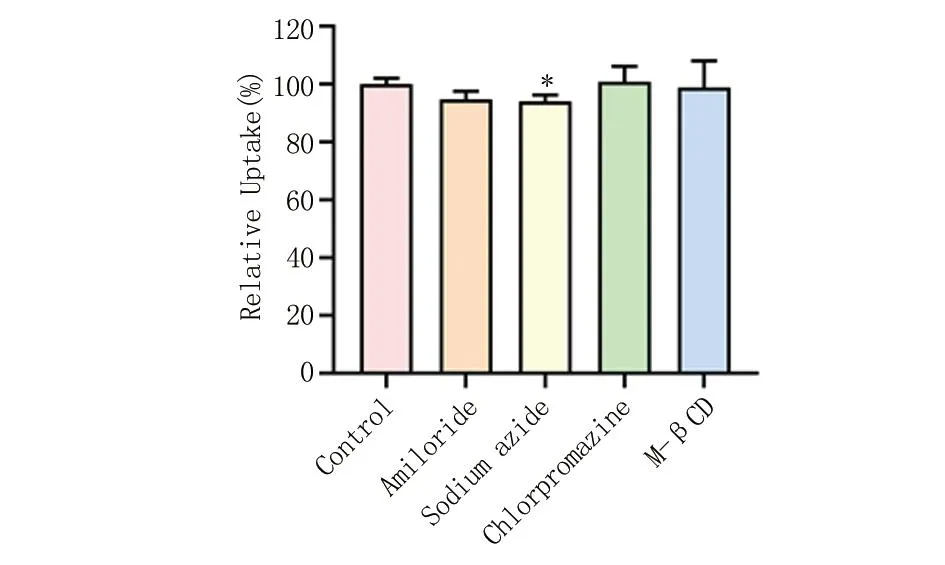
与对照组比较,*P<0.05。
2.5 CAM试验 为了进一步考察纳米胶束的生物相容性,采用HET-CAM来进行试验。图7为对照组和测试制剂在CAM上的血管反应结果。CAM暴露于0.1 M NaOH溶液30 s后出现大片出血点,2 min左右血管呈现枫叶状凝血。而生理盐水和TPGS-EL/VRC纳米胶束组5 min后,鸡胚CAM并未出现溶血现象,血管形态正常。根据文献[17]中评分标准进行判定,0.1 M的NaOH溶液显示出严重的刺激性,而生理盐水和TPGS-EL/VRC纳米胶束没有刺激性。这表明,TPGS-EL/VRC为 CAM的非刺激性物,进一步证明其生物安全性高。
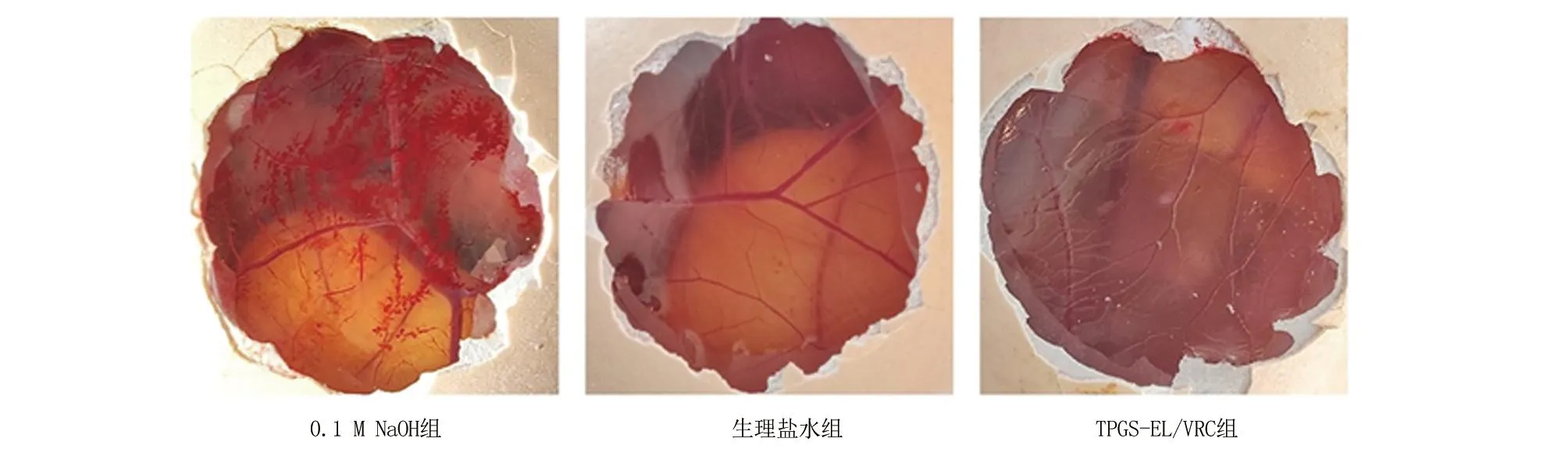
图7 鸡胚绒毛尿囊膜刺激性实验图片
2.6 抑菌环试验 采用纸片法研究TPGS-EL/VRC对白色念珠菌的抑菌活性,结果见表1,其典型平板见图8。在考察的VRC 5~10 μg/mL浓度范围,TPGS-EL/VRC组的抑菌半径均明显大于SOL/VRC组。TPGS-EL/VRC组在5 μg/mL药物浓度的抑菌环半径为(13.16 ± 0.28)mm,而SOL/VRC组在5 μg/mL药物浓度的抑菌环半径为(9.66 ± 0.57)mm。这表明,在低药物浓度时,TPGS-EL/VRC组的抗菌效果比SOL/VRC组好(P<0.001),这证实了所设计TPGS-EL纳米胶束对抗菌药物VRC的高效递送性能。这可能是TPGS可在水中自组装成胶束,提高难溶性药物的溶解度和生物利用度[18],此外,TPGS 作为P-糖蛋白抑制剂,能够抑制P-糖蛋白外排转运[19],从而增加药物的疗效。
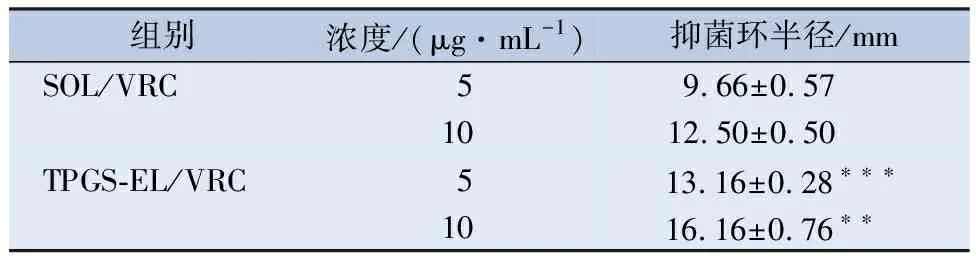
表1 抑菌环试验结果
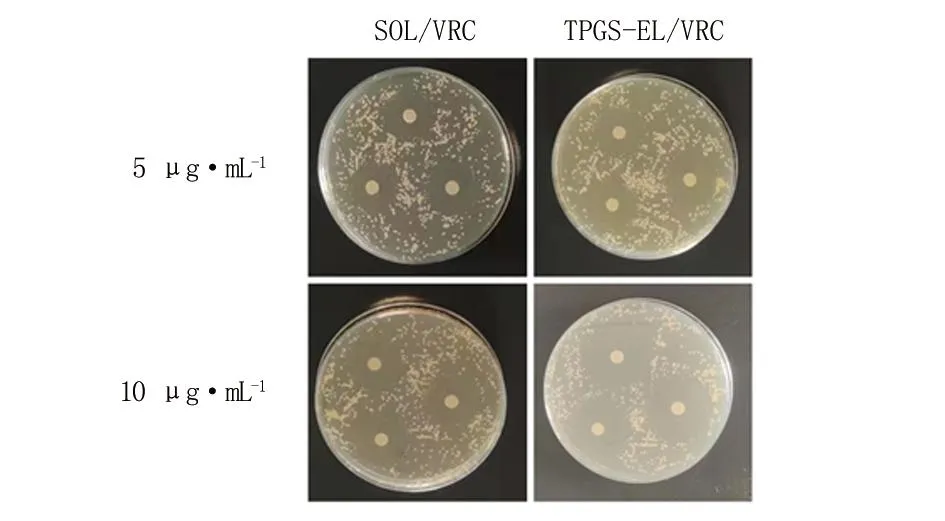
图8 抑菌环测试图片
2.7 体外抗真菌活性试验 为了验证TPGS-EL/VRC的体外抑菌效果,进行抑菌率试验,结果见图9。在0.01~0.04 μg/mL浓度范围内,TPGS-EL/VRC组抑菌效果均明显高于SOL/VRC组(P<0.01或<0.001)。且随着VRC浓度增加,两组的抑菌率均增加。即使在0.015 μg/mL药物浓度时,混合胶束组的抑菌率为66%,而溶液组只有12%的抑菌率,制剂组的抑菌率是溶液组的5倍高。这说明,在VRC药物低浓度下,TPGS-EL纳米胶束组依然发挥较好的抗菌效果,这与抑菌环试验结果相一致,也预示了所设计TPGS-EL/VRC眼用制剂较好的抗菌应用潜力。
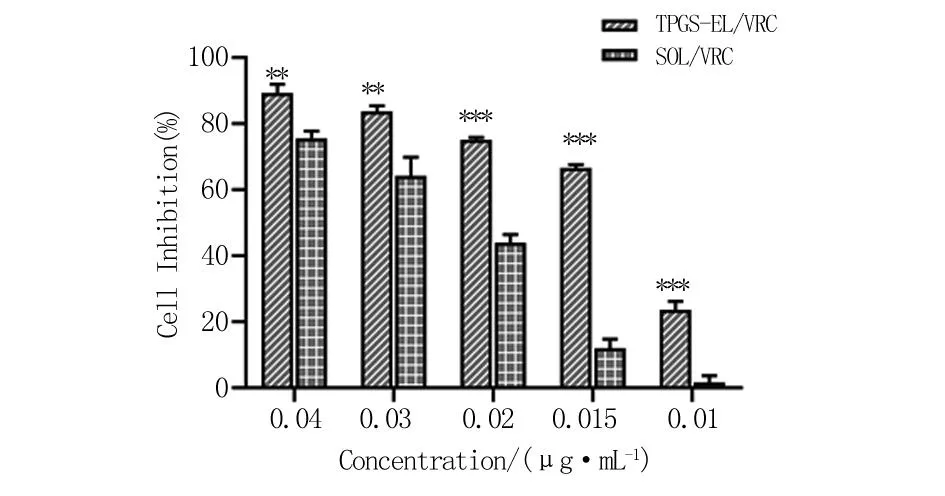
与SOL/VRC组比较,**P<0.01,***P<0.001。
3 讨论
真菌是造成微生物性眼部感染的重要原因之一,它们威胁视力,甚至导致不可逆转的视力丧失,且发病率呈现不断上升的趋势[20]。对于真菌性角膜炎来说,念珠菌是主要病原之一。目前临床上抗真菌药物主要为多烯类、唑类、嘧啶类、棘白菌素类,其中唑类抗真菌药物为主体[21]。VRC由于水溶性差、生物利用度低、副作用大等问题,在治疗白色念珠菌眼部感染存在局限性。
本研究构建一种新型的基于TPGS-EL的眼用混合胶束,用于提高VRC的递送效率和眼部白色念珠菌的治疗效果。利用薄膜水化法制备的TPGS-EL纳米胶束能够有效负载VRC,且工艺简单,具有合适的粒径(<150 nm)、较高的载药量与包封率等优点。同时,纳米胶束还能够快速、高效地被HCE-T细胞摄取。在治疗白色念珠菌性感染时,TPGS-EL/VRC纳米胶束可以有效地递送和增强真菌部位的VRC浓度,并通过TPGS的P-糖蛋白抑制作用减少真菌的耐药性,从而提高抗白色念珠菌的疗效。本研究将VRC包封到TPGS-EL胶束中具有很高的控制念珠菌感染的潜力,并期望在克服白色念珠菌引起的眼部感染的治疗等方面得到更广泛的应用。

