大鼠压力性损伤皮肤皮下组织中IL-6受体表达及其意义
董正惠, 李振刚, 祁进芳, 王志伟, 田旭功, 马小飞
(新疆医科大学1第六附属医院护理部, 乌鲁木齐 830000; 2第一附属医院重症医学中心, 乌鲁木齐 830054; 3护理学院, 乌鲁木齐 830017)
压力性损伤是由压力、摩擦力和剪切力引起的局部皮肤、皮下组织损伤[1]。目前认为压力性损伤是一种局部组织的缺血再灌注损伤。组织器官在压力、摩擦力与剪切力作用下缺血缺氧,在灌注恢复后大量炎性细胞因子释放介导局部剧烈炎症反应,造成细胞凋亡,加重组织损伤[2-3]。白介素6(Interleukin-6,IL-6)通过与膜结合型IL-6受体(Membrane-bounded interleukin-6 receptor, mIL-6R)或可溶型IL-6受体(Soluble interleukin-6 receptor, sIL-6R)结合后参与调控多种炎症细胞因子及凋亡相关蛋白的表达水平[4-7]。mIL-6R及sIL-6R表达水平可影响炎症反应及细胞凋亡,对压力性损伤的预防和治疗具有一定的潜在价值,但目前其表达水平与压力性损伤的关系尚未明确[8]。本研究拟通过分析大鼠压力性损伤模型中两种IL-6受体、细胞因子表达水平及细胞凋亡水平差异,探究IL-6受体影响压力性损伤发生发展的机制,为压力性损伤防治提供新的思路。
1 材料与方法
1.1 实验动物月龄为2~3个月,体重250~300 g的雄性SD大鼠60只由新疆医科大学动物实验中心提供[实验动物许可证号:SCXK(新)2023-0001]。实验动物在研究开始前一周单笼饲养,饲养环境为:恒温(18℃~24℃),恒湿(40%~50%),明暗交替各12 h,自由进食和饮水。
1.2 实验材料大鼠IL-6、sIL-6R ELISA试剂盒、大鼠抗IL-6R抗体、抗ICAM-1抗体、抗VEGF抗体、抗Bcl-2抗体、抗Bax抗体、抗Caspase-3抗体均购自美国Boster公司;大鼠sgp130Fc蛋白购自德国R&D公司;Tunel细胞凋亡试剂盒购自美国Boster公司。
1.3 实验方法
1.3.1 动物分组 使用随机数字表法将60只SD大鼠随机分为3组,每组20只。分别为正常对照组、压力性损伤模型组、sgp130Fc预处理组。(1)正常对照组:不做任何处理。(2)压力性损伤模型组:参照王晓慧等[9]的报道方法进行建模:腹腔内注射300 mg/kg水合氯醛全身麻醉,剔除股薄肌处毛发,使用小磁片循环压迫股薄肌2 h缓解1 h后再压迫2 h,重复3个循环建立局部组织压力性损伤模型。(3)sgp130Fc预处理组:参照Montufar-solis等[10]的实验方案,在大鼠麻醉前30 min给予sgp130Fc 250 ng腹腔内注射(特异性阻断由sIL-6R介导的IL-6反式信号通路)。在麻醉后建立压力性损伤模型,建模方法与压力性损伤模型大鼠相同。
1.3.2 血液及组织样本采集方法 建模成功后,大鼠置于冰上切取股薄肌受压处全层皮肤及皮下组织,使用0.9%氯化钠注射液冲净血液;部分组织用40 g/L多聚甲醛处理后常规石蜡包埋,制成厚度为0.5 cm的切片;其余组织剪碎后置于冻存管内于-80℃环境下保存备用。自大鼠尾静脉取静脉血2 mL置于含有分离胶的采血管内保存待检。标本采集完毕后大鼠再给予300 mg/kg水合氯醛腹腔内注射,达到深度麻醉状态后用颈椎脱臼法处死。
1.3.3 组织HE染色 组织石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ、二甲苯Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、75%酒精、水洗,切片烘干;苏木素浸染3 min,水洗后盐酸酒精分化液分化。水洗后烘干;伊红染色浸染1 s,水洗后100%酒精脱水;烘干后中性树胶封片;光学显微镜观察结果并采集图像。
1.3.4 ELISA法检测血液IL-6、sIL-6R表达水平 自大鼠尾静脉取静脉血,以1 500 r/min离心20 min以分离血液样本。取上层血清,采用ELISA试剂盒检测血清中IL-6、sIL-6R表达水平。
1.3.5 免疫组化法检测组织中mIL-6R、相关细胞因子及凋亡因子的表达 应用免疫组化法检测大鼠组织中膜结合型IL-6受体(mIL-6R)、血管内皮生长因子(VEGF)、细胞间黏附分子-1(ICAM-1)、B细胞淋巴瘤-2因子(Bcl-2)、B细胞淋巴瘤-2因子相关X蛋白(Bax)、半胱氨酸天冬氨酸蛋白水解酶-3(Caspase-3)的表达。组织切成0.5 cm×0.5 cm小块石蜡包埋制成切片。切片经脱蜡、冲洗、煮沸修复抗原、孵育、山羊血清封闭后分别滴加一抗(IL-6、IL-6R、VEGF、ICAM-1、Bcl-2、Bax、Caspase-3)。之后置于4℃冰箱过夜,再分别滴加山羊抗鼠-HRP二抗后二氨基联苯胺显色,苏木精复染后封片。每张切片取3个400倍不同视野,进入ImageScope软件的分析模块,设置组织切片上所有的深棕色为强阳性,棕黄色为中度阳性,浅黄色为弱阳性,蓝色细胞核为阴性。进而对每个组织点进行识别,分析出强阳性,中度阳性,弱阳性及阴性细胞的百分比,通过计算组织化学评分评估相对表达量(组织化学评分=强阳性百分比×3+中等阳性百分比×2+弱阳性百分比×1×100%)[11]。
1.3.6 末端标记法(Tunel)检测组织凋亡水平 凋亡细胞胞核固缩为棕褐色,可呈圆形、新月形或不规则形。应用Image-Pro Plus 6.0软件选取相同的棕黄色细胞核作为判断所有照片阳性细胞的统一标准,选取相同的蓝色细胞核为总细胞,对每张照片进行分析得出每张照片阳性细胞数以及总细胞数,并计算出凋亡指数(凋亡指数=凋亡细胞数/总细胞数×100%)[12]。
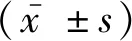
2 结果
2.1 大鼠压力性损伤组织病理学变化正常对照组大鼠皮肤结构清晰可见,胶原纤维紧密排列整齐;压力性损伤模型组大鼠表皮可见少量细胞坏死,胞质呈空泡化,胞核固缩或碎裂,胶原纤维排列紊乱,炎性细胞浸润增强;与压力性损伤模型组大鼠相比,sgp130Fc预处理组大鼠股薄肌处压力性损伤创面组织病理特征基本相同,但炎性细胞浸润程度较轻,见图1。
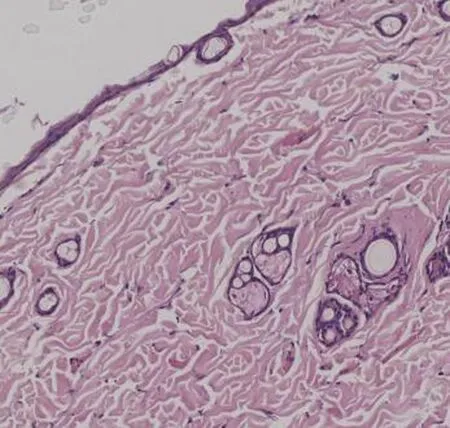
正常对照组
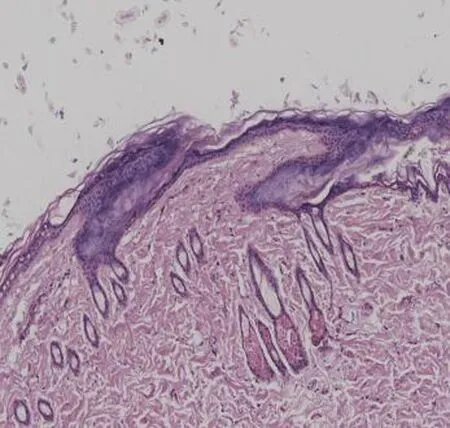
压力性损伤模型组
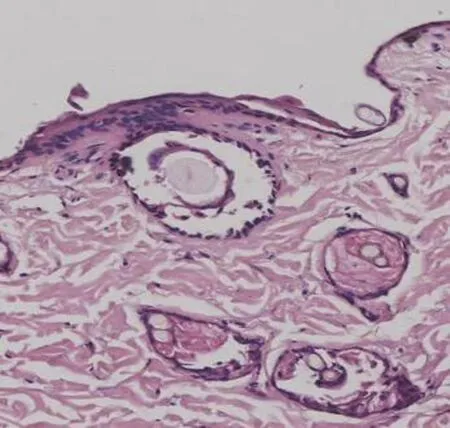
sgp130Fc预处理组
2.2 3组大鼠血液中IL-6、sIL-6R表达水平的比较与正常对照组大鼠相比,压力性损伤模型组大鼠及sgp130Fc预处理组大鼠血清IL-6及sIL-6R表达水平均显著升高(P<0.05)。sgp130Fc预处理组大鼠和压力性损伤模型组大鼠血清IL-6及sIL-6R表达水平比较, 差异无统计学意义(P>0.05),见表1。
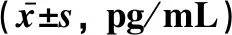
表1 3组大鼠血液中IL-6及sIL-6R表达水平的比较
2.3 3组大鼠组织中mIL-6R、相关细胞因子及凋亡因子的表达比较压力性损伤模型组大鼠组织中ICAM-1、Bax和Caspase-3的表达显著高于正常对照组大鼠;mIL-6R、VEGF的表达显著低于正常对照组大鼠(P<0.05)。sgp130Fc预处理组大鼠组织中mIL-6R、VEGF和Bcl-2的表达与压力性损伤模型组大鼠相比无明显差异(P>0.05),但ICAM-1、Bax、Caspase-3的表达明显低于压力性损伤模型组大鼠(P<0.05),见表2、图2。
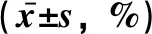
表2 3组大鼠组织中mIL-6R、相关细胞因子及凋亡因子的表达
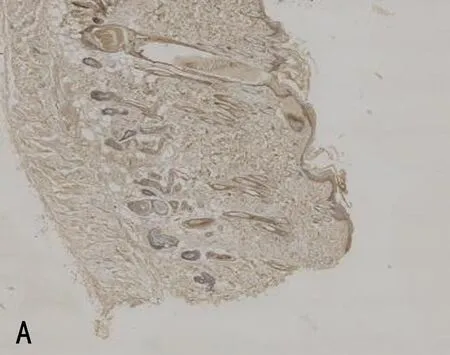


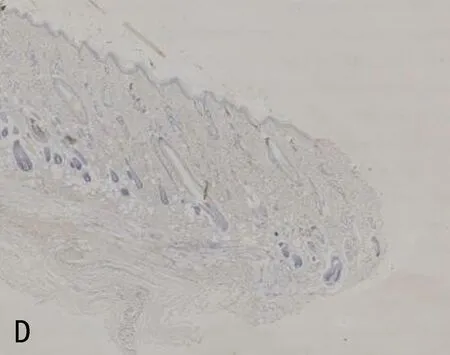


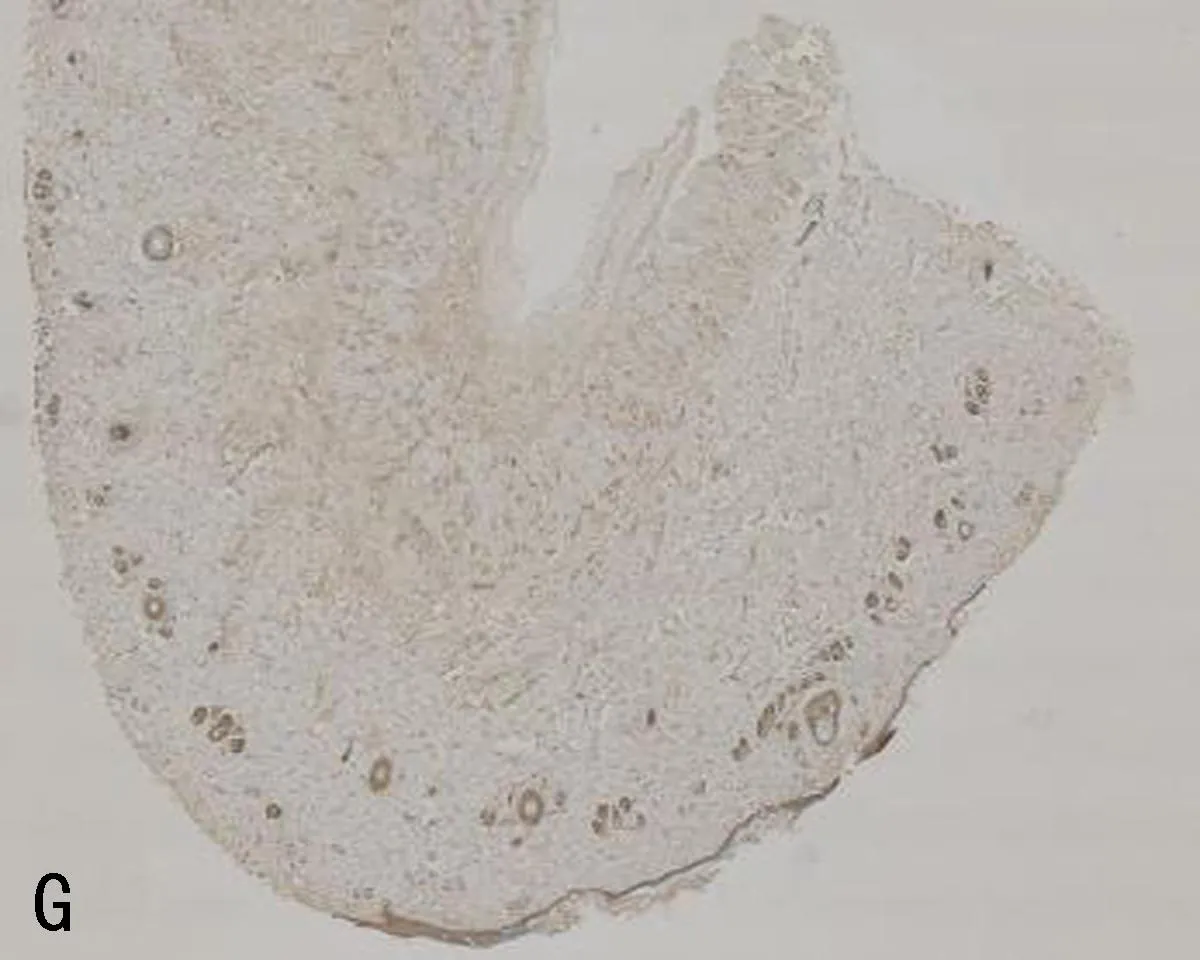
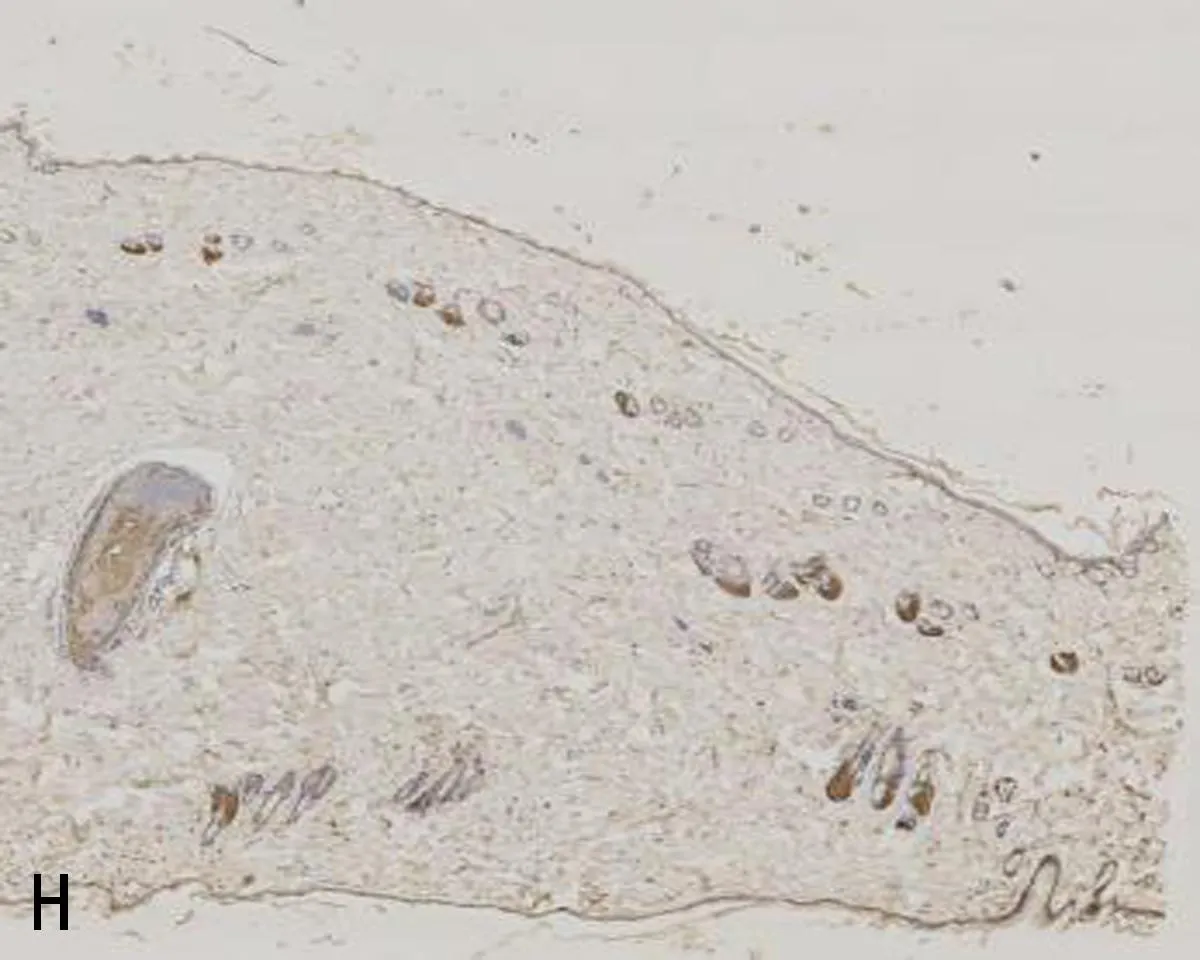
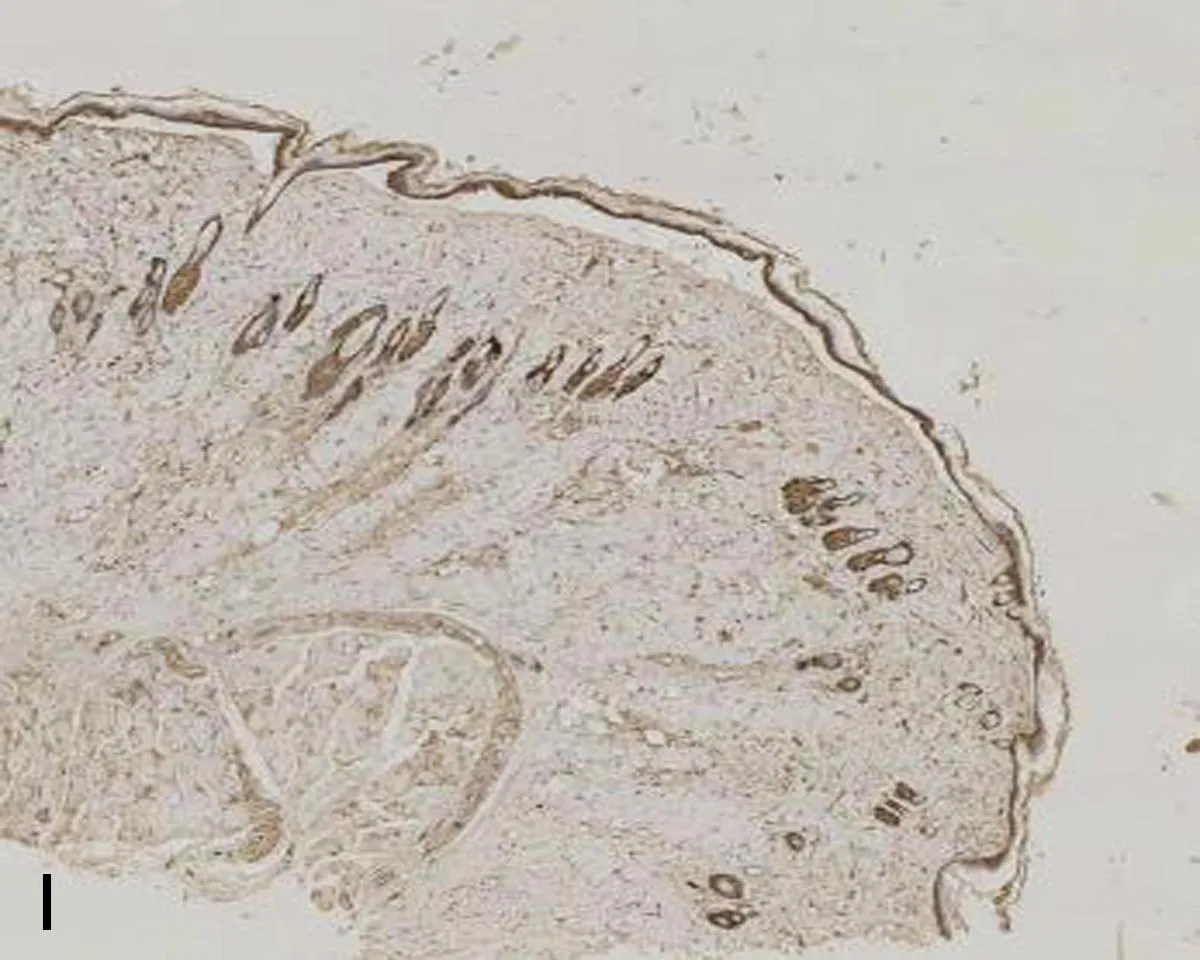


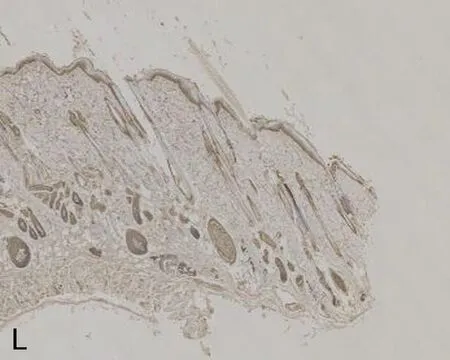

注:A, mIL-6R在正常对照组的表达; B, mIL-6R在压力性损伤模型组的表达; C, VEGF在正常对照组的表达; D, VEGF在压力性损伤模型组的表达; E, ICAM-1在正常对照组的表达; F, ICAM-1在压力性损伤模型组的表达; G, ICAM-1在sgp130Fc预处理组的表达; H, Bax在正常对照组的表达; I, Bax在压力性损伤模型组的表达; J, Bax在sgp130Fc预处理组的表达; K, Caspase-3在正常对照组的表达; L, Caspase-3在压力性损伤模型组的表达; M, Caspase-3在sgp130Fc预处理组的表达。
2.4 3组大鼠细胞凋亡水平的比较光镜下可观察到压力性损伤模型组及sgp130Fc预处理组大鼠的股薄肌组织中存在较多呈圆形、半圆形或不规则形的黄褐色细胞核,即凋亡细胞;正常对照组大鼠组织中凋亡细胞数量较少,见图3。压力性损伤模型组大鼠及sgp130Fc预处理组大鼠股薄肌组织细胞凋亡指数(38.13±3.75和25.42±3.71)均明显高于正常对照组(10.13±4.17),差异有统计学意义(P<0.05)。sgp130Fc预处理组大鼠股薄肌组织细胞凋亡指数低于压力性损伤模型组大鼠(P<0.05)。

正常对照组
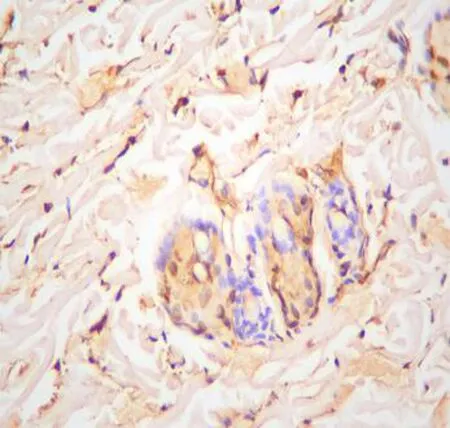
压力性损伤模型组
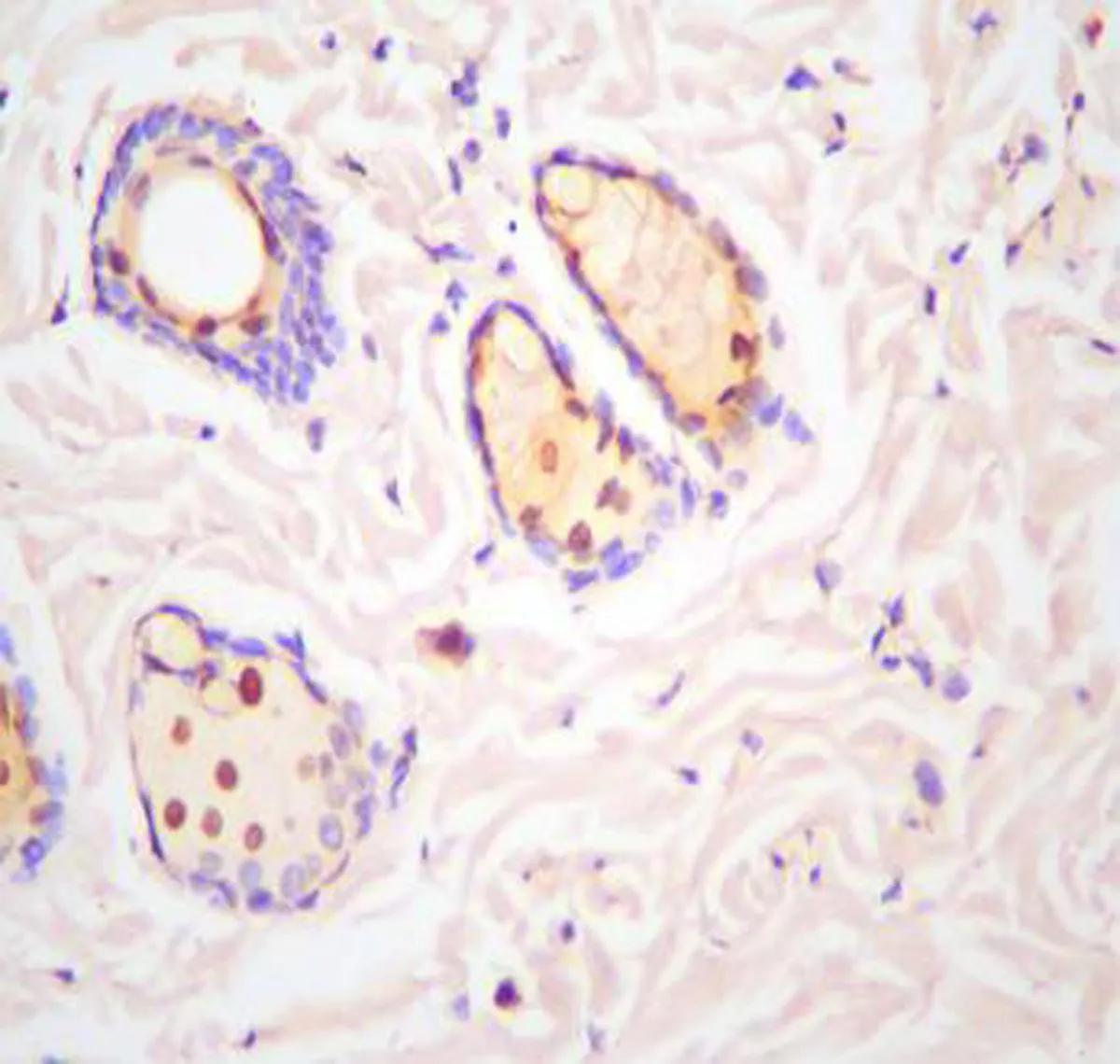
sgp130Fc预处理组
3 讨论
IL-6可通过与其2种不同形式的受体结合激活相应信号通路发挥生理作用[4],其与组织中的mIL-6R结合后主要表现为抗炎性质,有利于保护维持细胞正常的功能;机体处于急性炎症反应状态时组织细胞表面的IL-6R被蛋白酶水解后进入血液循环形成sIL-6R,IL-6与血液中游离的sIL-6R结合后激活其反式信号通路,主要表现为促炎性质[4,13]。本研究结果显示,压力性损伤模型组大鼠的股薄肌组织中mIL-6R表达明显低于正常对照组大鼠,而血液中的IL-6及sIL-6R水平显著高于正常对照组大鼠。异常升高的sIL-6R可与循环中的IL-6结合后激活反式信号通路,进一步激活炎症反应[8]。
VEGF可促进新生血管生成和胶原沉积,是组织修复的关键细胞因子[14]。本研究结果显示,压力性损伤模型组大鼠股薄肌组织中VEGF表达明显低于正常对照组大鼠,与Wang等[15]的研究结果一致。有报道称抑制局部过度炎症反应可上调VEGF表达保护新生血管生成,但本研究发现sgp130Fc预处理组大鼠与压力性损伤模型组大鼠组织中VEGF表达水平无明显差异,可能与VGEF表达受多种信号通路调控有关[16-17]。ICAM-1促进白细胞吞噬被感染和坏死的细胞,但其持续高表达可诱导发生血管内皮功能障碍[18]。本研究观察到大鼠压力性损伤建模的股薄肌处组织内有大量炎性细胞浸润,且ICAM-1表达明显高于正常对照组大鼠,与Cui等[19]及Zhang等[20]的研究结果一致。接受由IL-6/sIL-6R介导的反式信号通路特异性阻断剂(腹腔内注射sgp130Fc250 ng)预处理的大鼠其股薄肌组织中ICAM-1的表达明显减少,且其组织HE染色也显示该组大鼠皮下组织炎性细胞浸润程度减轻。说明sIL-6R激活反式信号通路可促进炎症因子表达,加重炎症反应和组织损伤。
光镜下观察大鼠压力性损伤建模的股薄肌组织可发现存在大量呈圆形、半圆形或不规则形的黄褐色细胞核的凋亡细胞,与Pan等[21]及Deng等[22]的研究结果一致。动物实验表明阻断IL-6/sIL-6R介导的反式信号通路可能有助于保护细胞功能,减少细胞凋亡[23-24]。本研究结果显示,与压力性损伤模型组大鼠相比,接受sgp130Fc预处理的大鼠其股薄肌组织中的抗凋亡因子Bcl-2表达无明显差异,但促凋亡因子Caspase-3和Bax表达显著降低;Tunel检测显示该组大鼠组织细胞凋亡指数明显低于压力性损伤模型组大鼠。以上结果说明阻断由sIL-6R介导的IL-6反式信号通路可能有助于减少细胞凋亡,保护细胞功能,与Barkhausen等[25]的研究结果相似。
综上所述,本研究发现压力性损伤大鼠组织中mIL-6R表达减少,而血液中的sIL-6R水平异常增高。sIL-6R异常增高可上调炎症因子表达水平,促使细胞发生凋亡。阻断异常表达的sIL-6R介导的反式信号通路可减轻炎症反应,减少细胞凋亡,在压力性损伤的预防和治疗中具有一定潜力。

