基于FOLFOX方案的肝动脉灌注化疗在肝癌围手术期的应用进展
王鹏程,廖晖,徐小平
南方医科大学珠江医院 肝胆二科,广东 广州 510000
肝癌是世界排名第六位的常见恶性肿瘤和第三大癌症相关死亡原因。东亚是全球肝癌发病率最高的地区[1]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型,占90%以上。目前国内外指南中,手术是早中期HCC的首选治疗方式。但由于70%~80%的肝癌患者诊断时已不符合手术指征,以及肝癌患者术后5年的高复发率,大部分患者未能取得满意的治疗效果[2]。近年来,我国学者对基于FOLFOX方案的肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)研究表明,该治疗方案在肝癌转化治疗、术前新辅助治疗及术后辅助治疗方面具有良好的应用效果和前景。本文将分别对FOLFOX HAIC用于肝癌的转化治疗、术前新辅助治疗和术后辅助治疗进展进行详细介绍。
1 FOLFOX HAIC方案的发展历史
HAIC是通过肝动脉可靠地将药物输注到整个肝脏和肝脏内的肿瘤,增加肿瘤局部的抗癌药物浓度,因首过效应减少了药物的全身分布,理论上可获得更强的抗肿瘤效果和更低的全身不良反应发生率[3]。FOLFOX化疗方案指经改进的FOLFOX 4、FOLFOX 6、mFOLFOX 6、FOLFOX 7方案[4-7](见表1)。应用于HAIC的FOLFOX方案主要是mFOLFOX 6和FOLFOX 7。
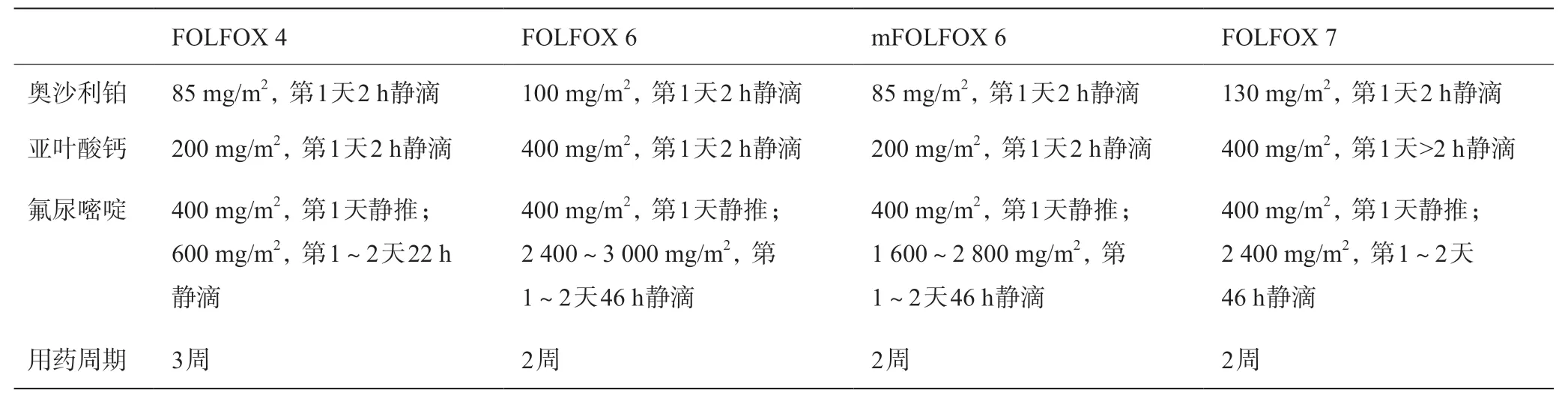
表1 FOLFOX各化疗方案
FOLFOX方案联合HAIC最早于21 世纪初应用于结直肠癌肝转移的治疗[8]。此后于2013 年,一项多中心随机临床试验研究表明,FOLFOX 4 化疗方案可以给晚期不可切除肝细胞癌(unresectable hepatocellular carcinoma,uHCC)患者带来生存获益,提示FOLFOX方案对肝癌的治疗作用[9]。第一次将FOLFOX方案与HAIC联用治疗HCC是2017年中山大学石明教授团队开展的一项Ⅱ期研究,该研究中,对于非手术大肝癌患者(病灶总直径>10 cm,最大病灶>7 cm),mFOLFOX 6-HAIC的治疗效果和安全性均优于经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE),且成功转化更多患者(10/38vs3/41,P=0.033)[10]。此后,FOLFOX HAIC以其良好的生存获益受到诸多关注和研究。
2 FOLFOX HAIC方案用于肝癌及肝癌围手术期治疗的现况
目前,欧美指南大多未推荐HAIC用于肝癌治疗[11-12];在日本指南中,HAIC被推荐用于合并门静脉侵犯肝癌患者的一线治疗,也可用作多发肝癌(≥4个)的二线治疗[13];韩国指南建议,不适用系统治疗、一线或二线系统治疗失败的门静脉侵犯、肝功能保留且无肝外转移的晚期HCC,可考虑HAIC[14]。
中国《原发性肝癌诊疗指南》2022 年版推荐,FOLFOX HAIC用于多次TACE后产生抵抗、合并门静脉癌栓、术后高危复发风险及伴肝外转移的患者,其疗效优于索拉非尼,也推荐用于无法手术的大肝癌患者的降期治疗[15]。
从现有研究来看,FOLFOX HAIC用于肝癌围手术期治疗的研究主要集中在不可切除肝癌的转化治疗方面。两项Ⅲ期临床研究显示,FOLFOX HAIC对uHCC的转化效率较索拉非尼和TACE有明显优势[16-17],在几份研究中,FOLFOX HAIC单独或联合系统治疗的转化率可达12.3%~29.6%[16-19]。此外,在2021年版《肝癌转化治疗中国专家共识》里,FOLFOX HAIC单独应用及联合索拉非尼应用被推荐为HCC的一线转化方案,主要适用于肿瘤负荷集中在肝内或合并门静脉癌栓的肝癌患者;该共识还推荐联合靶免治疗及放射治疗以提高转化率[20]。FOLFOX HAIC应用于肝癌术前新辅助治疗和术后辅助治疗的研究目前相对较少,但仍不乏一些优秀的研究,这些研究显示,FOLFOX HAIC可以增加部分肝癌手术患者的生存获益[21-23]。
3 FOLFOX HAIC方案在肝癌转化治疗中的应用
转化治疗是指应用多种治疗方式使不可切除肝癌转为可切除肝癌,然后行手术治疗。不可切除原因包括不满足手术安全的外科学原因和手术获益低于其他治疗方式获益的肿瘤学原因。近年来《肝癌转化治疗中国专家共识》把FOLFOX HAIC单独治疗及联合索拉非尼治疗列为HCC的一线转化治疗方案,建议用于肝内肿瘤负荷大或合并门静脉癌栓的HCC患者,并建议将FOLFOX HAIC与靶向治疗、免疫治疗、TACE及放射治疗联用,以提高转化率[20]。
3.1 FOLFOX HAIC方案单独用于肝癌转化治疗
2022年中山大学石明教授团队[16]开展的一项多中心随机对照研究中,随机将315例不可切除无血管侵犯和肝外转移的大肝癌患者(>7 cm)1∶1分配至FOLFOX HAIC组(n=159)和TACE组(n=156),其中FOLFOX HAIC治疗组手术转化率明显更高(24%vs12%,P=0.002),且其在中位生存时间(23.1个月vs16.1个月,P<0.001)、客观缓解率(RECIST 29.9%vs2.0%;mRECIST 49.7%vs5.0%,P<0.001)和严重不良事件发生率(19%vs30%,P=0.03)方面也均优于TACE治疗。可以看出,FOLFOX HAIC用于肝癌转化治疗较TACE更具优势,且更安全。不过上述研究的对象仅是BCLC A/B期的患者,对于BCLC C期的肝癌患者,FOLFOX HAIC在转化治疗方面较索拉非尼也具有显著优势。在一项Ⅲ期临床试验中(NCT03164382),FOLFOX HAIC治疗组有12.3%(16例)出现降期,其中位生存期(13.9个月vs8.2个月,P<0.001)、客观缓解率(RECIST 31.5%vs1.5%,P<0.001;mRECIST 35.4%vs5.3%,P<0.001)均优于索拉非尼治疗组[17]。(注:RECIST,response evaluation criteria in solid tumors,实体肿瘤疗效评价标准;mRECIST,modified response evaluation criteria in solid tumors,改良实体肿瘤疗效评价标准。)
3.2 FOLFOX HAIC方案联合靶向药物用于肝癌转化治疗
以索拉非尼为代表的靶向药物具有抗血管生成和抑制肿瘤细胞增殖的作用[24],HAIC则对肝内局部肿瘤控制有较好的效果,两者联用时,可能增加临床获益。在一项开放标签Ⅲ期研究中(NCT02774187),247例伴有门静脉侵犯的肝癌患者按照1∶1随机分为FOLFOX HAIC-索拉非尼联合治疗组(n=125)和索拉非尼单独治疗组(n=122),结果显示联合治疗组有16例(12.9%)患者成功转化并接受手术治疗,索拉非尼单药治疗组仅1例成功转化。此外,联合治疗组的中位生存期(13.37个月vs7.13个月;P<0.001)和无进展生存期(7.03个月vs2.60个月;P<0.001)较索拉非尼单药治疗具有明显优势[25]。另一项前瞻性单臂Ⅱ期研究中,对于FOLFOX HAIC联合索拉非尼治疗的35 例晚期肝癌患者,5 例成功转化并接受手术治疗,转化率14.3%[26]。
上述两份研究展示出FOLFOX HAIC联合靶向治疗对晚期肝癌患者转化治疗的能力。值得注意的是,临床研究NCT02774187中接受FOLFOX HAIC-索拉非尼联合治疗的患者病程(VP4,37.6%),与前文所述单独应用FOLFOX HAIC治疗进展期肝癌的Ⅲ期研究(NCT03164382)相比更晚(VP4,28.5%)[17]。而两者治疗中位生存期(13.37个月vs13.9个月)和手术转化率(16/125vs16/130)接近,因此FOLFOX HAIC-索拉非尼联合治疗在晚期HCC转化治疗方面具有优势。
3.3 FOLFOX HAIC方案联合免疫检查点抑制剂用于肝癌转化治疗
免疫检查点抑制剂通过阻断检查点蛋白与其配体之间的相互作用来防止T细胞失活,从而发挥抗肿瘤作用[27]。将免疫检查点抑制剂与HAIC联用,可以使HCC患者生存获益。一项纳入229例晚期肝癌患者的回顾性研究中,FOLFOX HAIC联合抗程序性细胞死亡蛋白1/程序性细胞死亡配体1(programmed cell death protein 1/programmed cell death ligand 1,PD-1/PD-L1)药物治疗的肝癌患者的中位总生存期(18.0个月vs14.6个月,P=0.018)、中位无进展生存期(10.0个月vs5.6个月,P=0.006)以及客观缓解率(mRESIST 38%vs30%,P=0.227)均高于FOLFOX HAIC单独治疗组,两组不良反应发生率差异无统计学意义,均为轻度且可控。联合治疗组成功转化后有14例(17.3%)患者接受手术治疗,而FOLFOX HAIC组为12 例(8.1%)(P=0.036)。这表明,免疫检查点抑制剂可在不增加不良反应的情况下,提高FOLFOX HAIC用于肝癌治疗的转化率[28]。
3.4 FOLFOX HAIC方案联合靶免治疗用于肝癌转化治疗
近年来,仑伐替尼等靶向药物联合抗PD-1/PDL1药物已应用于肝癌患者的治疗,并获得了良好的生存结局[29]。将靶免治疗与FOLFOX HAIC联用,有望提高转化率。在一项治疗进展期HCC的回顾性研究中,仑伐替尼、特瑞普利单抗及FOLFOX HAIC三联治疗较单用仑伐替尼在中位总生存期(未达到vs11.0个月,P<0.001)、中位无进展生存期(11.1个月vs5.1个月,P<0.001)、客观缓解率(mRECIST 67.6%vs16.3%,P<0.001)方面有显著优势,三联治疗组较仑伐替尼组也有更多患者成功转化并接受手术[9(12.7%)vs0,P=0.001]。不过,三联治疗在严重不良事件发生率上高于仑伐替尼组(15.5%vs10.5,P=0.35),且会增加肝功能障碍发生率[30]。另一项回顾性研究也显示,仑伐替尼、PD-1抑制剂联合FOLFOX HAIC(HPL组)较仑伐替尼联合PD-1抑制剂(PL组)治疗晚期HCC具有优势:HPL组在中位总生存期(15.9个月vs8.6个月,P=0.0015)、中位无进展生存期(8.8个月vs5.4个月,P=0.0320)和中位疾病控制率(77.6%vs44.0%,P<0.001)方面均高于PL组,增加了患者生存获益[31]。
目前,各项研究中FOLFOX HAIC联合靶免治疗uHCC的转化率有较大不同(12.7%~29.6%)[19,31-32],这些研究均为回顾性研究,且部分研究存在单中心和随访时间短等限制,因此需要大样本的前瞻性随机对照试验来验证三联疗法的疗效。
3.5 FOLFOX HAIC方案联合TAE用于肝癌转化治疗
在靶免药物和FOLFOX HAIC应用之前,TACE是主要的转化方案,但其转化率低下。在一项联合TAE和FOLFOX HAIC治疗uHCC患者的回顾性研究中,TAE-FOLFOX HAIC联合治疗的患者较TACE治疗有更好的中位无进展生存期(7.93个月vs2.60个月,P=0.003))、客观缓解率(37.14%vs20.00%,P=0.112)和疾病控制率(88.57%vs60.00%,P=0.006),对于BCLC C期患者,其无进展生存期获益更多[33]。
3.6 FOLFOX HAIC联合放疗用于肝癌转化治疗
外放疗已被证实对uHCC患者有生存获益[34]。在一项HAIC联合放疗治疗合并门静脉主干或第一分支癌栓的HCC患者的回顾性研究中,HAIC联合放疗相较于索拉非尼单药治疗,有更好的中位总生存期(9.9个月vs5.3个月,P=0.002)、无进展生存期(3.9个月vs2.1个月,P=0.048)和进展后生存期(3.7个月vs1.9个月,P=0.02)[35]。另一项回顾性研究则显示,放疗可以延长对HAIC有反应的肝内HCC患者的中位生存期(30.2 个月vs23.3 个月,P=0.7181),但差异无统计学意义[36]。上述研究提示,FOLFOX HAIC联合放疗可能使患者生存获益。
4 FOLFOX HAIC方案在肝癌术前新辅助治疗中的应用
新辅助治疗指对具有高危复发风险的肝癌手术患者,术前采用系统或局部治疗等方式,降低术后肿瘤复发风险及改善预后。《肝细胞癌新辅助及转化治疗中国专家共识》推荐,对于技术上可切除的CNLCⅡb期、Ⅲa期患者,可在术前行新辅助治疗,以减少术后复发。该共识中提及有效的新辅助治疗手段包括HAIC和放射治疗[37]。
中山大学郭荣平教授团队[21]开展的一项多中心Ⅲ期随机对照研究显示,对于超出米兰标准的BCLC A/B期HCC患者,术前接受FOLFOX HAIC新辅助治疗可以显著提高总体生存率(1、2、3年总体生存率分别为92.9%、78.6%、63.5%vs79.5%、62.0%、46.3%,P=0.016)和无进展生存率(6、12、18 个月无进展生存率分别为77.6%、50.4%、47.4%vs52.7%、42.8%、34.8%,P=0.017),而无复发生存率两组差异无统计学意义(6、12、18个月无复发生存率分别为63.8%、47.3%、47.3%vs52.7%、42.8%、34.8%,P=0.385)。这提示,术前行新辅助FOLFOX HAIC治疗可以延长患者生存期,但不能减少肿瘤复发。另一项纳入64例CNLC Ⅱa~Ⅲa期肝癌患者的单中心回顾性研究结果显示,在意向性分析中,术前行FOLFOX HAIC新辅助治疗的患者比术后行辅助门静脉灌注化疗的患者有更好的中位总生存期(未达到vs19.47个月,P=0.043)和中位无进展生存期(37.57个月vs6.73个月,P=0.049)。在符合研究方案的分析中,术前行FOLFOX HAIC新辅助治疗有更好的中位肝内无复发生存期(未达到vs6.63个月,P=0.009)和中位无肝外转移生存期(未达到vs7.03个月,P=0.040)[22]。
可以看出,FOLFOX HAIC应用于术前新辅助治疗可以增加部分患者生存获益,但能否降低术后肿瘤复发风险,目前还有争议。
5 FOLFOX HAIC方案在肝癌术后辅助治疗中的应用
在我国《原发性肝癌诊疗指南》中,对于肝癌切除术后有高危复发风险(肿瘤多发、合并肉眼或镜下癌栓、肿瘤直径>5 cm)的患者,推荐术后行预防性TACE治疗(证据等级1,推荐A)[15]。最近,有研究显示,FOLFOX HAIC可用于部分术后有高危复发风险的肝癌患者的辅助治疗。
中山大学李少华等[23]开展的一项多中心、随机对照、Ⅲ期研究中,315例伴有微血管侵犯的肝癌术后患者按1∶1随机分至术后FOLFOX HAIC治疗组(n=157)和术后无治疗的对照组(n=158),意向性分析中,治疗组和对照组的1、2和3年总体生存率分别93.8%、86.4%、80.4%和92.0%、86.0%、74.9%,两组差异无统计学意义(P>0.05);治疗组中位无病生存期为20.3个月,高于对照组的10.0个月(P=0.001);治疗组和对照组肿瘤复发率分别为40.1%(63/157)和55.7%(88/158),差异有统计学意义(P<0.05)。
日本学者Hatano等[38]开展的一项多中心回顾性研究中,对于伴门静脉一级分支和门静脉主干癌栓的肝癌患者,术后辅助HAIC治疗组和术后无治疗组患者的中位无病生存期分别为9.3个月和5.4个月(P=0.0149),HAIC组中位生存期长于无治疗组(28.1个月vs18.7个月,P=0.0024),HAIC组和无治疗组的5年OS分别为32.6%和22.1%。
台湾学者Hsiao等[39]开展的一项单中心回顾性研究显示,对于HCC多发且伴有微血管侵犯的患者,术后行辅助HAIC治疗较单纯手术的患者总生存期更长(69.7个月vs54.6个月,P<0.05),且多发肝癌A型的患者接受术后辅助HAIC治疗获益远超B型患者(中位总生存期分别为85.06 个月vs41.53 个月,P=0.004)。(注,A型:多个小结节相互靠近或巨大肿瘤伴多个卫星结节;B型:两个或两个以上的肿瘤分散在不同的节段)。可以看出,对于伴门静脉一级分支和门静脉主干癌栓的肝癌患者,以及HCC多发且伴有微血管侵犯的患者,术后行辅助HAIC治疗可能有生存获益;而对于仅伴微血管侵犯的肝癌患者,术后HAIC治疗虽能提高中位无病生存期以及降低肿瘤复发率,但不能延长患者总生存期。此外,术后辅助HAIC治疗与术后辅助TACE治疗的疗效差异,目前还不清楚。
6 小结与展望
近年来FOLFOX HAIC无论是在肝癌转化治疗,术前新辅助治疗还是在术后辅助治疗,都显示出良好的疗效与应用前景。将FOLFOX HAIC与系统治疗、TACE治疗及放疗等联合,可以进一步提高治疗效果和转化率,增加肝癌患者的生存获益。不过目前关于FOLFOX HAIC的一些观点还存在争议,且一些研究缺乏足够的说服力,还需要大型随机对照试验进行验证。

