七氟烷对β淀粉样蛋白1-40诱导的大鼠认知功能障碍影响及机制
邹敏,孙应中,魏艳妮,官焕春
作者单位:重庆市开州区人民医院麻醉科,重庆 405400
阿尔茨海默病(Alzheimer's disease,AD)是一种中枢神经系统变性疾病,主要表现为渐行性记忆减退、认知功能减退等,其主要病理特征是神经细胞外β 淀粉样蛋白(amyloid-β,Aβ)沉积[1]。海马区作为学习和记忆的关键脑区,在AD 早期阶段极易受到损害[2]。七氟烷是目前临床上普遍使用的吸入式挥发性麻醉剂[3],研究表明,七氟烷吸入可增加Aβ的寡聚肽沉积产生神经毒性[4],通过上调肿瘤坏死因子(tumor necrosis factor,TNF)-α 和白细胞介素(interleukin,IL)-1β 等炎症细胞因子的表达诱导神经元凋亡,以及随后的认知障碍。动物实验结果表明,七氟烷对老年大鼠认知能力有显著的损伤[5]。因此,对于术前患有AD 或具有AD 倾向的病人应用七氟烷后,是否进一步加重其认知功能障碍仍有待探讨。2021 年8 月至2022 年8 月,本研究拟评价七氟烷吸入对Aβ 诱导的AD 模型大鼠认知功能障碍及海马组织神经炎症和神经元凋亡的影响。
1 材料与方法
1.1 实验动物无特定病原体级12 周龄雄性Sprague-Dawley 大鼠32 只,体质量230~280 g,购自北京维通利华实验动物技术有限公司,使用许可证号:SYXK(京)2021-0010,饲养于重庆市开州人民医院实验动物中心。大鼠置于自然光照条件下,室内温度约25 ℃,相对湿度约50%;给予大鼠自由饮食,适应1周后进行实验。本研究符合一般动物实验伦理学原则。
1.2 主要试剂材料寡聚Aβ1-40溶液(Sigma,美国);兔源单克隆胶质纤维酸性蛋白(GFAP)抗体、兔源单克隆离子钙接头蛋白分子1(IBA1)抗体、兔源单克隆B 淋巴细胞瘤-xL(Bcl-xL)抗体、兔源多克隆胱天蛋白酶-9(caspase-9)抗体、兔源单克隆脑源性神经营养因子(BDNF)抗体和兔源单克隆晚期糖基化终末产物受体(RAGE)(Santa Cruz,美国);兔源多克隆β 肌动蛋白(β-actin)抗体(BioVision,美国);Aβ1-40酶联免疫吸附测定(ELISA)试剂盒(碧云天,上海);七氟烷(恒瑞医药有限公司,上海)。
1.3 动物模型的建立和分组
1.3.1 双侧海马内注射Aβ1-40构建AD 模型配置浓度为5 g/L 的Aβ1-40溶液,37 ℃培养箱内孵育1 周后4 ℃储存备用。腹腔注射10%水合氯醛(250 mg/kg)麻醉,将大鼠固定于脑立体定位仪上,注射部位选择在海马CA1 区(前囟后3.0 mm,中线外侧2.2 mm,颅骨表面下3.5 mm)。2 个不锈钢注射器通过引导套管插入尖端下方0.5 mm 处,在5 min 内将2 μL 的0.6%生理盐水(NS)或Aβ1-40溶液轻轻地缓慢注入CA1 区两侧。留针10 min,使注射溶液充分浸润。
1.3.2 实验分组采用随机数字表法,将32只大鼠分为四组:NS+氧气组、NS+七氟烷组、Aβ+氧气组和Aβ+七氟烷组,每组8只。
1.3.3 七氟烷吸入注射NS 或Aβ1-4014 d 后,各组大鼠分别暴露于2.5%七氟烷或30%氧气中4 h。七氟烷的吸入方法描述如下:大鼠在自制的麻醉室(50 cm×30 cm×30 cm)吸入七氟烷。麻醉室保持在37 ℃温水浴中,内部有2个通气孔:上层通气孔与麻醉泵相连,下层通气孔与气体监测器相连。首先在麻醉室中用5%的七氟烷对NS+七氟烷组和Aβ+七氟烷组的大鼠进行麻醉,2 min 后大鼠昏迷,用2.5%七氟烷和30%氧气持续吸入4 h(流速1.5 L/min)。NS+氧气组和Aβ+氧气组大鼠在麻醉室中仅给予30%氧气吸入4 h。
1.4 观察吸入七氟烷大鼠的生命体征NS+七氟烷组和Aβ+七氟烷组大鼠吸入5%七氟烷轻度麻醉后,将血气分析仪动脉导管插入大鼠颈动脉,另一端连接压力传感器。监测大鼠持续吸入2.5%七氟烷4 h 的血液动力学参数:平均动脉压(MAP)、心率、pH、动脉血二氧化碳分压(PaCO2)、动脉血氧分压(PaO2)和碳酸氢根(HCO3-)。
1.5 Morris 水迷宫实验(MWM)水迷宫的主要组成部分是一个圆形水池(直径160 cm,高50 cm),并根据池壁上的4 个等距点分为4 个相等的象限(Ⅰ、Ⅱ、Ⅲ和Ⅳ)。平台放置在第Ⅳ象限中心的水面下2 cm 处,其直径为15 cm。游泳试验的方法如下:将大鼠放在4 个不同象限的水池中,面对池壁,允许大鼠自由游动,直到找到隐藏在水底的平台。用Any-Maze 视频追踪系统记录大鼠的游泳速度和逃逸潜伏期(大鼠从进入水中到爬上平台的时间)。若大鼠在90 s 内没有找到平台,它们将被引导到平台上休息30 s,逃逸潜伏期被记录为90 s。定位航行试验后1 d,四组大鼠接受双侧海马内注射NS 或Aβ,14 d 后,在2.5%七氟醚或30%氧气中暴露4 h。暴露后7 d,所有大鼠接受第2 次MWM。移除平台,对所有大鼠进行空间探测测试,并记录探索原始平台的时间。然后,平台被移到原来象限的另一侧(第Ⅱ象限)。所有大鼠在新平台上接受了4 次测试。测试前,将大鼠放在新平台上30 s,然后按照上述方法进行测试,并记录游泳速度和逃逸潜伏期。取4次结果的平均值作为每只大鼠的实验结果。
1.6 ELISA 测定大鼠海马区Aβ1-40脱颈处死大鼠后,收集海马组织样本,立即放入冰NS(25 mL/g)中。用匀浆器在4 ℃下研磨海马组织。4 ℃离心(2 500 r/min,半径10 cm,15 min)获取上清液,转移至干净的小型离心管中。根据试剂盒说明书,用ELISA 法测量组织上清液中Aβ1-40表达水平,采用酶标仪在450 nm处读取吸光度。
1.7 蛋白质印迹法采集海马区标本并置于冰磷酸缓冲盐溶液(PBS)中,4 ℃下加入蛋白裂解缓冲液和蛋白酶抑制剂,用匀浆器研磨海马组织。裂解1 h,4 ℃、12 000 r/min(半径10 cm)离心20 min。蛋白-铜螯合化学试剂法检测样本蛋白含量,煮沸变性。应用聚丙烯酰胺凝胶电泳对40 μg 总蛋白进行电泳。湿转将蛋白转移至聚偏二氟乙烯膜上,8%脱脂牛奶封闭非特异性蛋白1 h,分别置于抗IBA1抗体(1∶500)、抗GFAP 抗体(1∶500)、抗Bcl-xL 抗体(1∶1 000)、抗caspase-9 抗体(1∶2 000)、抗RAGE 抗体(1∶1 000)和抗BDNF 抗体(1∶1 000)中4 ℃过夜,辣根过氧化物酶结合的二抗室温孵育1 h。采用增强化学发光法显示蛋白条带,Image-Pro Plus 6.0 软件进行灰度分析。
1.8 免疫组织化学染色海马组织取出后用10%多聚甲醛固定24 h,常规脱水、石蜡包埋、切片(5 μm)。将切片与GFAP(1∶1 000)或IBA1(1∶500)抗体在4 ℃下孵育至少18 h。辣根过氧化物酶结合的山羊抗兔免疫球蛋白G 抗体(1∶500)作为二抗在室温下孵育1 h,PBS 清洗,封片。光镜下拍照记录,放大倍数为400倍。
1.9 实时荧光定量逆转录聚合酶链反应(qRT-PCR)用组织匀浆器在Qiagen 裂解缓冲液中提取组织中的总RNA,并按照说明书用Qiagen RNeasy 小柱进行RNA 纯化。使用NanoDrop ND-1000 分光光度计对RNA 进行定量,并根据说明书,用NuGEN's Ovation 系统进行扩增和生物素标记。将50 ng 的RNA 加入SYBR qPCR 混合液中进行qRT-PCR。分组样品中的目标基因表达以β-actin 进行标准化。引物序列设计如下,IL-1β 正向:5′-GCTGTGGCAGCTACCTATGTCTTG-3′,反向:5′-AGGTCGTCATCATCCCACGAG-3′;核因子-κB(NF-κB)正向:5′-ACTGCCGGGATGGCTTCTAT-3′,反向:5′-CTGGATGCGCTGGCTAATGG-3′;诱导型一氧化氮合酶(iNOS)正向:5′-TCCACCTCCTTCCCTGAACTGG-3′,反向:5′-TGATGACGGTGATGAAGAATAT-3′;β-actin正向:5′-CTTAGTTGCGTTACACCCTTTCTTG-3′,反向:5′-CTGTCACCTTCACCGTTCCAGTTT-3′。每个样本重复检测3 次,2-ΔΔCt法计算基因相对表达量。
1.10 统计学方法采用SPSS 26.0 统计学软件对数据进行分析。计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步多组间两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 七氟烷吸入对大鼠生命体征的影响动脉监测结果显示,维持吸入2.5%七氟烷在NS+七氟烷组和Aβ+七氟烷组大鼠4 个不同时间点(1、2、3、4 h)的MAP、心率、pH、PaCO2、PaO2和HCO3-的测量值比较,差异无统计学意义(P> 0.05)。见表1。
表1 七氟烷吸入对大鼠生命体征的影响/
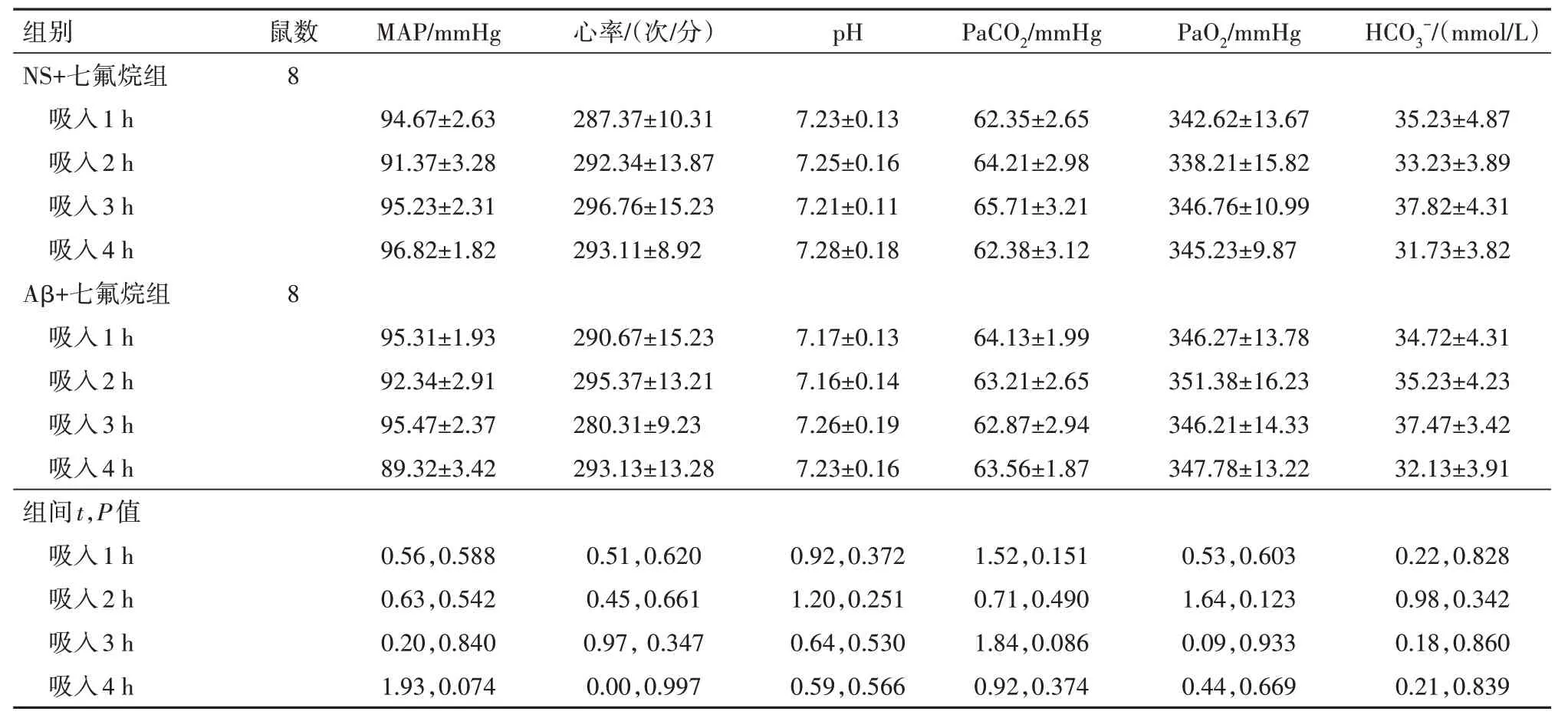
表1 七氟烷吸入对大鼠生命体征的影响/
注:MAP为平均动脉压,PaCO2为动脉血二氧化碳分压,PaO2为动脉血氧分压,HCO3-为碳酸氢根,NS为生理盐水,Aβ为β淀粉样蛋白。
?
2.2 七氟烷对大鼠认知能力以及海马区Aβ1-40水平的影响MWM 结果显示,与NS+氧气组比较,Aβ+氧气组大鼠原始平台探索时间减少,逃逸潜伏期延长,Aβ1-40蛋白表达增多,差异有统计学意义(P<0.05)。与Aβ+氧气组相比,Aβ+七氟烷组大鼠原始平台探索时间减少,逃逸潜伏期和Aβ1-40蛋白表达增加,差异有统计学意义(P<0.05)。NS+氧气组和NS+七氟烷组大鼠之间原始平台探索时间、逃逸潜伏期和Aβ1-40蛋白表达水平比较,差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠认知功能、海马区Aβ1-40表达比较/
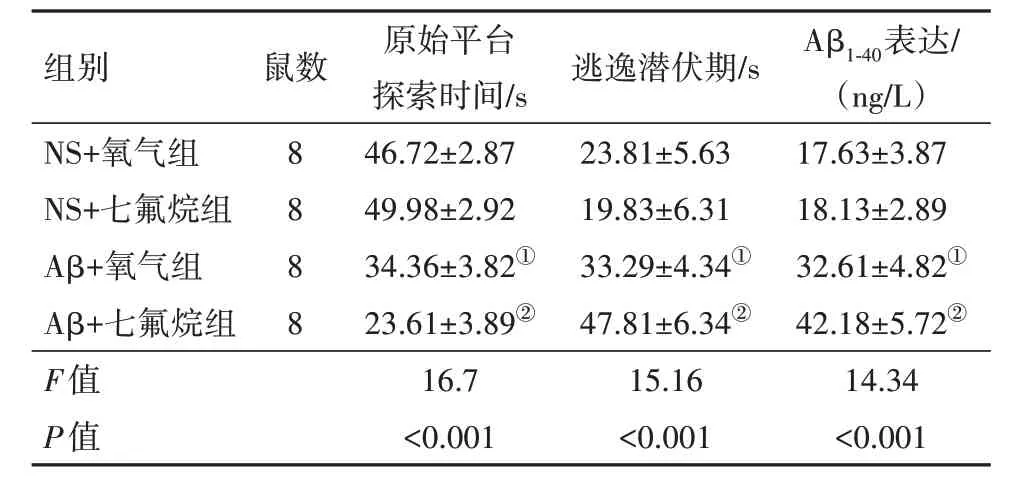
表2 各组大鼠认知功能、海马区Aβ1-40表达比较/
注:Aβ为β淀粉样蛋白,NS为生理盐水。①与NS+氧气组相比,P<0.05。②与Aβ+氧气组相比,P<0.05。
?
2.3 七氟烷对大鼠海马区GFAP 和IBA1 表达的影响各组大鼠海马组织表达GFAP 和IBA1 蛋白的星形胶质细胞和小胶质细胞分布在CA1 区各层。与NS+氧气组比较,Aβ+氧气组大鼠海马区GFAP和IBA1 蛋白表达升高,差异有统计学意义(P<0.05)。与Aβ+氧气组相比,Aβ+七氟烷组大鼠海马区GFAP和IBA1 蛋白表达进一步增多,差异有统计学意义(P<0.05)。NS+氧气组和NS+七氟烷组大鼠之间GFAP 和IBA1 蛋白表达差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠GFAP和IBA1表达比较/(个/高倍视野,)

表3 各组大鼠GFAP和IBA1表达比较/(个/高倍视野,)
注:GFAP 为胶质纤维酸性蛋白,IBA1 为离子钙接头蛋白分子1,NS为生理盐水,Aβ为β淀粉样蛋白。①与NS+氧气组相比,P<0.05。②与Aβ+氧气组相比,P<0.05。
?
2.4 七氟烷吸入对大鼠海马组织Bcl-xL、caspase-9、RAGE 和BDNF 蛋白表达的影响与NS+氧气组比较,Aβ+氧气组大鼠海马区caspase-9 和RAGE 蛋白的表达增高,Bcl-xL 和BDNF 蛋白表达降低(P<0.05)。与Aβ+氧气组相比,Aβ+七氟烷组大鼠海马组织caspase-9 和RAGE 蛋白的表达量明显增高,Bcl-xL 和BDNF 蛋白表达量显著降低(P<0.05)。而NS+O2组和NS+sevo 组之间的Bcl-xL、caspase-9、RAGE 和BDNF 的蛋白表达比较,差异无统计学意义(P>0.05)。见表4,图1。
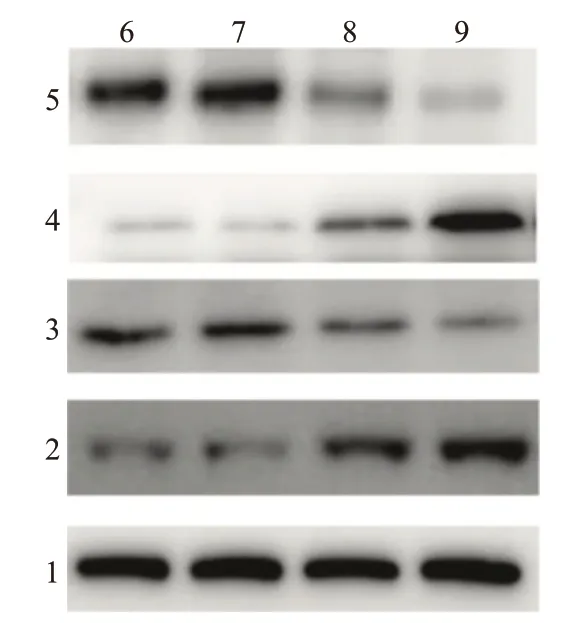
图1 各组大鼠海马中Bcl-xL、caspase-9、BDNF、RAGE蛋白表达水平
表4 各组大鼠海马区Bcl-xL、caspase-9、BDNF、RAGE蛋白表达水平比较/

表4 各组大鼠海马区Bcl-xL、caspase-9、BDNF、RAGE蛋白表达水平比较/
注:Bcl-xL为B淋巴细胞瘤-xL,caspase-9为胱天蛋白酶-9,BDNF为脑源性神经营养因子,RAGE为晚期糖基化终末产物受体,NS为生理盐水,Aβ为β淀粉样蛋白。①与NS+氧气组相比,P<0.05。②与Aβ+氧气组相比,P<0.05。
?
2.5 七氟烷吸入对大鼠海马组织IL-1β、NF-κB 和iNOS mRNA 表达的影响与NS+氧气组比较,Aβ+氧气组大鼠海马区IL-1β、NF-κB 和iNOS mRNA 表达升高(P<0.05)。与Aβ+氧气组相比,Aβ+七氟烷组大鼠海马区IL-1β、NF-κB 和iNOS mRNA 表达明显增多,差异有统计学意义(P<0.05)。而NS+O2组和NS+sevo 组之间的IL-1β、NF-κB 和iNOS mRNA 表达差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠海马区IL-1β、NF-κB和iNOS的mRNA相对表达量比较/
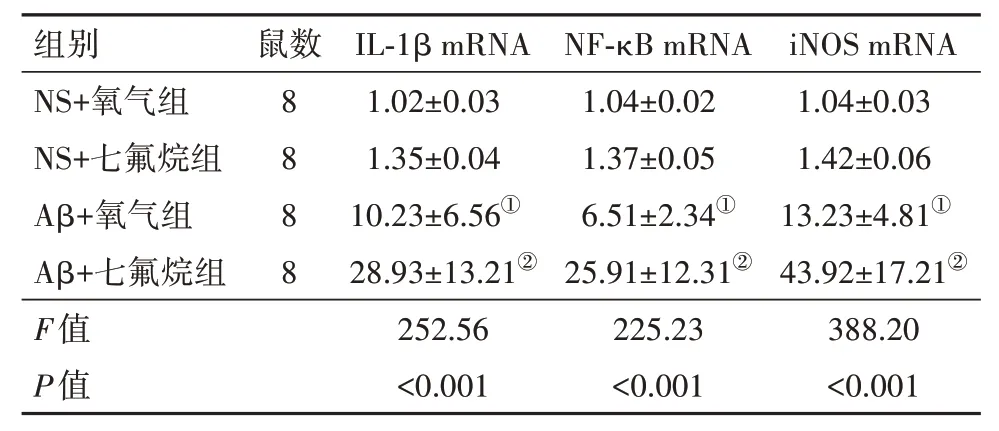
表5 各组大鼠海马区IL-1β、NF-κB和iNOS的mRNA相对表达量比较/
注:IL-1β 为白细胞介素-1β,NF-κB 为核因子-κB,iNOS 为诱导型一氧化氮合酶,NS为生理盐水,Aβ为β淀粉样蛋白。①与NS+氧气组相比,P<0.05。②与Aβ+氧气组相比,P<0.05。
?
3 讨论
传统观念将七氟烷引起的延迟性神经认知功能障碍归因于直接的神经毒性作用[6]。为了探讨对于术前患有AD 或具有AD 倾向的病人应用七氟烷是否会加重其认知功能障碍,本研究在大鼠双侧海马注射NS 或Aβ1-40后持续吸入30%氧气或2.5%七氟烷4 h。结果发现2.5%七氟烷仅对海马注射Aβ的大鼠产生神经毒性作用,对注射NS 的大鼠无损伤,这表明七氟烷对正常大鼠无影响。NS+七氟烷组或Aβ+七氟烷组大鼠的MAP、心率、pH、PaCO2,PaO2、HCO3-等生命体征无明显变化,表明在本研究中使用的七氟烷吸入时间和浓度是可行的。
与吸入氧气相比,Aβ组大鼠吸入七氟烷麻醉后逃逸潜伏期明显延长,提示七氟烷吸入可诱发大鼠神经认知功能障碍,这一结果与其他关于逃逸潜伏期的研究[7]一致。麻醉药物可能导致发育中大脑的广泛神经变性和持续学习障碍,但其行为异常的确切机制仍不清楚。多项研究表明,大鼠七氟烷暴露可显著增加多个脑区神经元凋亡[8]。Aβ 沉积是AD发病的重要神经病理学标志[9]。Du 等[10]的研究结果发现,与AD 相关的Aβ 肽沉积会诱发神经元凋亡。本研究数据显示,Aβ+七氟烷组大鼠吸入七氟烷后第7 天海马Aβ1-40水平明显增加。这些数据表明,七氟烷吸入导致AD 病人认知功能进一步损伤的部分原因是加剧细胞内Aβ1-40积累。尽管Aβ1-40和Aβ1-42肽在生物体液中普遍存在[11],但Aβ1-40被认为在AD病人中更具致病性[12]。
GFAP和IBA1常被用作星形胶质细胞和小胶质细胞激活的标志[13]。GFAP 是一种中间丝蛋白,其免疫染色主要用于星形胶质细胞与Aβ 斑块共定位[14]。IBA1作为一种钙结合蛋白,在显示小胶质细胞激活方面起重要作用,这种激活几乎与AD 老年斑中发现的Aβ 蛋白的致密沉积密切相关[15]。本研究结果显示,吸入七氟烷后第7 天,Aβ+sevo 组大鼠海马GFAP 和IBA1 表达明显增加,而吸入氧气后无明显变化,提示七氟烷主要作用于这些胶质细胞,加剧海马区神经胶质活化。
AD 的病理特征是错误折叠蛋白的积累和炎症变化,导致区域特定性突触丧失和神经元死亡[16]。目前认为,细胞凋亡的控制缺陷似乎在神经退行性疾病的发病机制中发挥核心作用[17]。Bcl-xL能够保护神经系统免受caspase-9 依赖性凋亡的影响,靶向破坏Bcl-xL 可导致未成熟神经元大量死亡,而抑制caspase-9 会导致神经元凋亡减少和神经发育异常。本研究结果显示,与Aβ+氧气组相比,Aβ+七氟烷组大鼠海马组织caspase-9 表达量明显增高,而Bcl-xL表达下降。这些发现提示,七氟烷暴露可能通过潜在地破坏凋亡细胞死亡调节中Bcl-xL 和caspase-9表达平衡而加剧认知功能障碍。RAGE 被认为是神经变性和神经炎症的潜在促发因素之一,在AD 影响的脑区表达增加[18]。BDNF 是一种神经营养因子,在调节突触传递、神经元存活、轴突导向以及记忆形成和认知方面发挥关键作用[19],可保护神经元免受Aβ 诱导的神经毒性损伤并促进Aβ 降解[20]。本研究结果发现,在Aβ 处理的海马中,七氟烷吸入增加了RAGE 的表达,并降低BDNF 水平,提示七氟烷吸入可能通过引发海马组织的神经毒性而导致认知能力下降。
已有研究证实NF-κB 信号通路对于调控炎症介质的表达有重要作用,可调控主要促炎因子IL-1β的转录,与细胞的增殖和凋亡等病理生理过程密切相关在AD 神经元损伤过程中发挥关键作用,并依赖于氧化应激的激活[21]。iNOS 具有显著的促炎作用,激活后可产生大量氧化因子ROS,增强机体氧化应激的程度,促进炎症因子表达[22]。qRT-PCR 结果显示,七氟烷吸入麻醉导致Aβ1-40诱导的AD 大鼠海马中Il-1β、NF-κB 和iNOS mRNA 表达增加,提示七氟烷吸入会驱动AD 病人强大的神经炎症变化,导致大脑神经元死亡。
综上所述,给予AD 模型大鼠七氟烷吸入麻醉可能会导致认知障碍和衰退,其基本机制是在Aβ注射的大鼠海马中形成神经毒性、神经炎症和神经元凋亡。

