机械应力下骨细胞行为变化的研究进展
詹红伟 王倩 移植 张蕾 张娟 李燕香 耿彬 吴萌 夏亚一* 姜金*
1.兰州大学第二医院,甘肃 兰州 730030
2.兰州大学第二临床医学院,甘肃 兰州 730030
骨细胞占骨组织细胞总量的90%以上,是骨骼中主要的机械应力感受细胞[1]。骨细胞具备多种生理功能,其中包括协调成骨细胞和破骨细胞的重塑、机械传导、矿物质稳态的调节、与除骨骼以外器官的相互作用等[2-3]。骨细胞还可直接重塑骨骼的细胞外基质骨,为骨骼结构和功能的维护和调控提供必要的支持[4]。骨细胞之间通过树突连接相互联系,并分布在充满液体的腔隙网络中,该网络遍布整个矿化的骨组织,机体在运动时,骨细胞的树突状结构能感受到周围液体所产生的流体剪切力(fluid shear stress,FSS)[5]。除了响应FSS外,骨细胞还能直接感知细胞外基质应变力的变化,这也是骨细胞感受机械刺激的另一个重要方式[6]。研究表明,生理上的机械应力刺激可以降低骨细胞的凋亡水平,并促进其分化[7-10]。此外,骨细胞在机械应力刺激下可以通过直接或间接的方式调节成骨细胞和破骨细胞的分化程度,从而参与骨重塑过程[11-16]。为了明确机械应力下骨细胞行为变化及其对其他类型细胞影响的具体作用机制,本文从骨细胞分化、凋亡及其与成骨细胞和破骨细胞的相互作用等方面对机械应力下骨细胞行为的研究进展进行综述,为今后骨质疏松基础研究提供理论参考。
1 机械应力对骨细胞分化的影响
1.1 骨细胞的分化过程
骨细胞是成骨细胞谱系中分化程度最高的细胞。成骨细胞来源于骨髓间充质干细胞,后者也可以分化成脂肪细胞和成软骨细胞。骨膜中的骨祖细胞分化为成骨细胞,有5%~20%的成骨细胞最终分化为骨细胞,而其余的成骨细胞会因细胞凋亡或逐渐扁平化成为骨衬细胞,分布在骨表面,如图1所示[17]。在骨细胞形成的过程中,成骨细胞的形态逐渐转变为以骨细胞为特征的树突状,这一过程还伴随着自噬介导的内质网面积和线粒体数量的减少,以及胞浆突起的形成[18]。这些长的细胞质突起穿过骨质中的小管道,使骨细胞之间可以相互作用,并分泌因子影响邻近的骨细胞和骨表面或骨髓中的其他细胞。与此同时,转录和翻译上的重大变化使骨细胞中调控骨平衡的分子得以表达[19]。研究已经证实不同基因负责细胞形态和骨小管网络的形成,例如,E11蛋白是骨细胞启动树突形成的关键分子[20];牙本质基质蛋白1表达则对牙齿的成熟至关重要[21]。

图1 机械应力调控骨细胞分化过程示意图Fig.1 Diagram depicting the regulation of osteocyte differentiation by mechanical stress
1.2 机械应力下影响分化的分子机制
Zhang等[10]利用3D生物打印技术制备了含有人骨髓间充质干细胞的石墨烯复合结构,并施加机械载荷,培养8周后形成了具有骨细胞特征的类器官。该研究发现,在机械刺激作用下,在第9~31 d,类器官内树突状细胞的比例和长度逐渐增加,并显著高于对照组。这表明长期机械载荷能够促进骨髓间充质干细胞向骨细胞分化。前列腺素E2(prostaglandin E2,PGE2)是机械载荷影响骨重建和吸收过程中的关键因子,它可以介导成骨细胞的矿化和破骨细胞分化[22](图1)。Wilmoth等[23]开发了一种新型3D水凝胶双层复合材料来模拟骨细胞生态位中的生理应力水平,并在其上培养IDG-SW3前体骨细胞。并发现,在PGE2干预下,骨细胞成熟标志物的骨硬化蛋白(sclerostin,Sost)表达显著增高,进展为更成熟的表型。这说明PGE2可以通过自分泌或旁分泌方式调节骨细胞在机械应力下的分化水平[9]。另一项研究发现,与去雌激素组相比,雌激素处理组骨细胞在流体剪切力作用下分泌的NO和PGE2水平升高,并且Sost和骨钙素表达也增加,这些结果提示雌激素参与调节骨细胞对机械应力刺激的敏感性[24]。骨细胞在受到机械应力刺激后,通过分泌PGE2和NO等信号分子来促进前体骨细胞的分化成熟,如图1所示。然而,有关其细胞内下游分子和信号通路的调控机制尚未得到充分报道,这为进一步研究提供了新的研究方向。
2 机械应力对骨细胞凋亡的影响
骨细胞凋亡是骨重塑过程中的一种生理现象,有利于去除死骨组织,实现骨细胞自我更新和维持骨质量[25]。然而,多种病理状态的发生和发展,可能会导致骨细胞凋亡失衡,如衰老、废用、糖皮质激素过量以及性腺激素缺乏等[26-28]。
骨细胞凋亡和机械刺激之间存在着“U”型关系[7]。机械刺激过弱或过强都会引起更多的骨细胞凋亡,而适度的机械应力刺激则可以降低骨细胞凋亡水平。有实验显示,在应力达到3 000~4 000微应变的峰值时,使用短时间应力刺激的骨细胞凋亡比率比无应力组减少了40%[8]。此外,在啮齿动物太空飞行模型中,机械卸载会促进骨细胞衰老和凋亡,这可能是导致机械卸载引起的骨代谢失衡的主要原因[29]。在机械卸载模型中,小鼠骨小梁和骨皮质的骨细胞凋亡及其导致的骨量流失均显著增加,这提示骨细胞凋亡在调节骨架对机械负荷变化适应性过程中发挥重要作用[30]。值得注意的是,骨细胞凋亡主要发生在骨皮质内表面附近,而靠近骨膜表面的骨细胞凋亡水平变化并不显著,这可能与皮质内表面附近的骨细胞对维持细胞活性所需生长因子的需求量更大有关[31]。
Tan等[32]将FSS作用于骨细胞,发现骨细胞内NO生成增加,并抑制了骨细胞凋亡,提示NO是FSS抑制骨细胞凋亡的重要介质。此外,整合素、Src激酶和ERK也是FSS下维持骨细胞活性的重要信号分子[33]。Kitase等[34]发现机械应力下骨细胞产生的PGE2也能保护其本身的活性,进一步证实PGE2通过EP2受体和EP4受体激活cAMP/PKA和PI3K/AKT信号通路,抑制GSK-3活性,促进β-catenin核转位和表达,从而对骨细胞起到保护作用。还有学者认为镶嵌在骨细胞上的整合素能感应生态位的FSS,并将机械信号传导至细胞质以防止细胞凋亡[30]。
细胞间隙连接蛋白43(connexin 43,Cx43)是骨细胞机械信号传导中的“质量检查点”,对维持其机械敏感性至关重要。FGF7可上调Cx43的表达,并促进β-catenin在胞质内聚集和部分核转位,从而维持骨细胞活性[35]。为保证骨细胞获得充足营养和氧气交换,其需要完整的腔隙-小管网络。然而,在机械卸载期间,腔隙-小管网络可能遭到破坏,导致骨细胞缺氧[36]。因此,有学者认为缺氧是机械卸载下骨细胞凋亡的另一个重要原因。缺氧会引起线粒体ATP减少、ROS增加和胞内pH降低等一系列变化,从而对细胞造成损伤并引发细胞凋亡[37]。生理状态下FSS在骨细胞周围产生流动,促进氧气扩散,从而抑制缺氧引起的细胞凋亡。Montesi等[38]发现在低氧条件下,骨细胞内氧调节蛋白150(ORP150)表达水平显著升高,并推测ORP150可能对低氧条件下的骨细胞具有保护作用。另有研究显示,在缺氧期间,腺病毒E1B19 kDa互作蛋白也呈现高表达状态,但其在骨细胞凋亡中的具体作用有待进一步研究[39]。
研究表明鸢尾素和骨形态发生蛋白-7(bone morphogenetic protein-7,BMP-7)也参与了机械应力下骨细胞凋亡的调控。Storlino等[30]发现,在老龄和失重小鼠模型中,鸢尾素能够通过抑制氧化应激和糖皮质激素的诱导来降低骨细胞凋亡,并增加皮质骨中存活骨细胞的数量。Wang等[40]发现,在地塞米松诱导的骨细胞凋亡模型中,机械刺激能够上调骨细胞内BMP-7表达来降低凋亡水平,并证实BMP-7抗凋亡作用主要通过其受体BMPR2介导,可能与PI3K/AKT/GSK3b信号通路的激活有关。骨细胞凋亡在骨代谢中扮演着重要的角色。机械刺激通过作用于骨细胞膜表面的整合素和Cx43,以及促进骨细胞分泌PGE2和BMP-7的方式,将机械信号转化为生物信号。随后,这些信号通过细胞内的ERK、cAMP/PKA和PI3K/AKT等信号通路介导,发挥对细胞凋亡的抑制作用,进而维持骨代谢平衡,见图2。

图2 机械应力调控骨细胞凋亡示意图Fig.2 Diagram depicting the regulation of osteocyte apoptosis by mechanical stress
3 机械应力下骨细胞与其他类型细胞的相互作用
骨细胞通过多种细胞传感器,包括初级纤毛、整合素、离子通道和缝隙连接等,感受机械刺激,被激活后释放生物信号,从而调控效应细胞的生物学行为。在机械应力下,骨细胞能够直接或间接地促进成骨细胞的分化,并抑制破骨细胞的分化。另外,骨细胞也能通过分泌细胞外囊泡的方式,有效地招募骨髓间充质干细胞并促进其成骨分化[41]。总之,骨细胞在机械应力下与成骨细胞和破骨细胞等相互作用中发挥着重要的生物学作用。
3.1 骨细胞与成骨细胞的偶联机制
成骨细胞的生长和定向分化受到多步骤的分子通路控制,其中不同的转录因子和信号蛋白对其分化起到重要的调控作用[42]。在机械应力下,骨细胞感应机械刺激并向成骨细胞发出信号,调节其分化程度。Cx43介导的缝隙连接是骨细胞直接调控成骨细胞的重要机制,通过缝隙连接骨细胞向成骨细胞发出信号,提高其碱性磷酸酶(alkaline phosphatase,ALP)的活性从而促进其分化。除此之外,骨细胞通过调控IL-6[12]、IL-11[11]、整合素α5[43]和PGE2[43]等的分泌来间接调控成骨细胞分化水平,见图3。

图3 机械应力介导骨细胞调控成骨细胞分化示意图Fig.3 Diagram depicting the regulation of osteoblast differentiation in osteocyte mediated by mechanical stress
Cx43已被证明在骨形成和动态平衡中扮演许多重要的角色,包括调节成骨细胞的增殖、分化和凋亡[44]。ALP是成骨细胞分化时分泌的一种糖蛋白酶,因此是成骨细胞分化的重要标志物。Taylor等[45]通过建立一种体外三维共培养系统(骨细胞-成骨细胞),证明了机械应力下骨细胞通过缝隙连接将生物信号传递给成骨细胞的能力。他们发现,在暴露于FSS下的骨细胞中,缝隙连接在骨细胞和成骨细胞之间形成,且成骨细胞的ALP活性显著增加,从而促进了成骨细胞的分化。Yvanoff等[46]开发了一种基于活细胞的微流控平台,研究了骨细胞和成骨细胞之间通过Cx43介导的缝隙连接的细胞间通讯。他们发现高分辨率荧光显微镜显示在成骨细胞和骨细胞之间接触处存在Cx43蛋白。暴露在微流体通道中的FSS会导致钙波响应从骨细胞传播到邻近的成骨细胞,从而促进了成骨细胞的分化。此外,他们还发现加入缝隙连接抑制剂(18β-甘草次酸)可以消除钙波从骨细胞向周围成骨细胞的传播[46]。Loiselle等[47]的研究结果同样表明,Cx43在骨细胞和成骨细胞之间的形成,并介导机械应力下骨细胞对成骨细胞分化的促进作用。
机械负荷会刺激骨细胞释放多种合成代谢信号,包括细胞因子、PGE2和整合素等,以诱导成骨细胞的分化。Hao等[12]发现,压缩循环力下MLO-Y4骨细胞可以产生IL-6,通过STAT3和ERK信号通路来调节小鼠颅骨成骨细胞的ALP活性,进而影响成骨细胞的分化。Dong等[11]研究发现,在机械应力下,IL-11可通过激活IL-11Rα-STAT1/3来增强Wnt信号的级联作用,从而促进成骨细胞的分化,有利于骨形成。此外,Zhao等[43]观察到,在机械应力下整合素α5是胫骨成骨反应的必需因素,其中机制可能是骨细胞细胞膜上的整合素α5通过Cx-43半通道释放PGE2,进而减少Sost蛋白,且增加β-catenin在成骨细胞中的表达,从而参与机械负荷下的成骨反应。Matsuzaka等[48]使用一种新型可控FSS刺激成骨细胞-骨细胞共培养装置,发现在不同水平FSS下,骨细胞可以通过增加PGE2的分泌来调节成骨细胞的排列,并通过高度排列的骨基质结构来实现骨组织的功能化。同时,Matsuzaka等[48]也发现,拮抗成骨细胞上PGE2的EP2和EP4受体可导致定向胶原基质上成骨细胞排列的丧失。
3.2 骨细胞与破骨细胞的偶联机制
破骨细胞是起源于单核巨噬细胞系的多核细胞,它是人体唯一能够明确降解骨的细胞,负责在旧骨区域分泌酸性物质、溶解骨中的矿物质,并分泌蛋白酶来消化骨基质。在机械应力下,破骨细胞的活动主要受到骨细胞的调控。其中,核因子κB受体活化因子配体(receptor activator of nuclear factor-kappa B ligand,RANKL)和骨保护素(osteoprotegerin,OPG)是调控破骨细胞分化的重要分子[49]。当骨细胞受到机械应力刺激后,通过降低RANKL/OPG比率来抑制破骨细胞的分化。此外,骨细胞还能通过调节细胞因子及信号分子的分泌来调控破骨细胞的分化,例如CXCL5[15]、IL-6[15]、NO[16]、MEPE[14]等,见图4。
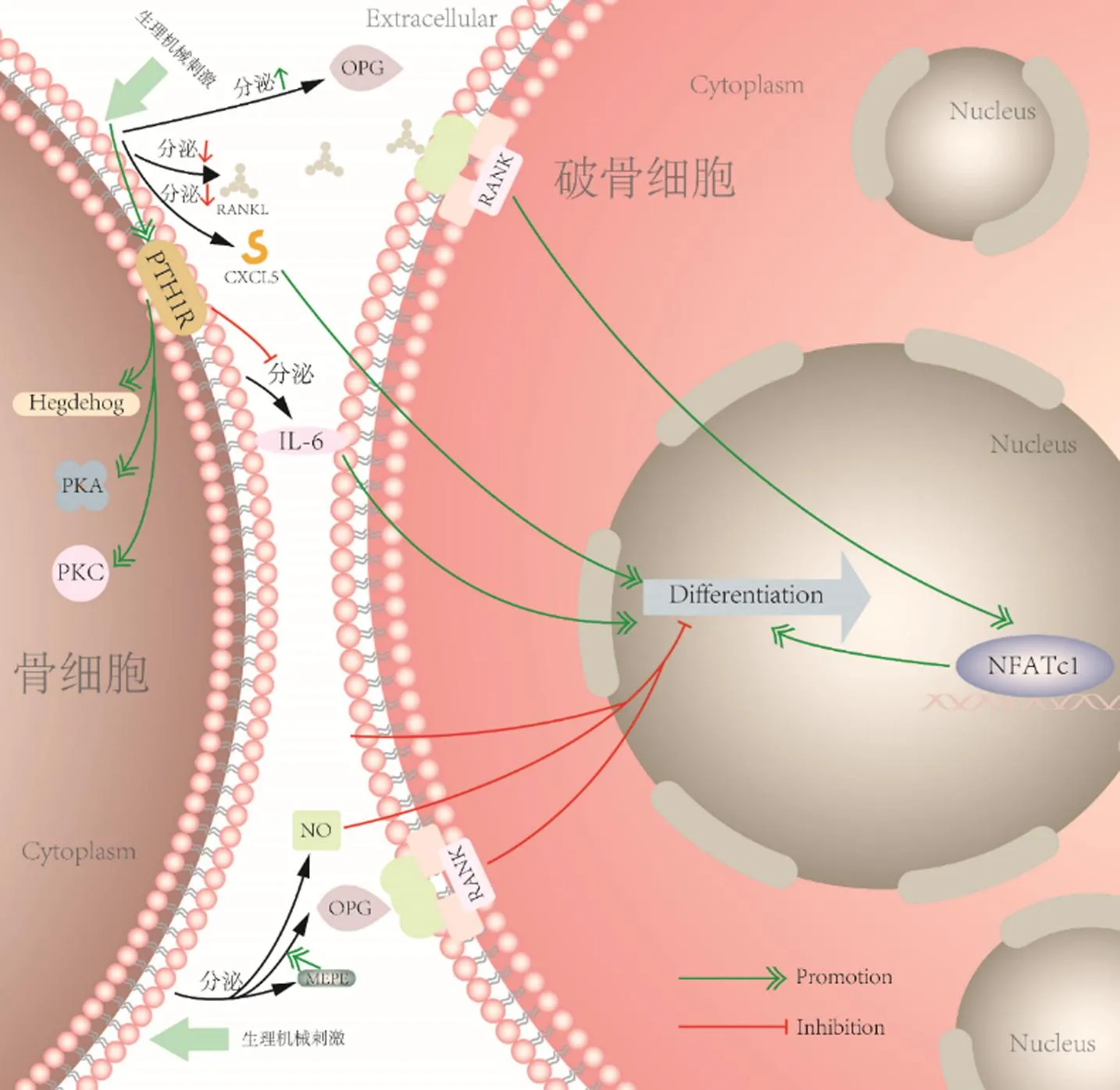
图4 机械应力介导骨细胞调控破骨细胞分化示意图Fig.4 Diagram depicting the regulation of osteoclast differentiation in osteocyte mediated by mechanical stress
骨细胞产生的RANKL在破骨细胞的分化过程中起主要调节作用。RANKL以膜结合的形式通过骨细胞树突状突起延伸到骨表面并进入骨髓和骨膜间,从而提供给破骨细胞前体细胞。进一步结合到破骨细胞前体表面的RANK上,刺激破骨细胞前体向破骨细胞表型转化,使破骨细胞成熟[50]。研究发现,在骨重建过程中,未受机械刺激的骨细胞为破骨细胞和破骨细胞前体细胞提供了一个有利于其增殖分化的环境,从而引导骨吸收沿着骨的负荷轴方向进行,而受到机械应力刺激的骨细胞则会减少RANKL的表达,从而抑制破骨细胞的分化[49]。Xu等[51]使用自主研发的微流控共培养平台研究骨细胞在不同水平FSS对破骨细胞分化的影响,发现与低水平FSS(0.5 Pa和1 Pa)刺激相比,在骨细胞受到2 Pa FSS刺激的小室中,分化的破骨细胞数量显著减少。骨细胞来源的OPG对于RANKL在骨细胞中的运输和随后的调节破骨细胞的功能是必需的。研究表明,在机械负荷下,MLO-Y4骨细胞的OPG蛋白的表达也发生了变化。Kulkarni等[14]使用脉冲流体力学加载骨细胞1 h后,对RANKL/OPG比值的变化进行了评估。他们发现在机械应力下,骨细胞可以通过分泌可溶性因子MEPE来促进自身OPG的分泌,从而抑制破骨细胞分化。Takayanagi等[52]进一步研究得出RANKL通过转录因子NFATc1 来调控破骨细胞的最终分化。
在机械应力下的骨细胞也能分泌细胞因子及信号分子来调控破骨细胞的分化。Pathak等[53]对人原代骨细胞用10%的类风湿性关节炎(rheumatoid arthritis,RA)血清或健康对照血清处理7 d,之后对其用脉冲流体力学施加1 h,发现RA血清可使RANKL/OPG表达比例增加3.4倍,显著促进了破骨细胞的分化,而机械负荷可以抵消这一作用。这表明机械应力可能阻止炎症驱动的骨细胞介导的RA内破骨细胞形成。他们还观察到,在机械应力下,正常血清处理的骨细胞在60 min内NO产生的总量增加了3.5倍。这一现象表明,骨细胞在受到机械应力刺激后,可能通过分泌大量的NO来抑制破骨细胞的分化。Tan等[16]同样发现,通过机械应力作用的骨细胞释放可溶性因子可调节破骨细胞的生成,且此作用至少部分依赖于机械应力对骨细胞内NO释放通路的激活。Lau等[54]发现在低强度高频振动下,骨细胞通过分泌可溶性因子抑制破骨细胞的数量和大小。同时,振动的骨细胞分泌的RANKL显著减少,这提示RANKL可能参与了低强度高频振动对破骨细胞分化的抑制作用。此外,Tirado-Cabrera等[15]通过蛋白质组学分析和中和实验表明,机械应力刺激的骨细胞通过减少CXCL5的分泌来抑制破骨细胞的募集和分化。另外,他们还发现,在机械应力下,骨细胞可以通过激活PTH1R来降低IL-6的分泌,从而抑制破骨细胞的分化。然而,另有学者发现压缩循环力下骨细胞通过增加IL-6的分泌来抑制破骨细胞分化[12]。
4 总结与展望
机械应力通过促进骨细胞分化和抑制凋亡的方式参与骨重塑过程。此外,受机械应力刺激的骨细胞通过直接或间接的方式促进成骨细胞分化,同时抑制破骨细胞分化,从而在骨代谢的生理或病理过程中发挥重要作用。尽管在体外研究中已经得到了大量关于机械应力下骨细胞生物学行为变化的证据,但为了进一步阐明这些变化在机械应力下的骨稳态中的作用,还需要开展更多以动物模型为基础的体内研究。此外,机械应力的刺激方式有多种形式,例如FSS、持续静压力、牵张力、微重力等。目前的研究主要集中在FSS上,未来的研究应该扩展到其他机械应力刺激方式,以更全面地了解机械应力对骨细胞生物学行为变化的机制,这将为预防和治疗骨质疏松提供坚实的理论基础。

