血脂康干预肥胖高血压合并代谢相关性脂肪肝的作用机制
龚智君 江宇宁 张淑洁 王修明 朱尧 蒋卫民


摘要 目的:通过评价高脂喂养诱导的肥胖高血压大鼠合并代谢相关性脂肪肝的病变程度,初步探索血脂康改善肥胖自发性高血压大鼠(SHR)合并代谢相关性脂肪肝的作用机制。方法:将24只6周龄的雄性SHR随机分为普通饮食组(STD组)、高脂饮食组(HFD组)、普通饮食血脂康治疗组(STD-X组)、高脂饮食血脂康治疗组(HFD-X组),每组6只。STD-X组、HFD-X组予以血脂康灌胃,STD组、HFD组予以生理盐水灌胃。实时监测大鼠体质量、血压变化;酶联免疫吸附法(ELISA)检测各组SHR肝脏游离脂肪酸(FFA)和三酰甘油(TG)水平;苏木精-伊红(HE)及油红O染色观察各组大鼠肝脏病理学形态变化;蛋白免疫印迹法检测各组SHR肝脏组织中过氧化物酶体增殖物激活受体α(PPARα)、过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)、肉毒碱棕榈酰基转移酶1-a(CPT1-a)的蛋白表达。结果:与HFD组比较,HFD-X组大鼠血压、体质量均有降低趋势,其中舒张压降低明显(P<0.05)。与HFD组比较,HFD-X组肝脏TG及FFA水平均明显降低(P<0.05),肝脏脂肪变性程度明显减轻。与STD组相比,HFD组PPARα、PGC-1α、CPT1-a蛋白表达量明显降低(P<0.05);STD-X组PPARα、PGC-1α、CPT1-a蛋白表达量均升高(P<0.05);与HFD组相比,HFD-X组PPARα、PGC-1α、CPT1-a蛋白表达量明显升高(P<0.05)。结论:血脂康通过上调PPARα/PGC-1α信号通路多个蛋白的表达,降低高脂喂养的SHR大鼠的血压,减轻其体质量,改善其合并代谢相关性脂肪肝导致的肝内脂肪堆积与肝细胞脂肪变性等。
关键词 自发性高血压;代谢相关性脂肪肝;肥胖;血脂康;实验研究
doi:10.12102/j.issn.1672-1349.2024.01.008
近年来,我国高血压及其并发症的患病率逐渐升高[1],其中,肥胖合并高血压的发病率明显增加[1]。肥胖是一种慢性代谢疾病,代谢相关性脂肪肝(metabolic associated fatty liver disease,MAFLD)是其最常见的并发症之一。2021年5月中国肝病学会发布的一项共识指出:支持将非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)重新定义为MAFLD,并将诊断标准定义为:肝活检组织学或影像学或血液生物标志物检查提示脂肪肝;同时合并超重/肥胖或2型糖尿病,或存在代谢功能障碍[2]。据统计,目前MAFLD的全球患病率约为25%[3]。研究表明,代谢紊乱与心血管不良事件(如脑卒中、心肌梗死、心力衰竭)相关且增加心血管疾病的死亡风险[4-5]。高血压是最常见的心血管危险因素,在合并肥胖及代谢紊乱的人群中尤为突出。但传统意义上的非酒精性脂肪肝与许多其他代谢疾病无关[6]。因此,MAFLD可能是代谢综合征的肝脏表现[7]。肥胖高血压和MAFLD常常同时出现,是一种综合性的代谢紊乱疾病。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)在人体内多个组織中都有表达,发挥促进脂肪酸(fatty acids,FA)的摄取、转运和氧化,参与能量代谢平衡的功能。脂质代谢中间产物游离脂肪酸(free fatty acid,FFA)可以激活过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα),并诱导PPARα调控的下游基因表达,降解上述中间产物,降低三酰甘油(triglyceride,TG)和FFA水平,可以减少肌肉中脂肪的含量,调节脂联素从而增高胰岛素敏感性,这些对肝脏的健康都至关重要[8]。过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)是过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的转录共激活因子,目前被认为是参与线粒体能量代谢的主要调节因子。PGC-1α调节中枢代谢功能,包括线粒体代谢、细胞分化、血管生成和炎症[9]。肝脏是协调人体新陈代谢的重要器官,其代谢机制复杂且与多种分子的交互相关,而越来越多的研究证明,PPARα/PGC-1α信号通路在肝脏的动态平衡中起着关键作用。PPARα及其辅助激活物PGC-1α均可在一定程度上影响肥胖高血压合并MAFLD带来的一系列代谢紊乱问题,两者共同上调肉毒碱棕榈酰基转移酶1-a(carnitine palmitoyl transferase 1-a,CPT1-a)的表达,提高机体脂肪酸氧化水平,从而改善肥胖高血压合并MAFLD病人的炎症反应和脂肪堆积,降低心血管事件的风险。既往研究发现,血脂康也是一种PPARα激动剂,能够参与调控PPARα相关的生物途径。中国冠心病二级预防研究[10]为血脂康的应用提供了充分的循证医学证据。本实验旨在探讨血脂康是否可以通过PPARα/PGC-1α信号通路干预肥胖高血压合并MAFLD。
1 材料与方法
1.1 实验动物
24只无特定病原体(SPF)级雄性6周龄左右自发性高血压大鼠(spontaneously hypertensive rats,SHR),初始体质量100~120 g,由北京维通利华实验动物技术有限公司提供[生产许可证号:SCXK(京)2012-0001],饲养于南京中医药大学SPF级动物实验中心,动物房的温度维持在(23±1)℃,湿度保持在(55±10)%,并且维持12 h光/暗循环;动物房通风良好,实验动物可在笼内自由活动,每周更换垫料2次,大鼠可以自由获得食物和水。实验开始前给予实验动物2周适应动物房环境的饲养时间,之后将24只SHR随机分为普通饮食组(STD组)、高脂饮食组(HFD组)、普通饮食血脂康治疗组(STD-X组)、高脂饮食血脂康治疗组(HFD-X组),每组6只。STD组、STD-X组大鼠连续16周给予普通饲料(由南京中医药大学动物实验中心提供);HFD组、HFD-X组大鼠连续16周给予高脂饲料(D12492,Research Diets,USA)。
1.2 实验药物
血脂康胶囊,国药准字Z10950029,北京北大维信生物科技有限公司生产。
1.3 主要试剂和仪器
TG试剂盒(南京建成生物研究工程所,货号:A110-1-1);Free Fatty Acid Assay(Abcam,货号:Ab6534);油红O染液(武汉谷歌生物科技有限公司,货号:G1016);苏木精-伊红(HE)染液(武汉谷歌生物,货号:G1005);二喹啉甲酸(BCA)蛋白定量检测试剂盒(Servicebio,货号:G2026);β-actin(Servicebio,货号:GB12001);辣根过氧化物酶(HRP)标记山羊抗兔(Servicebio,货号GB23303);HRP标记山羊抗大鼠(Servicebio,货号:GB23302)。台式高速冷冻离心机(大龙,型号:D3024R);酶标检测仪(BioTeK,型号:Epoch);全自动生化分析仪(深圳雷杜生命科学股份有限公司,型号:Chemray 800);电泳仪(Servicebio,型号:BV-2&BT-2)。
1.4 实验方法
1.4.1 干预方法
在实验开始的第1周, STD-X组、HFD-X组大鼠均予以血脂康(溶解于生理盐水中)300 mg/(kg·d)灌胃,STD组及HFD组大鼠采用等剂量生理盐水灌胃,均连续灌胃16周。在实验期结束时(即第16周),腹腔注射过量的戊巴比妥钠(250 mg/kg)处死大鼠。采血后,取出肝脏组织,称重,记录肝脏质量并储存于-80 ℃冰箱中待检。
1.4.2 一般指标检测
各组大鼠每周称重1次,每只大鼠连续测量3次体质量,取其平均值。在第12周,采用尾套法无创测量各组收缩压(SBP)、舒张压(DBP)和平均动脉压(mean arterial pressure,MAP)[11]。
1.4.3 酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)检测FFA和TG水平
ELISA检测各组肝脏FFA和TG水平,按照试剂盒说明书操作,之后于酶标仪上在不同波长下测各孔OD值,根据OD值计算出实际浓度。
1.4.4 HE染色及油红O染色观察肝脏病理学变化
通过HE染色、油红O染色观察各组大鼠肝脏病理学形态变化,按照常规取材、脱水、包埋、切片、染色、观察等途径进行操作,评价血脂康干预后SHR肝脏形态和变性程度,取材部位均为大鼠肝脏最大叶。
1.4.5 免疫蛋白印迹法(Western Blot)检测肝脏组织中PPARα、PGC-1α、CPT1-a的蛋白表达水平
采用Western Blot检测各组肝脏组织中PPARα、PGC-1α、CPT1-a的蛋白表达水平。将大鼠肝脏组织蛋白提取后用试剂盒测定蛋白浓度并于100 ℃下煮15 min进行蛋白变性,之后进行蛋白电泳、转膜及封闭。按照抗体说明书,配制一抗溶液,4 ℃冰箱摇床过夜。次日洗脱后再将二抗按比例稀释后,然后加入孵育槽中,放置摇床上慢摇,室温下孵育30 min;最后将聚偏二氟乙烯膜与混合好的化学发光试剂充分反应,用显影、定影试剂进行显影和定影,并用Image-J软件对条带进行灰度分析。
1.5 统计学处理
采用SPSS 25.0软件进行统计学分析。符合正态分布的定量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用最小显著差异法(LSD)检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 血脂康对大鼠体质量及血压的影响
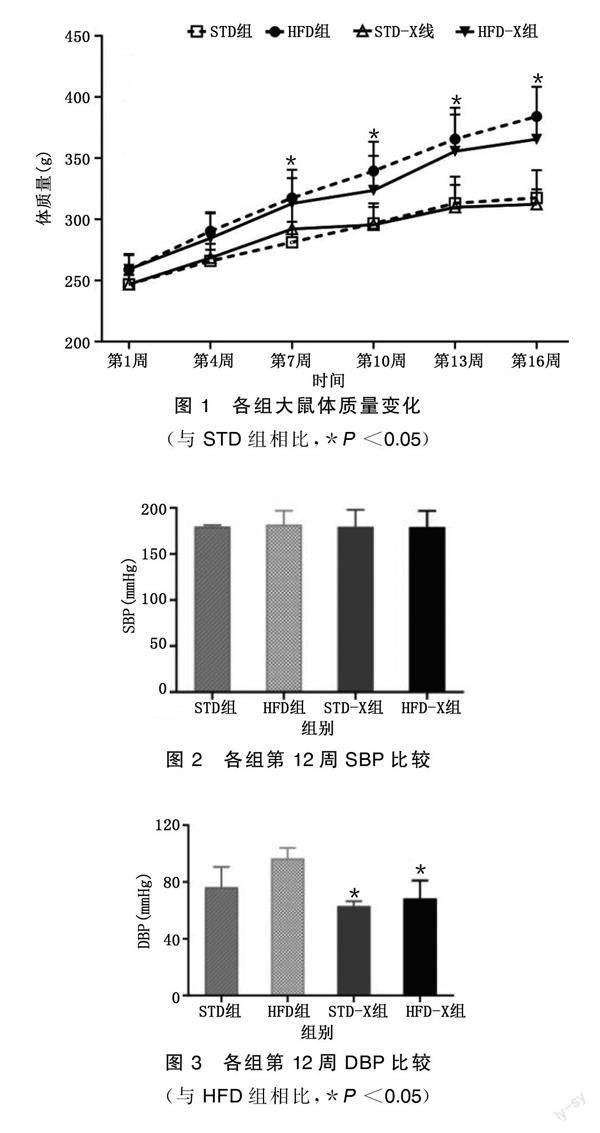
从第7周开始,HFD组大鼠的体质量开始明显高于STD组(P<0.05),随着高脂喂养时间的推进,这种差距逐渐明显,并且HFD组大鼠的体质量开始超过STD组的20%,证明肥胖高血压模型造模成功。在第16周,与HFD组相比,HFD-X组大鼠的体质量明显下降,但差异无统计学意义。第12周,与HFD组相比,HFD-X组DBP明显降低(P<0.05),且MAP也有所降低。详见图1~图4。
2.2 血脂康对大鼠肝脏TG和FFA的影响
与STD组比较,HFD组大鼠肝脏FFA、TG水平明显上升(P<0.05);与HFD组比较,HFD-X组大鼠肝脏FFA、TG水平明显下降明显(P<0.05)。详见图5。
2.3 血脂康对大鼠肝脏形态及变性程度的影响
HE染色结果显示,STD组大鼠肝细胞形态规则,未见明显的肝细胞坏死,也未见明显的肝细胞脂肪变性,肝小叶结构清晰完整,肝细胞排列较为整齐,未见较大的脂肪空泡及明显的炎性细胞浸润。HFD组大鼠肝细胞脂肪变性非常明显,且肝细胞排列紊乱,可见明显的大小不等、数量不同的脂肪空泡,肝细胞排列混乱,较多肝细胞肿胀变性,胞质疏松,染色偏淡。而经过血脂康治疗的HFD-X组大鼠肝小叶结构较为完整,肝细胞排列相对整齐,脂肪变性明显减轻,脂肪空泡体积缩小及数量明显减少。详见图6。
油红O染色结果顯示,与STD组相比,HFD组大鼠肝细胞内出现大量红色脂滴,油红O染色面积明显增大,细胞内脂质含量明显高于STD组。与HFD组比较,HFD-X组大鼠油红O染色面积明显缩小,细胞内红色脂滴数量明显减少,脂质含量明显降低。详见图7。
2.4 血脂康对大鼠肝脏组织中PPARα、PGC-1α、CPT1-a蛋白表达水平的影响
与STD组相比,HFD组PPARα、PGC-1α、CPT1-a的蛋白表达量明显降低(P<0.05),STD-X组PPARα、CPT1-a、PGC-1α蛋白表达量均增高(P<0.05);与HFD组相比,HFD-X组PPARα、PGC-1α、CPT1-a的蛋白表达量明显升高(P<0.05)。详见图8~图10。
3 討 论
随着世界肥胖发生率的不断增加,肥胖高血压合并各类代谢疾病的风险也与日俱增,当前的流行病学也已经明确将肥胖和高血压的风险联系起来[12]。在药物治疗方面,现有的西药不能完全满足肥胖高血压合并MAFLD病人的需求,而中药具有多层次、多成分、综合调控的特点,且临床应用历史悠久,有望成为新药开发的最有效来源之一。血脂康是由红曲发酵生产的,在我国被归类为处方药而不是膳食补充剂,既往的大量临床研究证实血脂康有确切的降脂疗效[13]。前期的实验研究表明,血脂康可以改善内脏组织的脂肪堆积,从而一定程度上改善肥胖导致的一系列代谢紊乱[14]。
PPARα可以有效改善MAFLD病人的糖脂代谢,减轻炎症反应,因此,PPARα激动剂有望成为治疗本病的新型药物[15]。PGC-1α是PPARα的辅助激活物,与PPARα结合后能够共同上调相关β氧化酶(如CPT1-a)的表达量,提高肝脏、β氧化水平,进而改善肝脏内脂肪堆积的现象。
SHR是理想的类似于人类原发高血压的动物模型,尤其是雄性SHR,其伴随的心血管疾病发病率高,是建立肥胖高血压大鼠动物模型的理想造模对象。通过高脂喂养,SHR可以呈现明显的肥胖体征,其内脏脂肪的蓄积及代谢紊乱的表现较为明显。本研究通过高脂喂养SHR获得肥胖高血压大鼠模型,因为采用高脂喂养,SHR的TG在肝脏中过多蓄积,造成了MAFLD的发生。采用血脂康干预后,HFD-X组SHR的DBP较HFD组明显下降,且DBP、MAP值均低于HFD组。在第16周,HFD-X组大鼠体质量较HFD组明显下降,说明血脂康有一定的减重作用。HFD-X组大鼠肝脏FFA、TG水平明显低于HFD组(P<0.05),提示血脂康一定程度上可以减轻肥胖SHR肝脏中TG和FFA的堆积,降低肝脏内的脂肪堆积程度。在肝脏中,通过病理切片的观察发现,HFD-X组大鼠无论在肝脏细胞形态、结构、排列,还是在脂滴数量及脂肪变性程度方面均明显优于HFD组。与HFD组相比,HFD-X组PPARα、PGC-1α、CPT1-a的蛋白表达量明显升高,表明血脂康通过PPARα/PGC-1α信号通路减轻高脂喂养的SHR的血压、体质量,改善其合并MAFLD导致的肝细胞脂肪变性等,从而改善肥胖高血压合并MAFLD导致的综合代谢紊乱。但血脂康改善肥胖高血压合并MAFLD的机制还有待进一步研究。
综上所述,高脂喂养的SHR兼顾了肥胖、高血压、MAFLD、代谢紊乱等多个体征,血脂康通过上调PPARα/PGC-1α信号通路相关蛋白的表达,在减轻肥胖高血压大鼠体质量、降低其血压的基础上,同时改善大鼠肝脏内FFA、TG堆积,减轻肝细胞脂肪变性,从而有效干预肥胖高血压合并MAFLD。
参考文献:
[1]陈伟伟,高润霖,刘力生,等.《中国心血管病报告2016》概要[J].中国循环杂志,2017,32(6):521-530.
[2]NAN Y M,AN J H,BAO J F,et al.The Chinese society of Hepatology position statement on the redefinition of fatty liver disease[J].Journal of Hepatology,2021,75(2):454-461.
[3]LONARDO A,BYRNE C D,CALDWELL S H,et al.Global epidemiology of nonalcoholic fatty liver disease:Meta-analytic assessment of prevalence,incidence,and outcomes[J].Hepatology,2016,64(4):1388-1389.
[4]LIU X Y,SUN N L,YU T,et al.The independent and joint association of blood pressure,serum total homocysteine,and fasting serum glucose levels with brachial-ankle pulse wave velocity in Chinese hypertensive adults[J].International Heart Journal,2016,57(5):627-633.
[5]ZANCHETTI A.Cardiovascular consequences of hypertension:therapeutic effects on organ damage and on cardiovascular events[J].Blood Press Suppl,1994,1:1-4.
[6]MELLINGER J L,PENCINA K M,MASSARO J M,et al.Hepatic steatosis and cardiovascular disease outcomes:an analysis of the Framingham Heart Study[J].Journal of Hepatology,2015,63(2):470-476.
[7]KIM C H,YOUNOSSI Z M.Nonalcoholic fatty liver disease:a manifestation of the metabolic syndrome[J].Cleveland Clinic Journal of Medicine,2008,75(10):721-728.
[8]ESCHER P,BRAISSANT O,BASU-MODAK S,et al.Rat PPARs:quantitative analysis in adult rat tissues and regulation in fasting and refeeding[J].Endocrinology,2001,142(10):4195-4202.
[9]CHENG C F,KU H C,LIN H.PGC-1α as a pivotal factor in lipid and metabolic regulation[J].International Journal of Molecular Sciences,2018,19(11):3447.
[10]LI J J,LU Z L,KOU W R,et al.Beneficial impact of Xuezhikang on cardiovascular events and mortality in elderly hypertensive patients with previous myocardial infarction from the China Coronary Secondary Prevention Study (CCSPS)[J].Journal of Clinical Pharmacology,2009,49(8):947-956.
[11]KUBOTA Y,UMEGAKI K,KAGOTA S,et al.Evaluation of blood pressure measured by tail-cuff methods (without heating) in spontaneously hypertensive rats[J].Biological & Pharmaceutical Bulletin,2006,29(8):1756-1758.
[12]MOLENAAR E A,HWANG S J,VASAN R S,et al.Burden and rates of treatment and control of cardiovascular disease risk factors in obesity:the Framingham Heart Study[J].Diabetes Care,2008,31(7):1367-1372.
[13]BANACH M,BRUCKERT E,DESCAMPS O S,et al.The role of red yeast rice (RYR) supplementation in plasma cholesterol control:a review and expert opinion[J].Atherosclerosis Supplements,2019,39:e1-e8.
[14]任炜炜,严羽,殷晓威,等.血脂康胶囊对高脂喂养大鼠内脏脂肪及代谢指标的影响[J].中西医结合心脑血管病杂志,2016,14(11):1218-1221.
[15]FOUGERAT A,MONTAGNER A,LOISEAU N,et al.Peroxisome proliferator-activated receptors and their novel ligands as candidates for the treatment of non-alcoholic fatty liver disease[J].Cells,2020,9(7):1638.
(收稿日期:2022-08-09)
(本文編辑郭怀印)
基金项目 江苏省自然科学基金项目(No.BK20181503);江苏省科技重点研发项目(No.BE2017775)
通讯作者 蒋卫民,E-mail:jwm0410@njucm.edu.cn
引用信息 龚智君,江宇宁,张淑洁,等.血脂康干预肥胖高血压合并代谢相关性脂肪肝的作用机制[J].中西医结合心脑血管病杂志,2024,22(1):46-51.

