丙泊酚靶向调节MAPK/ERK信号通路干预心肌缺血再灌注损伤的实验研究
王晓英 刘盼 韩丹 赵媛媛
摘要 目的:探讨丙泊酚靶向调节丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)通路干预心肌缺血再灌注损伤(MIRI)的作用机制。方法:分别构建体内大鼠心肌梗死模型和体外原代心肌细胞糖氧剥夺(OGD)模型模拟MIRI,实验分为对照组、模型组、阴性对照组和丙泊酚组。分别用流式细胞术检测原代心肌细胞凋亡率,蛋白免疫印迹法(Western Blot)检测心肌细胞凋亡相关蛋白及MAPK/ERK信号通路相关蛋白表达;使用转录组测序和VIPER方法检测心肌组织中蛋白质活性;通过2,3,5-氯化三苯基四氮唑(TTC)染色和苏木精-伊红(HE)染色观察大鼠心肌梗死面积、心肌组织变化;检测各组血清心肌酶活性。结果:与模型组比较,丙泊酚组丙泊酚处理后原代心肌细胞凋亡率、凋亡蛋白Caspase-3和Bax表达明显降低(P<0.01),抗凋亡蛋白Bcl-2表达明显升高(P<0.01),血清肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、肌钙蛋白T(cTnT)和天冬氨酸氨基转移酶(AST)水平明显下降(P<0.01),心肌梗死面积明显缩小,磷酸化ERK1/2(p-ERK1/2)、磷酸化C-Raf(p-C-Raf)和磷酸化MEK1/2(p-MEK1/2)蛋白表达明显增加(P<0.05)。结论:丙泊酚能减轻心肌缺血再灌注损伤,发挥心肌保护作用,可能是通过靶向调节MAPK/ERK信号通路实现的。
关键词 心肌缺血再灌注损伤;丙泊酚;细胞凋亡;心肌酶;丝裂原活化蛋白激酶;细胞外信号调節激酶;实验研究
doi:10.12102/j.issn.1672-1349.2024.01.010
急性心肌梗死(acute myocardial infarction,AMI)是冠心病最严重的临床表现之一[1]。急性心肌梗死时心脏血氧流动受阻,导致心肌缺血和缺氧坏死,同时心肌再灌注会加重原有的心肌损伤[2]。这一病理生理过程在临床上被定义为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)[3]。以往的研究表明,MIRI的病理机制非常复杂,主要包括心肌能量代谢受损、活性氧大量产生、钙离子超载、中性粒细胞浸润和血管内皮功能障碍,最终导致心肌细胞凋亡或坏死[4]。细胞外信号调节激酶(extracellular regulated protein kinases,ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的重要成员[5]。先前的研究表明,ERK可以调节细胞增殖和分化,活化的ERK/MAPK会进入细胞核,磷酸化多种转录因子[如c-fos和血清反应因子(SRF)],从而促进相关基因的表达[6]。心肌缺血状态下,MAPK/ERK信号通路被激活,促进缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)的表达,最终适应缺氧[7]。目前的研究发现,ERK1/2信号通路在MIRI中发挥心脏保护作用,此外ERK1/2信号通路的抑制促进缺血再灌注诱导的心肌细胞凋亡[8]。
丙泊酚主要用于麻醉和镇静,药理学研究显示,其作用包括抗炎和抑制促炎细胞因子的产生以及中性粒细胞浸润[9]。临床研究表明,丙泊酚可以诱导氧化应激生物标志物血红素加氧酶-1(heme oxygenase-1,HO-1)的大量表达,从而发挥抗氧化作用[10]。丙泊酚通过ATP结合盒转运子A1(ABCA1)上调促进胆固醇流出,防止内皮细胞炎症和活性氧引起的死亡[11]。此外,已被证明丙泊酚可以通过抑制缺氧缺糖即糖氧剥夺(OGD)对H9c2细胞的损伤发挥心脏保护作用[12]。然而,丙泊酚对预防和治疗心肌损伤的机制尚未完全阐明。丙泊酚可增加一氧化氮(NO)的生物利用度,上调人静脉内皮细胞内皮型一氧化氮合酶(eNOS)的表达水平,增加NO的生物合成水平[13]。此外,有研究报道,丙泊酚可激活ERK1/2信号通路[14]。总之,丙泊酚可能通过靶向调节MAPK/ERK信号通路发挥缺血再灌注损伤后心脏的保护作用。本研究通过结扎左前降支建立的经典模型和原代心肌细胞OGD模型,探讨丙泊酚的心脏保护作用及其对MAPK/ERK信号通路的影响。
1 材料与方法
1.1 原代心肌细胞的培养
所有动物手术均根据《实验动物护理和使用指南》(1996年修订)进行,本实验获得我院动物伦理委员会批准。用胶原酶Ⅱ(美国Sigma公司)从1~3 d龄Sprague-Dawley(SD)大鼠心室中分离原代心肌细胞。将含有悬浮细胞的上清液预培养1.5 h以除去非心肌细胞。随后将分离的心肌细胞以5×104 个/cm2密度接种到细胞培养板中,随后在含有10%胎牛血清(FBS,美国Gibco公司生产)和1%的青霉素-链霉素(北京索莱宝科技有限公司)的DMEM/F-12和羟乙基哌嗪乙硫磺酸(HEPES,美国Hyclone公司生产)混合液中培养,5%CO2培养箱中孵育。
1.2 OGD细胞模型
以二甲基亚砜(DMSO,美国Gibco公司生产)为介质,将丙泊酚(美国Gibco公司)溶解于含10% FBS中。丙泊酚治疗后24 h,丢弃培养基,用磷酸缓冲盐溶液(PBS)仔细冲洗。然后用KRB缓冲液替换溶液(KRB配制:NaCl 115 mmol/L,KCl 4.7 mmol/L,CaCl2 2.5 mmol/L,KH2PO4 1.2 mmol/L,MgSO4 1.2 mmol/L,NaHCO3 24 mmol/L,HEPES 10 mmol/L,pH 7.4)。在低氧环境(95%N2和5% CO2)中培养6 h后,将细胞在含有10% FBS的DMEM培养箱中培养5 h,该培养箱含有5%CO2和95%空气,用于复氧损伤。
1.3 大鼠心肌梗死模型
术前将体质量为180~200 g的雄性SD大鼠饲养在温度为25 ℃、湿度为45%的环境中,所有实验动物都可以自由获得食物和水。将丙泊酚溶解在0.5%羧甲基纤维素钠(CMC-Na)溶液(美国Gibco公司)中。将所有大鼠随机分为对照组、模型组、阴性对照组和丙泊酚组。在造模前1 h尾静脉注射药物,通过缺血30 min和再灌注2 h建立缺血/再灌注模型。待动物麻醉后,在第2肋和第4肋间左胸壁切口切开胸腔,6-0钢丝穿入左前降支远端1/3处的滑结,之后将导管置于结扎线和心肌组织之间。然后通过收紧缝合线来阻塞冠状动脉,缺血2 h后,松弛滑结,随后心肌再灌注24 h。除缺血再灌注外,对照组进行上述手术。
1.4 心肌梗死面积的测量
通过2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)染色评估心肌梗死面积。再灌注后立即处死大鼠,取出心脏样本,沿心尖至心脏底部切成5 mm厚的切片,在37 ℃用1%TTC孵育15~20 min后,采用数码相机(日本Canon公司)拍摄切片。心脏的红色部分被TTC染色,表明是幸存的组织,白色部分表示心肌梗死。最后使用Image-Pro Plus软件测量心肌梗死面积。
1.5 采用VIPER算法预测蛋白质活性的变化
基于从GEO数据库获得的233个RNA-seq表达谱数据,使用ARACNe建立心肌特异性转录调控网络模型。该网络的参数设置为:引导程序=100,P<10-8,图像每英寸长度内的像素点数(DPI)=0。转录调控网络包含1 623个转录因子、15 432个靶基因和432231个相互作用。基于以上获得的转录调控网络,使用Bioconductor(https://www. bioconductor.org/packages/release/bioc/html/viper.html)提供的VIPER算法预测参麦注射液对蛋白质活性的影响。最后将样本随机均匀地加扰1 000次,以估计统计学意义[15]。
1.6 细胞凋亡检测
采用膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(propidium iodide,PI)双染色试剂盒(英国abcam公司)检测心肌细胞凋亡的变化。用胰蛋白酶消化5×105个细胞,PBS在4 ℃漂洗2次。离心后将细胞重新悬浮在500 μL染色缓冲液中,然后加入5 μL膜联蛋白Annexin V-FITC和5 μL的PI染料,37 ℃黑暗中染色15 min,最后用细胞仪检测凋亡细胞[16]。
1.7 蛋白免疫印迹(Western Blot)法检测凋亡相关蛋白表达情况
向细胞中加入适量的RIPA裂解缓冲液和蛋白酶抑制剂苯甲基磺酰氟(PMSF)并混合均匀(RIPA和PMSF均购自Beyotime公司),胰蛋白酶消化细胞后加入裂解缓冲液,收集裂解物并转移到新的EP管中,随后使用冷冻高速离心机在14 000 r/min和4 ℃下离心30 min。离心完成后,收集蛋白质上清液,并在95 ℃加热10 min,使蛋白质变性,将制备好的蛋白质样品放在-80 ℃的冰箱中备用。蛋白质的浓度用二喹啉甲酸(BCA,购自Beyotime公司)法测量。蛋白样品在80 V恒压下用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离2.5 h后转移到聚偏二氟乙烯(PVDF)膜上。随后将PVDF膜浸入含有5%脱脂奶粉的TBST(购自瑞士Roche公司)中,并在摇床上缓慢摇动1 h。封闭完成孵育一抗,置于4 ℃冰箱過夜。次日取出,用TBST清洗3次,每次10 min后,孵育相应的第二抗体2 h。在暗室中使用增强化学发光试剂(ECL,购自美国Media公司)暴露免疫反应带,最后使用Image-Pro Plus v6分析蛋白质的相对表达。实验使用的一抗:小鼠抗大鼠Caspase-2单克隆抗体、免抗大鼠Bax单克隆抗体、免抗大鼠Bcl-2单克隆抗体、免抗大鼠ERK1/2单克隆抗体、兔抗大鼠丝氨酸-苏氨酸激酶1/2(MEK1/2)单克隆抗体、小鼠抗大鼠原癌基因丝苏氨酸蛋白激酶(C-Raf)单克隆抗体和小鼠抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体,均购自SantaCruzBiotechnology公司。实验使用的二抗有HRP标记的兔抗小鼠IgG和HRP标记的山羊抗兔IgG,均购自SantaCruz 公司。
1.8 苏木精-伊红(HE)染色观察心脏组织的变化
将大鼠处死后分离心脏样本,然后用4%多聚甲醛/PBS(pH 7.4)在4 ℃下处理48 h。然后用流动水洗涤组织,用70%、80%和95%乙醇脱水,并用100%乙醇处理,之后用二甲苯除去乙醇。将组织包埋在石蜡(2 μm)中,并严格按照制造商的HE染色试剂盒(购自Beyotime公司)说明进行染色。
1.9 酶联免疫吸附试验(ELISA)检测血清心肌酶活性
将大鼠处死后采集全血样品,根据肌酸激酶同工酶(CK-MB)、天冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)和肌钙蛋白T(cTnT)试剂盒(购自Beyotime公司)的说明,全血样品在室温下放置20 min,然后在室温下以3 000 r/min离心20 min。随后,收集分离的透明血清,用多功能酶标仪测定450 nm处CK-MB、AST、LDH和cTnT的吸光度,绘制标准曲线,计算每个样品中CK-MB、AST、LDH和cTnT的浓度。
1.10 统计学处理
采用SPSS 20.0软件进行统计分析,所有实验均重复3次。符合正态分布的定量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
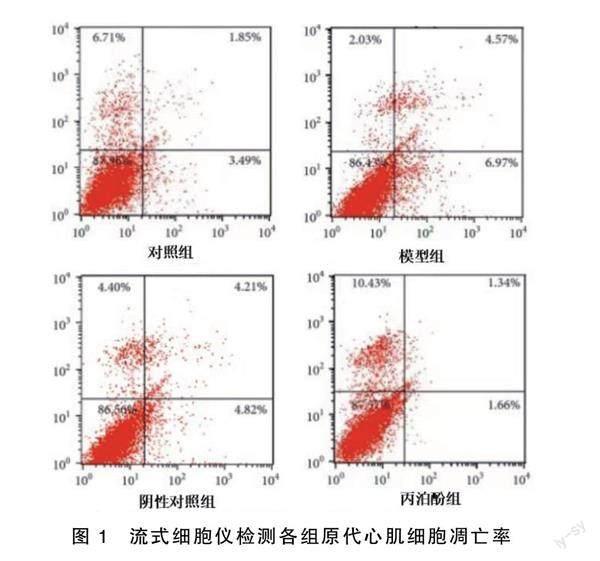
2.1 丙泊酚对缺氧/复氧诱导的原代心肌细胞凋亡的影响
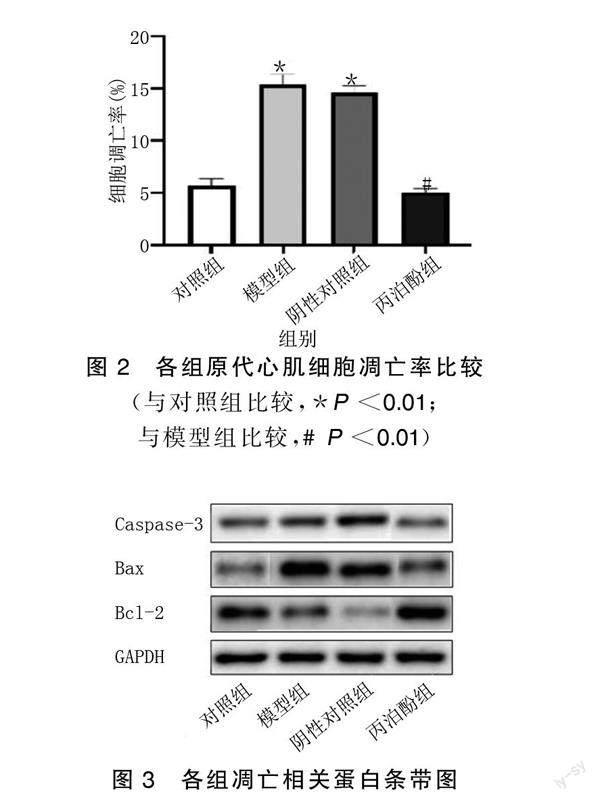
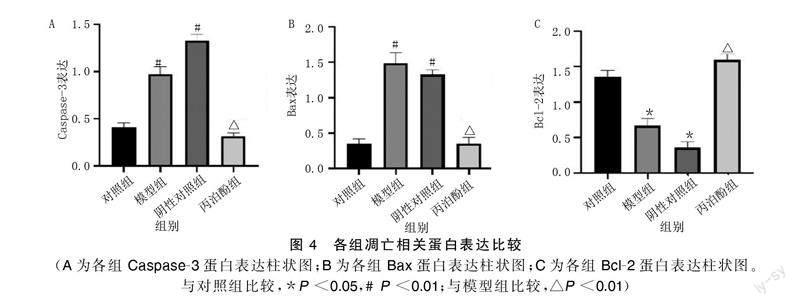
与对照组比较,模型组、阴性对照组原代心肌细胞凋亡率明显升高(P<0.01);与模型组比较,丙泊酚组原代心肌细胞凋亡率明显降低(P<0.01)。详见图1、图2。Western Blot检测结果显示,与对照组比较,模型组、阴性对照组凋亡蛋白Caspase-3和Bax表达明显升高(P<0.01),抗凋亡蛋白Bcl-2表达明显降低(P<0.05);与模型组比较,丙泊酚组凋亡蛋白Caspase-3和Bax表达明显降低(P<0.01),抗凋亡蛋白Bcl-2表达明显升高(P<0.01)。详见图3、图4。
2.2 丙泊酚对缺血再灌注诱导的大鼠血清心肌酶活性的影响
与对照组比较,模型组、阴性对照组血清CK-MB、LDH、cTnT和AST水平有不同程度升高(P<0.01),提示MIRI大鼠模型成功建立。经丙泊酚治疗后,丙泊酚组血清CK-MB、LDH、cTnT和AST水平较模型组明显下降(P<0.01),提示丙泊酚能减轻MIRI。详见图5、图6。
2.3 丙泊酚对缺血再灌注诱导大鼠心肌梗死面积的影响
TTC染色结果显示:与对照组比较,模型组、阴性对照组大鼠心肌梗死面积明显增加(P<0.01),丙泊酚组心肌梗死面积明显小于模型组(P<0.01)。详见图7、图8。
2.4 HE染色分析丙泊酚对缺血再灌注诱导大鼠心脏组织的影响
HE染色结果显示:与对照组比较,模型组、阴性对照组中心肌细胞排列紊乱,心肌细胞胞浆染色不均匀,心肌纤维排列松散无序,细胞间隙明显增宽,肌浆染色也不均匀,同时部分肌纤维变性肿胀,间质水肿,红细胞渗漏,中性粒细胞浸润。丙泊酚治疗后,可以观察到心肌细胞排列有序,染色均匀,细胞边界清晰,无间质水肿和中性粒细胞浸润,对心肌组织表现出了明显的保护作用。详见图9。
2.5 丙泊酚对原代心肌细胞MAPK/ERK信号通路的影响
为了寻找丙泊酚治疗后活性发生显著变化的蛋白质,从GEO数据库中下载了231个心肌组织基因表达谱数据,然后使用ARACNe法构建心肌组织特异性转录调控网络。ARACNe算法是基于大规模基因表达谱数据预测转录调控因子与信号蛋白下游基因关系的理论预测方法,已被证明是进行VIPER分析的有力方法。本实验基于VIPER分析得到6个活性显著上调的蛋白[MAPK3、反应结合蛋白(CREB)、丝裂原激活蛋白激酶1(MAP2K1)、c-fos、丝氨酸-苏氨酸蛋白激酶(Raf1)和MAPK1]和2个活性显著下调的蛋白植物盐超敏感基因(SOS1)和叉头框蛋白O3(FOXO3),提示MAPK/ERK信号通路的蛋白活性顯著上调(见图10)。Western Blot检测结果显示:与模型组比较,丙泊酚处理后MAPK/ERK信号通路中磷酸化ERK1/2(p-ERK1/2)、磷酸化C-Raf(p-C-Raf)和磷酸化MEK1/2(p-MEK1/2)蛋白表达明显增加(P<0.05)。详见图11、图12。
3 讨 论
心肌细胞活力下降和心室重构可能是急性心肌梗死病人因心力衰竭死亡的主要原因[17]。随着急诊溶栓、急诊介入治疗和冠状动脉搭桥术的广泛应用,急性心肌梗死病人的死亡率明显降低,同时病人的生存率显著提高[18]。研究发现,MIRI后心肌发生坏死,多种心肌酶释放到血液中,最终增加血清心肌酶的活性,该结果与之前的文献报道结果[19]一致。经丙泊酚预处理后,MIRI模型大鼠血清CK-MB、AST、LDH和cTnT水平下降,心肌细胞损伤减轻。本研究还通过流式细胞术检测心肌细胞凋亡,结果显示:经缺氧/复氧诱导后,模型组心肌细胞凋亡率明显增加。然而在丙泊酚处理后,心肌细胞凋亡率明显降低。通过TTC染色和HE染色检测心肌梗死面积和心肌组织的变化,结果显示:经缺血/再灌注诱导后,MIRI模型大鼠心肌梗死面积明显增大,心肌细胞排列紊乱,心肌纤维排列松散无序,细胞间隙明显增宽,同时部分肌纤维变性肿胀,间质水肿,红细胞渗漏,中性粒细胞浸润。经丙泊酚处理后,心肌梗死面积明显缩小,心肌细胞排列有序,染色均匀,细胞边界清晰,无间质水肿和中性粒细胞浸润。提示丙泊酚能改善心肌细胞损伤,对缺血再灌注大鼠心肌损伤有一定的预防作用。
目前研究表明,调控MIRI的分子机制非常复杂,主要集中在与细胞生长和存活相关的信号转导途径,如MAPK信号转导途径[20]和 磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)信号转导途径[21]。MAPK信号转导通路与心肌细胞凋亡有关[22]。细胞外刺激与细胞膜表面受体结合并将信号传递到细胞膜的过程中需要MAPK级联反应[23]。目前ERK信号通路是研究最多的MAPK相关通路,其参与调节多种生物过程,如各种细胞的存活、生长和死亡以及炎症相关的免疫反应[20,24]。有研究表明,在急性心肌梗死大鼠模型中激活ERK途径可增强心肌细胞的复氧作用,抑制心肌细胞的凋亡和炎症反应,这在一定程度上保护心肌免受缺血再灌注引起的继发性损伤[25]。本研究结果显示:在缺血/再灌注的体内心肌损伤模型中,与模型组比较,丙泊酚组MAPK/ERK信号通路中关键蛋白p-ERK1/2、p-MEK1/2和p-C-Raf表达水平明显升高,提示丙泊酚在MIRI大鼠的心脏保护作用可能是通过激活MAPK/ERK信号通路来实现的。另外,有研究报道,MAPK/ERK信号转导途径的下游分子ERK可以在刺激下将上游级联信号传递到细胞核中,最终调节细胞核中各种凋亡相关基因的表达如Caspase-3、Bcl-2、Bcl-xL、Bax、Bad和Bim[26-27]。Bcl-2和Bax是决定细胞接受细胞外刺激信号后是否激活凋亡信号通路的关键基因。本研究发现:经丙泊酚干预处理后,p-ERK1/2表达上调,p-ERK的活性被显著激活,从而抑制Caspase-3和Bax的表达并增加Bcl-2的表达,表明丙泊酚可以通过调节ERK通路的激活来干预Caspase-3、Bax和Bcl-2的表达。
綜上所述,丙泊酚可降低缺血再灌注损伤后心肌细胞凋亡率,缩小心肌梗死面积,减轻心肌组织损伤,发挥对心脏的保护作用,其保护机制可能与激活MAPK/ERK信号通路有关。
参考文献:
[1]LI G M,ZHANG C L,RUI R P,et al.Bioinformatics analysis of common differential genes of coronary artery disease and ischemic cardiomyopathy[J].European Review for Medical and Pharmacological Sciences,2018,22(11):3553-3569.
[2]KOHLHAUER M,DAWKINS S,COSTA A S H,et al.Metabolomic profiling in acute ST-segment-elevation myocardial infarction identifies succinate as an early marker of human ischemia-reperfusion injury[J].Journal of the American Heart Association,2018,7(8):e007546.
[3]EPELMAN S,LIU P P,MANN D L.Role of innate and adaptive immune mechanisms in cardiac injury and repair[J].Nature Reviews Immunology,2015,15(2):117-129.
[4]CHI H J,CHEN M L,YANG X C,et al.Progress in therapies for myocardial ischemia reperfusion injury[J].Current Drug Targets,2017,18(15):1712-1721.
[5]THIEL G,RSSLER O G.Resveratrol stimulates c-Fos gene transcription via activation of ERK1/2 involving multiple genetic elements[J].Gene,2018,658:70-75.
[6]MURPHY E,STEENBERGEN C.Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury[J].Physiological Reviews,2008,88(2):581-609.
[7]JIN K,WANG B,RUAN Z B,et al.Effect of miR-497 on myocardial cell apoptosis in rats with myocardial ischemia/reperfusion through the MAPK/ERK signaling pathway[J].European Review for Medical and Pharmacological Sciences,2019,23(19):8580-8587.
[8]YU W C,XU M,ZHANG T,et al.Mst1 promotes cardiac ischemia-reperfusion injury by inhibiting the ERK-CREB pathway and repressing FUNDC1-mediated mitophagy[J].The Journal of Physiological Sciences,2019,69(1):113-127.
[9]VASILEIOU I,XANTHOS T,KOUDOUNA E,et al.Propofol:a review of its non-anaesthetic effects[J].European Journal of Pharmacology,2009,605(1/2/3):1-8.
[10]WANG H H,ZHOU H Y,CHEN C C,et al.Propofol attenuation of renal ischemia/reperfusion injury involves heme oxygenase-1[J].Acta Pharmacologica Sinica,2007,28(8):1175-1180.
[11]MA X,LI S F,QIN Z S,et al.Propofol up-regulates expression of ABCA1,ABCG1,and SR-B1 through the PPARγ/LXRα signaling pathway in THP-1 macrophage-derived foam cells[J].Cardiovascular Pathology,2015,24(4):230-235.
[12]WANG B H,SHRAVAH J,LUO H L,et al.Propofol protects against hydrogen peroxide-induced injury in cardiac H9c2 cells via Akt activation and Bcl-2 up-regulation[J].Biochemical and Biophysical Research Communications,2009,389(1):105-111.
[13]OLIVEIRA-PAULA G H,LACCHINI R,PINHEIRO L C,et al.Endothelial nitric oxide synthase polymorphisms affect the changes in blood pressure and nitric oxide bioavailability induced by propofol[J].Nitric Oxide,2018,75:77-84.
[14]TITUS H E,LPEZ-JUREZ A,SILBAK S H,et al.Oligodendrocyte Ras G12V expressed in its endogenous locus disrupts myelin structure through increased MAPK,nitric oxide,and Notch signaling[J].Glia,2017,65(12):1990-2002.
[15]ALVAREZ M J,SHEN Y,GIORGI F M,et al.Functional characterization of somatic mutations in cancer using network-based inference of protein activity[J].Nature Genetics,2016,48(8):838-847.
[16]MCKINNON K M.Flow cytometry:an overview[J].Current Protocols in Immunology,2018,120:5.1.1-5.1.5.1.11.
[17]ZHANG C J,DENG Y Z,LEI Y H,et al.The mechanism of exogenous adiponectin in the prevention of no-reflow phenomenon in type 2 diabetic patients with acute myocardial infarction during PCI treatment[J].European Review for Medical and Pharmacological Sciences,2021,25(17):5322.
[18]WANG X M,WANG J H,TU T T,et al.Remote ischemic postconditioning protects against myocardial ischemia-reperfusion injury by inhibition of the RAGE-HMGB1 pathway[J].BioMed Research International,2018,2018:4565630.
[19]CHEN J Y,JIANG Z Z,ZHOU X,et al.Dexmedetomidine preconditioning protects cardiomyocytes against hypoxia/reoxygenation-induced necroptosis by inhibiting HMGB1-mediated inflammation[J].Cardiovascular Drugs and Therapy,2019,33(1):45-54.
[20]GUO W W,LIU X J,LI J J,et al.Prdx1 alleviates cardiomyocyte apoptosis through ROS-activated MAPK pathway during myocardial ischemia/reperfusion injury[J].International Journal of Biological Macromolecules,2018,112:608-615.
[21]LI X F,HU X R,WANG J C,et al.Inhibition of autophagy via activation of PI3K/Akt/mTOR pathway contributes to the protection of hesperidin against myocardial ischemia/reperfusion injury[J].International Journal of Molecular Medicine,2018,42(4):1917-1924.
[22]XIE L A,HE S Q,KONG N,et al.Cpg-ODN,a TLR9 agonist,aggravates myocardial ischemia/reperfusion injury by activation of TLR9-P38 MAPK signaling[J].Cellular Physiology and Biochemistry,2018,47(4):1389-1398.
[23]YU D S,LI M W,TIAN Y Q,et al.Luteolin inhibits ROS-activated MAPK pathway in myocardial ischemia/reperfusion injury[J].Life Sciences,2015,122:15-25.
[24]CHEN Y P,BA L N,HUANG W,et al.Role of carvacrol in cardioprotection against myocardial ischemia/reperfusion injury in rats through activation of MAPK/ERK and Akt/eNOS signaling pathways[J].European Journal of Pharmacology,2017,796:90-100.
[25]SCHAEFFER H J,WEBER M J.Mitogen-activated protein kinases:specific messages from ubiquitous messengers[J].Molecular and Cellular Biology,1999,19(4):2435-2444.
[26]LIU X B,GU J M,FAN Y Q,et al.Baicalin attenuates acute myocardial infarction of rats via mediating the mitogen-activated protein kinase pathway[J].Biological and Pharmaceutical Bulletin,2013,36(6):988-994.
[27]DUAN J,YANG Y,LIU H,et al.Osthole ameliorates acute myocardial infarction in rats by decreasing the expression of inflammatory-related cytokines,diminishing MMP-2 expression and activating p-ERK[J].International Journal of Molecular Medicine,2016,37(1):207-216.
(收稿日期:2022-01-30)
(本文編辑郭怀印)
基金项目 四川省卫生和计划生育委员会科研课题(No.17PJ596)
引用信息 王晓英,刘盼,韩丹,等.丙泊酚靶向调节MAPK/ERK信号通路干预心肌缺血再灌注损伤的实验研究[J].中西医结合心脑血管病杂志,2024,22(1):56-61;87.

