直肠癌局限性肝转移的手术及术后经门静脉途径灌注化疗的疗效分析
王永忠, 谢召平, 徐书楷, 胡安然
1997年1月至2005年12月的9年间,我科共完成直肠癌局限性肝转移手术40例,并将术后患者随机分成两组,分别采用经门静脉途径和外周静脉途径化疗,均取得了较好的疗效,现报告如下:
1 资料与方法
1.1 一般资料
本组患者共40例,其中男性29例,女性11例,男女之比为2.6∶1,年龄(56.8±8.5)岁。术前CEA≤15 μg/L 15例,>15 μg/L 25例。原发癌位于直肠中上段(距肛门口≥7 cm)31例,位于直肠下段(距肛门口<7 cm)9例。病理类型:未分化癌3例,低分化腺癌15例,中分化腺癌10例,高分化腺癌8例,其他4例。直肠癌合并同时性肝转移18例,延迟性肝转移(直肠癌术后6个月~5年出现肝转移)22例。肝转移瘤数目1个11例,2个12例,3个7例,4~5个10例。肝转移瘤部位,右肝24例,左肝10例,两侧均有6例。术前肝功能均为Child-Pugh A级,无肝硬化。
1.2 手术方式
1.2.1 直肠癌切除方式 行Dixon(直肠癌前切除)手术35例,Miles(腹会阴联合直肠癌切除)手术5例,其中同时性肝转移18例均行Dixon术,延迟性肝转移22例中行Miles术5例,Dixon术17例。
1.2.2 肝转移癌切除方式 行肝转移瘤局部切除31例,右半肝切除2例,左半肝切除3例,左外叶切除4例。
1.2.3 同时性肝转移的手术方式 同时性肝转移18例均采用同时性手术切除,其中肿瘤位于左肝者6例取正中切口上起剑突下至耻骨联合上方,余12例取两个切口:经右肋缘下切口行肝转移癌切除,经下腹正中切口行直肠癌前切除术,术中须换体位。手术顺序:18例中先切肝后切肠10例,先切肠后切肝8例。
1.3 术后化疗途径的选择
40例患者随机分成两组,A组22例,术中经胃网膜右静脉向门静脉内植入DDS泵(全植入式药物输注装置),术后经此泵行区域性灌注化疗。B组18例,采用经锁骨下静脉置管或周围静脉全身化疗。两组患者年龄、性别、体重等均相似,具有可比性,所用的化疗方案(表1)及其他抗肿瘤辅助用药均完全相同。

表1 化疗方案
LV需在5-Fu之前静脉滴注,第1-3天需水化碱化尿液。21天为1个周期,共化疗4~6周期。
1.4 随访及统计学处理
术后随访3~5年,观察术后1、3、5年生存率和复发率,计数资料用χ2检验,生存分析用log rank时序检验,P<0.05为差异有统计学意义。
2 结果
所有患者均安全度过围手术期。无膈下积液、感染、吻合口漏及其他严重并发症。术后随访3~5年,术后1、3、5年生存率分别为85%(34/40)、54.2%(13/24)和37.5%(6/16),1、3、5年复发率分别为7.5%(3/40)、45.8%(11/24)和62.5%(10/16)。术后不同途径化疗患者的生存情况比较见表2,术后3、5年生存率A组高于B组,复发率B组高于A组,经log rank时序检验,差异有统计学意义(P<0.05),说明经门静脉途径区域性灌注化疗疗效优于经外周静脉的全身性化疗。同时性肝转移与延迟性肝转移术后生存率和复发率相似,差异无统计学意义。
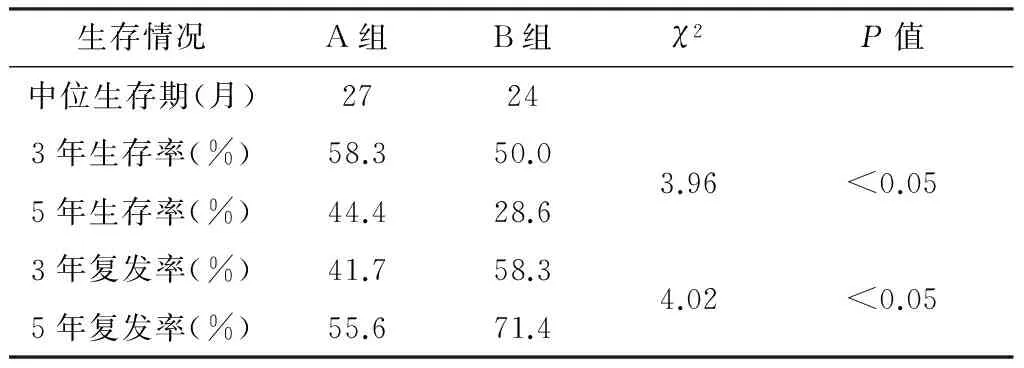
表2 两组患者的生存情况比较
3 讨论
3.1 关于直肠癌肝转移的手术治疗
肝脏是直肠癌最主要的远处转移部位,也是影响患者愈后的重要因素。约 40%~50%的直肠癌患者在原发癌确诊时或切除后5年内出现肝转移,前者称为同时性肝转移,后者称为延迟性肝转移。在所有直肠癌肝转移患者中约20%~40%属于局限性转移,手术切除是唯一有可能使其长期存活甚至治愈的手段,应采取积极的态度进行手术治疗[1]。但局限性肝转移的手术指征和手术时机如何把握,影响手术效果的因素有哪些,各家尚有争议[2]。目前一般认为,不论转移灶的直径或数量多少,只要转移灶能够切除且能留有足够的肝脏储备即应手术切除,但若70%以上肝脏受累或6个以上肝段受累,则属于不可切除的肿瘤[3]。本组40例,转移灶均不超过5个,多在3个以内,转移瘤位于一侧肝内者达34例,仅6例累及肝脏两侧且均可局部切除,术后1、3、5年生存率分别达85%、54.2% 和37.5%,效果较满意。关于手术切缘,有作者认为理想的切缘应距离转移灶1 cm以上,切缘不足1 cm容易残留肿瘤细胞导致术后复发[4]。我们认为不应将切缘>1 cm做为切除完全的唯一标准,如果肿瘤位于肝脏边缘部位,应努力争取达到1 cm 以上的切缘,如果肿瘤紧贴肝内主要血管,则应以手术安全为主,要尽量保留重要血管,只要肿瘤能够完整切除,即应认为手术彻底。Pawlik等[5]的研究结果也支持这一观点。
对于同时性肝转移患者的手术时机问题,目前仍有争议。主张异时性切除(先行直肠癌原发灶切除,2~3个月后再行肝转移灶切除)者认为同时性手术存在:(1)手术创伤大,切口暴露受限制,术中需扩大切口甚或改变体位做不同的手术切口。(2)肠切除为污染性手术,有潜在的增加腹腔感染的可能。(3)肝切除时肝门阻断引起肠道血液回流受阻可能会影响肠切除后吻合口的愈合能力。因此,术后并发症多、死亡率高[6]。主张同时性切除(在直肠癌原发灶切除的同时行肝转移灶切除)者认为虽然在理论上同时性切除有上述不利因素存在,但在实践中并未增加患者围手术期病死率和并发症发生率,因此同时性手术是安全可行的[7-9]。近年来,随着肝外科手术技术和围手术期管理水平的提高,持同时性手术切除观点者愈来愈多。本组直肠癌同时性肝转移18例,都采用同时性手术切除,均安全渡过围手术期,无腹腔感染、吻合口漏等严重并发症。因此,我们认为同时性手术并不增加手术风险,并可避免因异时手术等待过程中的肿瘤发展影响预后甚或失去手术机会,同时性手术值得提倡。已有研究表明肝转移灶大小是影响预后的独立因素[10]。
关于同时性手术是先切肝还是先切肠的问题,有作者认为[9]宜先行肝转移瘤切除,再行直肠癌原发灶切除,认为这样做的优势在于:(1)可减少对上腹部的污染;(2)肝门阻断在先,肠切除肠吻合在后,肝门阻断引起的肠道血液回流受阻对吻合口愈合的影响较小。本组18例,先切肝后切肠10例,先切肠后切肝8例,术后均无腹腔感染及吻合口漏等并发症,因此,我们认为对于先切肝还是先切肠的争议,在实践上并无实际意义,应根据患者实际情况灵活掌握。
3.2 关于术后经门静脉途径灌注化疗的前瞻性随机对照研究
虽然手术切除是治愈直肠癌肝转移的唯一有效途径,其疗效在临床上已无争议,但术后仍有较高的复发率,其远期疗效也并不乐观。国外大宗病例报道术后5年生存率为26%~40%,而复发率达65%~80%[11]。因此,应进一步寻求有效的术后治疗模式以进一步提高疗效,改善预后。术后化疗是临床上最常用的治疗方法,目前一般多采用经外周静脉的全身性化疗,但存在副反应多、疗效不稳定等缺点,因而不易被多数患者接受和坚持。直肠癌肝转移是一种缺乏血供的肿瘤,采用经肝动脉化疗栓塞术效果也欠佳。采用经门静脉途径的区域性灌注化疗是否更有效,安全性如何,相关研究报道较少。
我们对此进行前瞻性了对照研究,结果显示经门静脉途径的区域灌注化疗安全可行且效果更好。其可能的原因是:(1)在现有设备条件下,术前CT、MRI等影像学检查结合术中B超探查,可以将直径5 mm以上的肿瘤切除,但尚无法探知肝内所有的微小转移灶,在将已探及的转移灶切除的情况下,肝内可能还残留有一些微小转移灶。这些微小转移灶主要由门静脉供血。Conway等[12]报道,当肿瘤直径小于1 mm时,其血供几乎全来自门静脉。经门静脉途径的区域性灌注化疗对这些微小转移灶应有更好的杀灭作用。(2)直肠癌是通过门静脉收纳系统经血行转移至肝脏的,门静脉收集了来自胃肠道的大部分静脉回流血,在直肠癌原发灶切除后,门静脉各分支系统内仍可能残留有微小癌栓[13],对于这些微小癌栓,采用经门静脉途径的局部灌注化疗应具有更好的治疗效果。(3)有研究显示肝脏对直肠癌的远处转移有屏障作用,肝脏是直肠癌远处转移最常见甚至是唯一受累的器官,直肠癌转移至肝脏后并不继续扩散到远隔的其他器官而是只停留在肝脏内[14]。经门脉途径的区域性化疗,药物在肝内的有效浓度会更高,因而对肝内微小转移灶及门静脉微小癌栓的杀灭效果可能会更好,而经外周静脉的全身性化疗,其药物需经全身血液循环,其有效浓度已被稀释后才到达肝脏,因而疗效可能较差。吴清泉等[15]报道通过门静脉用药可使肝内药物浓度比全身用药提高80~100倍。区域性灌注化疗的药物经肝脏后仍会进入全身循环,因而也能取到一定的全身性化疗作用。
[1] Sadahiro S,Suzuki T,Ishikawa K,et al.Recurrence patterns after curative resection of colorectal cancer in patients followed for a minimum of ten years[J].Hepatogastroenterology,2003,50(53):1362-1366.
[2] 高军,张建立,丁连安.结直肠癌肝转移的外科治疗[J].中国实用外科杂志,2008,28(6):499-501.
[3] Poston GJ.Surgical strategies for colorectal liver metastases[J].Surg Oncol,2004,13(2-3):125-136.
[4] 赵晓中.直肠癌局限性肝转移手术切除预后分析[J].长治医学院学报,2004,18(3):197-198.
[5] Pawlik TM,Scoggins CR,Zorzi,et al.Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases[J].Ann Surg,2005,241(5):715-722.
[6] Penna C,Nordlinger B.Surgery of liver metastases from colorectal cancer:new promises[J].Br Med Bull,2002,64:127-140.
[7] Martin R,Paty P,Fong Y,et al.simultaneous liver and colorectal resections are safe for synchronous colorectal liver metastasis[J].J AM coll surg,2003,197(2):233-241.
[8] Tanaka K,Shimada H,Matsuo K,et al.Outcome after simultaneous colorectal and hepatic resection for colorectal cancer with synchrous metastases[J].surgery,2004,136(3)650-659.
[9] 赵义军,王葵,阎振林,等.结直肠癌同时性肝转移的手术疗效分析[J].肝胆外科杂志,2008,16(5):337-340.
[10] 周志伟,任镜清,万德森.结直肠肝转移病人预后的多因素分析[J].癌症,2006,25(9):1149-1152.
[11] Wanebo HJ,Chu QD,Avradopoulos KA,et al.Current perspectives on repeat hepatic resection for colorectal carcinoma:a review[J]. surgery,1996,119(4):361-369.
[12] Conway JG,Popp JA, Thurman RC. Microcirculation of hepatic nodules from diethylintrosamine-treated rats[J]. Cancer Res, 1985,45(8):3620-3625.
[13] 魏晓岗,赵海剑,程若川,等.结肠癌肝转移灶同期切除后门静脉化疗[J].昆明医学院学报,2006,27(4):82-84.
[14] Bentrem DJ,Dematteo RP,Blumgart LH.Surgical therapy for metastase disease to the liver[J].Ann Rev Med,2005,56:139-156.
[15] 吴清泉,张平.大肠癌肝转移切除并术中门静脉置灌注泵治疗体会[J].临床肿瘤学杂志,2003,8(4):293-294.

