姜黄素与β-榄香稀联用对涎腺腺样囊性癌细胞株SACC-LM生长抑制和凋亡的协同作用*
白 亮,李耀辉,王 如
(大连医科大学 附属第一医院 口腔颌面外科,辽宁 大连 116011)
抗癌药物对肿瘤产生的效果不仅依赖于对肿瘤细胞增殖的抑制,同时依赖于诱导肿瘤细胞凋亡。评价抗癌药物疗效的重要标志是能否诱导肿瘤细胞凋亡。大量研究表明,姜黄素能抑制多种肿瘤细胞生长,如食管癌、鼻咽癌等有诱导其凋亡的细胞毒作用。姜黄素一方面有一定抗肿瘤作用,另一方面也能通过抗氧化机制保护正常细胞,可降低β-榄香稀的细胞毒作用。作者通过实验探讨姜黄素联合β-榄香稀抑制涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)细胞株SACC-LM细胞是否有协同效应,能否诱导其凋亡,并对凋亡诱导和细胞周期阻滞关系进行研究。既往国内外学者对姜黄素诱导肿瘤细胞凋亡有大量研究报道,但姜黄素协同β-榄香稀抑制涎腺腺样囊性癌细胞株SACC-LM细胞增殖和诱导凋亡的研究鲜有报道。
1 材料和方法
1.1 研究材料
姜黄素:中国药品生物制品检定所提供;5%β-榄香稀乳剂:大连药物化学研究提供;SACC-LM:北京大学口腔医学院提供;Caspase-3鼠IgG和即用型SABC染色试剂盒(武汉博士德生物工程有限公司提供,批号070206)
1.2 研究方法
1.2.1 药物敏感性MTT测定法:将指数生长期的肿瘤细胞按每孔1×104个(1 mL)SACC-LM细胞接种到96孔培养板中,置37℃、5%CO2、100%湿度培养箱中24 h后,分别加入姜黄素、β-榄香稀及姜黄素联合β-榄香稀(浓度比1∶1)3组不同用药,每组药物分别以0、10、20、40、80、160 μg/mL的浓度顺次加药,对照组加不含药物的培养液,孵育24 h,弃上清液,每孔加含0.5 mg/mL的MTT溶液100 μL温育1 h,弃上清液,加溶解液100 μL温育0.5 h,摇匀后,用酶标仪在595 nm/630 nm波长测定,求A值。细胞存活率(%)=实验孔A均值/对照孔A均值×100%
1.2.2 流式细胞术检测细胞凋亡率:单独加10 μg/mL姜黄素、单独加10 μg/mL β-榄香稀、10 μg/mL姜黄素和10 μg/mL β-榄香稀联合用药,作用于SACC-LM细胞24 h,对照组不加药的SACC-LM细胞培养24 h,共4组细胞。1000 r/min离心5 min,制成1×106个/mL悬液。取细胞悬液PBS漂洗2次,70%预冷乙醇固定,4℃ 2 h。制成200 μL细胞悬液,加Rnase 100 μL 37℃水浴30 min。加碘化丙啶,15 min后,上机分析(Facs Vantange SE)。
1.2.3 药物对SACC-LM细胞株Caspase-3表达的影响:取对数生长期细胞制成细胞悬液,将其浓度调整为2.5×103/mL,接种于预置盖玻片的6孔板中,贴壁后加入不同组的药物溶液,使其终浓度为10 μg/mL,常规培养24 h后取出盖玻片,用4%聚乙二醇固定,按照试剂盒方法进行细胞免疫组化染色,检测Caspase-3蛋白的表达。显微镜下观察:每张涂片随机取10个视野,每个视野计数260~460个细胞,分别计数Caspase-3免疫阳性细胞数目和阴性细胞数目,进行统计学分析。
1.2.4 透射电镜观察:不加药的SACC-LM细胞培养24 h后作对照组,以10 μg/mL姜黄素和10 μg/mL β-榄香稀联合用药作用于SACC-LM细胞24 h为实验组。经漂洗、固定、脱水、包埋等制成电镜标本,双铅染色后,透射电镜观察并摄片。
1.3 统计学方法
应用SPSS11.0软件包进行统计学处理,单因素方差分析比较各组差异,结果以均数±标准差表示,以P<0.05为差异有统计学意义。计算各组半数抑制浓度(IC50)及95%可信区间,依据95%可信区间进行统计推断,绘制姜黄素、β-榄香稀,以及姜黄素联合β-榄香稀作用SACC-LM细胞的剂量-反应关系曲线图。
2 结 果
2.1 细胞增殖实验结果
姜黄素联合β-榄香稀(浓度比1∶1)作用于SACC-LM细胞株,与两种药物单独作用于SACC-LM细胞株相比,呈现出明显协同作用。按Bliss法先测出姜黄素和β-榄香稀各自IC50;设其为相加作用,公式:1/混合物预期IC50=a/姜黄素IC50+b/β-榄香稀IC50,且a+b=1,a=b=0.5。单独以姜黄素、β-榄香稀作用于SACC-LM细胞各自IC50的95%可信区间和姜黄素联合β-榄香稀(浓度比1∶1)作用于SACC-LM细胞的IC50的95%可信区间不重叠,证明它们之间比较差异有显著性意义(P<0.05)。见表1。在联合作用SACC-LM细胞中,1/混合物预期IC50=0.5/69.45+0.5/186.81。混合物预期IC50=101.4。混合物预期IC50/实测IC50=101.4/30.47=3.32>2.5。证明姜黄素联合β-榄香稀(浓度比1∶1)作用于SACC-LM细胞有协同作用。
表1姜黄素、β-榄香稀及它们联合用药对SACC-LM细胞毒性(IC50)μg/mL的影响

类别实测IC5095%可信区间姜黄素69.4558.34~89.51β-榄香稀186.81148.12~240.23联合用药1∶130.4724.87~37.65
时间相同,不同药物直接作用于SACC-LM细胞后,细胞均出现体积变小、变形,甚至发泡、皱缩等变化。而联合用药(浓度比1∶1)对肿瘤细胞的抑制作用最强,其抑制率随药物浓度增加而增大,具有浓度依赖性,并绘制其药物的量效关系曲线。见图1。
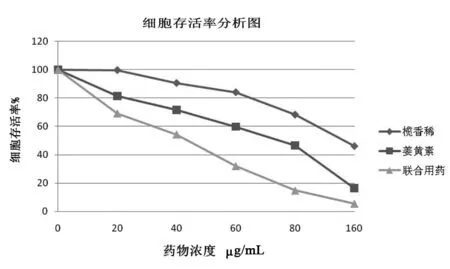
图1姜黄素/β-榄香稀/联合用药(浓度比1∶1)作用于SACC-LM细胞株的量效关系曲线
2.2 流式细胞术结果
对照组不加药的SACC-LM细胞24 h后,G1期细胞比例74.87%,G2期细胞比例9.36%,S期细胞比例15.77%。
单独加姜黄素后,G1期细胞比例40.89%,G2期细胞比例为36.39%,S期细胞比例22.73%,凋亡率10.53%,细胞阻滞在G2/m期。
单独加β-榄香稀后,G1期细胞比例53.93%,G2期细胞比例0.06%,S期细胞比例46.01%,凋亡率13.54%,细胞阻滞在S期。协同作用后,G1期细胞比例33.57%,G2期细胞比例0.00%,S期细胞比例66.43%,凋亡率26.57%,细胞阻滞在S期,凋亡率明显提高,见图2。
2.3 不同药物对SACC-LM细胞株Caspase-3表达的影响
经不同组药物(药物浓度10 μg/mL)处理过的SACC-LM细胞的细胞膜和细胞浆呈现棕黄色,细胞核染为蓝色,其阳性表达都比对照组高,差异有显著性意义(P<0.05),而以联合用药组阳性表达最高,见表2。

组 别阳性率(%)阴性对照组2.9±0.3β-榄香稀组20.8±2.1姜黄素组14.1±1.5姜黄素+β-榄香稀组46.2±3.2
2.4 透射电镜观察
对照组细胞完整,内质网丰富,核仁大而明显。联合用药组,细胞皱缩,核内染色质高度凝集,核染色质沿核膜发生边聚,线粒体固缩或肿胀,内质网破裂,有凋亡样坏死改变。见图3、4。
3 讨 论
姜黄素是从姜黄根茎中提取的一种酚性色素,具有抗肿瘤、抗氧化、抗HIV病毒等多种药理作用,是一种天然植物活性成分[1]。β-榄香稀是从中药莪术中提取的挥发油,对肝、肾功能无损害,毒副作用小。本实验3组药物姜黄素组、β-榄香稀组以及两者联合组均有抑制SACC-LM细胞生长的作用,但联合组抑制率最高。当达到半数抑制率IC50时,姜黄素浓度(69.45 μg/mL)是协同用药浓度(30.47 μg/mL)的2.27倍,β-榄香稀浓度(186.81 μg/mL)是协同用药浓度(30.47 μg/mL)的6.13倍,说明在较高的浓度时,各组药物主要通过直接杀死肿瘤细胞来抑制肿瘤生长,而联合用药组在较低的剂量下,也能显示较强诱导肿瘤细胞凋亡作用,说明两药联合诱导肿瘤细胞凋亡作用增强,有协同作用。
临床肿瘤学中,通常以S期细胞比例作为判断肿瘤增殖状态的指标,在G1期,细胞开始RNA和蛋白质合成,但DNA含量仍保持二倍体;进入S期后,DNA开始合成,此时细胞核内DNA含量介于G1期和G2期之间,DNA仍未复制成四倍体。本实验的可能机制为:联合用药(浓度比1∶1)作用SACC-LM细胞时,使姜黄素与β-榄香稀各自单独作用SACC-LM细胞株的细胞阻滞周期发生改变,并使肿瘤细胞周期阻滞在S期,抑制了肿瘤细胞增殖,并有明显增高的凋亡率,说明联合作用可产生较早期细胞凋亡。联合用药组Caspase-3的阳性表达远高于对照组(P<0.05),差异有显著性意义,活化的Caspase-3酶是早期细胞凋亡检测的信号分子,联合用药组可激活Caspase-3,使Caspase-3表达明显高于每个单独用药组,一旦依赖于Caspase-3的细胞水解过程被激活并启动,细胞凋亡不可逆转,同时裂解多聚苷核糖聚合酶和Caspase活化的脱氧核糖核酸酶抑制剂,最终导致肿瘤细胞DNA发生断裂,即发生明显凋亡。其结果与流式细胞仪检测的细胞DNA片断化出现时,细胞DNA正发生断裂,细胞DNA未复制成四倍体前,发生S期细胞阻滞,凋亡率明显提高的结果一致,也与电镜显示联合用药作用SACC-LM细胞出现明显凋亡形态一致。

Caspase在凋亡中所起的主要作用是:灭活细胞凋亡的抑制物(如bcl-2);水解细胞的蛋白质结构等。所以,联合用药组同时使bcl-2凋亡调控蛋白表达下调,bcl-2基因降低可提高细胞对协同用药的敏感性,采用Caspase-3表达技术,更证实了联合用药是通过激活Caspase-3和下调bcl-2调控蛋白表达来诱导肿瘤细胞发生凋亡,也说明两种药物有协同作用。
姜黄素的药理作用还有抑制氧自由基产生、抑制多种蛋白激酶活性等[2]。其毒副作用小,无明显的肝肾毒性,故而成为许多国内外学者的研究对象。杨甫文等[3]报道,姜黄素的抗肿瘤作用机制在不同肿瘤细胞中可表达为抑制肿瘤血管生成,抑制多种酶和蛋白的活性,涉及多种基因的表达和传导路径。而Liu等[4]采用MTT测定法和免疫组化等技术研究报道,姜黄素可抑制Raji淋巴瘤细胞增殖,同时诱导其凋亡,其作用机制可能和上调组蛋白乙酰基转移酶4蛋白表达等因素有关。又有Lim等[5]研究表明,姜黄素可通过上调抑癌基因p21、p53表达,抑制原癌基因MDM2,AP1等的表达。
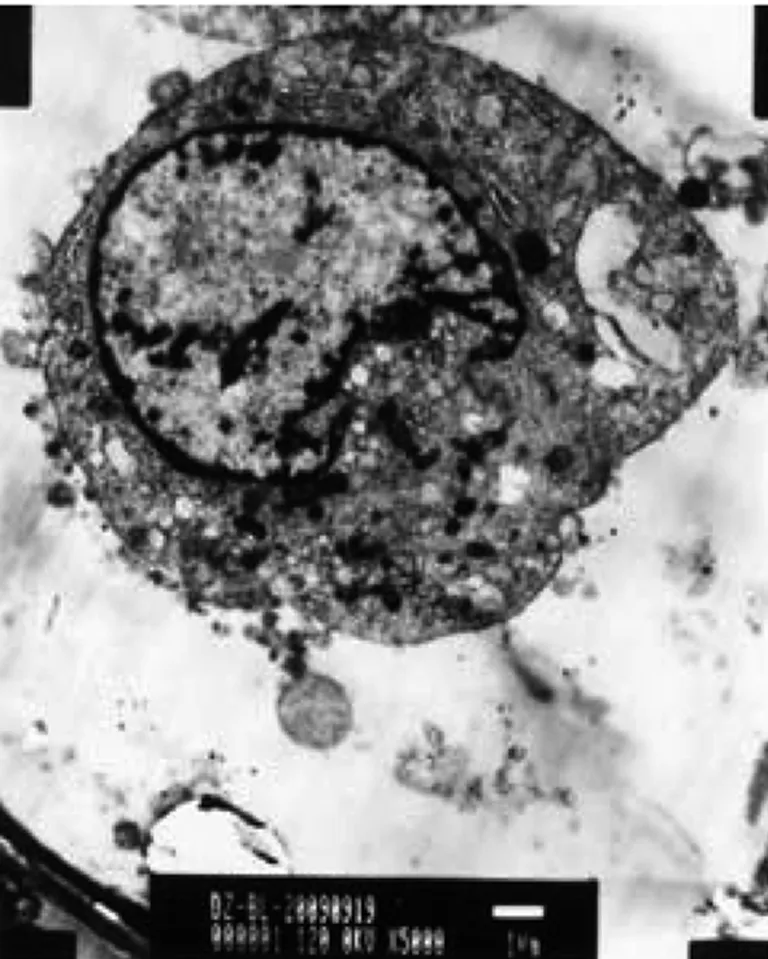
图3 对照组 透射电镜×5000
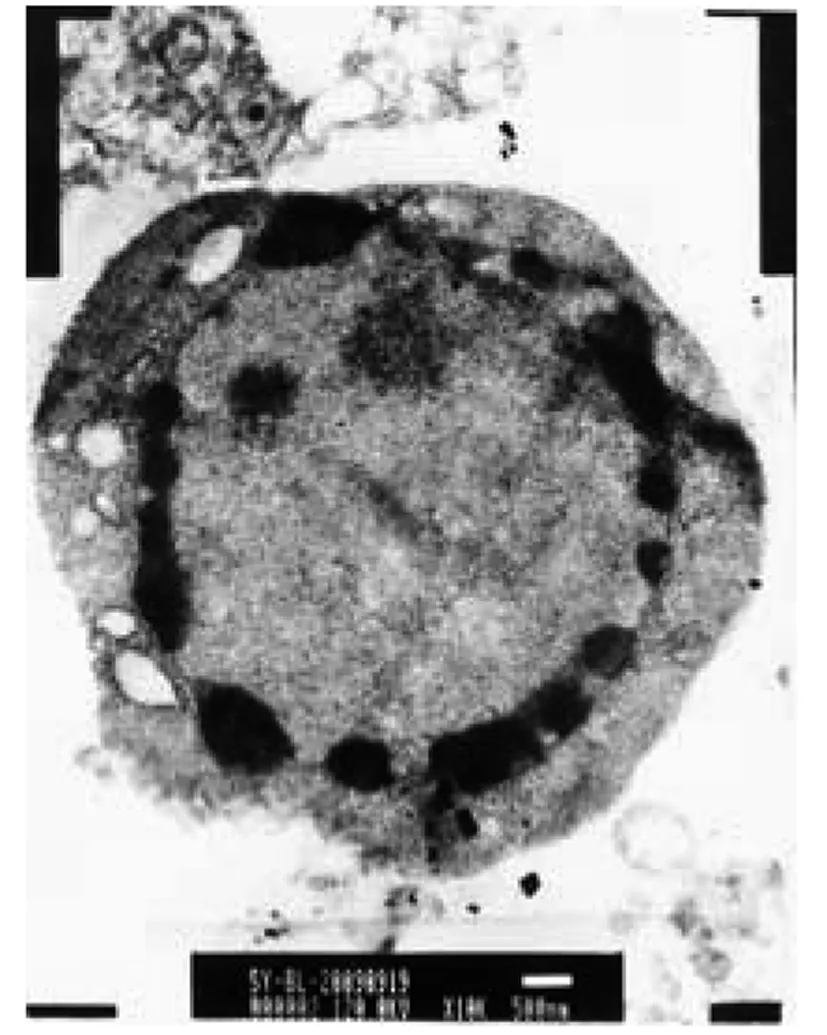
图4 联合用药组 透射电镜×10000
姜黄素抗肿瘤机制较为复杂,多靶点、多途径作用是其亮点。姜黄素与化疗药物联合应用是目前化学预防和治疗肿瘤研究热点之一。本实验姜黄素和β-榄香稀联合抑制SACC-LM细胞增殖并诱导其凋亡的协同作用机制尚需进一步探讨。姜黄素具有低毒、价低、来源广等优点,而β-榄香稀可从资源丰富的天然药物中寻求,较低浓度的姜黄素与β-榄香稀协同用药即可达到较高抑制肿瘤细胞SACC-LM生长和诱导其凋亡的作用。从另一侧面反应,降低了β-榄香稀用药浓度,良好地发挥了姜黄素保护正常细胞的抗氧化机制。既达到杀伤肿瘤细胞的目的,又避免了高浓度的姜黄素和高浓度的β-榄香稀对正常组织细胞的细胞毒作用。本实验是前期实验的延续,选择涎腺腺样囊性癌SACC细胞系的不同细胞株SACC-LM进行研究,为临床上防治涎腺腺样囊性癌的进一步研究提供良好的科学实验依据。由于涎腺腺样囊性癌具有嗜神经、嗜血管性等生物学行为,化疗在预防该肿瘤的复发、转移中有重要地位。希望通过不断的研究与探索,并摸索出成熟的化疗方案,以促进临床在治疗涎腺腺样囊性癌的措施方面有新的突破。
[1] Aggarwal S,Ichikawa H,Takada Y.Curcumin (diferuloylmethane)down-regulates expression of cell proliferation of Ikappabalpha kinase and Akt activation[J]. Mol Pharmacol,2006,69(1):195-206.
[2] 许东辉,王胜,金晶,等.姜黄素的药理作用研究进展[J].中草药,2005,36(11):1737-1740.
[3] 杨甫文,黄金中.姜黄素抗肿瘤研究机制进展[J]. 福州总医院学报,2006,13(4):248-251.
[4] Liu HL,Chen Y,Cui GH,et al. Curcumin,a potent antitumor reagent,is a novel histone deacetylase inhibitor regulating B-NHL cell line Raji proliferation[J].Acta Pharmacol Sin,2005,26(5):603-609.
[5] Lim,Zhang Z,Hill DL,et al. Curcumin,a dietary component,has anticancer,chemosensitization,and radiosensitization effects by down-regulating the MDM2 oncogene through the PI3K/mToR/ETS2 pathway[J].Cancer Res,2007,67(5):1988-1996.

