阿霉素诱导的卵巢癌耐药细胞P-糖蛋白的表达*
苗迎秋,李 志,高文仓
(1.大连大学 医学院 药理学教研室,辽宁 大连 116622;2.大连市中心医院 检验科,辽宁 大连 116033;3.大连大学 新华医院 肿瘤科,辽宁 大连 116021)
卵巢癌是一种常见的妇科恶性肿瘤,其治疗方法主要有手术和化疗。由于卵巢癌发病隐匿,约70%患者确诊时已为晚期。对多数晚期患者临床主要采用化学疗法 ,但总的来说疗效不理想 ,其中重要原因之一是卵巢癌患者对化疗产生抗药性[1]。由于化疗耐药致使晚期患者的5 年生存率仅为30%[2],卵巢癌耐药的发生及逆转机制是当前国内外妇产科学界极其紧迫的研究课题。对卵巢癌耐药机制进行探讨,不仅有利于更深入地了解疾病的发生发展,更有助于指导临床医生选择合理的化疗方案和化疗药物,采取针对性的治疗措施来逆转耐药,提高卵巢癌患者的生存率。建立理想的卵巢癌耐药细胞模型是深入研究卵巢癌细胞耐药机制的前提。在众多抗癌药中,阿霉素(ADR)是最具有代表性的药物。它可抑制RNA 和DNA的合成,对RNA的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。由于 ADR抗药可作为多药耐药(MDR)的典型代表,ADR的耐药特点也是MDR的全部特点[3],所以,本研究对诱导建立具有多药耐药表型的卵巢癌耐药株(SK-OV-3/adr)[4],继续用大剂量ADR反复冲击用药,并对诱导的卵巢癌耐药细胞中mdr1/P-gp的作用机制进行初步探讨。
1 材料和方法
1.1 材 料
1.1.1 卵巢癌敏感细胞株(SK-OV-3):由吉林省肿瘤研究所提供。
1.1.2 试剂:RPMI1640培养液Gibco/BRL公司产品;四甲基偶氮唑蓝(MTT) 和DMSO均为美国Sigma公司产品;胎牛血清;TRIzol试剂盒购自美国Invitr ogen公司。RT-PCR试剂盒、DNA聚合酶、DNA Marker、琼脂糖购自TaKaRa公司。多药耐药相关基因-1(mdr1)、β-actin引物购于大连宝生物工程有限公司,鼠抗人 P-gp单克隆抗体、生物素标记的抗体 (二抗 )、辣根过氧化物酶均购于北京中杉生物技术有限公司。
1.1.3 药品:阿霉素(ADR 浙江海正药业);足叶乙甙(VP-16 贵州汉方制药);长春新碱(VCR 广州白云山明兴制药)、紫杉醇(PTX贵州汉方制药)、逆转剂盐酸维拉帕米(Ver 新华医院肿瘤科提供)。
1.1.4 仪器:荧光分光光度计(960型)为上海三科仪器有限公司产品;酶标仪(Sunrise Remote)为TECAN产品;荧光显微镜(BX51TRF)为OLYMPUS产品;RT-PCR仪(TC512)为TECHNE产品。
1.2 方 法
1.2.1 卵巢癌耐药细胞株SK-OV-3/adr的建立:取生长对数期SK-OV-3细胞2×106个接种到含10 mL RPMI1640完全培养基的平皿中,置5 %CO2、相度湿度90%、温度37℃的培养箱中,24 h后细胞呈单层贴壁生长。先以终浓度为53.4 ng/mL的ADR培养液冲击细胞,72 h后弃含药培养液,PBS洗3遍,换新鲜RPMI1640完全培养液,2 d换液1次,洗去死亡细胞,待形成细胞克隆时传代,恢复稳定生长再提高ADR浓度。如此反复,间歇给药直至细胞可在浓度为15 ng/mL的ADR培养液中维持培养,初步建立了具有多药耐药表型的SK-OV-3/adr细胞株。在此基础上,作者分别以160 ng/mL、310 ng/mL、 630 ng/mL、 1250 ng/mL的ADR反复3次作用细胞后,再用10 μg/mL ADR作用1 h后,消化传代细胞至恢复健康后,换至含310 ng/mL的ADR培养液中继续培养,如上法反复冲击用药,最终获得的SK-OV-3/adr细胞株脱离ADR 2周后,采用MTT法测定SK-OV-3/adr细胞株对mdr1/P-gp主要底物ADR、VP-16、VCR、PTX 4种抗癌剂以及加逆转剂Ver后的细胞半数致死浓度(IC50)、耐药指数RI(药物对SK-OV-3细胞IC50/药物对SK-OV-3/adr细胞IC50)、逆转倍数(药物对SK-OV-3/adr细胞逆转前IC50/药物对SK-OV-3/adr细胞逆转后IC50)。
1.2.2 荧光显微镜观察不同时间细胞内的药物含量变化:取生长对数期SK-OV-3及SK-OV-3/adr细胞株以5×105个/孔的浓度接种到放有灭菌盖玻片的12孔培养板中,置5% CO2、相度湿度90%、温度37 ℃的培养箱中培养,24 h后待细胞呈单层贴壁生长,每孔换新鲜的RPMI1640完全培养基1 mL,并加入10 mg/mL ADR 1 μL,分别在30、60、120 min后,用预冷的PBS洗3次,捞取细胞爬片,甘油封片, 荧光显微镜下观察。
1.2.3 细胞内ADR含量的测定[5]:药物浓度-荧光强度标准曲线的绘制:以0.3 N盐酸的50 %乙醇配制不同浓度的 ADR,根据 ADR具有自发荧光的特点 ,从荧光分光光度计上测定相应浓度ADR的荧光强度(激发波长λ= 470 nm ,发射波长λ= 585 nm ,狭缝宽8 nm) 。根据药物浓度-荧光强度绘制曲线作为测定细胞内药物浓度的标准曲线。
取对数生长期SK-OV-3及SK-OV-3/adr细胞株以1×106个/孔的浓度接种到24孔培养板中,置5 %CO2、相度湿度90 %、温度37 ℃的培养箱中,24 h后待细胞呈单层贴壁生长,每孔换新鲜的RPMI1640完全培养基1 mL,分别加入10 mg/mL ADR 10 μL、 ADR(10 mg/mL) + Ver(5 mg/mL)混合液10 μL,孵育30、60、120 min后,用预冷的PBS洗3次,收获细胞,重新悬浮于0.3 N盐酸的50 %乙醇中消化4 ℃过夜。次日离心,取上清于荧光分光光度计上测定荧光强度,并从标准曲线上计算出细胞内ADR相应的浓度。
1.2.4 RT-PCR法检测耐药细胞系与非耐药细胞系mdr1基因的表达:总RNA 提取:收集对数生长期SK-OV-3及SK-OV-3/adr细胞用 Trizol 试剂盒提取细胞总RNA,然后用RT-PCR试剂盒采用二步法进行逆转录,检测mdr1表达。PCR反应条件为:94 ℃预变性3 min ,94 ℃ 变性 40 s ,退火温度 55 ℃,退火30 s ,72 ℃延伸 30 s ,共进行 45个循环 ,72 ℃再延伸4 min。引物设计参照文献[6],mdr1上游引物:5’-CCC ATC ATT GCA ATA GCA GG - 3’,下游引物:5’-GTT CAA ACT TCT GCT CCT GA - 3’,扩增片段长度157 bp。用2 %琼脂糖电泳观察 PCR产物 ,以β-action为内参基因。
1.2.5 Western blot法检测耐药细胞系与非耐药细胞系P-gp蛋白的表达[6]:收集对数生长期SK-OV-3及SK-OV-3/adr细胞,加入RIPA裂解缓冲液(终浓度为2 μg/mL)在冰上裂解细胞,提取总蛋白并测定含量。取含20 μg蛋白样品于8 %聚丙烯酰胺凝胶电泳分离,转膜,封闭液室温下封闭1 h,用含0.05 % Tween20的TTBS缓冲液(tris-buffered saline Tween20,TTBS)洗膜3次,加入相应的鼠抗人单克隆抗体(用封闭液1∶1000稀释),4℃培育过夜,TTBS漂洗3次后,加入辣根过氧化物酶标记的抗鼠二抗(用封闭液1∶500),37℃培育1 h,以GAPDH为内参,采用辣根过氧化物酶-增强发光显示系统显色,凝胶成像系统分析成像。
1.3 统计学方法
资料输入计算机采用SPSS11.0软件进行分析,IC50用线性回归法。
2 结 果
2.1 MTT法检测抗癌剂对SK-OV-3/adr细胞株的IC50、计算耐药指数、逆转倍数
2.1.1 不同抗癌剂对SK-OV-3/adr细胞株的IC50及耐药指数测得的结果:经MTT比色法测定,P-gp主要底物ADR、VP-16、PTX、VCR对诱导的SK-OV-3/adr的IC50均有明显增加,见表1。
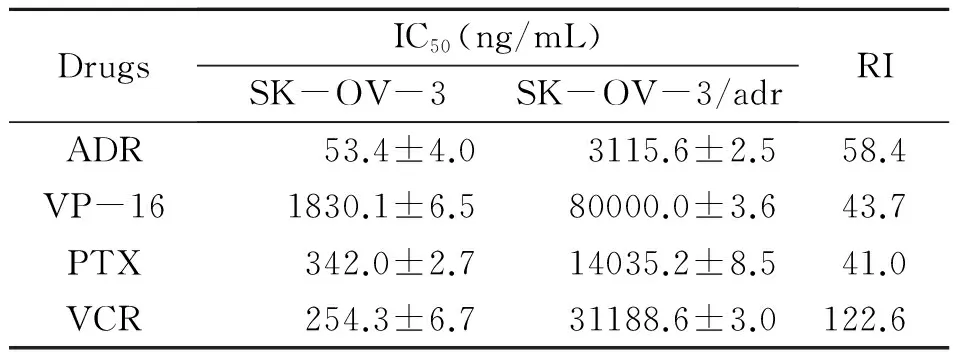
表1 不同抗癌剂对SK-OV-3/adr的IC50和测得的RI
SK-OV-3/adr vs SK-OV-3,P<0.01
2.1.2 Ver逆转后不同抗癌剂对SK-OV-3/adr细胞株的IC50及逆转倍数测得的结果: P-gp主要逆转剂Ver作用SK-OV-3/adr细胞后,经MTT比色法检测,与逆转前相比P-gp主要底物ADR、VP-16、PTX、VCR对SK-OV-3/adr细胞的IC50均有明显降低,加Ver后不同抗癌剂对SK-OV-3/adr的IC50和测得的逆转倍数,见表2。
表2加Ver后不同抗癌剂对SK-OV-3/adr的IC50和测得的逆转倍数
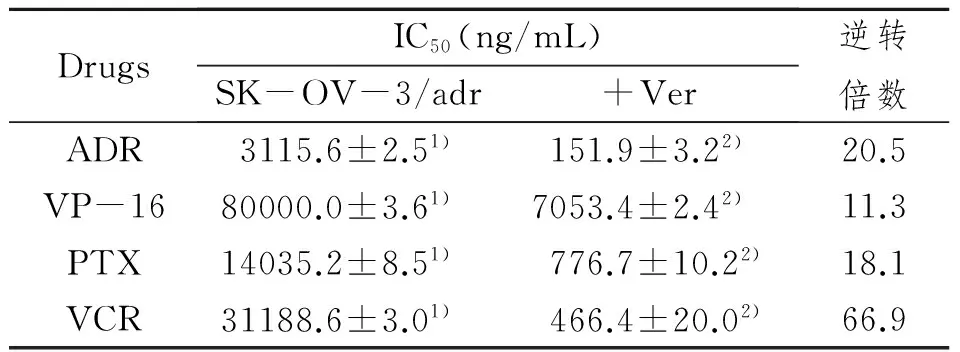
DrugsIC50(ng/mL)SK-OV-3/adr+Ver逆转倍数ADR3115.6±2.51)151.9±3.22)20.5VP-1680000.0±3.61)7053.4±2.42)11.3PTX14035.2±8.51)776.7±10.22)18.1VCR31188.6±3.01)466.4±20.02)66.9
逆转前vs逆转后,P<0.01
2.2 荧光显微镜观察不同时间细胞内的ADR含量变化
加入10 mg/mL ADR 1 μL,在30、60、120 min后,结果显示在敏感株SK-OV-3细胞内,ADR的荧光强度随时间而加强,且集中分布在细胞的核区;耐药株SK-OV-3/adr细胞内ADR的荧光强度在3个时间段未见有明显变化,ADR在核区分布明显减少,相对在胞质中增多(见图1)。
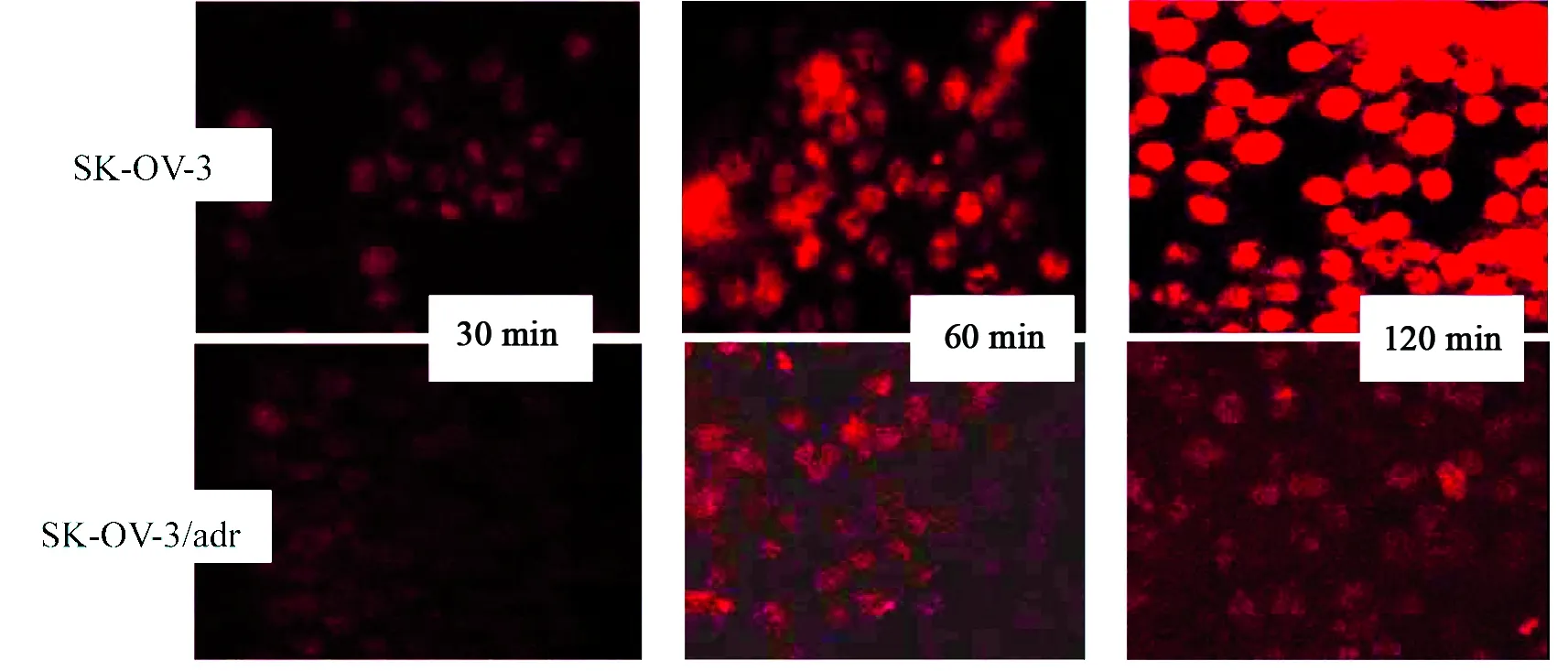
图1荧光显微镜下观察不同时间细胞内ADR的荧光强度
2.3 荧光分光光度法检测细胞内ADR浓度的结果
2.3.1 已知浓度ADR荧光强度的测定及标准曲线的制作:实验结果显示不同浓度的ADR与相应荧光强度之间的关系为良好的线性关系(见图2)。
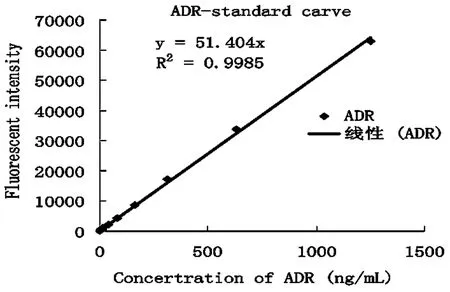
图2 不同浓度的ADR与相应荧光强度之间线性关系
2.3.2 细胞内药物含量的测定:敏感株SK-OV-3细胞内ADR平均浓度明显高于耐药株SK-OV-3/adr细胞(P<0.01),30、60、120 min ADR含量分别是耐药株SK-OV-3/adr的3.7、5.9、8.6倍,并且随时间的延长无明显的增加。当加入非细胞毒性剂量的Ver后,SK-OV-3/adr细胞内ADR平均浓度与逆转前相比明显升高 (P<0.01),并随时间的延长而升高。在SK-OV-3细胞中,逆转前、后,细胞内 ADR平均浓度都随时间的延长明显升高,二者相比差异无显著性意义(P>0.05),见表3。
2.4 RT-PCR法检测细胞mdr1基因的表达
RT-PCR实验结果显示ADR 诱导的SK-OV-3/adr细胞 mdr1呈阳性表达,而SK-OV-3细胞内mdr1未见表达,见图3。

表3 不同时间细胞内药物含量的测定
1) SK-OV-3细胞内ADR的含量;2)Ver干预后SK-OV-3细胞内ADR的含量;3)SK-OV-3/adr细胞内ADR的含量;4) Ver干预后SK-OV-3/adr细胞内ADR的含量(P<0.01,SK-OV-3 vs SK-OV-3/adr、SK-OV-3/adr逆转前 vs SK-OV-3/adr逆转后;P>0.05,SK-OV-3逆转前 vs SK-OV-3逆转后)

图3 ADR诱导的SK-OV-3/adr和SK-OV-3细胞内mdr1的测定结果
2.5 Western blot法检测细胞P-gp蛋白的表达
Western blot实验结果显示,ADR 诱导的SK-OV-3/adr细胞 P-gp呈阳性表达,而SK-OV-3细胞内P-gp未见表达,见图4。
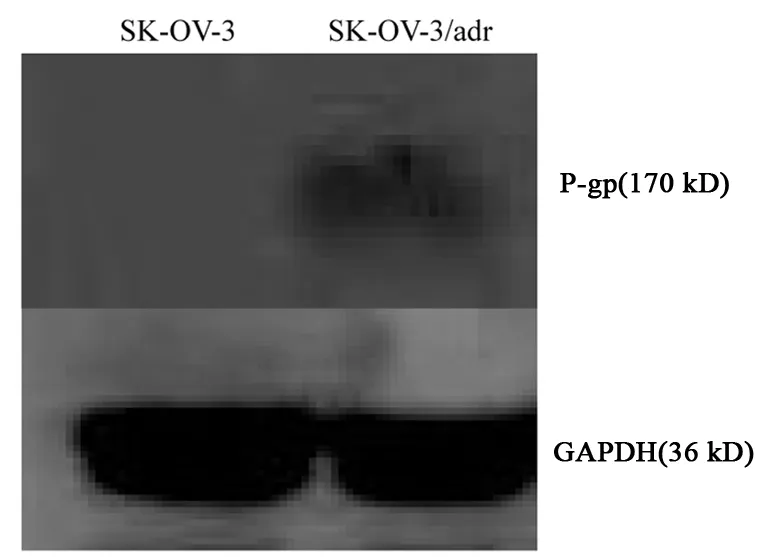
图4 ADR诱导的SK-OV-3/adr和SK-OV-3细胞内P-gp的测定结果
3 讨 论
目前,对ADR耐药的研究多采用浓度梯度递增法和高浓度间歇冲击法在体外诱导耐药细胞株。前者存在忽视了耐药性较低的缺点,而后者则容易引起细胞死亡而使实验中断。临床及体外实验证实,不同药物引起的耐药机制不一致,而且同一肿瘤在治疗的不同阶段,其耐药机制也不一致;同一种肿瘤细胞,用同一种药物诱导,诱导药物终浓度相同,不同的诱导方法可得到耐药机理不同的耐药细胞株[7]。本研究首先采用较大剂量的ADR间歇诱导卵巢癌细胞进行筛选,再采用药物浓度梯度递增法建立具有多药耐药表型的SK-OV-3/adr细胞株[4],其后与大剂量ADR反复冲击用药法相结合继续诱导,结果显示三种方法相结合诱导的细胞株仍对P-gp主要底物 ADR、VCR、PTX、VP16的耐药倍数大幅度提高,用P-gp的主要竞争底物Ver逆转后各药物对SK-OV-3/adr细胞株的IC50明显降低,提示此三种方法相结合诱导的耐药细胞株耐药机制可能仍与P-gp有关系。
目前,普遍认为多药耐药基因mdr1及其编码的P-gp过度表达是产生MDR的主要机制之一。P -gp相对分子量为 170 kD,属于腺苷三磷酸结合蛋白超家族成员,为能量依赖型药泵,具有膜转运蛋白的结构特征,在耐药细胞膜上过度表达,能将多种结构和作用机制不同的天然药物如紫杉醇、阿霉素等药物自细胞内泵出细胞外,使细胞内蓄积浓度下降,细胞内化疗药物达不到有效杀伤剂量而致耐药性产生[8]。近年来,药物在细胞内的异常分布及其与耐药机制的关系也日渐引起人们的重视。Maralai等[9]研究表明,在MDR细胞中,P-gp在细胞核上的表达是阻止药物进入核区的直接原因。本研究亦发现利用ADR本身固有的荧光,采用荧光显微镜观察ADR在细胞中的分布,结果显示在SK-OV-3细胞中,阿霉素集中分布在细胞的核区, 而在耐药株SK-OV-3/adr中,核区分布明显减少,相对在胞质中增多,这与国内外报道一致[10]。这种异常分布使得阿霉素在耐药细胞内远离作用靶点细胞核,不能发挥抗癌作用,从而构成耐药性的一个原因。用荧光分光光度法检测SK-OV-3/adr细胞内 ADR含量随时间的延长无改变,在30 min后基本达到平衡。加入Ver后,细胞内ADR含量随时间的延长而增加;而SK-OV-3细胞中ADR含量随时间的延长明显增加,提示细胞内药物蓄积减少可能是SK-OV-3/adr产生多药耐药性的主要机制。分析原因,可能是膜通透性改变致细胞对药物摄入减少或细胞内药物外流增加的结果。
许多研究表明,mdr1/P-gp与病人治疗结果密切相关。mdr1阳性病人生存期短,缓解率低,复发率高。因此,mdr1/P-gp的分析可作为癌症治疗结果的预测指标[2],也是临床医生制定治疗方案的参考依据。还有研究发现,P-gp在正常卵巢组织和卵巢良性肿瘤未见阳性表达,但在化疗或复发者P-gp阳性表达率增加,认为P-gp在介导化疗药物诱导的获得性多药耐药方面发挥着重要作用[11]。因此,探讨mdr1/P-gp在卵巢细胞多药耐药机制中的作用有其重要意义。本研究通过RT-PCR和Westernblot的测定结果显示SK-OV-3/adr细胞中mdr1/P-gp都呈阳性表达,而在SK-OV-3细胞中未见表达。这进一步验证了mdr1/P-gp在本实验诱导的SK-OV-3/adr细胞的多药耐药机制起主要作用,为更进一步研究肿瘤细胞的多药耐药机制和临床肿瘤治疗合理地选择化疗药物提供实验依据。
[1] 童英,潘凌亚,周生,等.多药耐药基因反义寡脱氧核苷酸对卵巢癌细胞株SKOV3多药耐药性逆转的作用[J].中华妇产科杂志,2000,35(11):677-6791.
[2] 马丁.卵巢癌多药耐药机制的探讨[J].中华妇幼临床医学杂志,2007,8(3):184-188.
[3] 刘岳彪,吴德政.阿霉素耐药与谷甘肽-S-转移酶[J].肿瘤,1994,14(2):17.
[4] 苗迎秋,张文玲,王曼丽,等.阿霉素诱导人卵巢癌细胞耐药株的建立及多药耐药表型测定[J] .大连医科大学学报,2009,31(3):258-261.
[5] 胡军,金伟,杨佩满.β-榄香稀逆转人乳腺癌MCF27/ADM细胞对阿霉素耐药性的研究[J].中华肿瘤杂志,2004,26(5):268-270.
[6] 高娜,张育,茆俊卿.某些中药对K562 /A02细胞Mdr基因及其表达产物的影响[J].中国实验血液学杂志,2008,16(4):785-789.
[7] Yang LY,Trujillo JM.Biological characterization of multidrug resistant human colon carcinoma sublines induced by two methods[J].Cancer Res,1990,50:321.
[8] 黎丹戎,张玮.黄芩素对卵巢癌耐药细胞株A2780/ADM逆转作用实验研究[J].肿瘤,2004,24(2):111-113.
[9] Maraldi NM,Zini N,Santi S,et al.P-glycoprotein subcellular localization and cell morphotype in MDR1 gene-transfected human osteosarcoma cells [J].Biol Cell,1999,91(1):17-28.
[10] 马强,张振书.阿霉素在耐药株LoVo/Adr细胞内的摄入及分布特点[J].第一军医大学学报,2002,22(3):264-266.
[11] 张树荣.卵巢癌耐药机制研究进展[J].实用妇产科杂志,2006,22(3):148-150.

