缺氧诱导因子-1α及血管内皮生长因子在卵巢上皮性肿瘤中的表达*
李玉岩,韩 璐
(大连市妇产医院,辽宁 大连 116051)
卵巢癌是最常见的妇科恶性肿瘤之一 ,发病机制尚未完全阐明,缺乏有效的早期诊断及治疗方法[1]。近年研究发现,缺氧诱导因子-1α(HIF-1α)及血管内皮生长因子(VEGF)在恶性肿瘤的发生、发展中发挥重要的作用。本文通过对HIF-1α及VEGF在卵巢癌组织中表达的研究,拟明确HIF-1α及VEGF与卵巢癌临床分期、分化程度、浸润深度的关系以及两因子之间的相关性,为卵巢癌的发病机理研究和诊治提供新的思路与方法。
1 材料和方法
1.1 材料来源
选取大连市妇产医院肿瘤科2006年1月~2007年12月间切除的卵巢癌组织58例,交界性肿瘤23例,正常卵巢组织38例(取自与肿瘤组织交界的正常组织),切取部分病变组织10%甲醛固定,另取一部分置液氮保存。所有患者术前均未做过放化疗。每例均有详细的临床资料,所有标本均经两位病理医师给予病理诊断。按FIGO标准进行临床分期:Ⅰ期8例,Ⅱ期13例,Ⅲ 期29例,Ⅳ 期8例。按WHO分化标准,中高分化9例,低分化49例。
1.2 主要试剂
兔抗人HIF-1α多克隆抗体(Cat:sc-1164)购自武汉博士德生物工程有限公司;鼠抗人VEGF(C-1)单克隆抗体为Santa Cruz公司产品(Cat:MSsc7269),SP超敏浓缩试剂盒购自福州迈新生物公司。
1.3 仪 器
Jim-xMV-Ⅲ型单垂直板电泳槽,大连竞迈生物科技有限公司;Jim-x ps-9型,半干式转移电泳仪,大连竞迈生物科技有限公司;高速台式离心机,上海安亭科学仪器厂;微量进样器,法国Gilson公司。
1.4 免疫组化SP法检测
1.4.1 实验步骤:标本经10%福尔马林固定,常规脱水石蜡包埋,作厚度3~4 μm的连续切片。3%过氧化氢室温作用10 min,CB液微波修复15 min,凉至室温,10%羊血清封闭15 min,兔抗人HIF-1α抗体工作浓度为1∶200,VEGF抗体工作浓度1∶100,4℃过夜。依次添加二抗和酶室温放置15 min, DAB显色。流水充分冲洗后苏木复染,依次脱水,中性树胶封片。以PBS代替一抗做阴性对照。阳性对照用已知阳性片按上述步骤进行。
1.4.2 结果判定:HIF-1α阳性细胞定位为胞浆或胞核着棕黄色,VEGF为胞浆着棕黄色。HIF-1α染色结果判断:按切片中细胞核着色率和/或细胞质染色深浅分类,(-):未着色;(+):<1%细胞核染色或细胞质染成浅黄色;(++):1%~10%细胞核染色或细胞质染成棕黄色;(+++):>10%的细胞核或细胞质染成棕褐色。VEGF染色结果为胞浆着棕黄色,判断按切片中着色细胞数量的比率分类,(-):0~5%细胞质被染色,(+):<25%细胞质被染色;(++):<50%细胞质被染色;(+++):≥50%细胞质被染色。
1.5 Western blot免疫印记
(1)蛋白印迹反应:切取冻存组织约0.2 g在PMSF裂解液中匀浆后,冰上放置30 min后,4℃下12000 r/min离心5 min,取上清蛋白比色法测总蛋白浓度。细胞裂解物与上样缓冲液等倍稀释,煮沸3 min后以每泳道100 μg总蛋白的上样量上样于7.5%SDS-聚丙烯酰胺凝胶电泳槽,进行电泳,直至溴酚蓝达到凝胶底部,拔掉电源。将滤纸、硝酸纤维素膜剪成与凝胶同样大小,浸泡于转移缓冲液中平衡30 min后,电转移40 min。5%脱脂奶粉37℃封闭2 h,HIF-1α抗体工作浓度为1∶400 , VEGF抗体工作浓度1∶300,4℃过夜,TTBS漂洗10 min×3次,加二抗(1∶200)37℃ 1 h,TTBS漂洗10 min×3次,再加酶(1∶200 )37℃放置1 h,TTBS漂洗10 min×3次,DAB显色3 min后终止。(2)结果采用UVP(CA91786)凝胶成相系统照相,记录条带的A值。
1.6 统计学方法
应用SPSS 10.0系统统计分析软件包进行数据处理。分类数据变量资料的比较采用成组设计的两样本非参数检验,多个样本的非参数检验,相关分析采用Spearman等级相关分析。
2 结 果
2.1 HIF-1α的表达
2.1.1 免疫组化结果:在58例卵巢癌组织中HIF-1α总阳性表达率为86.21%,其中强表达33例,中度表达10例, 弱表达7例,阴性表达8例。交界性肿瘤和正常卵巢组织阳性表达率分别为47.83%和13.16%,卵巢癌组织与交界性肿瘤及正常卵巢组织阳性表达率相比差异均有显著性意义(P<0.05),见图1、2。
HIF-1α随着临床分期的增高而表达增强(P<0.05)。随着病理分化的增加HIF-1α表达增强(P<0.05),见表1。
2.1.2 Western blot免疫印记结果:在120 kD位置上可见HIF-1α蛋白条带(图3),其平均A值在卵巢癌中为1705.33±181.88,在正常卵巢组织中的表达为450.17±165.53,在卵巢癌中的表达量是正常卵巢组织中的(4.58±1.73)倍,两者比较差异有显著性意义(P<0.05)。
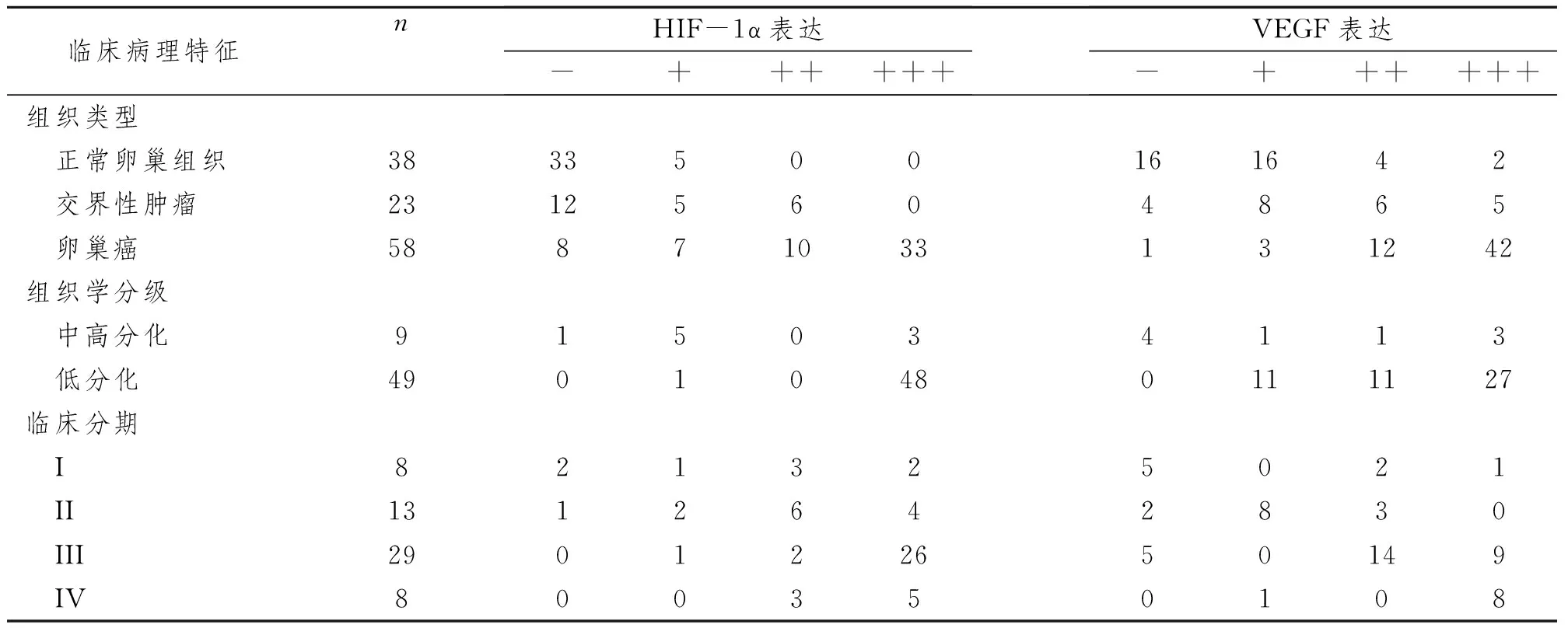
表1 HIF-1α和VEGF的相互关系及各自的表达水平与组织类型、分化程度的及临床分期的关系 (n)

图1 卵巢癌HIF-1α胞核表达阳性SP法 (DAB染色×200)

图2 卵巢癌HIF-1α胞质表达阳性
2.2 VEGF的表达
2.2.1 免疫组化结果:VEGF仅在细胞质中表达,正常卵巢组织、交界性肿瘤组织、交界性肿瘤组织及卵巢癌组织中均见VEGF的表达,其在卵巢癌组织阳性表达率为98.28%,其中强表达42例,中度表达12例,弱表达3例,阴性表达1例。VEGF在正常卵巢组织和交界性肿瘤组织中表达阳性表达率分别为57.89%、82.61%,三者两两比较差异均有显著性意义(P<0.05)。VEGF的表达随着卵巢癌临床分期的增高而增强(P<0.05),随着病理分级的增加VEGF的表达增强(P<0.05,见表1、图4)。
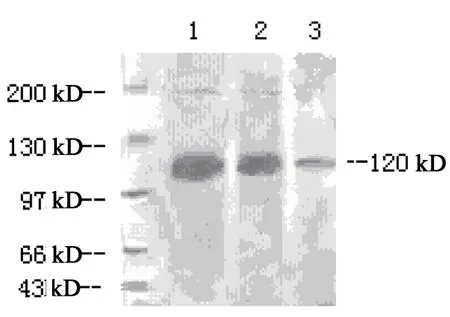
图3 HIF-1αLane1:卵巢癌组织;Lane2:交界性肿瘤组织;Lane3:正常卵巢组织

图4 卵巢癌VEGF胞质表达阳性1、2为卵巢癌组织,3为正常卵巢组织
2.2.2 Western blot免疫印记结果:在23 kD位置上可见VEGF蛋白条带,其平均A值在卵巢癌中为710.52±115.03,在正常卵巢组织中的表达为184.59±70.45,在卵巢癌中的表达量是正常卵巢组织中的(4.32±1.55)倍,两者比较差异有显著性意义(P<0.05),见图5。

图5 VEGFLane1:卵巢癌组织;Lane2:交界性肿瘤组织;Lane3:正常卵巢组织
2.3 卵巢癌组织中VEGF和HIF-1α蛋白表达的相关性
VEGF和HIF-1α的表达呈正相关(rs=0.536,P<0.05),见表1。
3 讨 论
肿瘤的发生、发展与细胞的过度增殖和凋亡的减少有关,肿瘤细胞无限制的增殖是其主要的特征,而细胞增殖需要大量耗氧。研究证实缺氧是实质性肿瘤物理微环境的基本特征之一,是决定恶性肿瘤预后的重要因素[2]。肿瘤细胞的失控性生长、高代谢状态使绝大多数肿瘤均存在缺氧因素。肿瘤细胞适应缺氧的策略,一是提高糖酵解速率,二是形成多血管体系。研究发现,HIF-1在肿瘤的能量代谢和血管生成等过程中起重要的调控作用,并可以促进肿瘤细胞的生长、浸润和转移等恶性生物学行为的发生[3]。
缺氧通常在距离功能性血管100~150 μm处发生。肿瘤组织氧分压为0~20 mm Hg(1 mm Hg=1.333 kPa),大部分肿瘤组织的氧分压低于2.5 mmHg,而正常组织为24~66 mmHg[4]。肿瘤组织的缺氧在肿瘤形成病理过程中异常重要,与肿瘤放、化疗耐受及恶性进展、远处转移密切相关[5]。HIF-1是由120×103的HIF-1a亚基和(91~94)×103的HIF-1β亚基构成的异二聚体转录因子,均属于碱性螺旋-环-螺旋(basic-helix-loop-helix) bHLH/PAS(PER-ARNT-SIM)家族成员。缺氧条件下HIF-1α降解受阻,胞质内HIF-1α积聚增多并发生核转位,移至细胞核中与HIF-1β结合形成HIF-1,与目的基因HRG中的HIF-1α结合点结合,促进其转录,引起一系列细胞对缺氧的反应[6]。
研究表明,HIF-1α在前列腺癌、肝癌、胃癌、宫颈癌等多种肿瘤中呈过表达,并与肿瘤侵袭性强和预后差有关[6]。本研究结果显示,HIF-1α在正常卵巢组织和卵巢良性上皮性肿瘤中无明显表达,交界性卵巢肿瘤组织及卵巢恶性肿瘤中的HIF-1α阳性表达率逐渐增高。本文的检测结果发现 33 例正常组织中均未见HIF-1α蛋白表达,而 58 例卵巢癌中HIF-1α阳性表达率为86.21%,在卵巢癌组织中, 癌肿的浸润深度、病理分级和TNM分期与HIF-1α阳性表达呈正相关,分化程度越差、分期越晚的病例HIF-1α阳性表达率越高,提示HIF-1α在卵巢癌形成发展过程中起重要作用,表明HIF-1α的表达可能反映出卵巢癌部分的的生物学行为,与其他肿瘤中的研究结果相符合[7]。但这是否能作为预测卵巢癌侵袭转移的一项重要指标还有待进一步的深入研究。HIF-1α在肿瘤组织中的表达增高可能有两个方面的原因:首先,在肿瘤的缺氧微环境中,肿瘤细胞通过HIF-1α的过表达来调控靶基因VEGF合成,促进新生血管的生成,维持氧和代谢的稳定,促进自身的生长和转移。其次,一些基因的突变活化了癌基因或通过灭活肿瘤抑癌基因的产物来增加HIF-1α的表达。
VEGF是一种相对分子质量为(34~45)×10的二聚体糖蛋白,为多肽类生长因子,它是内皮细胞特异性有丝分裂剂,能使血管内皮细胞变形、移动、分裂增殖,能增加血管通透性,是诱导肿瘤产生新生血管的最主要的细胞因子之一。其作用包括:①诱导血管内皮细胞增殖,促进新生血管内皮细胞生长;②增加血管通透性;③增加血管外纤维性凝胶而支持肿瘤血管内皮细胞生长,结果使肿瘤血管生成增加,肿瘤得到血液供应而持续生长。VEGF mRNA和蛋白在较多恶性肿瘤中表达,如在肾癌、膀胱癌、乳腺癌 、胃肠道癌及头颈部癌中均呈高水平表达,其在肿瘤血管的形成中起关键作用。现已证实 VEGF在实体瘤的发生发展中发挥着重要作用[8,9],在没有新血管形成以前,肿瘤只生长到1~2 mm,不会发生转移;而在新血管形成后肿瘤成数倍增长,转移几率随之增高[9]。它能增加血管通透性,促进肿瘤血管形成,对肿瘤血管内皮细胞增殖迁移及腹水产生发挥着重要作用。Carron CP等[10]研究发现VEGF及其受体在妇科恶性肿瘤组织中的表达明显高于相应的正常组织,VEGF及其受体的高水平表达与妇科肿瘤的侵袭、转移密切相关。
本研究结果显示,58例卵巢癌标本均有不同程度的 VEGF蛋白表达,其在卵巢癌组织阳性表达率为98.28%,其中强表达42例,主要集中在 Ⅲ~Ⅳ期卵巢癌中;中度表达12例;弱表达3例;不表达1例。卵巢癌中,在正常卵巢皮质中未见到VEGF强阳性表达。VEGF水平升高生存时间缩短,这与文献报道一致[11,12]。表明VEGF不仅与肿瘤恶性表型相关,在卵巢癌进展中起关键作用,其表达量与预后密切相关,可作为预测卵巢癌预后的一个间接指标。
VEGF基因表达受多种细胞因子、癌基因、抑癌基因产物及缺氧等因素的调控[13]。有研究证实,在VEGF的5′端增强子内存在HIF-1α结合位点,缺氧条件下,一方面, HIF-1α与VEGF5′端增强子结合后使VEGF的转录和表达增强,诱导VEGF对缺氧的反应,增加血管生成,使血液到达缺氧部位;另一方面, HIF-1α还可增加缺氧情况下VEGFmRNA的稳定性。因此,卵巢恶性肿瘤中VEGF高表达,HIF-1α也应该高表达,两者应有明显相关性[14]。本研究发现,在卵巢癌组织中VEGF和HIF-1α均呈高表达,而在正常组织中表达阳性率较低,随着组织学分级的增加和临床分期的提高,二者的表达强度和阳性率均有所提高,而在分化较好、临床分期较早的组织中则表达较弱,阳性率低。这进一步证实了二者存在正相关性,HIF-1α是VEGF的表达调控因子之一。
同时检测卵巢恶性肿瘤组织中HIF-1α及VEGF,不仅有助于卵巢癌的早期诊断和预测其侵袭性及预后,而且随着研究的不断深入,这一肿瘤生长调控的机制可为今后以HIF-1α和VEGF为靶点治疗卵巢恶性肿瘤提供新的思路。
[1] 乐杰.妇产科学[M].第7版.北京:人民卫生出版社,2007.330-331.
[2] JeanM. How cells endure low oxygen [J]. Science,2004,303 (2):1454.
[3] Giaccia AJ, Simon MC, Johnsin R. The biology of hy-poxia: the role of oxygen sensing in development, normal function and disease [J]. Genes Dev, 2004, 18 (11):218.
[4] GL.Targeting HIF-1 for cancer therapy[J].Nat Rev Cancer,2003,3(10):3721-3732.
[5] Maxwell PH, Dachs GU, Gleadle JM, et al. Hypoxia-inducible factor-1modulates gene expression in solid tumors and influ-ences both angiogenesis and tumor growth[J]. Proc Natl Acad Sci USA,1997, 94(15):8104-8109.
[6] Bimer P, Schindl M, Obemair A,et al.Overexpression of hypozie-in-ducible factor lalphe is a marker for an unfavorable prognosis in early-stage invasive cervical cancer[J].Cancer Res, 2000,60(17):4693-4696.
[7] Iervolino A, Trisciuoglio D, Ribatti D, et al.Bcl-2 overexpression in human melanoma cells increases angiogenesis through VEGF mRNA stabilization and HIF-1-medicated transcriptional activity[J].FASEB J,2002,16(11):1453-1455.
[8] J Du P,Wei JG,Li HP,et al.Expression of vascular endothelial growth factor in nude rat liver after planting human hepatocellular carcinoma cells [J].Di Si Junyi Daxue Xue bao 2001,22(12):1085- 1088.
[9] J Lu Y,Zhang A ,Wang S,et al.Role of vascular endothelial growth factor overexpression in ovarian tumor invasion and mechanism[J].Zhonghua Fu Chan Ke Zazhi,2002,37(5):294-297.
[10] Carron CP,Meyer DM,Pegg JA,et al.A Peptidomimetic antagonist of the intergrin alpha(V)beta3 inhibits leydig cell tumor growth and development of hypercalcemia of malignancy [J]. Cancer Res,1998,58(9):1930-1935.
[11] Garz GG,Giavattni A,Lucarini G,et al.Vascular endothelial growth factor expression as a prognostic index in serous ovarian cystoadenocarcinomas[J].Gynecology,2006,73:396-401.
[12] 李双弟,万小平,桃兆瑞,等.血管内皮生长因子及受体与上皮卵巢癌发展 [J].肿瘤,2003,23(3):226.
[13] 王苏荣,孙菊香,辛柱香.血管内皮生长因子在卵巢癌中的表达及其临床意义[J].临床肿瘤学杂志,2001,6(3):480-484.
[14] 杨军, 陈明清, 董坚. VEGF/VEGFR2信号转导通路在抗肿瘤血管生成中的作用[J]. 世界华人消化杂志 2007,15(34): 3611-3616.

