供者凋亡细胞静脉输注在异种肝移植中所产生体液免疫机理
张业伟,孙 磊,严栋梁,刘允怡,王太洪
(1.南京医科大学附属江苏省肿瘤医院普外科,江苏南京,210009;2.南通大学第二附属医院普外科,江苏南通,226300;3.香港中文大学医学院附属香港威尔斯亲王医院外科学系)
供者器官来源严重不足深深阻碍了和困扰着器官手术的推广和应用。随着对异种移植的兴趣和深入研究,跨物种的异种移植已经成为医学领域的热点。异种1移植除了解决供移植器官来源的问题外,还可能避免人类病毒的感染(如HIV和肝炎病毒),因为动物组织对人感染的病毒不感染,异种移植有可能今后用于治疗新的传染病,如心肌炎、病毒性肺炎或肾炎等。
本研究分别以正常和经全身预处理(RIC)的贵州香猪为供者、中国猕猴为受体,建立异种肝移植模型。探讨异种肝移植术后超急性排斥反应发生的机制;及探讨受体静脉输注异种供体来源凋亡细胞能否抑制异种移植免疫排斥反应及其可能的作用机制。
1 材料与方法
1.1 实验动物
健康贵州香猪(雌雄不限,14.5~24.5 kg,由太仓育种猪厂提供)作为供体。中国猕猴(1月大,1~1.5 kg,雄性,由苏州西山中科有限公司提供)作为受体。饲养条件符合无特定病原(SPF)动物饲养标准。术前禁食8 h、自由饮水,术后不给免疫抑制剂及抗生素,予单笼饲养,自由摄食、饮水。
1.2 实验分组
实验选用近交系的中国猕猴为受者和贵州香猪为供者,进行原位肝脏移植。受者猕猴随机分为A、B、C组,A组为正常对照组,n=6;B组为实验对照组,n=28,在接受RIC之后,再接受供者贵州香猪的异种异基因骨髓(BM)静脉输注;C组为实验组,n=36,在接受RIC之后,再接受供者贵州香猪的BM和凋亡细胞同时静脉输注。
手术后每日观察大体情况,生存时间、统计生存率。在术后规定时间点(4、7 d)取外周血,第14天牺牲动物获取外周血和肝脏及脾脏保存以备检测。
1.3 凋亡脾细胞的制备
取3×106脾细胞,离心(1500 rpm/min,10m in),加入Hanks液,混匀后均匀点于无菌6孔板中,37℃下置于紫外线灯下照射,光源距离样品垂直距离40 cm,波长320 nm,照射时间为20min,吸取细胞悬液,离心,去上清,加入完全培养基,37℃、5%C02培养箱中培育。
1.4 肝功能测定
取各组肝移植术后外周血分离血清,通过自动生化分析仪(UVIDEC-77,Japan)测定丙氨酸转氨酶(ALT)、总胆红素(TB)值。
1.5 T细胞亚群分析
取未刺激的外周全血50μL并分别加入9μL PerCp-抗猴CD3mAb(购自 BeckmanCoul公司),FITC-抗猴CD4 mAb(购自BeckmanCoul公司)和APC-Cy7-抗猴CD8 mAb(购自BeckmanCoul公司),于4℃下避光孵育30 min后溶血,用PBS洗涤重悬后用FACSCanto(Beckm an-Coul,USA)检测。采用BeckmanCoul FACSDiva软件分析数据。
1.6 Foxp3+CD4+CD25+测定
取未刺激的外周全血50μL后加入10μL的CD4-FITC与CD25-APC cock tail(购自BeckmanCoul公司),并于4℃下避光孵育30m in以标记CD4+CD25+T细胞;经溶血洗涤后使用1 m L Fixation/Perm缓冲液穿膜45 m in,而后用洗涤缓冲液洗涤后加人1μL正常人血清于4℃封闭15min,之后直接加人10μL PE-抗猴Foxp3 mAb(购自 Beckm anCoul公司)或加人 10μL PE-IgG2b做为同型对照(试剂盒提供)于4℃避光孵育30 min。经洗涤缓冲液洗涤2次后用300 μL flow cytimetry staining buffer重悬并上FACSCanto检测。采用BeckmanCoul FACSDiva软件分析数据,计算CD4+CD25+细胞中Foxp3+细胞百分率。
1.7 GITR表达分析
用RPM l 1640培养液按1∶1体积比稀释采集的肝素钠抗凝全血并充分混匀,而后加人佛波酯(167μg/L)和离子霉素(1 mg/L)在50 m L/L CO2细胞培养箱中37℃下培养6 h。刺激培养后的全血用于GITR检测。Human regulatory T cell Staining kit(购自eBioscience公司),RPM l 1640培养基干粉(购自GIBCO公司),佛波醋和离子霉素(购自sigma公司),小牛血清(购自武汉三利生物技术公司)。取刺激培养后的50μL全血并分别加入 10 μL PerCp-CD3、5 μL APC-Cy7-CD8于4℃下避光孵育30 min。之后溶血并用PBS洗涤1次,用残留的PBS重悬细胞后再加入10μLPE-抗猴G lTRmAb(购自R&D公司)或10μLPE-IgG1(购自BeckmanCoul公司)作为同型对照于4℃下避光孵育 45 m in,洗涤后用FACSCanto检测。采用BeckmanCoul FACSDiva软件分析数据。
1.8 统计学处理
数据用统计软件SPSS 13.0进行统计学处理。计量资料以均数±标准差表示,采用完全随机方差分析。生存分析用Kaplan-Meier法作生存曲线,并用Log Rank法进行显著性检验,以P=0.05为显著性检验水准。
2 结 果
2.1 各组猴肝移植术后存活期比较
Kaplan-Meier法生存曲线示A和C组存活期均大于100 d,两组间无显著差异。表明以贵州香猪为供体、中国猕猴为受体即使主要组织相容性抗原完全不同,肝脏移植后受体仍能获得长期存活。B组因超急性排斥反应,受体猕猴存活期为3 h~16 d,平均生存时间(3±1.1)d,生存时间和生存率显著降低,与阴性对照组和同种肝脏移植组及C组相比有显著降低。
2.2 各组猴肝移植术后肝功能的变化
各组肝功能检测,B、C两组由于缺血再灌注及手术创伤引起的损害,与正常对照组相比,C组术后第4天可看到一定程度的ALT、TB升高,以后逐渐下降于术后第14天恢复正常。提示该模型术后早期出现了急性排斥反应并引起了肝损害,但宿主自身可克服排斥反应而长期生存。B组受体术后外周血血清ALT、TB值增高明显,并持续增加,在不同时间点均明显高于A、C 2组(见表1)。

表1 各组大鼠肝移植术后肝功能的变化
2.3 各组猴肝移植术后外周血T细胞亚群分析
FACSCanto检测各组外周血T细胞亚群,3组间其CD3+T细胞计数的差异无统计学意义。T细胞亚群分析显示,3组间其CD3+CD4+T细胞无明显变化。C组术后第4天周血CD3+CD8+略有上升,CD4+/CD8+略有下降,但在术后第7、14天恢复正常并与A组相比无明显差异,提示该模型术后早期出现了急性排斥反应并引起了肝损害,但宿主自身可克服排斥反应而长期生存。B组CD3+CD8+/%增高明显,并持续增加,在不同时间点均明显高于A、C两组,但是CD4+/CD8+并持续下降,在不同时间点均明显低于A、C两组。受体猕猴在接受RIC之后,再接受供者贵州香猪的BM和凋亡细胞同时静脉输注,可有意降低受体猕猴体内T淋巴细胞中CD3+及CD8+细胞比率,抑制受体猕猴脾脏T淋巴细胞的增殖,抑制受体猕猴脾脏CTL所占比例(见表2)。

表2 各组大鼠肝移植术后外周血T细胞亚群分析

表3 各组肝移植术后外周血中Foxp3+CD4+CD25+Treg与CD4+CD25+T细胞的比例(%)
2.4 各组猴肝移植术后外周血Foxp3+CD4+CD25+Treg和CD4+CD25+T细胞的表达
FACSCanto检测各组外周血Foxp3+CD4+CD25+Treg,与A组相比,C组术后第4天Foxp3+CD4+CD25+Treg和CD4+CD25+调节性T细胞数量较同种肝脏移植组有所降低但与A组相比无明显差异,而在术后7 d、14 d时明显上升,显著高于A组同时间的比例。B组肝术后Foxp3+CD4+CD25+Treg和CD4+CD25+调节性T细胞比例即呈现明显下降,与显著低于A、C组两组同时间段的比例(见表3)。
2.5 各组猴肝移植术后外周血T细胞亚群上GITR表达分析
在猕猴的外周血中绝大多数淋巴细胞处于静息期,未经刺激时T细胞上不能检出明显GITR表达,但经佛波醋和离子霉素联合刺激培养后A组以及B组和C组T细胞上GITR表达均有增加,且B组外周血T细胞亚群上的GITR表达均显著高于A组和C组。但在不同时间点下T细胞亚群上GITR的表达模式不同,如C组术后第4天CD3+CD4+T细胞上的GITR表达高于其在CD3+CD8+T细胞亚群上的表达,但是随着排斥反应增强,GITR在CD3+CD4+T细胞上的表达降低,而在CD3+CD8+T细胞上表达增加 (见表4)。
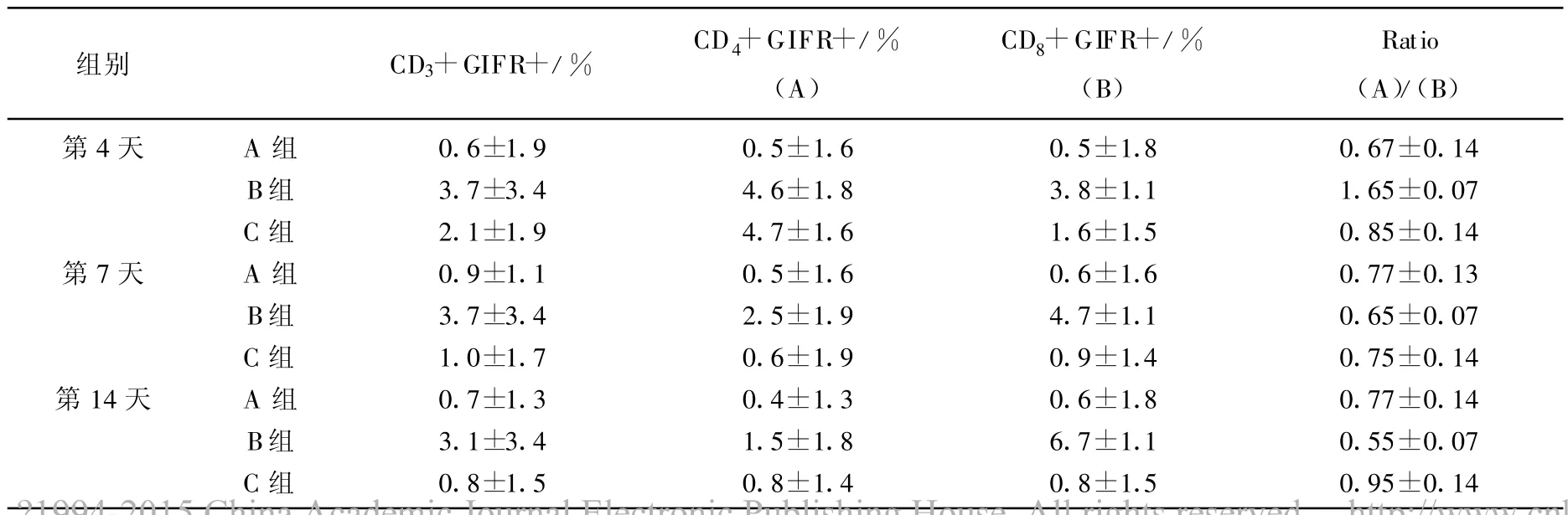
表4 各组肝移植术后外周血T细胞亚群上GITR表达分析
3 讨 论
在部分品系大鼠、小鼠等动物间进行同种异基因肝脏移植,即使主要组织相容性抗原完全不同也可以形成自发性移植免疫耐受[1]。本研究建立的异种肝移植模型,受体为猴、供体为猪,因为猴体内的天然抗体及补体系统和人接近,猪器官移植给灵长类,术后立即发生介导超急性排斥反应是由于受者体内预存抗体特异性识别α-半乳糖苷(Galα1-3Gal)。
本研究结果显示:C组受体猕猴在肝脏移植后虽能够获得长期存活,但术后第4、7天血清ALT、TB值与B组受体猴在肝脏移植后相比均有明显升高,但在术后14 d左右下降到正常水平并且与正常对照组无差异,经移植肝脏病理检测无排斥反应现象发生。表明C组实验组受体猴,在接受RIC之后,再接受供者贵州香猪的BM和凋亡细胞同时静脉输注。受体在术后早期阶段可能经历了排斥反应但可最终获得自发性免疫耐受。
有研究显示去除大鼠模型中的CD4+CD25+Treg后可以诱导自身免疫性疾病的发生和发展[2],提示CD4+CD25+Treg功能障碍在器官或/和细胞移植排斥反应的病理发生中具有重要作用[3-4]。Jiang与Demirkiran等在肝移植中等也证实CD4+CD25+调节T细胞对肝移植后形成免疫耐受抑制排斥反应有关[5-6]。通过动态监测三组受体猴肝移植术后外周血中CD3+CD4+T细胞的比例,3组间相比较无显著差异。而CD3+CD8+T细胞比例监测的结果是,B、C组和A组相比术后第4天升高明显,并且持续至术后7 d,但C组在术后14 d恢复正常并与A组相比无明显差异。B组受体术后CD3+CD8+T比例增高明显,并持续增加,在不同时间点均明显高于A、C组,提示B组急性排斥反应时受体外周血中T细胞平衡失控。而且有报道CD3+CD8+T细胞高表达T细胞活化标志HLA-DR,其分泌的细胞因子呈Th2极化[7]。此提示B组急性排斥反应受体CD3+CD8+T细胞增殖以及功能活化明显。大量活化的CD3+CD8+T细胞可通过其细胞毒性作用诱导靶细胞凋亡增加,当凋亡细胞数量超过体内树突状细胞等抗原呈递细胞的处理能力时即会增加自身抗原的暴露而促使疾病的发生发展;通过对3组受体猴肝移植术后脾脏CTL杀伤活性检测的结果和外周血中CD3+CD8+细胞的比例动态监测是一致。而B组受体猴体内CD3+CD8+T细胞的过度活化,则可能是Foxp3+CD4+CD25+T reg介导的免疫抑制功能的障碍和GITR提供的共刺激活化信号共同作用的结果。
Piccirillo等[8]报道CD4+CD25+Treg通过抑制IL-2的分泌以及CD25的上调表达而抑制CD3+CD8+T细胞的增殖活化。对B组和C组外周血Treg的表达分析显示急性排斥反应组外周血Foxp3+CD4+CD25+Treg表达比例在各个时间点均明显低于正常对照组,而C组体内Foxp3+CD4+CD25+T reg表达比例在术后第4天明显低于正常对照组和同种肝脏移植组,并且持续至术后7 d,但在术后14 d恢复正常并与正常对照组和同种肝脏移植组相比无明显差异,提示受体猴,异种肝移植术后急性排斥反应是因体内调节性T细胞生成障碍;而该作用的障碍使得Foxp3+CD4+CD25+Treg对CD3+CD8+T细胞的免疫抑制能力减弱,从而促使B组体内的CD3+CD8+T细胞呈现出高度的功能活性,并使其在B组外周血中的表达增加,而C组术后早期外周血中的CD3+CD8+T细胞表达也是增加。B组体内Foxp3+CD4+CD25+Treg表达的降低可能是由体内CD3+CD4+T细胞上高表达的GITR信号介导的。
Roncheti等[9]报道GITR跟信号的活化可以促使CD4+CD25+Treg向效应性+CD4+CD25+T细胞转化,并诱导其抑制活性丧失,而GITR分子在急性排斥反应组体内CD4+CD25+T细胞上高表达。该研究结果显示:B组外周血中CD3+CD4+T细胞上GITR表达显著增加,同时也显示B组外周血中CD3+CD4+T细胞和CD3+CD8+T细胞膜上GITR的表达均显著高于正常对照组,然而B组外周血中仅CD3+CD8+T细胞表达增加,提示尽管GITR信号对T细胞具有共刺激活化作用,但是 CD3+CD8+T细胞对GITR信号的活化作用似乎更为敏感。Roncheti等[9-10]报道活化的GITR-/-T细胞较 GITR+/+T细胞更易发生由CD3信号诱导的凋亡,GITR信号的活化有助于T细胞的存活。B组外周血中CD3+CD8+T细胞上G ITR表达的增加有可能促使其长期存活,从而使得B组外周血中CD3+CD8+T细胞表达增加。G ITR信号通过其对淋巴细胞的共刺激活化作用和凋亡抑制作用而参与了B组CD3+CD8+T细胞的增殖活化与存活,促使B组外周血T细胞亚群紊乱。
总之,本研究显示当受体猕猴在接受RIC之后,再接受供者贵州香猪的BM和凋亡细胞同时静脉输注,诱导异种肝移植受体自发性免疫耐受的机制,可能是通过使受体外周血中Foxp3+CD4+CD25+Treg比例增加,CD3+CD4+T细胞以及CD3+CD8+T细胞上GITR表达降低,从而使得由Foxp3+CD4+CD25+Treg介导的免疫抑制信号增加来实现。
[1] Calne R.A lmost tolerance in the clinic[J].Transplant Proc,1998,30:3846.
[2] Sakaguchi S,Sakaguchi N,Shim izu J,et al.Immunologic tolerance maintained by CD25+CD4+regulatory T cells:their common role in controlling autoimmunity[J].tumorimmunity,and transplantation tolerance.Immunol Rev,2001,182(1):18.
[3] Jiang S,Lechler R I,He X S,et al.Regulatory T cellsand transplan tation tolerance[J].Hum Immunol,2006,67(10):765.
[4] W ood K J,SakaguchiS.Regulatory T cellsin transplantation tolerance[J].Nat Rev Immunol,2003,3(3):199.
[5] Dem irkiran A,Kok A,Kw ekkeboom J,et al.Low circulating regulatory T-cell levels after acute rejection in liver transplantation.Liver Transpl.2006,12(2):277.
[6] Jiang X,Morita M,Sugioka A,et al.The importance of CD25+CD4+regulatory T cells in mouse hepatic allograft tolerance[J].Liver Transpl,2006,12(7):1112.
[7] Amel-KashipazM R,HugginsM L,Lnyon P,et al.Quantitative and qualitative analysis of the balance between type l and type 2 cy tokineproducing CD8-and CD8+T cells in system ic lupus erythematosus[J].JAutoimmun,2001,17(2):155.
[8] Piccirillo C A,Shevach EM.Cutting edge:controlofCD8+T cell activation by CD4+CD25+immunoregulatory cells[J].J Immunol,2001,167(3):1137.
[9] Ronchetti S,Zollo O,BruscoliS,et al.GITR,amember of the TNF receptor superfam ily,is co-stimulatory tomouse T lymphocyte subpopulations[J].Eur J Immunol,2004,34(3):613.
[10] RonchettiS,NocentiniG,Riccardi C,et al.Role of GITR in activation response of T lymphocytes[J].Blood,2002,100(1):350.

